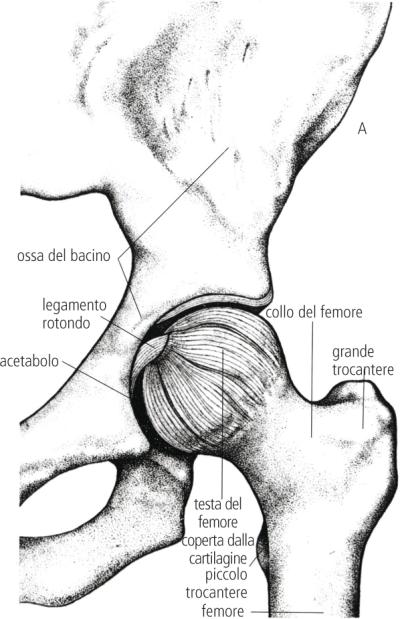
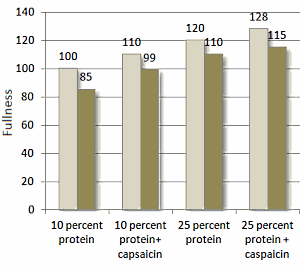Breve introduzione all’argomento:
Nel giugno 2021 è stato pubblicato un eccellente lavoro di Guillermo Escalante, Scott W. Stevenson, Christopher Barakat, Alan A. Aragon e Brad J. Schoenfeld che analizza le comuni pratiche applicate dai bodybuilder nella settimana precedente la gara (Peak Week) esponendone la logica applicativa in base alle evidenze scientifiche in nostro possesso.[Peak week recommendations for bodybuilders: an evidence based approach | BMC Sports Science, Medicine and Rehabilitation | Full Text (biomedcentral.com)] Ho deciso quindi di scrivere un articolo dettagliato sulla settimana pre-contest, utilizzando come base lo studio sopra citato e aggiungendo la mia ricerca personale, al fine di spiegarne le modalità di gestione migliori che, senz’altro, potranno tornare utili tanto agli atleti quanto ai preparatori.
Punto di partenza:

Il Bodybuilding è uno sforzo competitivo per il miglioramento della composizione corporea la quale verrà giudicata con parametri che comprendono la combinazione delle dimensioni muscolari, la simmetria, la “condizione” (bassi livelli di grasso corporeo) e presentazione sul palco. Per avere successo, i concorrenti devono presentare la loro forma fisica migliore durante il giorno (o i giorni) della competizione. I bodybuilder impiegano tipicamente periodi di 8-22 o più settimane di preparazione in cui la dieta e i programmi di esercizio vengono modificati dalla off season nel tentativo di perdere la maggior percentuale di grasso corporeo e guadagnare o mantenere la massa muscolare scheletrica [1,2,3,4,5,6 ,7,8,9,10]. Negli ultimi giorni di preparazione, i concorrenti implementano interventi per “tirare” il loro corpo nel tentativo di massimizzare l’estetica nel giorno della gara [11,12,13,14]. Gli interventi spesso utilizzati includono l’alterazione dei loro regimi di esercizio e l’assunzione di macronutrienti, acqua ed elettroliti con gli obiettivi di:
1-massimizzare il contenuto di glicogeno muscolare come mezzo per migliorare la “pienezza” muscolare (cioè il volume);
2-ridurre al minimo l’acqua sottocutanea (nel tentativo di sembrare “asciutti” anziché “acquosi”, migliorando così l’estetica muscolatura) e
3-ridurre al minimo il gonfiore addominale per mantenere un girovita più piccolo e ottimizzare le proporzioni fisiche e l’estetica generale [11, 12, 14,15 ,16,17].
Sebbene i concorrenti possano utilizzare metodi naturali per raggiungere questi obiettivi, sappiamo benissimo che vi è un ampio uso segnalata di auto-prescrizione di farmaci per il miglioramento delle prestazioni/estetica [8, 18, 19, 20, 21].
Uno studio osservazionale ha raccolto informazioni sulle strategie nutrizionali della Peak Week e dei giorni di gara tra 81 bodybuilder natural (maschi= 59, femmine = 22) tramite un questionario di 34 elementi; l’indagine ha elencato le strategie di picco comunemente utilizzate e ha fornito spazio aggiuntivo per informazioni qualitative [11]. La stragrande maggioranza dei partecipanti (93,8%) ha riferito di aver utilizzato una strategia di picco la settimana prima della competizione (denominata appunto “Peak Week”), con la manipolazione di Carboidrati (CHO), Acqua e/o Sodio segnalata più comunemente [ 11]. L’obiettivo primario dichiarato della manipolazione dei CHO era massimizzare le concentrazioni di glicogeno muscolare utilizzando principi simili al carico dei CHO classico [11]. Inoltre, i concorrenti hanno manipolato l’assunzione di Acqua e/o Sodio nel tentativo di indurre un effetto diuretico/poliuria per eliminare l’acqua superflua.[11]
In un altro studio, i ricercatori hanno condotto interviste approfondite per identificare e descrivere diverse strategie dietetiche utilizzate da sette culturisti maschi natural durante la off season, la stagione, la Peak Week e il post-season [14]. Durante la Peak Week, sei partecipanti hanno riferito di aver utilizzato un regime di carico di carboidrati modificato per tentare di aumentare il contenuto di glicogeno. Inoltre, tutti i partecipanti hanno riferito di aver manipolato l’assunzione di acqua mentre tre hanno manipolato contemporaneamente l’assunzione di sodio nel tentativo di ridurre l’acqua corporea nella speranza di creare un aspetto più “asciutto”.[14]
Sebbene esistano molti protocolli delle Peak Week al fine di tentare il miglioramento dell’estetica, mancano ricerche sull’efficacia e la sicurezza dei metodi comunemente usati dai bodybuilder. Dal momento che lo studio in questione non tratta i bodybuilder supplementati farmacologicamente, aggiungerò delle note esplicative sui metodi aggiuntivi utilizzati da questi atleti.
Lo scopo di questo articolo è:
1-rivedere la letteratura attuale sui protocolli di picco più comunemente impiegati dai bodybuilder;
2-fornire raccomandazioni basate sull’evidenza per le strategie di picco pre-gara per concorrenti e preparatori.
Manipolazione dei Carboidrati:
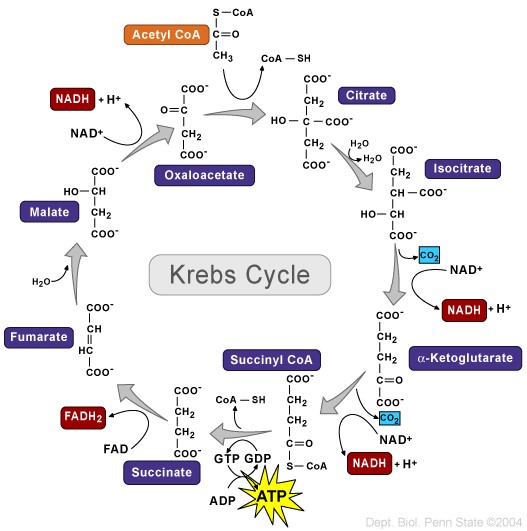
La manipolazione dell’assunzione di Carboidrati è una popolare strategia di picco pre-gara diffusa tra i bodybuilder [11, 12, 14]. La strategia, generalmente adottata durante la settimana che precede la competizione, prevede la limitazione sostanziale dell’assunzione di Carboidrati per diversi giorni (spesso indicata come fase di esaurimento o scarica) seguita da un breve periodo di consumo elevato di Carboidrati, con l’obiettivo di ottenere una supercompensazione dei livelli di glicogeno quando i carboidrati sono “stoccati” [22]. I livelli di glicogeno muscolare a riposo con una dieta mista (normale) sono ~ 130mmol/kg di muscolo (peso umido) in individui allenati (un po’ più alti dei soggetti sedentari) [23], o circa 23g di glicogeno (unità di glucosio) per chilogrammo di tessuto muscolare. Il glicogeno muscolare è organizzato nella cellula in frazioni subcellulari [24] e immagazzinato come un complesso di glicogeno-glicogenina (“granulo”) [25] che crea un effetto osmotico il quale attira acqua nella cellula mentre il glicogeno viene immagazzinato [26, 27], aumentando così il volume delle cellule muscolari. Le prime ricerche hanno suggerito che ogni grammo di glicogeno muscolare immagazzinato è accompagnato da circa 3-4g di acqua intracellulare [28]. Questo è superiore al valore comunemente indicato di 2,7g di acqua per grammo di glicogeno, a volte arrotondato a 3g di acqua per grammo di glicogeno, derivato da studi sul fegato di ratto [29, 30]. Tuttavia, i livelli di glicogeno muscolare risultanti dopo il carico di glicogeno sono altamente variabili [31], forse a causa della complessità sottostante all’accumulo di glicogeno intramuscolare [25]. Allo stesso modo, mentre è chiaro che il carico di glicogeno può aumentare il contenuto di acqua intracellulare [31], lo spessore muscolare [15] e le stime della massa corporea magra (LBM) [32], l’entità relativa dell’idratazione intracellulare in grammi di acqua per grammo di glicogeno può variare così tanto da non essere statisticamente correlato con il contenuto di glicogeno.[30]
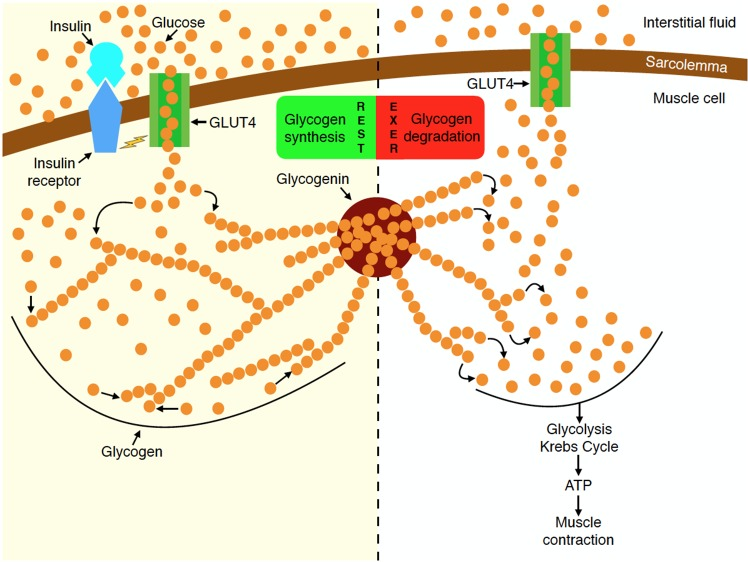
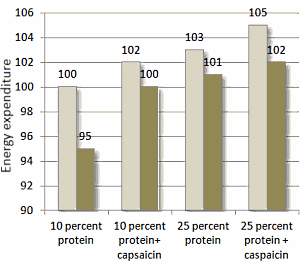
Sebbene la ricerca controllata sull’argomento sia limitata a ciò che è ottimale per i bodybuilder, le prove attuali sembrano indicare un potenziale beneficio della manipolazione dei carboidrati come strategia di picco. Una serie di casi esaminati da Bamman et al., i quali hanno esaminato sei bodybuilder maschi, ha fornito il supporto iniziale di un effetto benefico [1]. Secondo quanto riferito, i bodybuilder si sono impegnati in un protocollo di carico di carboidrati tre giorni prima della competizione (assunzione media di ~ 290g/giorno). Le misurazioni degli ultrasuoni effettuate 24-48 ore in questo periodo di carico di carboidrati hanno mostrato un aumento del 4,9% dello spessore del muscolo bicipite brachiale rispetto alle misurazioni ottenute sei settimane prima. Sebbene questi risultati sembrino suggerire che il protocollo di carico di carboidrati sia stato efficace nel migliorare in modo acuto la dimensione muscolare, va notato che il lungo intervallo tra le sessioni di test rende impossibile trarre conclusioni sulla causalità a questo proposito. Inoltre, gli autori dello studio non hanno valutato l’assunzione di carboidrati durante la fase di esaurimento dei carboidrati, offuscando ulteriormente gli effetti diretti del protocollo di carico. Pertanto, sebbene i risultati siano intriganti, il livello di prove a sostegno può essere considerato basso.
Un recente studio quasi sperimentale di de Moraes et al. [15] getta una luce più obiettiva sull’argomento. Ventiquattro bodybuilder dilettanti di alto livello sono stati divisi in base al fatto se avessero o meno manipolato i carboidrati come strategia di picco; il gruppo che ha manipolato i carboidrati ha impiegato una fase di esaurimento di tre giorni (che porta immediatamente al giorno del peso) seguita da una fase di carico di 24 ore (che porta al giorno della gara). Lo spessore muscolare è stato misurato sia al momento del peso che il giorno della gara. Inoltre, le foto dei concorrenti scattate in questi momenti sono state mostrate a un gruppo di giudici federati di bodybuilding, che hanno valutato soggettivamente il loro fisico; da notare, i giudici erano ciechi alle pratiche nutrizionali dei concorrenti. I risultati hanno mostrato un aumento del 3 % della dimensione muscolare della parte superiore delle braccia per coloro che hanno manipolato l’assunzione di carboidrati prima della competizione rispetto a nessun cambiamento in coloro che non lo hanno fatto. Inoltre, solo il gruppo che ha manipolato l’assunzione di carboidrati ha mostrato miglioramenti nelle misure estetiche soggettive, come determinato dall’ispezione visiva delle foto. Una potenziale limitazione dello studio è che i soggetti non sono stati sottoposti a test anti-doping prima della competizione; pertanto, non è noto se l’uso di steroidi anabolizzanti e/o altre sostanze sintetiche (ad es. synthol) possa aver influenzato i risultati. Gli studi futuri dovrebbero accertare tramite autovalutazione, poligrafo e/o analisi del sangue lo stato di libero/migliorato dei soggetti ed escludere o confrontare i risultati in base all’uso di steroidi da parte del soggetto nonché all’uso di altri farmaci che possono influenzare il bilancio idrico.
Recentemente, Schoenfeld ed Escalante hanno condotto un caso di studio in cui hanno seguito un bodybuilder natural di alto livello nel corso della sua preparazione al contest [33]. A partire dalla settimana prima della data della competizione, il concorrente ha ridotto notevolmente l’assunzione di carboidrati a < 50g/giorno per 3 giorni (domenica, lunedì, martedì) e poi ha eseguito una ricarica dei carboidrati a una quantità > 450g/giorno nei successivi 2 giorni (Mercoledì e giovedì). Simile alla ricerca precedente, la valutazione ecografica ha mostrato che la strategia di picco aumentava notevolmente lo spessore muscolare. In questo particolare caso di studio, gli aumenti sono stati del 5% negli arti superiori e del ~ 2 % negli arti inferiori; a causa delle limitate prove disponibili, è difficile fornire un motivo razionale per cui c’era una differenza tra i gruppi muscolari. Dati i risultati soggettivi riportati da de Moraes et al. [15], si può dedurre che questi risultati erano probabilmente significativi dal punto di vista della concorrenza.
Quando si considera la totalità della ricerca attuale, l’evidenza suggerisce che la manipolazione dei carboidrati è una valida strategia di picco per aumentare il volume della massa muscolare il giorno della gara; tuttavia, l’evidenza dovrebbe essere considerata preliminare data la relativa scarsità di studi pubblicati sull’argomento. Inoltre, la strategia può portare a un aumento dei sintomi gastrointestinali come dolore addominale, bruciore di stomaco, stitichezza e diarrea [15], che a loro volta possono influenzare negativamente la capacità di eseguire in modo ottimale la preparazione al giorno della gara e il contest stesso. Pertanto, i concorrenti dovrebbero sperimentare la strategia con almeno 2-4 settimane di anticipo per determinarne gli effetti a livello individuale e apportare le modifiche necessarie secondo necessità.
Manipolazione di acqua e sodio:
Acqua e sodio sono frequentemente manipolati dai bodybuilder, indipendentemente o contemporaneamente, impiegando una varietà di strategie che comportano il “carico” e la limitazione di entrambi [11], con l’obiettivo di ridurre al minimo l’acqua sottocutanea per massimizzare la definizione del muscolo scheletrico sottostante [8, 11, 12 , 14, 19, 20]. È noto che diversi bodybuilder si auto-prescrivono diuretici farmaceutici per facilitare il processo [8, 19,20,21, 34, 35]. I bodybuilder possono anche impiegare queste strategie per scendere a classi di peso inferiori, il che può fornire un vantaggio competitivo se il concorrente è in grado di recuperare parte del peso sotto forma di volume intramiocellulare (“riempimento” tramite glicogeno e/o stoccaggio di trigliceridi intramiocellulari) prima della competizione. Sebbene l’acqua e il sodio siano due componenti dietetici separati, è fondamentale comprendere che la manipolazione di una variabile influenza l’altra; quindi, esamineremo insieme queste due variabili.
In un’indagine precedentemente citata sulle strategie delle Peak Week e dei giorni di gara utilizzate dai bodybuilder natural, la manipolazione dell’acqua è stata la seconda strategia più popolare implementata (dietro la manipolazione dei carboidrati) [11]. I ricercatori hanno riferito che i concorrenti hanno implementato il carico dell’acqua (65,4%), la restrizione dell’acqua (32,1%) o entrambi (25%) per ottenere un aspetto “asciutto”. La quantità di acqua consumata durante la fase di carico variava da 4 a 12L al giorno ed era tipicamente seguita da restrizioni idriche di 10-24 ore prima della competizione. Oltre alla manipolazione dell’acqua, i ricercatori hanno anche riferito che i concorrenti utilizzavano la restrizione di sodio (13,6 %), il carico di sodio (18,5 %), o entrambi (6,2 %) senza un ordine temporale coerente per il regime di carico/restrizione del sodio (un errore limitante); tuttavia, la manipolazione del sodio veniva generalmente praticata tre o quattro giorni prima della competizione. È stato segnalato anche l’uso del tè al dente di leone per le sue presunte proprietà diuretiche.
Nello studio precedentemente discusso di Mitchell et al. [14], i ricercatori hanno riferito che il 100% dei partecipanti (n = 7) ha utilizzato la pratica del carico e del taglio dell’acqua durante la Peak Week. Questa strategia prevedeva di bere >10L di acqua al giorno all’inizio della settimana e quindi di ridurre l’assunzione ogni giorno successivo prima della competizione. La teoria alla base di questa pratica era quella di consumare quantità superflue di acqua per aumentare naturalmente l’escrezione di liquidi nel tentativo di espellere preferenzialmente l’acqua sottocutanea; tuttavia, i partecipanti hanno riferito che i risultati di questa strategia erano in gran parte non significativi [14]. Dei sette partecipanti che hanno manipolato l’acqua durante la Peak Week, tre (42,8%) hanno anche manipolato il sodio per aiutare a rimuovere l’acqua sottocutanea [14]. Hanno riferito di aumentare notevolmente l’assunzione di sodio per i primi tre giorni della Peak Week, seguita da una completa restrizione dell’assunzione di sale per i tre giorni prima della competizione; tuttavia, i risultati sono stati incoerenti e i partecipanti hanno dichiarato che non avrebbero manipolato il sodio in futuro [14]. Si noti che la decisione unanime dei partecipanti di abbandonare queste strategie di manipolazione dell’acqua e del sodio suggerisce che probabilmente non le avevano né eseguite né perfezionate in precedenza (ad esempio, come prova o durante la Peak Week per un’altra competizione).
Altre ricerche supportano i risultati degli studi di cui sopra. Probert et al. ha condotto un sondaggio su 382 bodybuilder competitivi insieme a interviste personali di 30 dei partecipanti e ha riferito che i bodybuilder si sono spesso impegnati in pratiche di deplezione del sodio e disidratazione nei giorni precedenti la competizione [12]. Sebbene i partecipanti abbiano riconosciuto i rischi di queste strategie, le hanno minimizzate come pratiche temporanee ma necessarie [12]. In effetti, i casi clinici documentano condizioni potenzialmente pericolose per la vita dovute a pratiche estreme di manipolazione dell’acqua e del sodio [19, 20]. In un caso, un bodybuilder maschio di 35 anni si è presentato al pronto soccorso dopo essersi sentito debole, stordito e aver avvertito crampi muscolari dolorosi mentre posava durante una gara di bodybuilding; i test hanno rivelato onde T di picco sull’elettrocardiogramma (ECG), iperkaliemia (alti livelli di potassio), iponatriemia (bassi livelli di sodio nel sangue), intossicazione da acqua e rabdomiolisi [20]. Il bodybuilder ha riferito di aver bevuto 12 litri di acqua al giorno per sette giorni prima della competizione insieme a 100 mg al giorno di Spironolattone (un diuretico da prescrizione risparmiatore di potassio) e scarico del sale per due giorni prima della competizione; è stato curato, stabilizzato e dimesso con successo [20]. In un altro caso, un bodybuilder professionista di 26 anni è stato trasportato al pronto soccorso il giorno dopo una gara a causa di palpitazioni cardiache e incapacità di stare in piedi a causa della difficoltà nel muovere le estremità [19]. Ha riferito l’assunzione orale di 2 × 80mg di Furosemide (un diuretico da prescrizione) 48 e 24 ore prima della competizione con l’obiettivo di migliorare la definizione muscolare; ha perso 5-6 kg di peso corporeo a causa della nicturia [19]. I test hanno rivelato ipokaliemia grave (bassi livelli di potassio; al contrario dell’iperkaliemia nel caso di studio discusso in precedenza probabilmente dovuto all’uso di un diuretico dell’ansa rispetto a un diuretico risparmiatore di potassio), iperglicemia (livelli elevati di glucosio nel sangue), iperlattatemia (alti livelli di lattato nel sangue) e tachicardia sinusale con onde U pronunciate all’ECG compatibili con ipokaliemia [19]. Sebbene l’ipokaliemia sia una condizione potenzialmente pericolosa per la vita, il bodybuilder è stato trattato con successo e dimesso la mattina successiva [19].
Nonostante le varie strategie riportate dai bodybuilder per manipolare l’acqua e il sodio allo scopo di sembrare “pieni e asciutti”, le prove attuali non indicano che queste pratiche siano specificamente efficaci e/o sicure. Inoltre, sebbene diverse strategie di manipolazione dell’acqua e del sodio siano state pubblicate da un certo numero di preparatori di bodybuilding che hanno lavorato con bodybuilder di grande successo [16, 17, 36], né l’efficacia né la sicurezza di queste diverse metodologie sono state valutate scientificamente. Quindi, i principi fisiologici della regolazione dei fluidi corporei devono essere considerati quando si tenta di formulare strategie per promuovere un aspetto “pieno e asciutto”, e queste strategie possono essere discordanti con quelle attualmente utilizzate dai bodybuilder e/o suggerite dai loro preparatori.
Il contenuto di acqua corporea totale (TBW) rappresenta circa il 60 % del peso corporeo medio di una persona ed è costituito da acqua intracellulare (ICW) (~ 67 %) e acqua extracellulare (ECW) (~ 33 %). L’ECW è ulteriormente compartimentato nel fluido interstiziale che circonda le cellule (~ 25 %) e il plasma sanguigno (~ 8 %) [37, 38]. Quindi, dal punto di vista di un bodybuilder, ridurre al minimo il fluido interstiziale extracellulare che circonda i miociti, in particolare l’acqua sottocutanea, preservando o aumentando l’ICW intramiocellulare rappresenta lo scenario ideale per un aspetto “pieno e asciutto”, cioè, per cui l’aspetto della muscolarità è massimizzato . Sebbene questo concetto possa sembrare un compito semplice da realizzare manipolando solo l’acqua e il sodio, potrebbero essere necessarie altre strategie incentrate sull’ottimizzazione del volume intramiocellulare (cioè quelle mirate al glicogeno intramiocellulare, ai trigliceridi e al contenuto di potassio) insieme alla manipolazione dell’acqua. e sodio per migliorare l’aspetto della muscolosità.
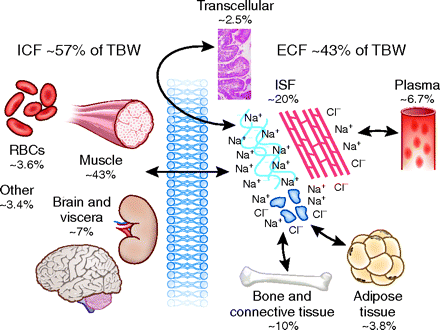
Durante la normale omeostasi fluido-elettrolitica, il compartimento extracellulare contiene la maggior parte del sodio (Na+), cloruro (Cl-) e bicarbonato (HCO3-), mentre il compartimento intracellulare contiene la maggior parte dell’acqua, potassio (K+) e fosfato ( PO43−) [39]. Sebbene entrambi i compartimenti contengano tutti i suddetti composti, la quantità di ciascuno varia tra i compartimenti in modo tale che la concentrazione totale di soluti (osmolarità) sia la stessa [39]. I meccanismi omeostatici controllano l’equilibrio idrico ed elettrolitico per garantire che la TBW e l’osmolarità corporea totale (TBO) rimangano equilibrate e l’acqua si ridistribuisca tra i compartimenti intracellulari ed extracellulari in modo tale che l’osmolarità dei fluidi corporei si avvicini alla TBO [37]. Infatti, Costill et al. hanno studiato le perdite muscolari di acqua ed elettroliti mentre i partecipanti pedalavano in una camera ambientale calda per perdere il 2,2 (% (fase 1), il 4,1 % (fase 2) e il 5,8 % (fase 3) del loro peso corporeo in un periodo stimato di 5,5 ore [40] . Quando i partecipanti hanno perso il 2,2% del loro peso corporeo entro la prima ~ 1,5 h nella fase 1, il 30% dell’acqua persa era ICW mentre il 70% era ECW [40]. Tuttavia, il rapporto tra ICW ed ECW perso è diventato 52 % ICW/48 % ECW allo stadio 2 (~ 3.5 h mark) e 50 % ICW/50 % ECW allo stadio 3 (~ 5.5 h mark) [40]. Gli autori hanno affermato che la grande perdita di ICW nel muscolo allo stadio 1 può essere spiegata dalla significativa perdita di contenuto di glicogeno muscolare (che contiene acqua) dalla pre-disidratazione a 115 mmol/kg fino a 76 mmol/kg; tuttavia, i livelli di contenuto di glicogeno muscolare sono scesi a una velocità molto inferiore a 73 mmol/kg allo stadio 2 e 61 mmol/kg allo stadio 3 quando il rapporto o ICW:ECW si è stabilizzato [40]. Pertanto, il rapporto tra la perdita ECW e ICW sembra rimanere vicino a 1:1 poiché i livelli di glicogeno si stabilizzano nel tempo e vengono raggiunti livelli più elevati di disidratazione. Pertanto, sembra che la ritenzione del glicogeno muscolare, evitando l’esercizio che si basa fortemente sull’uso del glicogeno, possa essere importante se i metodi di perdita di acqua devono effettuare una perdita favorevole di ECW rispetto a ICW (ECW > ICW) in modo tale che la dimensione muscolare venga mantenuta mentre l’ECW interstiziale viene preferibilmente perso, migliorando l’aspetto della “definizione” muscolare. Allo stesso modo, l’immagazzinamento e la ritenzione del glicogeno muscolare dipendono fortemente dalla disponibilità di potassio (un catione intracellulare primario – vedi sopra) [41,42,43,44,45,46], quindi sembra che garantire un’adeguata assunzione di potassio durante le procedure di carico di carboidrati e disidratazione sia fondamentale per ottimizzare l’aspetto scenico.
È importante sottolineare che se le alterazioni dell’osmolarità plasmatica (attraverso i cambiamenti nell’acqua corporea totale e degli elettroliti) raggiungono una soglia fisiologica, allora una complessa rete neuroendocrina in tutto il corpo, nel cervello, vasi sanguigni, reni e ghiandole endocrine, risponderà per stabilizzarlo [47] . L’osmolarità plasmatica è influenzata dalle variazioni (aumento o diminuzione) della concentrazione di soluti (cioè sodio) nel sangue nonché dalle variazioni del volume del fluido; il volume del fluido è influenzato dall’acqua corporea totale (TBW) [48]. L’osmolarità plasmatica può aumentare per un’eccessiva perdita di acqua o per un aumento significativo dell’assunzione di sodio; al contrario, l’osmolarità plasmatica può diminuire con un consumo insufficiente di elettroliti o un’eccessiva assunzione di acqua [49]. L’osmolarità plasmatica e la pressione sanguigna sono regolate in modo tale che l’aumento dell’osmolarità plasmatica si traduca in una diminuzione della pressione sanguigna e viceversa [49]. Inoltre, le variazioni della pressione sanguigna mediate dallo spostamento dell’osmolarità plasmatica sono contrastate dai barocettori arteriosi e renali [50].
Durante la disidratazione, come potrebbe essere impiegato durante la Peak Week, l’osmolarità plasmatica aumenta, la pressione sanguigna diminuisce ed i barocettori renali nell’apparato iuxtaglomerulare (JGA) rilasciano l’ormone Renina; a sua volta, questo attiva il sistema Renina-Angiotensina-Aldosterone (RAAS) [51]. Quando viene attivato il RAAS, viene avviato il processo di mantenimento dell’omeostasi dei fluidi, elettroliti e pressione sanguigna [51] e alla fine rilascia l’ormone Aldosterone dalle ghiandole surrenali per perfezionare ulteriormente l’omeostasi [52, 53]. I barocettori nell’aorta e nelle arterie carotidi rilevano anche una diminuzione della pressione sanguigna e segnalano il rilascio dell’Ormone Antidiuretico (ADH, noto anche come Vasopressina) dalla ghiandola pituitaria per conservare l’acqua, aumentare il volume del sangue e aumentare la pressione sanguigna [48]. Al contrario, se la pressione sanguigna aumenta a causa dell’aumento del volume sanguigno arterioso, gli atri cardiaci percepiscono un allungamento e rilasciano l’ormone Fattore Natriuretico Atriale (ANF) per aumentare l’escrezione di sodio, inibire la vasocostrizione renale, attenuare la secrezione di Renina e infine diminuire il volume sanguigno e la pressione sanguigna [54].
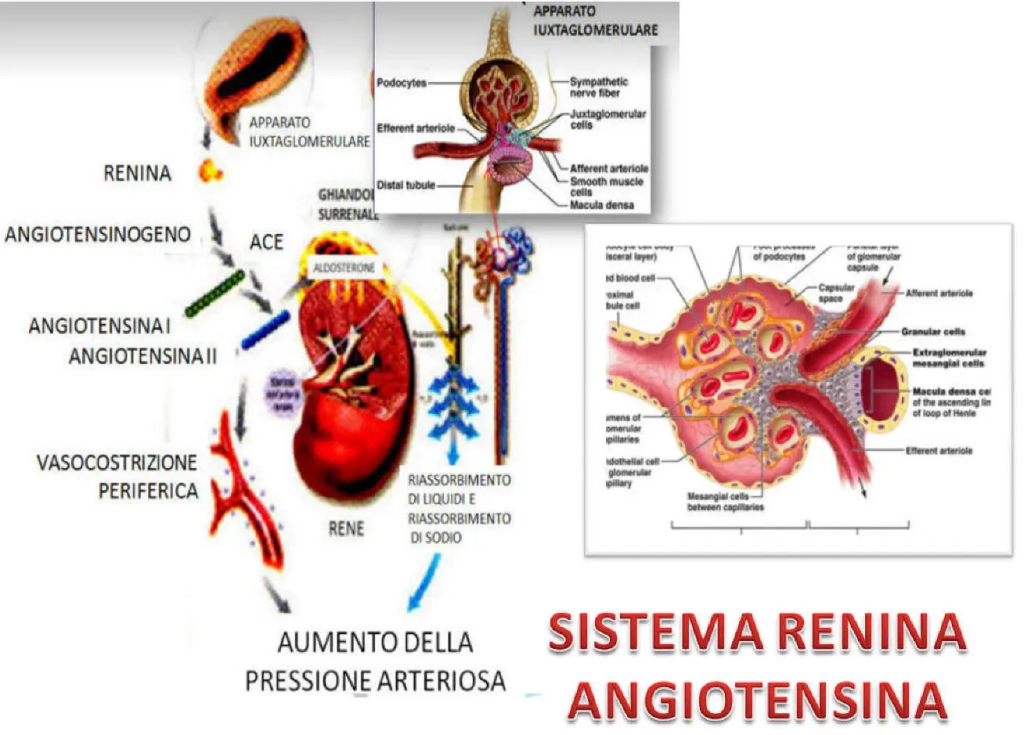
Collettivamente, se l’acqua e il sodio non vengono manipolati e programmati con cura, questi meccanismi fisiologici che lavorano per mantenere il corpo in omeostasi potrebbero non produrre l’effetto desiderato di ridurre selettivamente il fluido nello spazio extracellulare/sottocutaneo. Sebbene questi meccanismi siano in atto per mantenere il corpo in equilibrio, non tutti gli ormoni rilasciati hanno un effetto immediato sul corpo quando l’osmolarità plasmatica è alterata. Ad esempio, uno studio ha mostrato un effetto ritardato dell’ADH quando i ricercatori hanno esaminato gli effetti del carico d’acqua sulla perdita di peso acuta negli atleti di sport da combattimento confrontando una strategia di carico d’acqua per tre giorni in cui il gruppo sperimentale ha consumato 100ml/kg/giorno di acqua rispetto ad un gruppo di controllo che ha consumato 40ml/kg/giorno di acqua [55]. Durante il successivo giorno di disidratazione con entrambi i gruppi che consumavano 15ml/kg/giorno di acqua, i livelli di ADH nel gruppo di carico idrico sono aumentati da ~ 2,3pmol/L a ~ 3,8pmol/L alla 13a ora e ~ 5pmol/L a la 24a ora di restrizione dei liquidi, momento in cui le perdite di massa corporea hanno superato quelle del gruppo di controllo dello 0,6 % (~ 2,5 vs. 3,1 % rispetto al basale) [55]. Pertanto, nonostante l’aumento della produzione totale di liquidi da 3 giorni di carico idrico combinato con un giorno di drastica restrizione dei liquidi, i livelli di ADH stavano ancora salendo oltre le 24 ore di disidratazione [55]. In un altro studio, i ricercatori hanno ridotto l’assunzione di sodio a livelli estremamente bassi (10meq/giorno) per ~ 6 giorni in 16 uomini sani e hanno misurato i livelli di RAAS, Aldosterone plasmatico, sodio urinario e sodio sierico a 24 ore, 48 ore e ~ 6 giorni dopo l’intervento [53]. Sebbene i livelli sierici di sodio siano rimasti abbastanza coerenti tra 137,6 e 139meq/l per il periodo di ~ 6 giorni, i ricercatori hanno riferito che l’attivazione del RAAS era evidente entro 24 ore e diminuiva la produzione di sodio nelle urine da 217meq/24 ore fino a 105meq/24 ore [53]. Inoltre, ci sono volute 48 ore per osservare un forte aumento dei livelli di Aldosterone plasmatico per ridurre ulteriormente la produzione di sodio nelle urine a 59meq/24 ore e altri ~ 4 giorni affinché la produzione di sodio nelle urine si stabilizzasse a 9,9meq/24 ore [53]. Quindi, c’è un ritardo temporale nello stabilire l’omeostasi di fluidi ed elettroliti durante il quale la manipolazione di acqua e sodio può essere implementata per indurre la diuresi prima che i meccanismi omeostatici protettivi si manifestino completamente per arrestare la perdita di acqua.
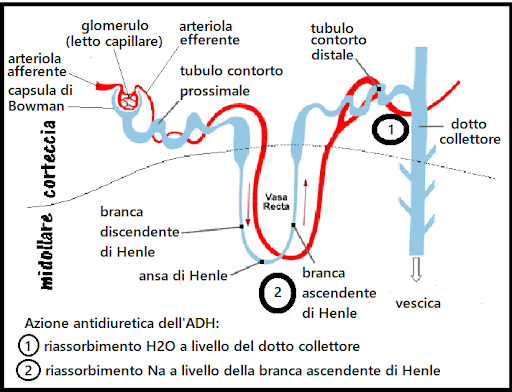
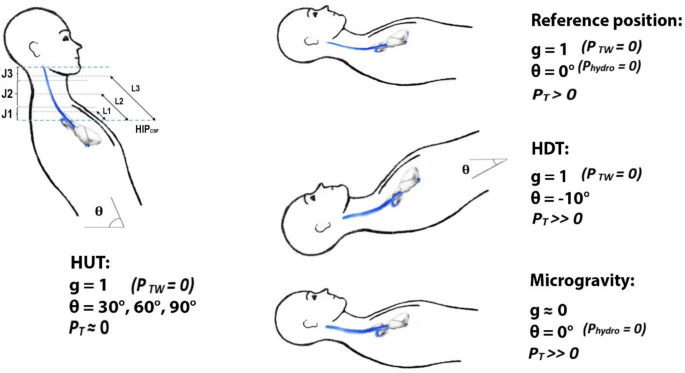
Mentre i bodybuilder manipolano spesso l’acqua e/o il sodio alterandone l’assunzione [8, 11, 12, 14, 19, 20], può essere presa in considerazione anche un’altra strategia praticabile per aumentare la diuresi. La letteratura sull’atrofia da disuso e gli adattamenti cardiovascolari all’assenza di gravità durante il volo spaziale [56] rivela una strategia precedentemente descritta [36] che i culturisti possono impiegare per promuovere la diuresi durante le ~ 24 ore prima della competizione. Riposare e/o dormire con una posizione di “inclinazione a testa in giù” (HDT) (tipicamente da − 4 a -6˚ per cui l’intera superficie durante il sonno è inclinata verso il basso [57, 58] simula l’aumento del ritorno venoso cardiaco (e la perdita di pressione ortostatica) che si verifica durante la microgravità. Ciò si traduce in diuresi e risposte cardiovascolari simili a quelle osservate acutamente durante il volo spaziale [57,59], mediate in parte da un aumento del Peptide Natriuretico Atriale (rilasciato dal cuore) e da una riduzione della Renina plasmatica [60,61] Mauran et al., ad esempio, hanno dimostrato che queste risposte ormonali e la diuresi e la natriuresi associate ritornano ai valori di base entro 24 ore [62], provocando una perdita di peso corporeo di circa 1,0-1,3 kg senza variazioni della frequenza cardiaca a riposo o del sangue [58, 60, 61] Brevi periodi di HDT più grave fino a -30 % evocano aumenti graduali della pressione venosa centrale oltre quelli di -6 % HDT [63], sebbene le risposte diuretiche all’angolo HDT siano inferiori a −T6 % non sembra siano stati studiati. Brevi (≤ 2 h) periodi di HDT fino a -40˚ sembrano ben tollerati [64, 65], ma una HDT prolungata ad angoli -12 % aumenta significativamente la pressione intracranica e intraoculare [66]. Inoltre, chi soffre di reflusso gastrico dovrebbe essere consapevole che l’HDT potrebbe in teoria peggiorare la sintomatologia, dato che sollevare la testa sopra il livello del letto (l’opposto dell’HDT) è un rimedio efficace [67,68,69,70]. Questo probabilmente non è un problema per coloro che normalmente non soffrono di reflusso gastrico [71]. Pertanto, i bodybuilder potrebbero plausibilmente impiegare l’HDT durante il riposo e il sonno durante le 12-24 ore prima della competizione per incoraggiare ulteriormente la diuresi se necessario.
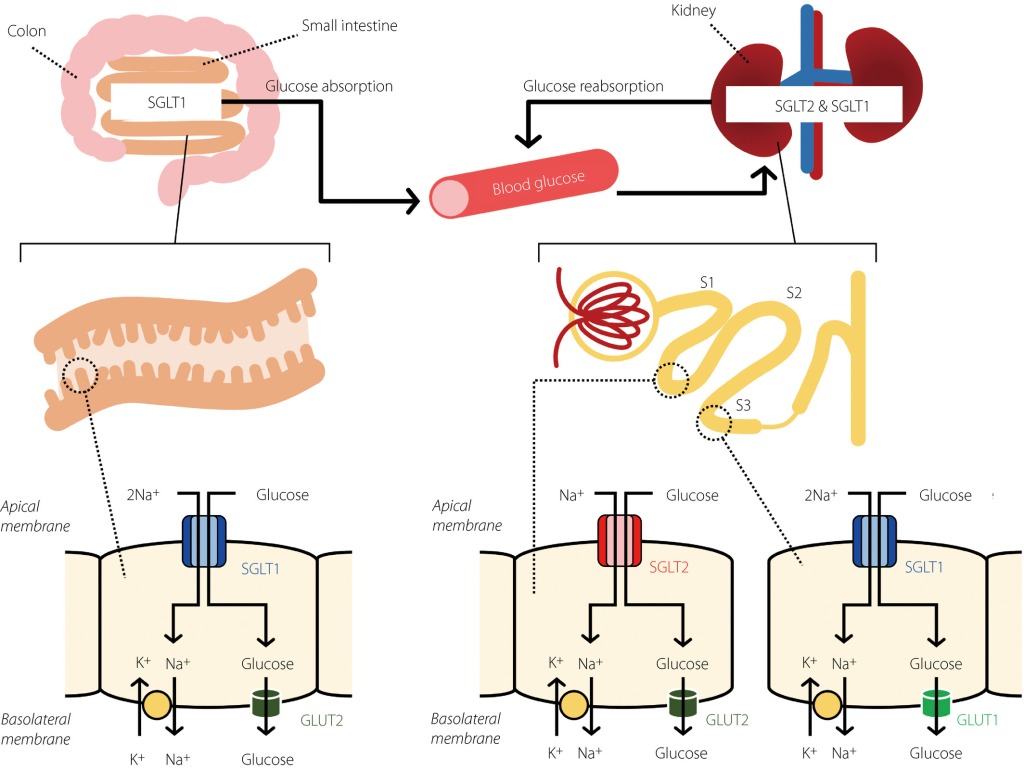
Un’altra considerazione quando si manipola l’assunzione di acqua e sodio è il ruolo importante che svolgono nell’assorbimento dei carboidrati. I cotrasportatori sodio-glucosio dipendenti (SGLT) sono proteine presenti nell’intestino tenue che consentono il trasporto del glucosio attraverso la membrana cellulare; una forte evidenza suggerisce che la consegna del trasporto di carboidrati è limitata dalla capacità di trasporto SGLT1 [72,73,74,75]. Poiché il carico di carboidrati sembra avere potenziali benefici per i bodybuilder di apparire “pieni”, è importante la disponibilità di sodio per il co-trasporto del glucosio attraverso le membrane cellulari. È interessante notare che lo studio di de Moraes et al. hanno riferito che il carico di carboidrati ha indotto vari sintomi gastrointestinali nei bodybuilder agonisti [15]. Sebbene l’assunzione di sodio non sia stata riportata in questo studio, alcuni dei sintomi potrebbero essere stati dovuti alla mancanza di sodio nella dieta poiché i bodybuilder hanno riferito di ridurre al minimo l’assunzione di sodio mentre si avvicinano al giorno della gara [11, 14, 20]. Inoltre, poiché ogni grammo di glicogeno attira ~ 3–4g di acqua nel muscolo [31] e questo è un processo dipendente dal potassio (vedi sopra), una mancanza di acqua e di potassio può anche ridurre l’efficacia del raggiungimento di un aspetto “pieno”.
Contrariamente al tipico obiettivo di ridurre l’acqua corporea (extracellulare, sottocutanea), il disturbo psicologico/stress emotivo può causare ritenzione di liquidi corporei [76] attraverso l’azione delle catecolamine (in particolare della Dopamina) [77,78,79] e degli ormoni surrenalici includendo sia il Cortisolo [80] che l’Aldosterone [81]. La ritenzione idrica durante condizioni sperimentali di stress che richiedono competizione è soggetta a variabilità interindividuale, forse dovuta in parte a differenze genetiche [82]. In casi estremi, situazioni emotivamente stressanti possono evocare polidipsia e alterare l’omeostasi dei fluidi in modo tale che aumenti fino a 9 kg (~ 20 libbre) di massa corporea possono accumularsi in appena 48 ore [78, 79]. Pertanto, c’è supporto per l’osservazione empirica comune che lo stress psicologico possa contrastare i tentativi del bodybuilder agonista di ridurre l’acqua corporea, specialmente nei casi estremi di ansia pre-gara. Gli autori raccomandano di eseguire una prova pratica della strategia della Peak Week ~ 2–4 settimane prima della competizione effettiva, in parte per ridurre l’ansia e assicurare al concorrente che la strategia della Peak Week è sia gestibile che efficace. Sebbene ciò vada oltre lo scopo di questo articolo, la gestione dello stress è riconosciuta come un aspetto importante della psicologia dello sport [83, 84] ed è molto probabile che sia importante per i concorrenti che trovano gli ultimi giorni prima della competizione così stressanti da influenzare negativamente il loro aspetto sul palco.
Sulla base di questi principi dell’equilibrio idrico-elettrolitico e delle attuali prove disponibili, sembra che la manipolazione dell’acqua e del sodio debba essere attentamente considerata, pianificata e praticata insieme alla manipolazione dei carboidrati se devono essere utilizzate. Sebbene sembrino esserci alcuni potenziali benefici nell’implementazione di queste strategie per migliorare la forma fisica il giorno della competizione, possono verificarsi effetti potenzialmente dannosi se queste variabili vengono calcolate in modo errato e/o con un cronometraggio errato che può causare ai bodybuilder di perdere il loro picco e/o incorrere in problemi di salute; quindi, lasciare queste variabili a se stesse potrebbe essere un’opzione migliore per alcuni concorrenti. Poiché è stato riferito che i bodybuilder considerano la manipolazione del sodio e dell’acqua come pratiche temporanee ma necessarie minimizzando i potenziali rischi coinvolti, è necessario prestare attenzione poiché sono state segnalate misure estreme che hanno portato a condizioni potenzialmente letali [12, 19, 20]. Le sezioni sulle applicazioni pratiche di questo articolo delineeranno ulteriormente come queste variabili possono essere manipolate in modo sicuro sulla base delle prove attualmente disponibili.
Grassi alimentari:
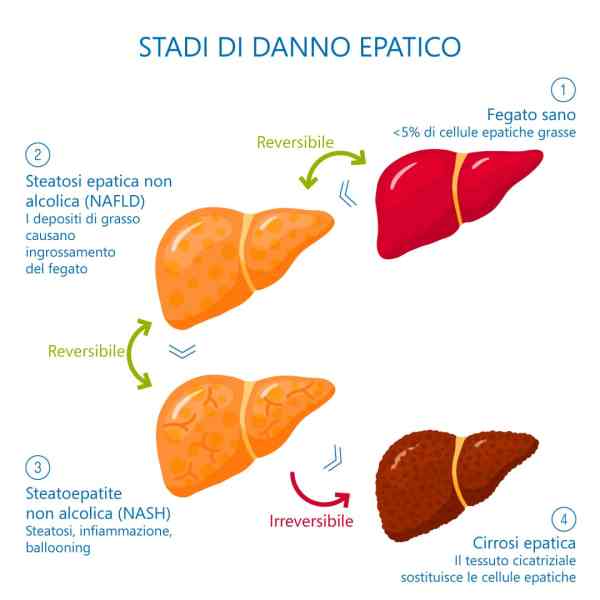
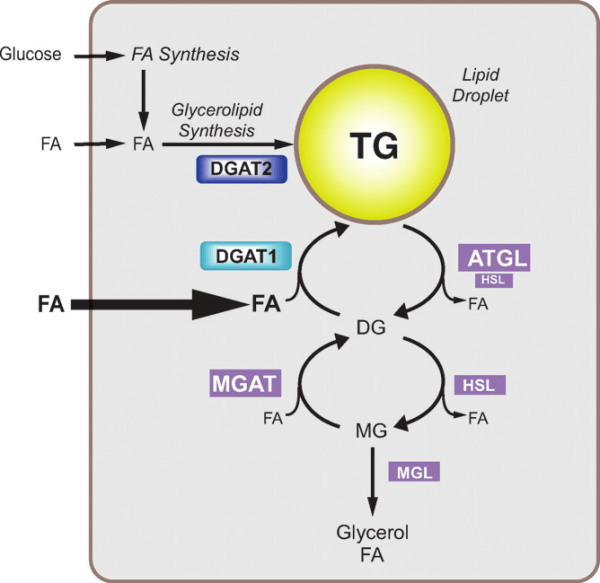
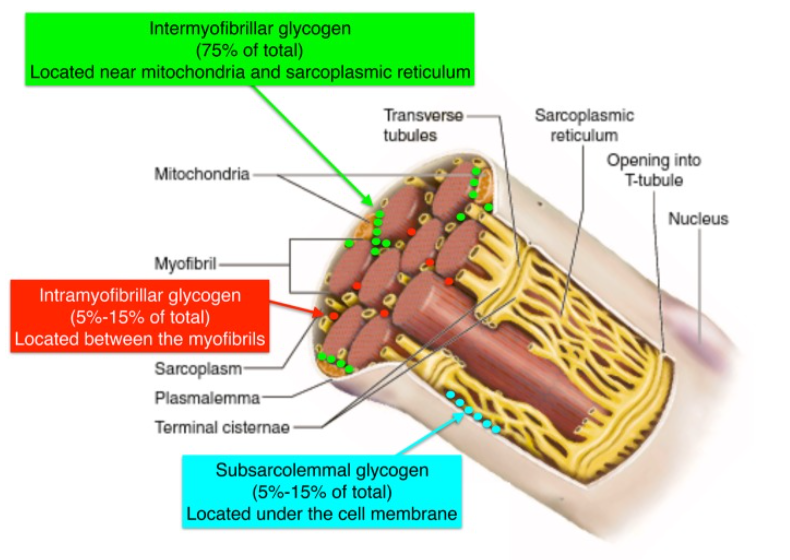
Oltre al glicogeno, le cellule muscolari immagazzinano anche energia sotto forma di Trigliceridi Intramuscolari (IMT). Infatti, nelle cellule muscolari viene immagazzinata quasi la stessa quantità di energia immagazzinata nell’IMT rispetto al glicogeno [85]. Tuttavia, i depositi di IMT variano considerevolmente negli esseri umani, in parte in funzione dello stato di allenamento, del tipo di fibra muscolare, della sensibilità all’Insulina, del sesso e della dieta [85]. L’IMT possono ammontare a ~ 1 % del peso muscolare [86, 87], ma poiché il grasso è meno denso del muscolo scheletrico [88], il volume di IMT in una cellula muscolare completamente “caricata di grasso” potrebbe superare il 2% del volume muscolare [89, 90]. Nei ratti (17), un singolo esercizio può ridurre il contenuto di IMT muscolare del 30% e tre giorni di una dieta ricca di grassi possono aumentare la conservazione dell’IMT di circa il 60% rispetto al basale [91]. Negli esseri umani, il reintegro alimentare di IMT può essere più lento quando anche il ripristino del glicogeno è una priorità [89, 92, 93, 94]. Tuttavia, le riserve di IMT sono aumentate dall’assunzione di grassi nella dieta [91, 95] e ridotte durante l’esercizio di contro-resistenza [96] e di endurance [85].

Sebbene il carico dei grassi sia una strategia nota nell’ambiente del Bodybuilding da molti anni [97, 98], a mia conoscenza la strategia non è stata studiata direttamente nel contesto della Peak Week del bodybuilding (p. es., in combinazione con altre strategie dietetiche come la supercompensazione del glicogeno) . Nello studio sui roditori menzionato sopra [91], tre giorni di dieta ricca di grassi seguiti da tre giorni di dieta ricca di carboidrati (CHO) hanno determinato una supercompensazione sia dei IMT che del glicogeno; tuttavia, e c’era da aspettarselo, 6 giorni di soli CHO elevati hanno prodotto l’effetto di carico di glicogeno previsto, ma non sono riusciti a elevare i livelli di IMT al di sopra del basale. Negli esseri umani, le diete ad alto contenuto di CHO/a basso contenuto di grassi possono effettivamente far precipitare le riserve di IMT [92,93,94], forse perché i IMT vengono utilizzati preferenzialmente per coprire i costi energetici della riparazione cellulare post-esercizio e dell’assemblaggio di glicogeno-glicogenina [94, 99]. Considerando che un bodybuilder di grandi dimensioni (ad es. un uomo di categoria pesi massimi) può trasportare oltre 60kg di muscoli [100, 101], aumentare le riserve di IMT da uno stato relativamente “esaurito” a uno “carico” potrebbe concepibilmente aumentare il volume muscolare di > 1 % [85 ]; ipoteticamente, questo si traduce nell’aggiunta di ≥ 0,6kg di massa magra. Quindi, il carico di grasso sembra essere una strategia promettente da utilizzare in combinazione con il carico dei CHO durante la Peak Week per i bodybuilder, e quindi merita studi futuri in un ambiente controllato.
Proteine alimentari:
Insieme all’assunzione di carboidrati e grassi durante la Peak Week, l’ottimizzazione dell’assunzione di proteine merita di essere trattata, poiché è una componente importante e indispensabile della dieta. La dose dietetica raccomandata negli Stati Uniti (RDA) per le proteine per gli adulti è di 0,8g/kg [102] ed è rimasta invariata dal ~ 1980, nonostante la continua esposizione della sua inadeguatezza. In un invito a rivalutare e rivedere la RDA, Layman [103] ha sostenuto che il fabbisogno proteico è inversamente proporzionale all’assunzione di energia. Quest’ultimo punto si applica alle persone a dieta in generale, ma ha un significato speciale per gli atleti in condizioni ipocaloriche prolungate, incarnate dai bodybuilder agonisti nel pre-gara. Alla luce di prove crescenti, un’assunzione giornaliera di 1,2-1,6g/kg è stata proposta come ottimale per la popolazione generale che mira a ottimizzare la salute e la longevità all’interno di uno stile di vita fisicamente attivo [104]. Verso l’estremità più atletica dello spettro, nella meta-analisi più completa del suo genere, Morton et al. [105] hanno scoperto che un apporto proteico di ~ 1,6g/kg (IC al 95 % superiore di 2,2 g/kg) massimizzava l’ipertrofia muscolare e la forza negli atleti di resistenza amatori non a dieta. In uno studio più rappresentativo dei bodybuilder, Bandegan et al. [106] hanno valutato la sintesi proteica dell’intero corpo tramite il metodo degli indicatori dell’ossidazione degli aminoacidi (IAAO) e hanno determinato un fabbisogno medio stimato di 1,7g/kg/giorno con un intervallo di confidenza superiore del 95% di 2,2 g/kg/giorno vicino al loro massimo muscolare raggiungibile. In un protocollo simile utilizzando il metodo IAAO, Mazzulla et al. [107] hanno stimato che il fabbisogno proteico degli uomini allenati contro-resistenza è di 2,0-2,38g/kg.
In una review sistematica di Helms et al. [108] è stato riferito che 2,3-3,1g/kg di massa magra (FFM) erano appropriati per soggetti allenati contro-resistenza in condizioni ipocaloriche. Tuttavia, dei sei studi inclusi nella review, solo due hanno coinvolto atleti competitivi altamente allenati e solo uno studio ha esaminato i bodybuilder agonisti. Quest’ultimo studio è stato condotto da Mäestu et al. [109], che hanno monitorato la composizione corporea e il profilo ormonale di bodybuilder di livello nazionale e internazionale durante le ultime 11 settimane di preparazione al contest. I concorrenti hanno dichiarato che non stavano utilizzando steroidi da un minimo di due anni prima dello studio. L’assunzione di proteine era di 2,68g/kg (2,97 g/kg FFM) al basale e 2,48 g/kg (2,66 g/kg FFM) al punto di valutazione finale (3 giorni prima della gara).
Chappell et al. [2] hanno riportato che nei bodybuilder di alto livello natural, l’assunzione di proteine di fine preparazione di uomini e donne che si sono posizionati tra i primi 5 è stata rispettivamente di 3,3g/kg e 2,8g/kg. La composizione corporea non è stata riportata in questo studio. Sulla base dei tipici intervalli percentuali di grasso corporeo alla fine della preparazione, l’aggiunta del 4-6% all’assunzione degli uomini e del 13-15% all’assunzione delle donne fornirebbe una stima dei grammi di proteine consumati per kg di FFM. Un caso studio di Kistler et al. [3] su un campione di bodybuilder natural di alto livello ha riportato un apporto proteico di 3,4g/kg (3,6 g/kg FFM). Sebbene la natura descrittiva di questi studi precluda la capacità di trarre conclusioni sul fatto che il livello di assunzione osservato fosse benefico, neutro o dannoso da un punto di vista fisico, sembrano convergere su un dosaggio proteico simile nella fase finale del periodo pre-gara.
Una possibile considerazione per il dosaggio delle proteine durante la Peak Week è se mantenere l’assunzione di proteine statica o modificarla durante le fasi di esaurimento e carico dei carboidrati. Sebbene attualmente non esistano prove concrete su ciò che è ottimale per la nostra conoscenza, lo studio di de Moraes et al. [15] che ha riportato un aumento del volume muscolare e un miglioramento dell’aspetto fisico come risultato di un protocollo di carico di carboidrati fornisce alcune prove che i bodybuilder alterano il loro apporto proteico durante la Peak Week. In questo studio, il protocollo di esaurimento/carico prevedeva tre giorni di dieta a basso contenuto di carboidrati (1,1g/kg) e ad alto contenuto proteico (3,2g/kg) seguiti da un solo giorno di dieta ad alto contenuto di carboidrati (9,0g/kg) e dieta ipoproteica (0,6g/kg). Sembra probabile che si sarebbero verificati aumenti simili del volume muscolare se le proteine fossero state mantenute statiche. Tuttavia, nonostante il ridotto apporto proteico (46,6g nel giorno durante il carico di carboidrati rispetto ai 252,4g nei giorni di scarica dei carboidrati), il disagio gastrointestinale era ancora significativamente maggiore rispetto al gruppo di controllo senza carico di carboidrati. Ciò indica la possibilità che mantenere alta l’assunzione di proteine durante il giorno di carico avrebbe ulteriormente peggiorato i sintomi gastrointestinali, potenzialmente a causa di un’eccessiva assunzione di cibo. Un’alternativa sarebbe quella di mantenere le proteine statiche, ma ridurre il carico di carboidrati (che in questo caso era ~714g), tenendo più di 1 giorno per il carico di carboidrati. Questo sembra un approccio più pratico (vedi sopra), in modo tale che un apporto totale di carboidrati ancora maggiore possa essere consumato ma con meno rischio di problemi gastrointestinali.
Una strategia potenzialmente praticabile per alterare l’assunzione di proteine durante la Peak Week è mantenere l’assunzione di proteine relativamente alta a ~ 2,5–3,5g/kg/giorno durante i primi ~ 3 giorni di esaurimento del glicogeno di una strategia di supercompensazione del glicogeno, seguita da una apporto proteico di ~ 1,6g/kg/giorno durante una dieta ricca di carboidrati per 1-3 giorni (vedi sopra), terminando almeno 24 ore prima della competizione programmata. Successivamente, potrebbe essere impiegata una strategia per indurre la diuresi e (ulteriormente) aumentare le riserve di IMT durante il giorno precedente la competizione seguendo una dieta ricca di proteine e povera di carboidrati (riccha di grassi) per un breve periodo (~12-24 h). Come discusso in precedenza, quando si caricano i carboidrati utilizzando un approccio a basso contenuto di grassi, i livelli di IMT possono diminuire, ma livelli elevati di glicogeno persistono per diversi giorni senza contrazioni impegnative che riducono il glicogeno (ad esempio, esercizio contro-resistenza o eccessiva attività fisica). Alti livelli di glicogeno intramuscolare e dell’acqua intracellulare associata impedirebbero quindi la perdita di ICW che tipicamente accompagna la diuresi. Aumentare l’assunzione di proteine consumate il giorno prima del contest, o semplicemente consumare proteine ad alti livelli tipicamente impiegati dai bodybuilder pre-gara (~ 3,0-3,5g/kg/giorno; vedi sopra) e recentemente dimostrato di essere generalmente sicuro per periodi più lunghi [ 110], incoraggerà una maggiore deaminazione ossidativa degli amminoacidi e l’ureagenesi [111] che si avvicinano ai tassi massimi osservati in individui sani [112, 113]. La clearance dell’urea ematica a sua volta richiede un gradiente osmotico durante la sua escrezione renale, causando così diuresi [114, 115]. Inoltre, il ritorno a una dieta a basso contenuto di carboidrati (ad esempio, una simile a quella utilizzata all’inizio della settimana per il carico di grassi in preparazione al carico di carboidrati) promuoverebbe anche la perdita di acqua corporea [116, 117]. Pertanto, aumentare o mantenere un’assunzione elevata di proteine mentre si riduce l’assunzione di carboidrati e contemporaneamente aumenta l’assunzione di grassi durante il giorno prima della competizione, annullerebbe i guadagni indesiderati di acqua extracellulare/sottocutanea sperimentati durante il carico di carboidrati [118]. Sarebbe inoltre complementare ad altre misure strategiche progettate per indurre la diuresi come la manipolazione dell’assunzione di acqua/sodio/potassio, l’integrazione alimentare e il posizionamento del corpo (ad es. HDT) che offrirebbe anche una seconda opportunità per il carico dei grassi durante la Peak Week. Nell’incertezza sull’efficacia della modifica di de Moraes et al. e altri protocolli può essere mitigata solo per tentativi ed errori, come verrà ulteriormente discusso nella sezione delle applicazioni pratiche, e giustificano ulteriori indagini scientifiche.
Supplementazione alimentare:
Il consumo di integratori è comune tra i bodybuilder ed è spesso manipolato durante le loro fasi preparatorie (cioè off-season e pre-gara) [2, 3, 5]. Sebbene sia ben noto che i bodybuilder utilizzino integratori come proteine in polvere, polimeri del glucosio, stimolanti pre-allenamento, sostanze adattogene/nootrope, creatina, vitamine/minerali, omega-3, termogenici, diuretici erboristici e molto altro [2, 7], c’è una scarsità di dati su come questi integratori influenzino il processo di picco dell’atleta per migliorare la propria condizione fisica. Quindi, discuteremo i potenziali benefici dell’utilizzo di integratori alimentari (cioè polveri di proteine / carboidrati, acidi grassi), creatina ed erbe durante la settimana di punta.
Integratori alimentari che forniscono un substrato energetico come proteine e carboidrati sono stati regolarmente segnalati da altri ricercatori che esaminano i bodybuilder [2, 3, 5]. Chappell et al. [2] hanno esaminato cinquantuno (35 uomini e 16 donne) bodybuilder natural e hanno scoperto che ~ 75 % degli uomini e ~ 89 % delle donne sono stati integrati con polveri proteiche. L’integrazione di carboidrati era meno popolare, con solo il ~37 % dei concorrenti uomini e nessuna concorrente donna che ne segnalava l’uso. I bodybuilder possono utilizzare questi integratori alimentari come mezzo per manipolare e consumare quantità specifiche di macronutrienti. Come accennato in precedenza nelle sezioni carboidrati e acqua/sodio, i bodybuilder cercano di massimizzare il glicogeno muscolare e il suo effetto osmotico associato come mezzo per aumentare il volume muscolare totale. Pertanto, è comune integrare con varie polveri di carboidrati (ad esempio Destrosio, Ciclo-Destrine altamente ramificata, ecc.). Le caratteristiche dei carboidrati come l’osmolalità, il tasso di clearance gastrica e l’indice glicemico sono alcune delle variabili fisiche che gli atleti dovrebbero prendere in considerazione poiché possono variare significativamente tra le fonti e possono influire sui sintomi gastrointestinali (ad es. gonfiore, crampi, diarrea, stitichezza, ecc.) [ 119,120,121]. Inoltre, è stato dimostrato che l’indice glicemico di diverse fonti di carboidrati influisce sui tassi di sintesi del glicogeno [122, 123]. Questo può essere di maggiore importanza per i bodybuilder che mirano a riempire le riserve di glicogeno in una finestra temporale breve (ad esempio dopo aver preso peso), poiché i carboidrati ad alto indice glicemico hanno dimostrato tassi di risintesi del glicogeno superiori [122]. Tuttavia, in un arco di tempo più lungo (cioè 8 + ore), le riserve di glicogeno possono essere reintegrate in modo simile, indipendentemente dalla frequenza di alimentazione [124], quando si consuma una quantità totale adeguata di carboidrati [125]. Inoltre, i dati hanno dimostrato che la combinazione di proteine e carboidrati può migliorare la risintesi del glicogeno [126]. Tuttavia, sembra prudente che gli atleti non “sperimentino” durante la Peak Week con nuovi CHO, fonti proteiche o altri integratori non integrati nelle strategie specifiche della Peak Week per ridurre il rischio di manifestare sintomi gastrointestinali negativi o altre conseguenze deleterie.
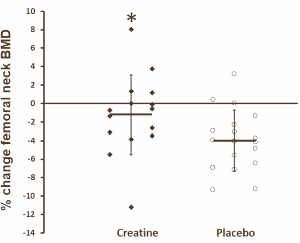
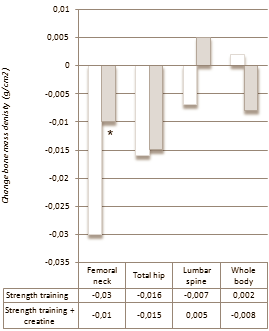
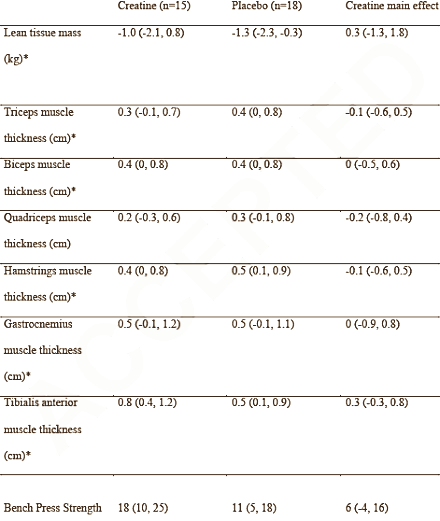
Esistono prove sostanziali a sostegno dell’uso della supplementazione di creatina per i bodybuilder. Chappell et al. hanno riferito che ~ 48 % degli uomini e ~ 51 % delle donne hanno integrato con creatina durante la preparazione del contest [2]. È stato dimostrato che la creatina migliora la composizione corporea (cioè aumenta la massa corporea magra, diminuisce la massa grassa) [127, 128] e aumenta lo stato di idratazione intracellulare [129, 130]. Ziegenfuss et al. [129] hanno dimostrato che una fase di carico di creatina di tre giorni ha aumentato il volume del fluido intracellulare di ~ 3 % senza influire sul fluido extracellulare. L’uso dell’analisi dell’impedenza bioelettrica multifrequenza (MBIA) ha indotto alcuni a interpretare inizialmente i dati con un certo scetticismo. Tuttavia, uno studio di follow-up che impiega lo stesso schema di carico di creatina di tre giorni ha osservato un aumento del 6,6% del volume muscolare della coscia tra gli atleti di potenza NCAA d’élite, come determinato dalla risonanza magnetica standard [131]. È stato anche dimostrato che l’integrazione di creatina aiuta nella sintesi del glicogeno e nella sua supercompensazione [132]. Inoltre, il consumo di CHO con creatina aumenta il carico di creatina [133], che aumenta l’idratazione cellulare come detto sopra [32, 129]. Infine, i livelli di creatina muscolare diminuiscono molto lentamente dopo il carico [134], quindi l’assunzione di creatina dopo il carico di glicogeno nella settimana di picco non è necessaria, tranne forse in piccole quantità per accelerare potenzialmente l’apporto di carboidrati dell’ultimo minuto, il giorno della competizione, nel muscolo scheletrico. Pertanto, l’integrazione di creatina può essere uno strumento potenzialmente efficace durante la Peak Week per l’espansione acuta della massa muscolare. Tuttavia, va notato che non tutti gli individui risponderanno all’assunzione di creatina esogena a fronte di un aumento significativo del contenuto di creatina muscolare [135, 136]. In particolare, i “responder” tendono ad essere quelli che hanno un’area di fibre muscolari di tipo II più ampia (cioè quelli con una propensione innata per lo sprint e/o gli sport di forza/potenza) [137, 138] e/o quelli con creatina iniziale inferiore ai livelli basali, forse a causa della mancanza di assunzione (p. es., coloro che non hanno integrato con creatina o che sono vegetariani che non integrano) [139].
L’integrazione di acidi grassi omega-3 [acido eicosapentaenoico (EPA), acido docosaesaenoico (DHA)] è stata osservata anche nei bodybuilder [2, 3]. Chappell et al. hanno riferito che il 39% degli uomini e il 47% delle donne consumavano un integratore di omega-3 (ad esempio olio di pesce, krill, olio di lino) [2]. Sebbene dati sostanziali in molti dati demografici della popolazione supportino l’uso di EPA e DHA come mezzo per ridurre l’infiammazione sistemica e migliorare la sensibilità all’insulina [140, 141], rimane sconosciuto se ciò possa migliorare il processo di picco.
Come discusso in precedenza, l’uso di diuretici è stato comunemente riportato nel bodybuilding agonistico [8, 19,20,21, 34, 35]. I bodybuilder usano spesso diuretici (sia estratti vegetali che farmaci) per aumentare la produzione di urina ed espellere il sodio nel tentativo di alterare il volume dei liquidi, migliorare la composizione corporea e presentare un fisico più “qualitativo”[142]. Inoltre, alcuni possono utilizzare i diuretici per ridurre la massa corporea totale con l’obiettivo di stabilire una specifica classe di peso [8, 19,20,21, 34, 35, 143]. Ad esempio, Caldwell et al. [143] hanno studiato gli effetti di un diuretico da prescrizione (Furosemide 1,7mg/kg) su atleti di vari sport (ad es. sollevatori di pesi e artisti marziali) e hanno riportato una significativa riduzione della massa corporea totale (-3,1 α 0,8kg) in un periodo di 24 ore. Tuttavia, a causa dei potenziali effetti collaterali e della loro capacità di mascherare l’uso di farmaci per il miglioramento delle prestazioni, i diuretici soggetti a prescrizione sono stati vietati dall’Agenzia mondiale antidoping [144]. Sebbene questi farmaci non siano presumibilmente utilizzati dai bodybuilder natural, sono stati impiegati da agonisti non sottoposti a test [19, 20]. È interessante notare che alcuni integratori a base di erbe che non sono vietati hanno dimostrato un effetto diuretico e possono essere impiegati allo stesso modo da culturisti doped e natural. Ad esempio, è stato dimostrato che il Taraxacum Officinale (Dente di Leone) aumenta significativamente la frequenza di urinazione e la produzione di escrezione in modo acuto (cioè entro una finestra di 10 ore) [145]; tuttavia, per quanto ne sappiamo, nessuna ricerca ha esaminato direttamente il suo impatto sugli spostamenti dei fluidi intracellulari rispetto a quelli extracellulari o sulla sua efficacia durante la Peak Week.
La vitamina C (acido ascorbico) è idrosolubile e considerata non tossica anche in quantità elevate [146]. Poiché richiede la filtrazione renale per l’escrezione, provoca anche diuresi osmotica [147]. La ricerca supporta un effetto diuretico della vitamina C sia orale che endovenosa [148], con dosi giornaliere di appena 11mg/kg che producono diuresi nei bambini [149], sebbene una dose endovenosa di 500mg non sia riuscita a indurre diuresi nei maschi adulti [150] . Uno studio sia su soggetti sani che su pazienti con carenza di vitamina C ha dimostrato che le perdite urinarie di vitamina C (e la diuresi concomitante) si verificano solo al di sopra della soglia di concentrazioni ematiche di ~ 14mg/L (che corrisponde ai livelli di saturazione dei tessuti). Questi dati suggeriscono che il raggiungimento di concentrazioni ematiche di vitamina C che promuovono la diuresi varia in funzione dei tassi di assorbimento e assorbimento/deposito nei tessuti [151] (3). Dato il suo uso comune, la relativa sicurezza e la potenziale efficacia come diuretico non farmacologico, l’uso dell’acido ascorbico in uno scenario di picco della preparazione (compresi i modelli di dosaggio per ridurre al minimo il disagio gastrointestinale e ottimizzare le concentrazioni ematiche nel contesto dei tempi dei pasti e di altri fattori che possono influenzare l’assorbimento) giustificano ulteriori ricerche. Infatti, a causa della scarsità di ricerche disponibili sull’argomento, è difficile formulare raccomandazioni definitive sull’uso e sul dosaggio durante la Peak Week. Tuttavia, sulla base delle prove disponibili, il dosaggio ripetuto (ogni poche ore) di 500-1000mg di vitamina C è una strategia praticabile da utilizzare durante le 12-24 ore prima della competizione per accelerare potenzialmente la perdita di acqua corporea con effetti collaterali minimi (ad es. disturbi gastrointestinali). Si prega di notare che è necessaria cautela poiché un consumo eccessivo di vitamina C può causare diarrea osmotica [152].
L’uso di un integratore di Caffeina è di menzione speciale per le sue proprietà diuretiche. Dosi di almeno ~ 250-300mg di Caffeina (2-3 tazze di caffè) possono essere assunte per promuovere la diuresi acuta in coloro che non sono tolleranti alla caffeina a causa dell’uso cronico [153]. D’altra parte, diversi giorni di astinenza possono ripristinare la sensibilità agli effetti diuretici della caffeina (sebbene l’effetto diuretico sia ancora presente solo a queste dosi maggiori) [154]. Anche gli effetti diuretici, migliorativi dell’umore [155] e delle prestazioni della caffeina [156] dovrebbero essere considerati nel contesto di potenziali disturbi del sonno se assunta in modo acuto per promuovere la diuresi per ridurre il peso la notte prima della competizione, così come l’effetto di astinenza se l’uso viene interrotto bruscamente [157]. Una potenziale strategia della Peak Week sarebbe quella di limitare la caffeina all’inizio della settimana (specialmente nei consumatori cronici, per ripristinare la sensibilità), impiegarla all’inizio della giornata come diuretico (p. es., il giorno prima della competizione) per limitare gli effetti negativi su qualità del sonno e continuare il suo uso in seguito (p. es., il giorno della competizione) per prevenire gli effetti di astinenza sia sull’omeostasi dei liquidi che sull’umore e sull’eccitazione [157]. È stato notato che la caffeina può essere impiegata (3-8mg/kg) come agente per accelerare il carico di glicogeno [158], sebbene i dati siano scarsi ed equivoci su questo effetto [159]. Pertanto, gli atleti che potrebbero scegliere di includere la caffeina per aumentare il carico di carboidrati a metà della Peak Week potrebbero anche perdere la sua utilità come diuretico durante i giorni successivi (ad esempio, quando tentano di “asciugarsi” ~ 24h prima di salire sul palco ).
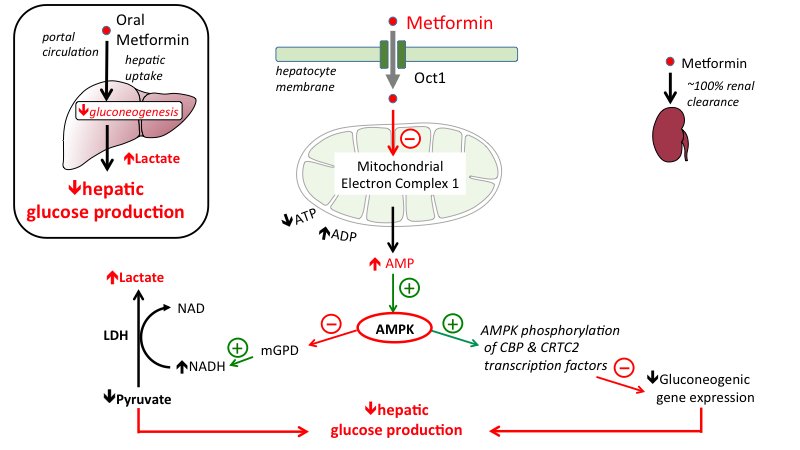
L’uso del farmaco Metformina (500mg-1.5g/die) è utilizzato durante i giorni di ricarica dei CHO della Peak Week. Essa aumenta la sensibilità all’insulina e il miglioramento del ripartizionamento calorico. Nonostante riduca in parte l’assorbimento glucidico e possa alterare la glicogenolisi epatica, molti atleti hanno riferito di usarla con successo aggiustando la quantità di carboidrati la dove necessario e senza compromissioni della supercompensazione del glicogeno muscolare. La pratica d’uso della Metformina ha di gran lunga sostituito il malsano utilizzo dell’Insulina la quale mostra una quantità secreta più che sufficiente dall’alimentazione. L’aggiunta di un GDA (farmacologico o OCT) ne migliora l’effetto. Si sconsiglia un suo inserimento nella Peak Week se non già testata in precedenza dal momento che può causare disturbi gastrointestinali con conseguenti eventi diarroici.
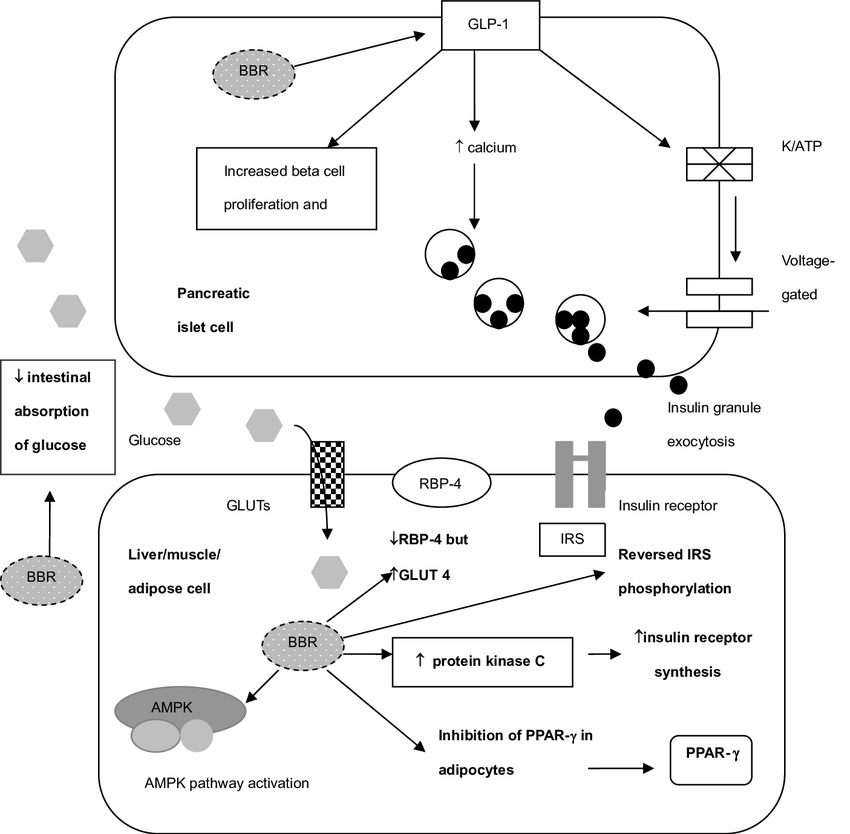
Come sostituto alla Metformina, l’uso della Berberina è stato applicato da alcuni atleti durante la Peak Week nei giorni di ricarica dei carboidrati. L’attività della Berberina, similmente alla Metformina, si esplica attraverso i PPAR–γ e l’attivazione indiretta del AMPK, con conseguente aumento del uptake del glucosio (migliore insulino sensibilità) sia da parte del miocita che del adipocita (quest’ultimo, in una condizione di bassa concentrazione e deplezione epatico-muscolare di glicogeno risulta limitato per ciò che concerne la ripartizione calorica).
I dosaggi di Berberina che hanno dimostrato un impatto statisticamente significativo, anche alla luce della ricerca scientifica svolta fino ad oggi, vanno dai 500mg a 1.5g al giorno assunti in 2-3 somministrazioni di uguale portata distribuite durante la giornata (preferibilmente prima dei pasti principali). L’abbinamento con la Silimarina ha mostrato di aumentarne la biodisponibilità. L’emivita della Berberina è stata stimata essere di circa 5-6 ore.(The 5-minute Herb and Dietary Supplement Consult – a cura di Adriane Fugh-Berman (pag. 158)) Ai dosaggi comunemente usati nella medicina tradizionale e nel limite di 1.5g/die la Berberina è ben tollerata e sicura; a dosaggi più alti può determinare: disturbi gastrointestinali, dispnea, diminuzione pressoria, sintomi simil-influenzali e danno cardiaco. (https://www.ncbi.nlm.nih.gov/pubmed/10767672)
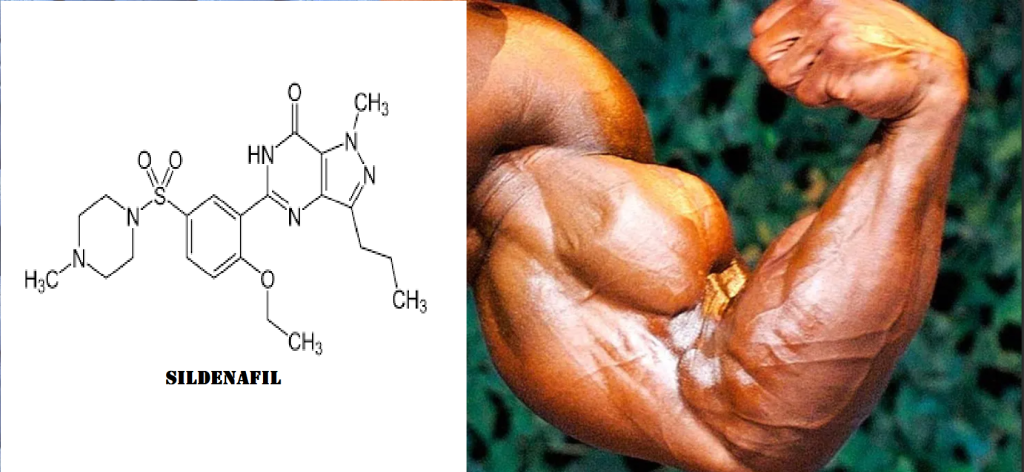
I “NO-booster” vengono utilizzati da alcuni atleti il giorno del contest. Alcuni si limitano ad assumere 8g di Citrullina Malato 30 minuti-1h prima di salire sul palco. Altri, invece, aggiungono, al fine di potenziare l’effetto “pump”, il Sildenafil assumendolo ad un dosaggio di 25-100mg 1h prima di salire sul palco.
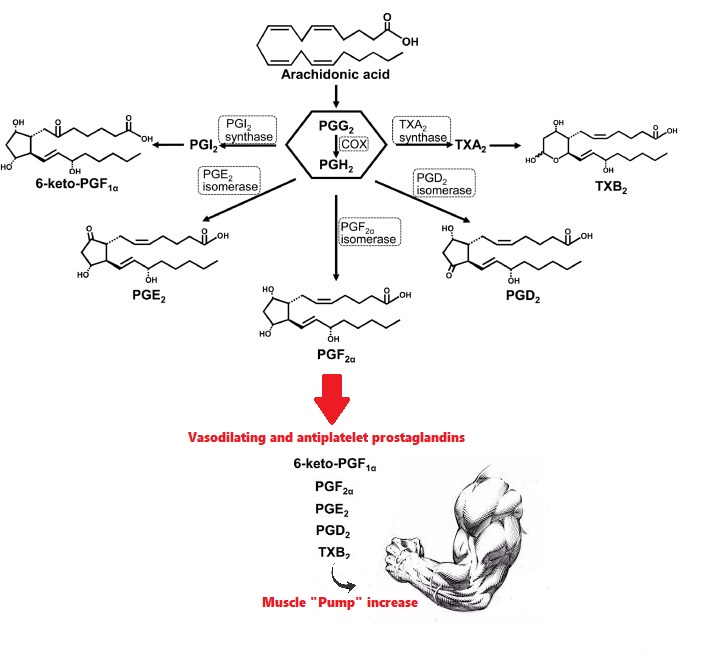
Alcuni “intrepidi” con poca conoscenza su farmacologia ed emivita, somministrano per via intramuscolare nei gruppi carenti la PGF1-α per aumentare il “pump” in questi gruppi. Si tratta di una pratica di nicchia e, in definitiva, poco efficace per via della breve vita attiva della molecola (pochi minuti) e la scomodità di utilizzo durante un contest.
Sono anche utilizzate le soluzioni topiche anti-infiammatorie e drenanti per aumentare il flusso dei liquidi extracellulari dalle zone critiche come le gambe. Molecole come il Glicosaminoglicanopolisolfato che viene applicato a partire dall’ultimo post workout del “Leg Day” fino alla sera prima del contest con applicazione in 3 somministrazioni. La sua efficacia è risultata apprezzabile e additiva con le altre pratiche per il controllo dei liquidi extracellulari, anche se vanno comunque valutate le risposte individuali.
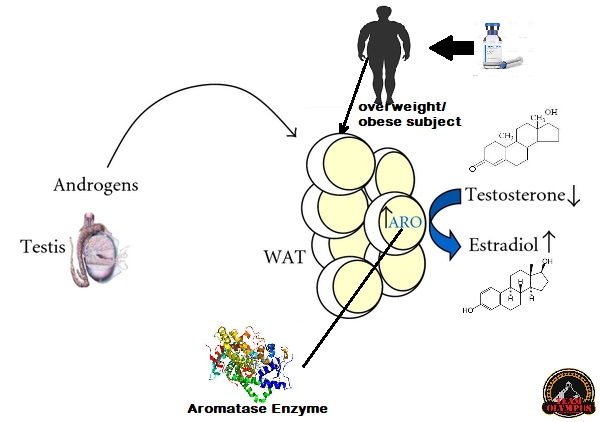
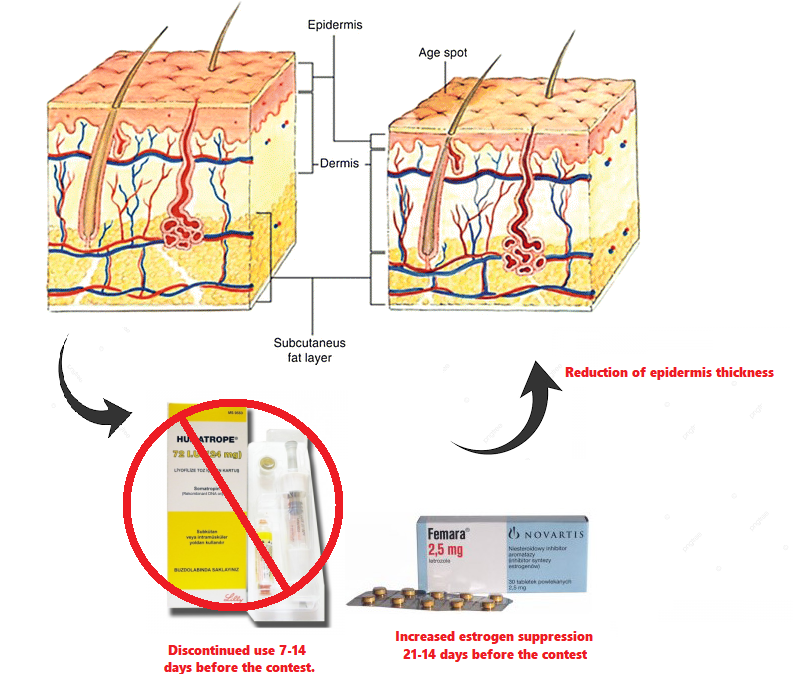
I bodybuilder utilizzatori di PEDs usano in vista della Peak Week anche pratiche per la riduzione marcata degli estrogeni per via farmacologica (vedi inibitori dell’Aromatasi) nel tentativo di ridurre lo spessore della pelle. L’Estradiolo, come il GH, è implicato nella sintesi di collagene, una riduzione ulteriore di queste due variabili potrebbe ridurre nel giro di 14 giorni lo spessore cutaneo. La pratica, per essere oggettiva, deve basarsi sugli esami ematici di controllo per valutare i livelli di E2. Non esiste alcuna letteratura in merito ma semplici dati aneddotici raccolti negli anni. E’ scontato dire che gli effetti negativi degli estrogeni sullo spessore della pelle possono richiedere diversi mesi affinché vangano eliminati completamente, quindi il mantenimento di un elevato livello di estrogeni durante i primi mesi di preparazione alla gara per poi farli calare fino al livello minimo solo un paio di settimane prima dell’esibizione non è l’ideale. Per tutti coloro che usano grandi dosi di AAS aromatizzabili per tutta la maggior parte della preparazione, tenete questo bene in mente.
Fibre e FODMAP:
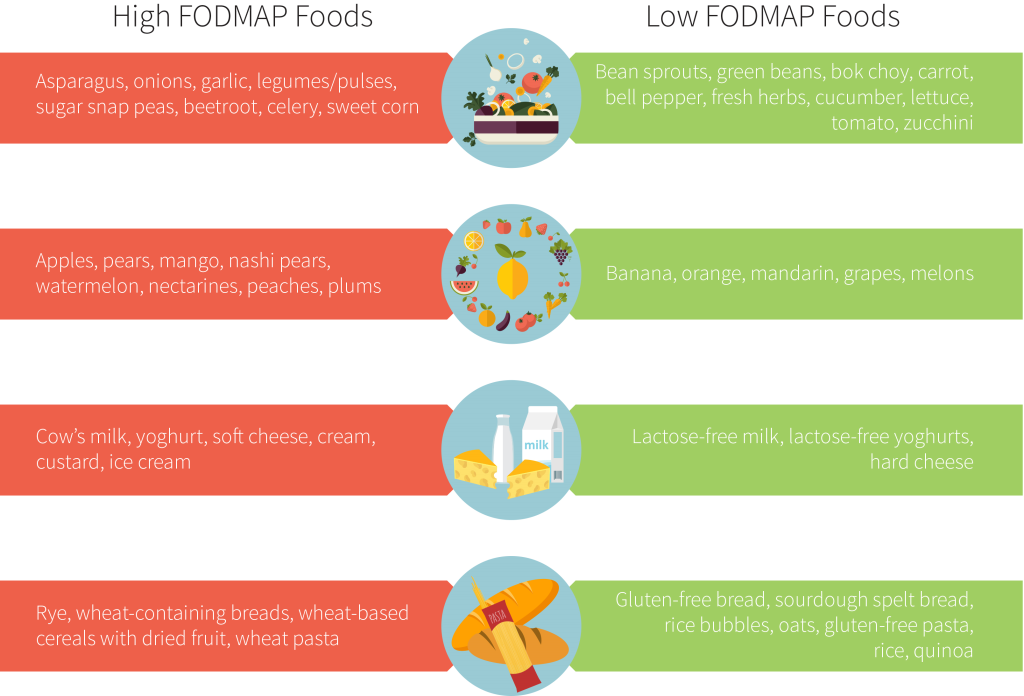
La fibra alimentare è materia vegetale indigeribile proveniente da fonti di carboidrati che possono essere classificate come idrosolubili o insolubili (cioè fermentabili) e svolge un ruolo vitale nella salute gastrointestinale e nella regolarità del movimento intestinale [160]. I culturisti che mirano a ridurre la massa corporea totale durante la Peak Week come mezzo per fare una particolare classe di peso possono trarre beneficio dalla riduzione intenzionale dell’assunzione di fibre. Ad esempio, Reale et al. [55] hanno studiato l’effetto delle manipolazioni dietetiche (cioè macronutrienti, fibre, sodio e assunzione di acqua) sulla perdita di peso acuta per gli atleti da combattimento e hanno prescritto 10-13g di fibre per ridurre il contenuto intestinale totale e la massa corporea. Diverse fonti di cibo influiscono sulle caratteristiche di massa fecale e quelle ricche di fibre tendono ad aumentare l’acqua nello spazio interstiziale e la massa delle feci [161]. I dati hanno dimostrato che una relazione diretta tra l’assunzione di fibre e il contenuto intestinale con periodi di restrizione acuta (di appena due giorni) è efficace nello svuotamento/pulizia del tratto gastrointestinale [162]. Pertanto, la logica per ridurre l’assunzione di fibre prima della competizione è in genere quella di ridurre al minimo il rischio di gonfiore/ritenzione idrica [11] e, per alcuni, può essere una strategia efficace per stabilire una classe di peso.
Sebbene la ricerca sull’argomento sia limitata, Chappell et al. [11] hanno riferito che i bodybuilder che hanno osservato hanno ridotto gravemente il loro apporto di fibre principalmente riducendo/omettendo le verdure fibrose durante la Peak Week. Inoltre, è ben noto che oligosaccaridi, disaccaridi, monosaccaridi e polioli fermentati (FODMAP) sono scarsamente assorbiti, attirano fluidi all’interno del tratto gastrointestinale e aumentano la probabilità di gonfiore/gas [163]. Pertanto, potrebbe essere consigliabile per i bodybuilder limitare le fonti di cibo ad alto contenuto di FODMAP durante la Peak Week. Questo potrebbe essere uno dei motivi per cui anche le fonti alimentari come latticini e fonti ricche di lattosio e glutine sono aneddoticamente limitate in questo periodo. D’altra parte, fonti di fibre come la gomma di guar [164] e lo psillio [165], che hanno dimostrato di ridurre i sintomi della sindrome dell’intestino irritabile dominata sia da stitichezza che da diarrea, potrebbero essere impiegate su base individuale per compensare il disagio gastrointestinale, come notato sopra nello studio di de Moraes et al. [15]. Nonostante la mancanza di dati all’interno di questo gruppo demografico, la fibra alimentare è probabilmente una variabile che può influire sul processo di picco di un bodybuilder e dovrebbe essere considerata su base individuale nel contesto con gli altri aspetti dell’approccio della Peak Week.
Allenamento:
Poiché i bodybuilder si allenano invariabilmente e principalmente con esercizi contro-resistenza (RE), la misura in cui questo tipo di allenamento in particolare riduce il glicogeno e i IMT merita una considerazione. In uno studio iniziale sull’uso di substrati energetici durante un RE in bodybuilder allenati, Essen-Gustavsson e Tesch [96] hanno scoperto che una sessione di RE ad alto volume nella parte inferiore del corpo riduceva sia il glicogeno che i IMT del vasto laterale di ~ 30%, e che sia i livelli a riposo che l’entità della deplezione era correlata rispettivamente agli enzimi energeticamente connessi come la esochinasi e il 3-idrossi-Co-A deidrogenasi. In un altro studio, solo tre serie di Curl delle braccia (80% 1RM o ~ 12RM) erano sufficienti per ridurre il glicogeno del bicipite brachiale del 24 % e aumentare il lattato muscolare ~ 20 volte nei bodybuilder allenati [166]. Allo stesso modo, Roberg et al. [167] hanno scoperto che 6 serie di estensioni del ginocchio (~ 13 ripetizioni/serie; intervalli di riposo di 2 minuti) hanno ridotto il glicogeno muscolare di circa il 40% negli uomini allenati contro-resistenza, ma i livelli di glicogeno hanno recuperato il 50% delle perdite durante le 2 ore di riposo a digiuno, presumibilmente a causa dell’immediata assimilazione post-esercizio dei metaboliti glicogenolitici (ad esempio, lattato) [168]. Lo stesso gruppo ha anche scoperto che un regime di corrispondenza del carico di lavoro esterno (impiegando il doppio del carico in modo tale da impostare una media di solo ~ 6 ripetizioni ad esaurimento) produceva un modello quasi identico di uso di glicogeno e recupero immediato post-esercizio. Pertanto, il RE eseguito con intervalli di ripetizioni comunemente impiegati tra i bodybuilder riduce sostanzialmente le riserve di glicogeno muscolare in un modo correlato al carico di lavoro/volume di una data seduta.

In linea con la ricerca precedente che suggeriva che l’ossidazione del grasso è maggiore nelle donne così come in quelle con livelli di grasso corporeo più elevati [85, 169], uno studio su donne obese non allenate ha rilevato che il 42% delle riserve IMT miste a riposo sono state utilizzate solo durante 6 serie di 10 ripetizioni di estensione del ginocchio [170]. Mentre i IMT erano tornati al 33% al di sotto della linea di base 2 ore dopo l’esercizio, nonostante l’assenza di assunzione di cibo, le riserve di glicogeno muscolare sono diminuite solo del 25% nel corso della seduta, ma non sono riuscite a recuperare significativamente in assenza di consumo di cibo [170]. I dati di cui sopra suggeriscono che il ripristino dei IMT può procedere lentamente in luogo delle fonti alimentari [171], mentre per i CHO è necessario per ripristinare sostanzialmente i livelli di glicogeno una deplezione acuta post allenamento contro-resistenza con riassorbimento degli intermedi glicolitici.
Pertanto, il potenziale di modificare le riserve di glicogeno intramuscolare e di IMT attraverso la dieta (vedi sopra) e l’esercizio è chiaro, ma gli effetti corrispondenti possono essere variabili tra i bodybuilder in funzione della dieta pre-gara (la composizione e il contenuto dei macronutrienti possono influenzare le riserve a riposo), attività enzimatica muscolare e sesso, tra le altre variabili non studiate. Anche il danno muscolare indotto dall’esercizio può essere importante nell’interpretazione dei dati di cui sopra poiché è altamente variabile [172,173,174], una funzione dello stato di allenamento [175] e noto per compromettere la sensibilità all’insulina muscolare [176] così come il rifornimento di glicogeno [177] . Evitare un danno muscolare eccessivo può quindi essere importante quando si considera una strategia di allenamento contro-resistenza durante la Peak Week non solo per massimizzare le riserve di glicogeno e IMT, ma anche per prevenire indolenzimento muscolare a insorgenza ritardata indesiderato che potrebbe impedire la capacità di attivare i muscoli [178] durante la posa sul palco. In effetti, le richieste energetiche di recupero da un allenamento apportante danno muscolare possono essere così grandi che in casi estremi i livelli di glicogeno possono continuare a diminuire dopo l’esercizio e non recuperare completamente in 24h nonostante un elevato consumo di CHO (10 g/kg/giorno) [179 ]. La variabilità nell’entità dell’infiammazione post-esercizio [180, 181] può anche spiegare la sopra menzionata variabilità nell’entità dell’idratazione che accompagna il carico di glicogeno. I livelli di IMT a riposo e di glicogeno sono più elevati e vengono utilizzati più facilmente in soggetti allenati che impiegano un carico di lavoro assoluto maggiore. Tuttavia, il ripristino post-esercizio di entrambe le riserve di energia è correlato alla sensibilità all’insulina e procede in modo simile rispetto ai depositi a riposo, indipendentemente dallo stato di allenamento [182]. Pertanto, l’elevata sensibilità all’insulina generalmente osservata nei bodybuilder nel pre-gara [5, 7, 90, 183, 184] conferisce un vantaggio per i depositi di IMT e il ripristino del glicogeno dopo sessioni di allenamento ad alto fabbisogno di substrato [185], ma la loro maggiore massa e capacità muscolare per ridurre le riserve di energia muscolare impongono che l’assunzione di grassi alimentari e CHO debba essere proporzionalmente grande per garantire un effetto super compensativo.
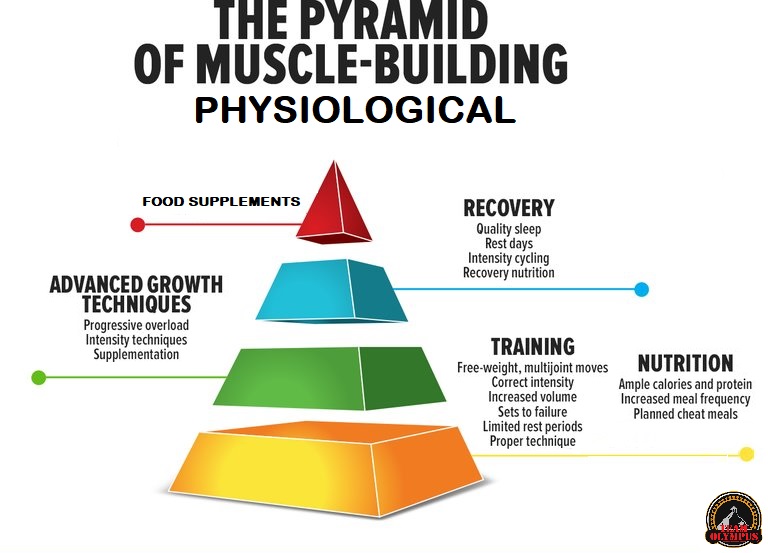
Applicazioni pratiche per la Peak Week:
È evidente che i bodybuilder implementano una varietà di strategie per la Peak Week nonostante la scarsità di ricerche specifiche sulla sicurezza e l’efficacia sui bodybuilder. Poiché ci sono molte variabili correlate da considerare durante il processo di picco che si influenzano direttamente a vicenda, non sono possibili raccomandazioni specifiche per la Peak Week. Inoltre, ci sono significative risposte interindividuali alla manipolazione di queste variabili e i bodybuilder potrebbero dover adottare approcci diversi durante la Peak Week a seconda delle loro circostanze, obiettivi e come il loro corpo risponde alle alterazioni delle variabili. Ad esempio, gli approcci alla Peak Week potrebbero differire sostanzialmente in base alle circostanze di un bodybuilder che deve raggiungere un peso per una specifica classe rispetto a un bodybuilder che non è vincolato da un limite di peso. Allo stesso modo, gli atleti che gareggiano nelle varie suddivisioni di categoria del bodybuilding potrebbero dover adottare approcci diversi (ad es. women’s physique/figure/wellness/bikini/fitness e men’s physique/classic physique) in cui gli standard di giudizio possono differire da quelli del bodybuilding tradizionale.
Mentre una discussione approfondita degli standard di giudizio sfumati e in qualche modo fluidi (che variano tra le numerose federazioni/organizzazioni di bodybuilding) delle varie categorie del culturismo competitivo esula dallo scopo di questo articolo, le seguenti considerazioni generali possono essere applicate nella costruzione di una strategia della Peak Week per queste altre categorie:
- (1) Lo standard per la magrezza nelle divisioni femminili non bodybuilding spesso richiede livelli di grasso corporeo più elevati e meno muscolosità rispetto al bodybuilding femminile, e può anche quindi richiedere poche o nessuna delle manipolazioni della Peak Week descritte fino a qui ;
- (2) Aneddoticamente, le concorrenti femminili (tipicamente nelle divisioni Bikini o Figure) possono ridurre intenzionalmente il grasso corporeo totale per ottenere livelli di grasso corporeo inferiori e competitivi e, invece di applicare procedure diuretiche, “carico d’acqua”, nel tentativo di ridurre la comparsa di eccessivo magrezza, mantengono l’aspetto desiderato di una distribuzione del grasso corporeo più uniformemente e omogenea;
- (3) I concorrenti fitness, in cui vengono giudicate le prestazioni fisiche e l’aspetto fisico, potrebbero dover creare approcci altamente individualizzati al ripristino dell’acqua e dei depositi energetici che ottimizzino la competitività, minimizzino il rischio di lesioni e tengano conto della tempistica relativa dei set di routine e fisici nel corso di una gara.
Date le attuali prove discusse nel corso di questo articolo, offro le seguenti raccomandazioni generali per i bodybuilder al fine di aiutare i lettori a sviluppare strategie personalizzate per la Peak Week che coordinino l’assunzione di macronutrienti, le strategie di idratazione e di gestione degli elettroliti, l’integrazione e la routine di allenamento contro-resistenza/endurance(cardio). È importante sottolineare che queste raccomandazioni non dovrebbero essere considerate “regole” concrete in quanto esiste una significativa variabilità individuale di come gli atleti possono rispondere alla manipolazione di queste variabili. Infatti, a causa del numero di variabili che possono essere manipolate e degli scenari espansi che possono verificarsi, presento linee guida più specifiche di Peaking per:
- (1) Un concorrente Physique femminile (60kg che non è vincolata da un limite di peso (BB1);
- (2) un bodybuilder supermassimo (105 kg) che non è vincolato da un limite di peso (BB2);
- (3) un concorrente Classic Physique che deve essere sotto un limite di peso (85 kg) in base alla sua classe di altezza (BB3)
In tutte le circostanze, si presumerà che i concorrenti effettuino il check-in (e il peso, se applicabile) il venerdì pomeriggio per competere il sabato mattina per il giudizio preliminare e il sabato sera per le finali. Si prega di notare che, nonostante queste circostanze specifiche, le raccomandazioni presentate nella Fig. 1 e nelle Tabelle 1, 2 e 3 dovrebbero essere viste come punti di partenza raccomandati che probabilmente richiederanno aggiustamenti basati sulle risposte dell’individuo all’alterazione delle variabili. La strategia simulata della Peak Week nella Fig. 1 è presentata solo come illustrativo esemplificativa e non devono essere considerati consigli dietetici, di esercizio fisico e/o medici prescrittivi. Si prega di fare riferimento al testo per una spiegazione razionale dettagliata per la manipolazione di macronutrienti, acqua, sodio e potassio presentata nella Fig. 1 e nelle Tabelle 1, 2 e 3. A tal fine, le strategie della Peak Week includerebbero le seguenti considerazioni:

1) Durante un protocollo di esaurimento/supercompensazione indotta da allenamenti contro-resistenza, l’attività fisica dovrebbe coinvolgere tutti i principali gruppi muscolari e impiegare una varietà di esercizi per garantire una riduzione diffusa dei livelli di IMT e di glicogeno nell’intera massa muscolare.
2) Utilizzando uno schema di ripetizione relativamente alto (>12 ripetizioni) con un approccio a volume più basso o più alto [167], ed esercitando uno sforzo e/o un carico sufficienti per impegnare la maggior parte dei tipi di fibre [186,187,188] ma fermandosi prima del cedimento applicando un rapporto tra volume/intensità ben delineato e non eccessivo, evitando nuovi esercizi, sembra un approccio prudente per garantire che il danno muscolare sia ridotto al minimo.
3) Gli esercizi che sovraccaricano il muscolo nella fase di allungamento/o eccentrico dominante (es. Stacco da terra rumeno, DB Lat Pullover, DB Fly) dovrebbero essere ridotti al minimo poiché è stato dimostrato che l’allenamento con modalità di allungamento aumenta il danno muscolare [189].
4) L’esercizio cardiovascolare dovrebbe essere ridotto o eliminato preferibilmente prima di entrare nella fase compensatoria delle riserve energetiche nei giorni precedenti la competizione.
5) L’allenamento contro-resistenza durante la Peak Week dovrebbe generalmente avvenire all’inizio della settimana, distribuito su 3-4 giorni a seconda della suddivisione di allenamento abituale dell’atleta, per consentire un tempo adeguato per la supercompensazione durante i giorni prima di salire sul palco di gara. Allenare le gambe per prime in questa serie di allenamenti della Peak Week consente il massimo tempo per il recupero in questi gruppi muscolari.
6) Il potenziale per il carico di glicogeno di compromettere la conservazione dei IMT suggerisce che la separazione dei periodi di carico di glicogeno e di grassi può essere prudente, con una dieta ad alto contenuto di CHO che precede gli sforzi per il carico dei grassi [92]. Ridurre la coingestione dei grassi con grandi quantità di carboidrati può anche evitare gli effetti negativi degli acidi grassi liberi sulla formazione di glicogeno [190], ridurre la distensione gastrica accelerando lo svuotamento gastrico, nonché migliorare il carico di glicogeno aumentando ulteriormente i livelli di glucosio nel sangue e di insulina [191,192,193] . Se consumate in giorni diversi, le diete contenenti grassi a 2g/kg/giorno [92] e CHO a 10g/kg/giorno [100] possono ripristinare e potenzialmente sovracompensare i rispettivi depositi energetici entro 24 ore. La variabilità individuale e gli obiettivi/bisogni dell’atleta possono richiedere strategie diverse, incluso consentire >24h per il carico di glicogeno [194] se le circostanze lo consentono.
7) Piuttosto che introdurre nuovi alimenti, consumare principalmente gli stessi costituenti dietetici durante la Peak Week che si consumano durante le settimane/mesi precedenti può anche essere utile per evitare disturbi gastrici. Poiché le fonti di carboidrati di frutta e fruttosio stimolano meglio il ripristino del glicogeno epatico, mentre il glucosio lo fa per il glicogeno muscolare [195], si raccomanda che la maggior parte dei carboidrati consumati provenga da fonti a base di amido/glucosio. Da notare, tuttavia, che è stato dimostrato che combinazioni di glucosio, fruttosio e saccarosio con bevande sportive aumentano la velocità di assorbimento dei liquidi dall’intestino tenue prossimale [196]. Pertanto, si consiglia agli atleti di sperimentare prima della settimana di picco su quali fonti di carboidrati funzionano meglio per loro.
8) Garantire che le proteine siano co-ingerite, anche se in quantità inferiori, con i CHO durante la ricarica può aumentare il rilascio di insulina e facilitare il carico di glicogeno [197, 198].
9) Un apporto proteico più elevato (es. 3,0g/kg) può essere combinato con un apporto più elevato di grassi durante i periodi di deplezione dei CHO per avviare il carico di grassi seguito da un carico di CHO con un apporto proteico inferiore (es. 1,6 g/kg) per compensare le riserve di glicogeno . Una volta completato il carico di carboidrati, può essere implementata una dieta ad alto contenuto proteico (3,0 g/kg)/alto contenuto di grassi/basso contenuto di CHO. Ancora una volta, la variabilità individuale e gli obiettivi/bisogni dell’atleta possono richiedere strategie diverse per raggiungere il massimo della forma fisica.
10) Varie strategie di carico dei CHO sono state riportate nel bodybuilding. Ad esempio, Roberts et al. [199] discussero la pratica della ricarica dei CHO a caricamento frontale (l’assunzione è maggiore all’inizio della settimana e poi ridotta per mantenere la pienezza muscolare fino alla competizione) e il carico dei CHO a caricamento posteriore (l’assunzione avviene più tardi nella settimana ma può comportare meno tempo per apportare modifiche al fisico). In alternativa, potrebbe essere utilizzato anche un modello in cui i CHO vengono esaurite all’inizio della settimana (7 − 4 giorni out), caricati a metà settimana (3 − 2 giorni out), e quindi regolati/mantenuti (1 giorno out). Nello studio di de Moraes et al. [15], è stato utilizzato un metodo di carica a ritroso, ma sono necessarie ulteriori prove prima di formulare raccomandazioni più concrete. Sulla base delle prove attuali, si raccomanda il terzo modello discusso, come presentato nella Tabella 1 per la concorrente Physique femminile di 60kg e il bodybuilder di sesso maschile di 105kg, per ottenere i benefici del carico frontale e del carico posteriore; tuttavia, devono essere prese in considerazione le risposte/preferenze individuali al carico dei CHO e le esigenze dell’individuo (ad es., fare una classe di peso può richiedere il carico a ritroso).
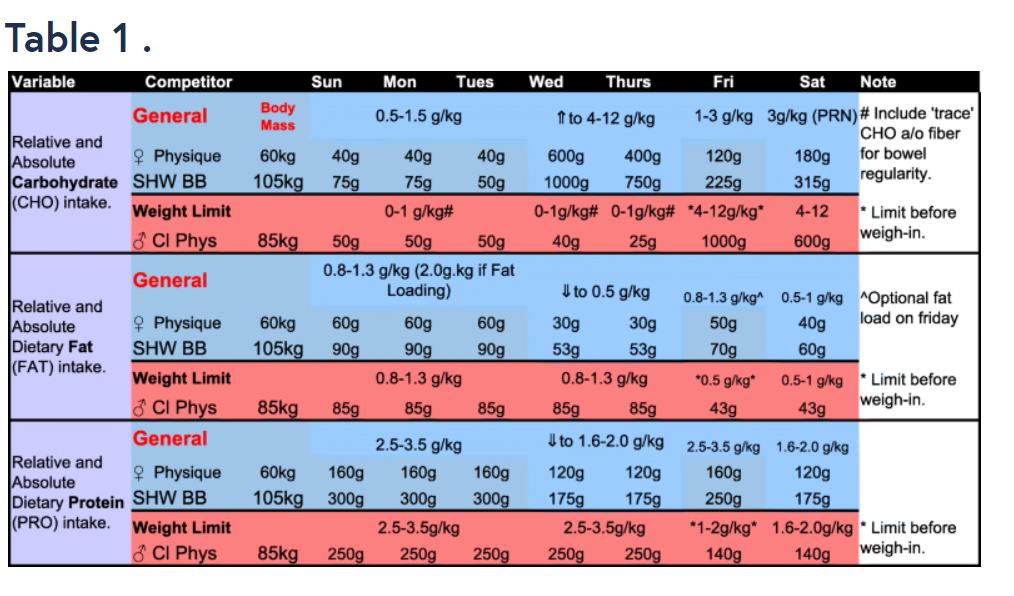
11) La precedente dieta pre-gara può influenzare la tolleranza del concorrente alla manipolazione dietetica, nonché l’entità della restrizione dietetica di grassi e CHO durante i giorni di allenamento della Peak Week necessari per accelerare un successivo effetto super-compensativo. Ad esempio, quei concorrenti che seguono una dieta ricca di CHO/basso contenuto di grassi, ma molto ipocalorica (lasciando i livelli di glicogeno cronicamente bassi) potrebbero evitare di eliminare completamente i CHO durante l’allenamento della Peak Week. Tuttavia, coloro che hanno utilizzato un approccio a basso contenuto di carboidrati potrebbero continuare a utilizzare una dieta di questo tipo durante la Peak Week, ma potrebbero diffidare di applicare un allenamento eccessivo (invece di un approccio tapering) se i livelli di glicogeno sono già probabilmente diminuiti all’inizio della Peak Week.
12) In generale, ridurre i CHO e aumentare l’assunzione di grassi (in base alla tollerabilità individuale) durante i giorni di allenamento (“esaurimento”) della Peak Week può facilitare il carico di glicogeno durante i giorni successivi all’allenamento e, contemporaneamente, garantire che i livelli di IMT non vengano abbassati eccessivamente. Dopo 1-2 giorni di carico di glicogeno a metà/fine settimana come raccomandato nel prima citato approccio al carico dei CHO, i livelli di IMT potrebbero essere aumentati il giorno prima della competizione con un approccio ad alto contenuto di grassi/basso di CHO che servirebbe anche a ridurre l’acqua corporea in eccesso [117]. Ancora una volta, la variabilità individuale e gli obiettivi/bisogni dell’atleta possono richiedere strategie diverse con queste linee guida generali come base.
13) La pratica del carico d’acqua seguita dalla restrizione idrica è stata documentata come una strategia di perdita di peso sicura ed efficace per perdere TBW negli atleti da combattimento [55]. Sebbene il rapporto tra ECW e ICW perso non sia stato riportato in questo studio, Costill et al. [40] (come affermato in precedenza) hanno riportato che il rapporto tra ECW e perdita di ICW rimane vicino a 1:1 quando i livelli di glicogeno si stabilizzano nel tempo e vengono raggiunti livelli più elevati di disidratazione. Pertanto, sembra che la ritenzione del glicogeno muscolare, evitando l’esercizio che fa molto affidamento sul glicogeno, possa essere importante se i metodi di perdita di acqua devono essere effettuati per una perdita favorevole di ECW rispetto a ICW (ECW > ICW) in modo tale che la dimensione muscolare venga mantenuta mentre L’ECW interstiziale viene preferibilmente perso, migliorando potenzialmente l’aspetto della “definizione” muscolare.
14) Molte variabili possono alterare l’approccio utilizzato per il carico/esaurimento idrico (cioè quanta acqua l’atleta è abituato a bere regolarmente), ma i partecipanti allo studio di Reale et al. hanno perso con successo la TBW bevendo una grande quantità di acqua (100ml/kg) per tre giorni, seguita da una significativa riduzione dell’acqua a 15ml/kg il quarto giorno [55] senza effetti deleteri. In alternativa, l’assunzione di acqua può essere mantenuta relativamente costante (ad eccezione di qualche ora prima di gareggiare per prevenire qualsiasi distensione addominale) per ridurre al minimo le variabili manipolate; in effetti, questo potrebbe essere l’approccio migliore se non vengono eseguite prove pratiche prima della competizione. Mantenere una ratio Sodio:Acqua pari a 1:0.4 (per semplificare, 1L d’acqua = 1g di Cloruro di Sodio (Na)= 400mg di Sodio) fino al giorno precedente alla gara aggiungendo nelle ultime 24h il Glicerolo (generalmente 3 dosi da 10-20ml) il quale ha un noto effetto osmotico intracellulare.
15) Poiché il glicogeno muscolare crea un effetto osmotico, attirando l’acqua nella cellula mentre il glicogeno viene immagazzinato [26], il carico di CHO dovrebbe essere effettuato insieme all’assunzione di acqua [199] in modo che l’ICW muscolare possa essere massimizzato mentre l’assunzione di CHO è alta. Dopo circa tre giorni di carico d’acqua con un apporto di CHO più alto (se si utilizza il metodo di carico d’acqua), l’assunzione di acqua può diminuire a ~ 15ml/kg per 24h, il che aiuterà a indurre la diuresi entro ~ 24h prima della competizione. Si noti che questa raccomandazione si basa su quanto studiato e riportato; tuttavia, gli autori riconoscono che maggiori assunzioni di acqua possono essere preferenziali, come 30-40ml/kg, ma non sono state studiate e quindi richiedono ulteriori ricerche.
16) Aumentare o mantenere un’assunzione elevata di proteine mentre si riduce il consumo di carboidrati e contemporaneamente aumentare l’assunzione di grassi durante il giorno prima della competizione può invertire i guadagni indesiderati di acqua extracellulare/sottocutanea sperimentati durante il carico dei carboidrati [118].
17) È stato riportato che l’assunzione di sodio è significativamente ridotta dai bodybuilder durante la Peak Week [11, 14, 20], ma i tempi di questa pratica dovrebbero essere attentamente implementati e l’assunzione di sodio non dovrebbe essere ridotta contemporaneamente al carico dei CHO poiché l’evidenza suggerisce che la somministrazione di CHO è limitata dalla capacità di trasporto di SGLT1 [72,73,74,75]. Una volta che l’assunzione di CHO è diminuita dopo il carico di glicogeno, l’assunzione di sodio può essere temporaneamente ridotta poiché la ricerca indica che l’attivazione del RAAS è evidente entro 24 ore e sono necessarie ~ 48 ore per osservare un forte aumento dei livelli di Aldosterone plasmatico [53]. Questo ritardo temporale nello stabilire l’omeostasi di fluidi ed elettroliti, se programmato correttamente, può essere implementato per indurre la diuresi prima che i meccanismi omeostatici protettivi si manifestino completamente per arrestare la perdita di acqua. A seconda delle esigenze del bodybuilder prima della competizione (ad esempio, necessità di stabilire una classe di peso), nella Tabella 2 sono presentati vari scenari di assunzione di sodio. In alternativa, il sodio può essere mantenuto come costante per ridurre al minimo le variabili manipolate; in effetti, questo potrebbe essere l’approccio migliore se non vengono eseguite prove pratiche prima della competizione. Il mantenimento di una corretta ratio Sodio:Acqua, accennata in precedenza, garantisce una migliore escrezione di liquidi e impedisce la comparsa di stati di iponatriemia. L’assunzione di Potassio (2g netti al giorno) garantisce all’atleta una migliore omeostasi qualitativa dei liquidi corporei.
18) I bodybuilder utilizzatori di PEDs che presentano nel proprio protocollo il GH, dovrebbero cessarne l’uso almeno 14-7 giorni prima della competizione dal momento che il peptide ha una attività di alterazione del RAAS.
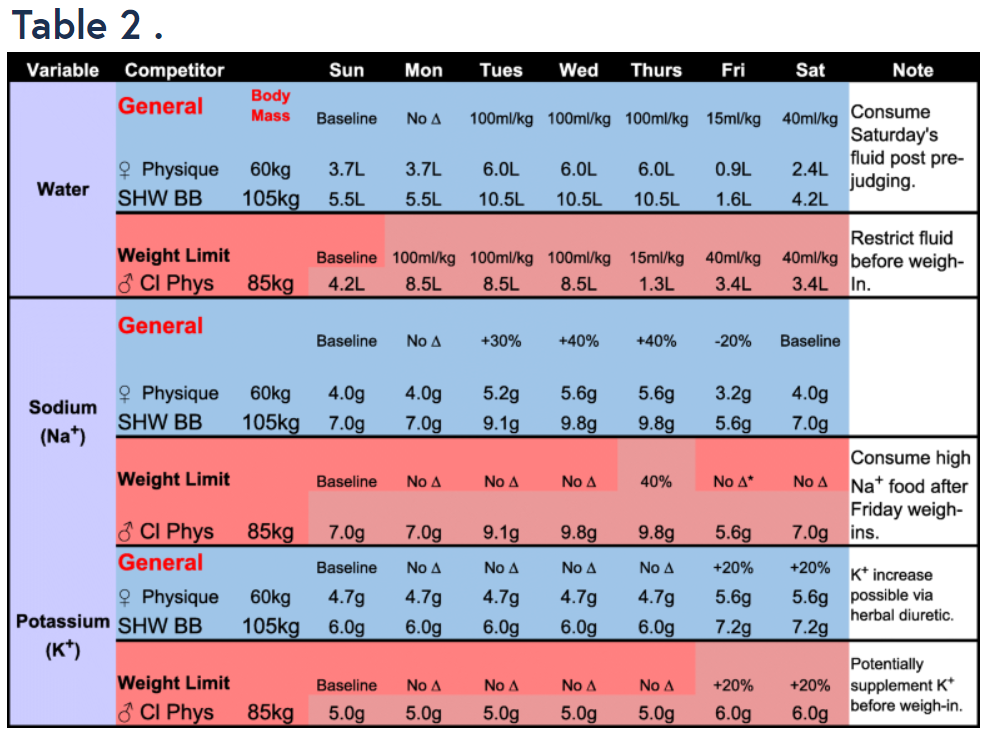
18) L’immagazzinamento e la ritenzione del glicogeno muscolare dipendono fortemente dalla disponibilità di potassio (un catione intracellulare primario) [41,42,43,44,45,46]. Pertanto, garantire un’adeguata assunzione di potassio durante le procedure sia di carico dei carboidrati che di riduzione dell’acqua (se aggiunta) è probabilmente fondamentale per ottimizzare l’aspetto della pratica attraverso lo stoccaggio e la ritenzione di glicogeno muscolare e quindi stimolare una perdita più favorevole di ECW rispetto a ICW quando si utilizzano strategie di disidratazione.
19) Ridurre l’assunzione di fibre durante la Peak Week sembra offrire alcuni potenziali benefici. Rale et al. [55] hanno riferito che la riduzione dell’assunzione di fibre a 10-13 g/giorno per ~ 5 giorni ha ridotto con successo il contenuto intestinale totale e la massa corporea nei contact fighters. I dati hanno dimostrato che una relazione diretta tra l’assunzione di fibre e il contenuto intestinale con periodi di restrizione acuta (di appena due giorni) è efficace nello svuotamento/pulizia del tratto gastrointestinale [162]. Pertanto, la logica per ridurre l’assunzione di fibre prima della competizione è tipicamente quella di ridurre al minimo il rischio di gonfiore/ritenzione idrica [11] e, per alcuni, parte del loro processo per creare una classe di peso.
20) L’utilizzo di alcuni integratori durante la Peak Week può rivelarsi vantaggioso per gli atleti. È stato dimostrato che l’integrazione di creatina aiuta nella sintesi del glicogeno e nella sua supercompensazione [132]. Inoltre, il consumo di CHO con creatina aumenta il carico di creatina [133], che aumenta l’idratazione intracellulare [32, 129]. Insieme alla creatina, possono essere prese in considerazione anche polveri di carboidrati (ad es. destrosio, ciclo-destrine altamente ramificate, ecc.). Le caratteristiche dei carboidrati come l’osmolalità, il tasso di clearance gastrica e l’indice glicemico sono alcune delle variabili che i bodybuilder dovrebbero prendere in considerazione poiché questi fattori possono variare significativamente tra le fonti e possono influire sui sintomi gastrointestinali (ad es. gonfiore, crampi, diarrea, costipazione, ecc.) [ 119,120,121]. Sia le polveri di proteine del siero di latte idrolizzate, gli EAA, le classiche proteine che le polveri di carboidrati possono essere utilizzate come mezzi per manipolare e consumare quantità specifiche di macronutrienti senza dover consumare grandi volumi di cibo. Anche l’uso di diuretici erboristici e farmacologici, con le dovute precauzioni, possono essere inseriti negli ultimi giorni prima del contest per facilitare l’eliminazione dell’acqua extracellulare. Come detto in precedenza, l’uso di Metformina o Berberina nei giorni di ricarica dei CHO ha il potenziale di migliorare la “qualità” di questa pratica per via di un migliore ripartizionamento calorico. L’uso di “NO-booster” come Citrullina Malato e/o Sildenafil possono dare un affetto “pump” dando un aspetto muscolare più “pieno”. Soluzioni topiche con attività anti-infiammatoria/drenante, come quelle contenenti Glicosaminoglicanopolisolfato, possono agevolare la perdita di liquidi extracellulari in aree critiche come le gambe (applicazione dal post workout dell’ultimo Leg Day fino alla sera precedente il contest). Sempre per i bodybuilder utilizzatori di PEDs, la riduzione estrema dei livelli estrogenici nelle ultime due settimane pre-contest può facilitare l'”assottiogliamento” della cute per via del legame tra sintesi di Collagene e Estrogeni.
21) Situazioni emotivamente stressanti possono evocare polidipsia e alterare l’omeostasi dei fluidi in appena 48 ore [78, 79]. Quindi, lo stress psicologico può contrastare i tentativi del bodybuilder agonista di ridurre l’acqua corporea, specialmente nei casi estremi di ansia pre-gara. Come notato in precedenza, si raccomanda di eseguire una prova pratica della strategia della Peak Week ~ 2–4 settimane prima della competizione effettiva, in parte per ridurre l’ansia e assicurare al concorrente che la strategia della Peak Week è sia gestibile che efficace.
22) Riposare e/o dormire con una posizione di “inclinazione a testa in giù” (HDT) (tipicamente da − 4 a -6˚ per cui l’intera superficie del corpo durante il sonno è inclinata verso il basso [57, 58] simula l’aumento del ritorno venoso cardiaco (e la perdita di pressione ortostatica) che si verifica durante la microgravità e si traduce in diuresi e risposte cardiovascolari [57, 59]. Pertanto, i concorrenti potrebbero plausibilmente impiegare l’HDT quando riposano e dormono durante le 12-24 ore prima della competizione per stimolare ulteriormente la diuresi. Questo potenziale beneficio dovrebbe essere bilanciato con possibili effetti dannosi della pratica sui modelli di sonno, che potrebbero interferire con le prestazioni in gara.
23) Il peso della bilancia può essere utilizzato durante la Peak Week per valutare e confermare i livelli di idratazione (vedere la seguente sezione “Considerazioni pratiche per il giorno della gara”).
24) Dal momento che sono coinvolte una moltitudine di variabili e una sostanziale interindividualità biologica, una pratica o “mock” Peak Week durante le ~ 2-4 settimane prima della competizione può fornire informazioni preziose sull’entità e sui tempi appropriati delle alterazioni della dieta e dell’allenamento durante la Peak Week. Inoltre, può attenuare i livelli di stress che un bodybuilder può avere prima della competizione, il che può facilitare il modo in cui il corpo risponde al protocollo della Peak Week.
25) Gli atleti che possono partecipare a una serie di competizioni in successione relativamente rapida, in genere su base settimanale, dovrebbero costruire strategie per le Peak Week (come negli esempi qui riportati) che possono essere replicate, con aggiustamenti aggiuntivi se necessario, durante il periodo di tempo tra le gare . Ciò può richiedere ai concorrenti di mantenere uno stretto controllo dietetico e di stabilire rapidamente l’omeostasi dei fluidi post-gara in modo da ripristinare le condizioni iniziali di base (ad esempio, i livelli di glicogeno muscolare) su cui può fare affidamento una data strategia della Peak Week. Inoltre, oltre ai rischi medici rilevati citati in precedenza, l’uso non oculato di diuretici farmacologici durante la Peak Week può probabilmente interrompere l’omeostasi dei liquidi e diminuire l’affidabilità e quindi il successo delle strategie diuretiche impiegate in una serie di competizioni in stretta prossimità temporale.
26) Come detto in precedenza, i bodybuilder utilizzatori di PEDs utilizzano in vista della Peak Week anche pratiche per la riduzione marcata degli estrogeni per via farmacologica (vedi inibitori dell’Aromatasi) nel tentativo di ridurre lo spessore della pelle. L’Estradiolo, come il GH, è implicato nella sintesi di collagene, una riduzione di queste due variabili potrebbe ridurre nel giro di 14 giorni lo spessore cutaneo. La pratica, per essere oggettiva, deve basarsi sugli esami ematici di controllo per valutare i livelli di E2. Non esiste alcuna letteratura in merito ma semplici dati aneddotici raccolti negli anni.

È essenziale capire che nessuna delle suddette strategie della Peak Week fornirà un restyling fisico per compensare la mancanza di una preparazione corretta o della aderenza durante le fasi di preparazione al contest off-season o pre-gara. Il grasso corporeo deve essere ridotto al minimo ~ 2–3 settimane prima della competizione, in modo che il concorrente possa concentrarsi sulla riduzione al minimo dell’acqua sottocutanea per mostrare al meglio la muscolatura e sull’ottimizzazione delle dimensioni muscolari aumentando le riserve intramuscolari di glicogeno e trigliceridi. Pertanto, l’utilizzo di strategie per la Peak Week è semplicemente un mezzo per ottenere un aspetto migliore durante il giorno della competizione sul palco “sintonizzando” il corpo rispetto al semplice mantenimento della dieta e delle strategie di allenamento pre-gara (cioè quelle focalizzate principalmente sulla riduzione del grasso corporeo e sul mantenimento della massa muscolare).
Considerazioni pratiche per il giorno della gara:

Idealmente il fisico presentato sul palco rappresenta il miglior aspetto possibile dell’atleta, superando quello delle settimane e dei mesi precedenti. Garantire che il picco si verifichi il giorno della competizione spesso richiede un approccio su misura con almeno le seguenti considerazioni:
- Programma della giornata di gara: quando viene giudicato l’atleta e quante volte? Molte organizzazioni competitive includono più turni di valutazione [200,201,202] e categorie tali che la competizione può svolgersi nel corso di un’intera giornata (o più).
- Strategie (pre-programmate o meno) per mettere a punto l’aspetto del fisico il giorno della competizione manipolando l’assunzione di acqua, cibo e integratori alimentari secondo necessità.
- Aspetto personale e percezione del fisico (quanto detto sopra), ed altri mezzi per valutare la fase preparazione. Naturalmente, gli obiettivi della Peak Week settimana di punta per ridurre al minimo l’acqua sottocutanea e garantire che i IMTG e le riserve di glicogeno del muscolo scheletrico siano massimizzate, mettendo i muscoli in pieno rilievo e mostrando la massima “muscolarità” dovrebbero essere ampiamente raggiunti prima del risveglio il giorno della competizione. Nel gergo del bodybuilding, queste componenti della muscolatura potrebbero essere considerate “secchezza” (mancanza di fluido sottocutaneo) e “pienezza” (le riserve energetiche delle cellule muscolari sono completamente riempite / supercompensate). Tuttavia, spesso è necessaria una messa a punto per ottimizzare l’aspetto del fisico quando viene giudicato.
A mia conoscenza, non vi è ricerca che esamini la misura in cui i mezzi soggettivi o altri mezzi pratici al fine di garantire la buona preparazione al giorno della competizione di bodybuilding siano associati al presunto fluido sottocutaneo e alle misure istologiche. Tuttavia, i seguenti sono modi comunemente accettati e suggeriti in precedenza [36] per valutare la prestanza per il giorno del contest:
- Le riserve di glicogeno muscolare sono “piene” e l’atleta può ottenere un buon “pump”? I metaboliti glicolitici (ad esempio, lattato e fosfato inorganico) derivati dall’uso del glicogeno producono una risposta di iperemia reattiva post-esercizio nota come “pump” [203] che gonfia il tessuto muscolare, aumentandone lo spessore fino a ~ 10% [204, 205]. Ciò rappresenta un vantaggio per l’aumento acuto della dimensione muscolare prima di salire sul palco e spostare il fluido in specifici ventri muscolari (idealmente anche riducendo così il volume del fluido sottocutaneo interstiziale per migliorare ulteriormente l’aspetto della muscolosità, tale che un atleta può preferibilmente “pompare” la muscolatura per migliorare l’equilibrio dell’espansione muscolare.
- L’atleta è “secco”? L’acqua corporea è stata ridotta abbastanza da ridurre al minimo il fluido sottocutaneo per evidenziare notevolmente la muscolatura sottostante?
- L’atleta è “piatto”? Creare una situazione di pienezza muscolare e con un aspetto fisico “asciutto” richiede uno stretto atto di riequilibrio fisiologico. La “pompa” iperemica richiede un fluido corporeo adeguato per spostarsi nel ventre muscolare; tuttavia, un atleta con alti livelli di glicogeno muscolare ma acqua corporea eccessivamente ridotta può sperimentare la “piattezza muscolare”, cioè la mancanza di un “pump” muscolare solitamente associata a un aspetto sciupato a causa dell’eccessiva disidratazione. D’altra parte, la colpa potrebbe essere anche della mancanza di glicogeno muscolare come fonte di osmoliti metabolici per l’effetto “pump” [203].
Sia le riserve di glicogeno (“pienezza”) che la disidratazione (aspetto “asciutto”) dipendono dall’omeostasi dei fluidi che cambia rapidamente. Pertanto, propongo che il peso della bilancia possa essere impiegato come indicatore rudimentale, ma pratico e oggettivo dell’idratazione corporea nel contesto del “pump” muscolare e dell’aspetto visivo, nonché delle perdite di liquidi urinari [notare che il colore delle urine è una misura di campo adeguata dello stato di idratazione, ma può essere alterata dal consumo di integratori alimentari [206, 207]. Pertanto, misurare il peso corporeo durante la Peak Week e il suo tasso di variazione può aiutare a determinare la misura in cui l’acqua corporea è stata ridotta al minimo il giorno della competizione. Le misurazioni per un ipotetico concorrente sono fornite nella Tabella 4. Presumiamo qui che il glicogeno del muscolo-scheletrico sia stato adeguatamente super compensato (aumentando il contenuto di acqua intramiocellulare e aumentando il peso corporeo) dopo un periodo di ridotta assunzione di carboidrati che riduce il contenuto di acqua corporea (e peso corporeo) all’inizio della Peak Week (vedi sopra). Se le strategie di disidratazione determinano una riduzione del peso della bilancia che si avvicina o è inferiore ai livelli di pre ricarica dei carboidrati, ipotizziamo che ciò rifletta che i cambiamenti desiderati nell’ECF (riduzione del fluido sottocutaneo) e negli spazi ICF (aumento del fluido intramiocellulare e del glicogeno) siano stati raggiunti.

La figura 2 di seguito delinea un albero decisionale del giorno della competizione che un concorrente potrebbe utilizzare per affrontare le possibilità discusse sopra (mancanza di pienezza muscolare o condizione fisica “asciutta”, o essere “piatto”). Presumiamo una preferenza per ridurre al minimo l’acqua corporea rispetto alla pienezza muscolare. Inoltre, tenete presente che lo scenario in cui la “piattezza” è un problema potrebbe richiedere una combinazione di aggiunta di acqua, sodio, carboidrati e/o grassi alimentari a seconda delle circostanze. Le precedenti esperienze di “finta Peak Week” e di assunzione di carboidrati possono servire bene all’atleta nella scelta di un giorno strategicamente appropriato per dare il massimo sul palco. Questo stesso albero decisionale può essere applicato ripetutamente in situazioni in cui l’atleta viene giudicato in più round.
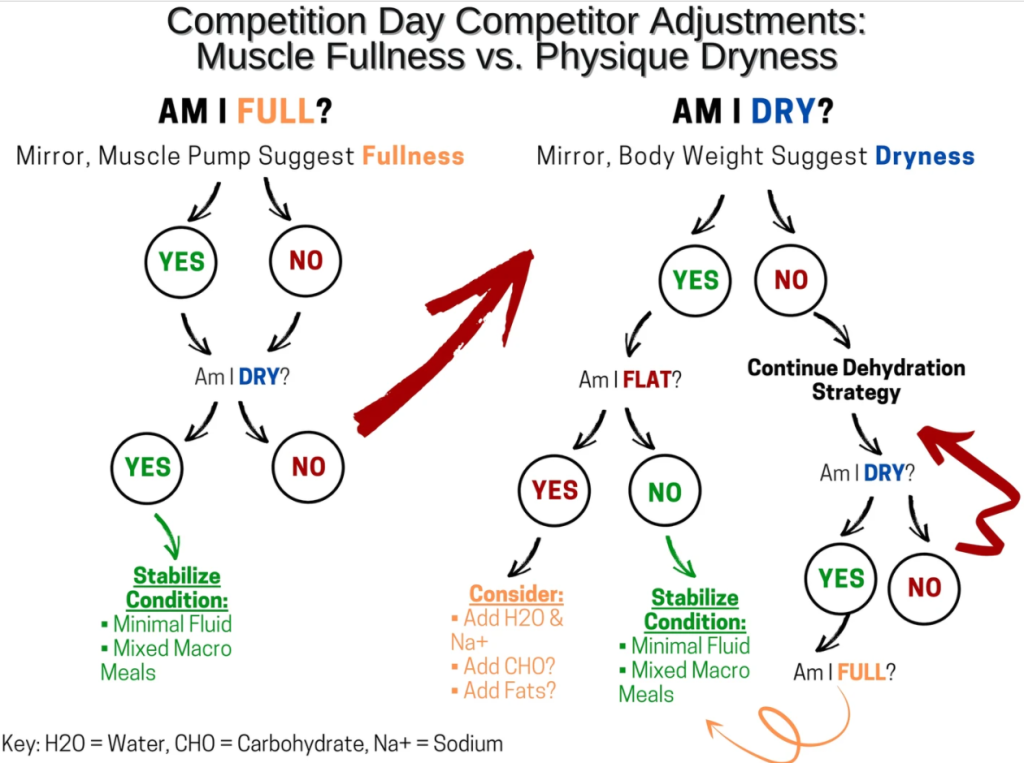
Conclusioni:
Ricapitolando, l’evidenza suggerisce che i bodybuilder usano frequentemente strategie di “Peak Week” come il carico dei CHO, la manipolazione di acqua/sodio e altri approcci nel tentativo di migliorare il loro fisico durante l’ultima settimana di preparazione alla competizione. Sfortunatamente, c’è una scarsità di ricerche sull’efficacia e la sicurezza di queste strategie quando implementate individualmente o collettivamente. Poiché le variabili che vengono frequentemente manipolate dai bodybuilder sono correlate, l’alterazione di una variabile in genere influenza altre variabili. Inoltre, le risposte interindividuali all’alterazione di queste variabili rendono ancora più difficile fornire precise “regole” da seguire per la Peak Week. Data la complicata interazione di variabili fisiologiche durante la Peak Week, nonché l’interindividualità biologica e la variabilità nell’importanza attribuita alla massimizzazione dei vari aspetti della muscolarità attraverso le diverse categorie competitive, ci sono una moltitudine di vie di ricerca per studiare le strategie della Peak Week. In particolare, un esame strettamente controllato degli effetti quantificabili della supercompensazione del glicogeno, della disidratazione graduale tramite la manipolazione del sodio e/o dell’acqua e delle strategie di “pump” pre-palco, insieme alla documentazione dei cambiamenti visivi “pratici” soggettivi associati nell’aspetto fisico, potrebbero essere aree di studio rilevanti che possono aiutare a informare meglio i concorrenti e indirizzarli lontano da pratiche potenzialmente pericolose e/o meno efficaci della fase Peak Week . Pertanto, grazie alla review di Brad J. Schoenfeld e colleghi, e alla piccola aggiunta delle mie ricerche e annotazioni, viene presentato questo articolo al fine di rappresentare un approccio basato sull’evidenza alle strategie di picco pre-gara basate sullo stato attuale della letteratura scientifica (e sull’aneddotica più affidabile) nella speranza che possa stimolare il miglioramento dell’atleta e/o del preparatore i quali possono accrescere le loro conoscenze e maturare una corretta comprensione delle delicate componenti che caratterizzano la preparazione ad un contest di Bodybuilding potendo così sviluppare approcci pratici e sicuri applicabili per ottimizzare la forma fisica da mostrare sul palco.
Gabriel Bellizzi
Riferimenti:
- Bamman MM, Hunter GR, Newton LE, Roney RK, Khaled MA. Changes in body composition, diet, and strength of bodybuilders during the 12 weeks prior to competition. J Sports Med Phys Fitness. 1993;33:383–91. https://www.ncbi.nlm.nih.gov/pubmed/8035587.
- 2.Chappell AJ, Simper T, Barker ME. Nutritional strategies of high level natural bodybuilders during competition preparation. J Int Soc Sports Nutr. 2018;15:4. doi:https://doi.org/10.1186/s12970-018-0209-z.CAS Article PubMed PubMed Central Google Scholar
- 3.Kistler BM, Fitschen PJ, Ranadive SM, Fernhall B, Wilund KR. Case study: Natural bodybuilding contest preparation. Int J Sport Nutr Exerc Metab. 2014;24:694–700. doi:https://doi.org/10.1123/ijsnem.2014-0016.Article PubMed Google Scholar
- 4.Robinson SL, Lambeth-Mansell A, Gillibrand G, Smith-Ryan A, Bannock L. A nutrition and conditioning intervention for natural bodybuilding contest preparation: case study. J Int Soc Sports Nutr. 2015;12:20. doi:https://doi.org/10.1186/s12970-015-0083-x.Article PubMed PubMed Central Google Scholar
- 5.Rossow LM, Fukuda DH, Fahs CA, Loenneke JP, Stout JR. Natural bodybuilding competition preparation and recovery: a 12-month case study. Int J Sports Physiol Perform. 2013;8:582–92. https://www.ncbi.nlm.nih.gov/pubmed/23412685.
- 6.Tinsley GM, Trexler ET, Smith-Ryan AE, Paoli A, Graybeal AJ, Campbell BI, et al. Changes in Body Composition and Neuromuscular Performance Through Preparation, 2 Competitions, and a Recovery Period in an Experienced Female Physique Athlete. J Strength Cond Res. 2019;33:1823–39. doi:https://doi.org/10.1519/JSC.0000000000002758.Article PubMed Google Scholar
- 7.Helms ER, Aragon AA, Fitschen PJ. Evidence-based recommendations for natural bodybuilding contest preparation: nutrition and supplementation. J Int Soc Sports Nutr. 2014;11:20. doi:https://doi.org/10.1186/1550-2783-11-20.CAS Article PubMed PubMed Central Google Scholar
- 8.Kleiner SM, Bazzarre TL, Litchford MD. Metabolic profiles, diet, and health practices of championship male and female bodybuilders. J Am Diet Assoc. 1990;90:962–7. https://www.ncbi.nlm.nih.gov/pubmed/2365938.
- 9.Gentil P, de Lira CAB, Paoli A, dos Santos JAB, da Silva RDT, Junior JRP, et al. Nutrition, pharmacological and training strategies adopted by six bodybuilders: case report and critical review. Eur J Transl Myol. 2017;27. https://www.ncbi.nlm.nih.gov/pmc/articles/pmc5391526/.
- 10.Mitchell L, Slater G, Hackett D, Johnson N, O’connor H. Physiological implications of preparing for a natural male bodybuilding competition. EJSS. 2018;18:619–29. doi:https://doi.org/10.1080/17461391.2018.1444095.Article PubMed Google Scholar
- 11.Chappell AJ, Simper TN. Nutritional Peak Week and Competition Day Strategies of Competitive Natural Bodybuilders. Sports (Basel). 2018;6. doi:https://doi.org/10.3390/sports6040126.
- 12.Probert A, Palmer F, Leberman S. The Fine Line: An insight into “risky”practices of male and female competitive bodybuilders. Annals of Leisure Research. 2007;10:272–90. https://www.tandfonline.com/doi/abs/https://doi.org/10.1080/11745398.2007.9686767.
- 13.Spendlove J, Mitchell L, Gifford J, Hackett D, Slater G, Cobley S, et al. Dietary Intake of Competitive Bodybuilders. Sports Med. 2015;45:1041–63. doi:https://doi.org/10.1007/s40279-015-0329-4.Article PubMed Google Scholar
- 14.Mitchell L, Hackett D, Gifford J, Estermann F, O’Connor H Do Bodybuilders Use Evidence-Based Nutrition Strategies to Manipulate Physique? Sports (Basel). 2017;5. doi:https://doi.org/10.3390/sports5040076.
- 15.de Moraes WMAM, de Almeida FN, Dos Santos LEA, Cavalcante KDG, Santos HO, Navalta JW, et al. Carbohydrate Loading Practice in Bodybuilders: Effects on Muscle Thickness, Photo Silhouette Scores, Mood States and Gastrointestinal Symptoms. J Sports Sci Med. 2019;18:772–9. https://www.ncbi.nlm.nih.gov/pubmed/31827362.
- 16.Norton L, Baker P. The Complete Contest Prep Guide (Male Cover). CreateSpace Independent Publishing Platform; 2018. https://play.google.com/store/books/details?id=k9S5uwEACAAJ.
- 17.Aceto C. Championship Bodybuilding. ASL Publications; 2001.
- 18.Konrad C, Schüpfer G, Wietlisbach M, Gerber H. [Insulin as an anabolic: hypoglycemia in the bodybuilding world]. Anasthesiol Intensivmed Notfallmed Schmerzther. 1998;33:461–3. doi:https://doi.org/10.1055/s-2007-994284.CAS Article PubMed Google Scholar
- 19.Mayr FB, Domanovits H, Laggner AN. Hypokalemic paralysis in a professional bodybuilder. Am J Emerg Med. 2012;30:1324.e5–8. doi:https://doi.org/10.1016/j.ajem.2011.06.029.Article Google Scholar
- 20.Kingston M. Dangers of ripping in body building. Intern Med J. 2011;41:708–9. doi:https://doi.org/10.1111/j.1445-5994.2011.02550.x.CAS Article PubMed Google Scholar
- 21.Caldwell JE. Diuretic therapy and exercise performance. Sports Med. 1987;4:290–304. doi:https://doi.org/10.2165/00007256-198704040-00005.CAS Article PubMed Google Scholar
- 22.Goforth HW Jr, Arnall DA, Bennett BL, Law PG. Persistence of supercompensated muscle glycogen in trained subjects after carbohydrate loading. J Appl Physiol. 1997;82:342–7. doi:https://doi.org/10.1152/jappl.1997.82.1.342.CAS Article PubMed Google Scholar
- 23.Ivy JL. Muscle glycogen synthesis before and after exercise. Sports Med. 1991;11:6–19. doi:https://doi.org/10.2165/00007256-199111010-00002.CAS Article PubMed Google Scholar
- 24.Nielsen J, Ørtenblad N. Physiological aspects of the subcellular localization of glycogen in skeletal muscle. Appl Physiol Nutr Metab. 2013;38:91–9. doi:https://doi.org/10.1139/apnm-2012-0184.CAS Article PubMed Google Scholar
- 25.Graham TE, Yuan Z, Hill AK, Wilson RJ. The regulation of muscle glycogen: the granule and its proteins. Acta Physiol. 2010;199:489–98. doi:https://doi.org/10.1111/j.1748-1716.2010.02131.x.CAS Article Google Scholar
- 26.Oakley HB, Young FG. The osmotic pressure of glycogen solutions. Biochem J. 1936;30:868–76. doi:https://doi.org/10.1042/bj0300868.CAS Article PubMed PubMed Central Google Scholar
- 27.King RFGJ, Jones B, O’Hara JP. The availability of water associated with glycogen during dehydration: a reservoir or raindrop? Eur J Appl Physiol. 2018;118:283–90. doi:https://doi.org/10.1007/s00421-017-3768-9.CAS Article PubMed Google Scholar
- 28.Olsson K-E, Saltin B. Variation in Total Body Water with Muscle Glycogen Changes in Man. Acta Physiol Scand. 1970;80:11–8. doi:https://doi.org/10.1111/j.1748-1716.1970.tb04764.x.CAS Article PubMed Google Scholar
- 29.McBride JJ, Guest MM, Scott EL, Others. The storage of the major liver components; emphasizing the relationship of glycogen to water in the liver and the hydration of glycogen. J Biol Chem. 1941;139:943–52. https://www.cabdirect.org/cabdirect/abstract/19411401274.
- 30.Sherman WM, Plyley MJ, Sharp RL, Van Handel PJ, McAllister RM, Fink WJ, et al. Muscle glycogen storage and its relationship with water. Int J Sports Med. 1982;3:22–4. doi:https://doi.org/10.1055/s-2008-1026056.CAS Article PubMed Google Scholar
- 31.Shiose K, Yamada Y, Motonaga K, Sagayama H, Higaki Y, Tanaka H, et al. Segmental extracellular and intracellular water distribution and muscle glycogen after 72-h carbohydrate loading using spectroscopic techniques. J Appl Physiol. 2016;121:205–11. doi:https://doi.org/10.1152/japplphysiol.00126.2016.CAS Article PubMed Google Scholar
- 32.Bone JL, Ross ML, Tomcik KA, Jeacocke NA, Hopkins WG, Burke LM. Manipulation of Muscle Creatine and Glycogen Changes Dual X-ray Absorptiometry Estimates of Body Composition. Med Sci Sports Exerc. 2017;49:1029–35. doi:https://doi.org/10.1249/mss.0000000000001174.CAS Article PubMed Google Scholar
- 33.Schoenfeld BJ, Alto A, Grgic J, Tinsley GM, Trexler ET. Alterations in body composition, resting metabolic rate, muscular strength, and eating behavior in response to natural bodybuilding competition preparation: A case study. Journal of Strength Conditioning Research. 2020. doi:https://doi.org/10.1519/JSC.0000000000003816. ;Publish Ahead of Print.Article PubMed Google Scholar
- 34.Albertson TE, Chenoweth JA, Colby DK, Sutter ME. The Changing Drug Culture: Use and Misuse of Appearance- and Performance-Enhancing Drugs. FP Essent. 2016;441:30–43. https://www.ncbi.nlm.nih.gov/pubmed/26881771.
- 35.Hickson JF Jr, Johnson TE, Lee W, Sidor RJ. Nutrition and the precontest preparations of a male bodybuilder. J Am Diet Assoc. 1990;90:264–7. https://www.ncbi.nlm.nih.gov/pubmed/2303663.
- 36.Stevenson SW. Be Your Own Bodybuilding Coach: A Reference Guide For Year-Round Bodybuilding Success. Integrative Bodybuilding, LLC; 2018. https://play.google.com/store/books/details?id=nzi4ugEACAAJ.
- 37.Tobias A, Mohiuddin SS. Physiology, Water Balance. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2019. https://www.ncbi.nlm.nih.gov/pubmed/31082103.
- 38.Sawka MN, Coyle EF. Influence of body water and blood volume on thermoregulation and exercise performance in the heat. Exerc Sport Sci Rev. 1999;27:167–218. https://www.ncbi.nlm.nih.gov/pubmed/10791017.
- 39.NSCA -National Strength & Conditioning Association. Campbell B, Spano M. NSCA’s Guide to Sport and Exercise Nutrition. Human Kinetics; 2011. https://play.google.com/store/books/details?id=nu96DwAAQBAJ.
- 40.Costill DL, Coté R, Fink W. Muscle water and electrolytes following varied levels of dehydration in man. J Appl Physiol. 1976;40:6–11. doi:https://doi.org/10.1152/jappl.1976.40.1.6.CAS Article PubMed Google Scholar
- 41.Gardner LI, Talbot NB, Cook CD, Berman H, Uribe RC. The effect of potassium deficiency on carbohydrate metabolism. J Lab Clin Med. 1950;35:592–602. https://www.ncbi.nlm.nih.gov/pubmed/15412290.
- 42.Clarke DW. The influence of potassium ion upon glucose uptake and glycogen synthesis in the isolated rat diaphragm. Can J Biochem Physiol. 1955;33:687–94. https://www.ncbi.nlm.nih.gov/pubmed/13240543.
- 43.Kreitzman SN, Coxon AY, Szaz KF. Glycogen storage: illusions of easy weight loss, excessive weight regain, and distortions in estimates of body composition. Am J Clin Nutr. 1992;56 1 Suppl:292S – 293S. doi:https://doi.org/10.1093/ajcn/56.1.292S.
- 44.Patrick J. Assessment of body potassium stores. Kidney Int. 1977;11:476–90. doi:https://doi.org/10.1038/ki.1977.65.CAS Article PubMed Google Scholar
- 45.King RFGJ, Cooke C, Carroll S, O’Hara J. Estimating changes in hydration status from changes in body mass: considerations regarding metabolic water and glycogen storage. J Sports Sci. 2008;26:1361–3. doi:https://doi.org/10.1080/02640410802192768.Article PubMed Google Scholar
- 46.Torres HN, Birnbaumer L, Del Carmen Garcia M, Bernard E, Belocopitow E. Glycogen metabolism in muscle homogenates. I. The effect of potassium ions on glycogen synthesis. Arch Biochem Biophys. 1966;116:59–68. doi:https://doi.org/10.1016/0003-9861(66)90012-9.CAS Article PubMed Google Scholar
- 47.Knepper MA, Kwon T-H, Nielsen S. Molecular physiology of water balance. N Engl J Med. 2015;372:1349–58. doi:https://doi.org/10.1056/NEJMra1404726.CAS Article PubMed PubMed Central Google Scholar
- 48.Spano M, Kruskall L, Travis Thomas D. Nutrition for Sport, Exercise, and Health. Human Kinetics; 2017. https://play.google.com/store/books/details?id=dvR6DwAAQBAJ.
- 49.Kanbay M, Aslan G, Afsar B, Dagel T, Siriopol D, Kuwabara M, et al. Acute effects of salt on blood pressure are mediated by serum osmolality. J Clin Hypertens. 2018;20:1447–54. doi:https://doi.org/10.1111/jch.13374.CAS Article Google Scholar
- 50.Schweda F. Salt feedback on the renin-angiotensin-aldosterone system. Pflugers Arch. 2015;467:565–76. doi:https://doi.org/10.1007/s00424-014-1668-y.CAS Article PubMed Google Scholar
- 51.Gomez RA, Sequeira Lopez MLS. Who and where is the renal baroreceptor?: the connexin hypothesis. Kidney international. 2009;75:460–2. doi:https://doi.org/10.1038/ki.2008.536.CAS Article PubMed PubMed Central Google Scholar
- 52.Scott JH, Menouar MA, Dunn RJ. Physiology, Aldosterone. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2020. https://www.ncbi.nlm.nih.gov/pubmed/29261963.
- 53.Rogacz S, Williams GH, Hollenberg NK. Time course of enhanced adrenal responsiveness to angiotensin on a low salt diet. Hypertension. 1990;15:376–80. doi:https://doi.org/10.1161/01.hyp.15.4.376.CAS Article PubMed Google Scholar
- 54.Maack T. Role of atrial natriuretic factor in volume control. Kidney Int. 1996;49:1732–7. doi:https://doi.org/10.1038/ki.1996.257.CAS Article PubMed Google Scholar
- 55.Reale R, Slater G, Cox GR, Dunican IC, Burke LM. The Effect of Water Loading on Acute Weight Loss Following Fluid Restriction in Combat Sports Athletes. Int J Sport Nutr Exerc Metab. 2018;28:565–73. doi:https://doi.org/10.1123/ijsnem.2017-0183.CAS Article PubMed Google Scholar
- 56.Convertino VA, Bloomfield SA, Greenleaf JE. An overview of the issues: physiological effects of bed rest and restricted physical activity. Med Sci Sports Exerc. 1997;29:187–90. doi:https://doi.org/10.1097/00005768-199702000-00004.CAS Article PubMed Google Scholar
- 57.Blomqvist CG, Stone HL. Cardiovascular adjustments to gravitational stress. Compr Physiol. 2011;:1025–63. http://neuroyates.com/honorshumanphysiology/clinicalpapers/Cardio_Gravitational-Stress.pdf.
- 58.Nixon JV, Murray RG, Bryant C, Johnson RL, Mitchell JH, Holland OB, et al. Early cardiovascular adaptation to simulated zero gravity. J Appl Physiol. 1979;46:541–8. doi:https://doi.org/10.1152/jappl.1979.46.3.541.CAS Article PubMed Google Scholar
- 59.Convertino VA, Bisson R, Bates R, Goldwater D, Sandler H. Effects of antiorthostatic bedrest on the cardiorespiratory responses to exercise. Aviat Space Environ Med. 1981;52:251–5. https://www.ncbi.nlm.nih.gov/pubmed/7283897.
- 60.Mauran P, Sediame S, Pavy-Le Traon A, Maillet A, Carayon A, Barthelemy C, et al. Renal and hormonal responses to isotonic saline infusion after 3 days’ head-down tilt vs. supine and seated positions. Acta Physiol Scand. 2003;177:167–76. https://onlinelibrary.wiley.com/doi/abs/10.1046/j.1365-201X.2003.01059.x?casa_token=aXoRJ9ceXV8AAAAA:2WA6uD_yoUfSi8ayHb30rOTAOEghdhIGhwFXqAsbNenvQL8eUUuPgEOH_xExJwt4cJmrwqzoujhcbw.
- 61.Norsk P. Gravitational stress and volume regulation. Clin Physiol. 1992;12:505–26. doi:https://doi.org/10.1111/j.1475-097x.1992.tb00355.x.CAS Article PubMed Google Scholar
- 62.Mauran P, Sediame S, Traon AP, Maillet A, Carayon A, Barthelemy C, et al. Effects of a three-day head-down tilt on renal and hormonal responses to acute volume expansion. Am J Physiol. 1999;277:R1444–52. doi:https://doi.org/10.1152/ajpregu.1999.277.5.R1444.CAS Article PubMed Google Scholar
- 63.Nagaya K, Wada F, Nakamitsu S, Sagawa S, Shiraki K. Responses of the circulatory system and muscle sympathetic nerve activity to head-down tilt in humans. Am J Physiol. 1995;268(5 Pt 2):R1289–94. doi:https://doi.org/10.1152/ajpregu.1995.268.5.R1289.CAS Article PubMed Google Scholar
- 64.Reuter DA, Felbinger TW, Schmidt C, Moerstedt K, Kilger E, Lamm P, et al. Trendelenburg positioning after cardiac surgery: effects on intrathoracic blood volume index and cardiac performance. Eur J Anaesthesiol. 2003;20:17–20. doi:https://doi.org/10.1017/s0265021503000036.CAS Article PubMed Google Scholar
- 65.Kalmar AF, Foubert L, Hendrickx JFA, Mottrie A, Absalom A, Mortier EP, et al. Influence of steep Trendelenburg position and CO 2 pneumoperitoneum on cardiovascular, cerebrovascular, and respiratory homeostasis during robotic prostatectomy. Br J Anaesth. 2010;104:433–9. doi:https://doi.org/10.1093/bja/aeq018.CAS Article PubMed Google Scholar
- 66.Marshall-Goebel K, Mulder E, Bershad E, Laing C, Eklund A, Malm J, et al. Intracranial and Intraocular Pressure During Various Degrees of Head-Down Tilt. Aerosp Med Hum Perform. 2017;88:10–6. doi:https://doi.org/10.3357/AMHP.4653.2017.Article PubMed Google Scholar
- 67.Khan BA, Sodhi JS, Zargar SA, Javid G, Yattoo GN, Shah A, et al. Effect of bed head elevation during sleep in symptomatic patients of nocturnal gastroesophageal reflux. J Gastroenterol Hepatol. 2012;27:1078–82. doi:https://doi.org/10.1111/j.1440-1746.2011.06968.x.Article PubMed Google Scholar
- 68.Scott DR, Simon RA. Supraesophageal Reflux: Correlation of Position and Occurrence of Acid Reflux–Effect of Head-of-Bed Elevation on Supine Reflux. J Allergy Clin Immunol Pract. 2015;3:356–61. doi:https://doi.org/10.1016/j.jaip.2014.11.019.Article PubMed Google Scholar
- 69.Meyers WF, Herbst JJ. Effectiveness of positioning therapy for gastroesophageal reflux. Pediatrics. 1982;69:768–72. https://www.ncbi.nlm.nih.gov/pubmed/7079042.
- 70.Cohn JR. Elevation of the Head of Bed to Treat Supraesophageal Reflux: Controlling the Trigger and Reducing the “Drip.” J Allergy Clin Immunol Pract. 2015;3:362–4. https://www.jaci-inpractice.org/article/S2213-2198(15)00129-4/abstract.
- 71.Heijke SA, Smith G, Key A. The effect of the Trendelenburg position on lower oesophageal sphincter tone. Anaesthesia. 1991;46:185–7. doi:https://doi.org/10.1111/j.1365-2044.1991.tb09405.x.CAS Article PubMed Google Scholar
- 72.Jeukendrup AE. Nutrition for endurance sports: marathon, triathlon, and road cycling. J Sports Sci. 2011;29(Suppl 1):91–9. doi:https://doi.org/10.1080/02640414.2011.610348.Article Google Scholar
- 73.Jeukendrup A. A step towards personalized sports nutrition: carbohydrate intake during exercise. Sports Med. 2014;44(Suppl 1):25–33. doi:https://doi.org/10.1007/s40279-014-0148-z.Article PubMed Central Google Scholar
- 74.Jeukendrup AE, McLaughlin J. Carbohydrate ingestion during exercise: effects on performance, training adaptations and trainability of the gut. Nestle Nutr Inst Workshop Ser. 2011;69:1–12. doi:https://doi.org/10.1159/000329268. discussion 13–7.CAS Article PubMed Google Scholar
- 75.Jeukendrup AE. Training the Gut for Athletes. Sports Med. 2017;47(Suppl 1):101–10. doi:https://doi.org/10.1007/s40279-017-0690-6.Article PubMed PubMed Central Google Scholar
- 76.Mandell AJ, Mersol-Sabbot I, Mandell MP. Psychological disturbance and water retention. Arch Gen Psychiatry. 1964;10:513–8. doi:https://doi.org/10.1001/archpsyc.1964.01720230075008.CAS Article PubMed Google Scholar
- 77.Banday AA, Lokhandwala MF. Dopamine receptors and hypertension. Curr Hypertens Rep. 2008;10:268–75. doi:https://doi.org/10.1007/s11906-008-0051-9.CAS Article PubMed Google Scholar
- 78.Kuchel O, Cuche JL, Buu NT, Guthrie GP, Unger T, Nowaczynski W, et al. Catecholamine Excretion in “Idiopathic” Edema: Decreased Dopamine Excretion, a Pathogenic Factor? The Journal of Clinical Endocrinology Metabolism. 1977;44:639–46. doi:https://doi.org/10.1210/jcem-44-4-639.CAS Article PubMed Google Scholar
- 79.Kuchel O, Cuche JL, Hamet O, Buu NT, Nowaczynski Boucher R, Genest J. Idiopathic edema: New pathogenetic and therapeutic aspects. Mod Med Can. 1976;31:619–24.Google Scholar
- 80.Espiner EA. The effects of stress on salt and water balance. Baillieres Clin Endocrinol Metab. 1987;1:375–90. doi:https://doi.org/10.1016/s0950-351x(87)80068-x.CAS Article PubMed Google Scholar
- 81.Kubzansky LD, Adler GK. Aldosterone: a forgotten mediator of the relationship between psychological stress and heart disease. Neurosci Biobehav Rev. 2010;34:80–6. doi:https://doi.org/10.1016/j.neubiorev.2009.07.005.CAS Article PubMed Google Scholar
- 82.Light K, Koepke J, Obrist P, Willis P. Psychological stress induces sodium and fluid retention in men at high risk for hypertension. Science. 1983;220:429–31. doi:https://doi.org/10.1126/science.6836285.CAS Article PubMed Google Scholar
- 83.Nicholls AR, Polman RCJ, Levy AR. A path analysis of stress appraisals, emotions, coping, and performance satisfaction among athletes. Psychol Sport Exerc. 2012;13:263–70. doi:https://doi.org/10.1016/j.psychsport.2011.12.003.Article Google Scholar
- 84.Hanton S, Thomas O, Mellalieu SD. Management of competitive stress in elite sport. International Olympic Committee sport psychology handbook. 2009;:30–42. https://books.google.com/books?hl=en&lr=&id=UwI4xd3a5W0C&oi=fnd&pg=PA30&dq=Hanton+S+Thomas+O+and+Mellalieu+SD+Management+of+competitive+stress+in+elite+sport+2009&ots=ODW4HUUsq4&sig=un9LxJpac8-2dTgVGI9kjCw82o4.
- 85.van Loon LJC. Use of intramuscular triacylglycerol as a substrate source during exercise in humans. J Appl Physiol. 2004;97:1170–87. doi:https://doi.org/10.1152/japplphysiol.00368.2004.Article PubMed Google Scholar
- 86.Frayn KN, Maycock PF. Skeletal muscle triacylglycerol in the rat: methods for sampling and measurement, and studies of biological variability. J Lipid Res. 1980;21:139–44. https://www.ncbi.nlm.nih.gov/pubmed/7354251.
- 87.Starling RD, Trappe TA, Parcell AC, Kerr CG, Fink WJ, Costill DL. Effects of diet on muscle triglyceride and endurance performance. J Appl Physiol. 1997;82:1185–9. doi:https://doi.org/10.1152/jappl.1997.82.4.1185.CAS Article PubMed Google Scholar
- 88.Keats TE. Reference Man. A Report Prepared by a Task Group of Committee 2 of the International Commission on Radiological ProtectionReference Man. A Report Prepared by a Task Group of Committee 2 of the International Commission on Radiological Protection. ICRP Publ. 23. Cloth, $50.00; ₤ 21.50. Pp. 480, with figures. Oxford, Pergamon Press, 1975. Radiology. 1975;117:584–584. doi:https://doi.org/10.1148/117.3.584.
- 89.van Loon LJC, Schrauwen-Hinderling VB, Koopman R, Wagenmakers AJM, Hesselink MKC, Schaart G, et al. Influence of prolonged endurance cycling and recovery diet on intramuscular triglyceride content in trained males. Am J Physiol Endocrinol Metab. 2003;285:E804–11. doi:https://doi.org/10.1152/ajpendo.00112.2003.Article PubMed Google Scholar
- 90.Dubé JJ, Amati F, Toledo FGS, Stefanovic-Racic M, Rossi A, Coen P, et al. Effects of weight loss and exercise on insulin resistance, and intramyocellular triacylglycerol, diacylglycerol and ceramide. Diabetologia. 2011;54:1147–56. doi:https://doi.org/10.1007/s00125-011-2065-0.CAS Article PubMed PubMed Central Google Scholar
- 91.Shinohara A, Takakura J, Yamane A, Suzuki M. Effect of the classic 1-week glycogen-loading regimen on fat-loading in rats and humans. J Nutr Sci Vitaminol. 2010;56:299–304. doi:https://doi.org/10.3177/jnsv.56.299.CAS Article PubMed Google Scholar
- 92.Décombaz J. Nutrition and recovery of muscle energy stores after exercise. SCHWEIZERISCHE ZEITSCHRIFT FUR SPORTMEDIZIN UND SPORTTRAUMATOLOGIE. 2003;51:31–8. https://ssms.ch/fileadmin/user_upload/Zeitschrift/51-2003-1/07-2003-1.pdf.
- 93.Decombaz J, Fleith M, Hoppeler H, Kreis R, Boesch C. Effect of diet on the replenishment of intramyocellular lipids after exercise. Eur J Nutr. 2000;39:244–7. https://idp.springer.com/authorize/casa?redirect_uri=https://link.springer.com/content/pdf/10.1007/s003940070002.pdf&casa_token=KPQETCIB6tUAAAAA:LYP3-oXpXtmiTXk7zGOgOjtZa47nT5Df8voNSC_OkN7RUfT3ay1PYUxrz3C1OF9U4u0C4ECAzl1V3wQpEw.
- 94.Spriet LL. Metabolic regulation of fat use during exercise and in recovery. Nestle Nutr Inst Workshop Ser. 2011;69:39–53. doi:https://doi.org/10.1159/000329281. discussion 53–8.CAS Article PubMed Google Scholar
- 95.Zderic TW, Davidson CJ, Schenk S, Byerley LO, Coyle EF. High-fat diet elevates resting intramuscular triglyceride concentration and whole body lipolysis during exercise. Am J Physiol Endocrinol Metab. 2004;286:E217–25. doi:https://doi.org/10.1152/ajpendo.00159.2003.CAS Article PubMed Google Scholar
- 96.Essen-Gustavsson B, Tesch PA. Glycogen and triglyceride utilization in relation to muscle metabolic characteristics in men performing heavy-resistance exercise. Eur J Appl Physiol Occup Physiol. 1990;61:5–10. https://idp.springer.com/authorize/casa?redirect_uri=https://link.springer.com/article/10.1007/BF00236686&casa_token=Td7tAAIrqeAAAAAA:4JmL2F0bjS-lXEbu45VJD7_sa9yea81nbaYF85LNufOAbofFiqJjmfUGwxiYHX42InAspYx6lIzKqOPOEw.
- 97.Fat Loading. https://muscleinsider.com/features/fat-loading. Accessed 6 Aug 2020.
- 98.D’Angelo A Dialing In My Way: The Final Week Preparation! 2002. https://www.bodybuilding.com/fun/angelo2.htm. Accessed 6 Aug 2020.
- 99.Kiens B, Richter EA. Utilization of skeletal muscle triacylglycerol during postexercise recovery in humans. Am J Physiol. 1998;275:E332–7. doi:https://doi.org/10.1152/ajpendo.1998.275.2.E332.CAS Article PubMed Google Scholar
- 100.Bussau VA, Fairchild TJ, Rao A, Steele P, Fournier PA. Carbohydrate loading in human muscle: an improved 1 day protocol. Eur J Appl Physiol. 2002;87:290–5. doi:https://doi.org/10.1007/s00421-002-0621-5.CAS Article PubMed Google Scholar
- 101.Prior BM, Modlesky CM, Evans EM, Sloniger MA, Saunders MJ, Lewis RD, et al. Muscularity and the density of the fat-free mass in athletes. J Appl Physiol. 2001;90:1523–31. doi:https://doi.org/10.1152/jappl.2001.90.4.1523.CAS Article PubMed Google Scholar
- 102.National Research Council, Commission on Life Sciences. Food and Nutrition Board, Subcommittee on the Tenth Edition of the Recommended Dietary Allowances. Recommended Dietary Allowances: 10th Edition. National Academies Press; 1989. https://play.google.com/store/books/details?id=gHB32IsIpu0C.
- 103.Layman DK. Dietary Guidelines should reflect new understandings about adult protein needs. Nutr Metab. 2009;6:12. doi:https://doi.org/10.1186/1743-7075-6-12.CAS Article Google Scholar
- 104.Phillips SM, Chevalier S, Leidy HJ. Protein “requirements” beyond the RDA: implications for optimizing health. Appl Physiol Nutr Metab. 2016;41:565–72. doi:https://doi.org/10.1139/apnm-2015-0550.CAS Article PubMed Google Scholar
- 105.Morton RW, Murphy KT, McKellar SR, Schoenfeld BJ, Henselmans M, Helms E, et al. A systematic review, meta-analysis and meta-regression of the effect of protein supplementation on resistance training-induced gains in muscle mass and strength in healthy adults. Br J Sports Med. 2018;52:376–84. doi:https://doi.org/10.1136/bjsports-2017-097608.Article PubMed Google Scholar
- 106.Bandegan A, Courtney-Martin G, Rafii M, Pencharz PB, Lemon PW. Indicator Amino Acid-Derived Estimate of Dietary Protein Requirement for Male Bodybuilders on a Nontraining Day Is Several-Fold Greater than the Current Recommended Dietary Allowance. J Nutr. 2017;147:850–7. doi:https://doi.org/10.3945/jn.116.236331.CAS Article PubMed Google Scholar
- 107.Mazzulla M, Sawan SA, Williamson E, Hannaian SJ, Volterman KA, West DWD, et al. Protein Intake to Maximize Whole-Body Anabolism during Postexercise Recovery in Resistance-Trained Men with High Habitual Intakes is Severalfold Greater than the Current Recommended Dietary Allowance. J Nutr. 2020;150:505–11. doi:https://doi.org/10.1093/jn/nxz249.Article PubMed Google Scholar
- 108.Helms ER, Zinn C, Rowlands DS, Brown SR. A Systematic Review of Dietary Protein During Caloric Restriction in Resistance Trained Lean Athletes: A Case for Higher Intakes. Int J Sport Nutr Exerc Metab. 2014;24:127–38. doi:https://doi.org/10.1123/ijsnem.2013-0054.CAS Article PubMed Google Scholar
- 109.Mäestu J, Eliakim A, Jürimäe J, Valter I, Jürimäe T. Anabolic and Catabolic Hormones and Energy Balance of the Male Bodybuilders During the Preparation for the Competition. Journal of Strength Conditioning Research. 2010;24:1074–81. doi:https://doi.org/10.1519/jsc.0b013e3181cb6fd3.Article PubMed Google Scholar
- 110.Antonio J, Ellerbroek A, Silver T, Vargas L, Tamayo A, Buehn R, et al. A High Protein Diet Has No Harmful Effects: A One-Year Crossover Study in Resistance-Trained Males. Journal of Nutrition Metabolism. 2016;2016:1–5. doi:https://doi.org/10.1155/2016/9104792.CAS Article Google Scholar
- 111.Vella F. Biochemistry. By RH Garrett and CM Grisham. pp 1154. Saunders College Publishing: Harcourt Brace, Orlando, FL. 1995.£ 19.95. Biochem Educ. 1995;23:108–8. https://iubmb.onlinelibrary.wiley.com/doi/abs/https://doi.org/10.1016/0307-4412(95)90667-3.
- 112.Bilsborough S, Mann N. A review of issues of dietary protein intake in humans. Int J Sport Nutr Exerc Metab. 2006;16:129–52. doi:https://doi.org/10.1123/ijsnem.16.2.129.CAS Article PubMed Google Scholar
- 113.Rudman D, DiFulco TJ, Galambos JT, Smith RB 3rd, Salam AA, Warren WD. Maximal rates of excretion and synthesis of urea in normal and cirrhotic subjects. J Clin Invest. 1973;52:2241–9. doi:https://doi.org/10.1172/JCI107410.CAS Article PubMed PubMed Central Google Scholar
- 114.Epstein FH, Kleeman CR, Pursel S, Hendrikx A. THE EFFECT OF FEEDING, PROTEIN AND UREA ON THE RENAL CONCENTRATING PROCESS 1. Journal of Clinical Investigation. 1957;36:635–41. doi:https://doi.org/10.1172/jci103463.CAS Article PubMed Central Google Scholar
- 115.Levinsky NG, Berliner RW. The role of urea in the urine concentrating mechanism. J Clin Invest. 1959;38:741–8. doi:https://doi.org/10.1172/JCI103854.CAS Article PubMed PubMed Central Google Scholar
- 116.Gomez-Arbelaez D, Bellido D, Castro AI, Ordoñez-Mayan L, Carreira J, Galban C, et al. Body Composition Changes After Very-Low-Calorie Ketogenic Diet in Obesity Evaluated by 3 Standardized Methods. J Clin Endocrinol Metab. 2017;102:488–98. doi:https://doi.org/10.1210/jc.2016-2385.Article PubMed Google Scholar
- 117.Yang MU, Van Itallie TB. Composition of weight lost during short-term weight reduction. Metabolic responses of obese subjects to starvation and low-calorie ketogenic and nonketogenic diets. Journal of Clinical Investigation. 1976;58:722–30. doi:https://doi.org/10.1172/jci108519.CAS Article PubMed Central Google Scholar
- 118.Strong JA, Shirling D, Passmore R. Some effects of overfeeding for four days in man. Br J Nutr. 1967;21:909–19. doi:https://doi.org/10.1079/bjn19670090.CAS Article PubMed Google Scholar
- 119.Vist GE, Maughan RJ. The effect of osmolality and carbohydrate content on the rate of gastric emptying of liquids in man. J Physiol. 1995;486(Pt 2):523–31. doi:https://doi.org/10.1113/jphysiol.1995.sp020831.CAS Article PubMed PubMed Central Google Scholar
- 120.Takii H, Kometani T, Nishimura T, Kuriki T, Fushiki T. A sports drink based on highly branched cyclic dextrin generates few gastrointestinal disorders in untrained men during bicycle exercise. Food Sci Technol Res. 2007;10:428–31. https://www.jstage.jst.go.jp/article/fstr/10/4/10_4_428/_article/-char/ja/.
- 121.Birchall EF, Fenton PF, Pierce HB. Gastric emptying and intestinal absorption of dextrose solutions. Am J Physiol. 1946;146:610–2. doi:https://doi.org/10.1152/ajplegacy.1946.146.4.610.CAS Article PubMed Google Scholar
- 122.Burke LM, Collier GR, Hargreaves M. Muscle glycogen storage after prolonged exercise: effect of the glycemic index of carbohydrate feedings. J Appl Physiol. 1993;75:1019–23. doi:https://doi.org/10.1152/jappl.1993.75.2.1019.CAS Article PubMed Google Scholar
- 123.Wee S-L, Williams C, Tsintzas K, Boobis L. Ingestion of a high-glycemic index meal increases muscle glycogen storage at rest but augments its utilization during subsequent exercise. J Appl Physiol. 2005;99:707–14. doi:https://doi.org/10.1152/japplphysiol.01261.2004.CAS Article PubMed Google Scholar
- 124.Costill DL, Sherman WM, Fink WJ, Maresh C, Witten M, Miller JM. The role of dietary carbohydrates in muscle glycogen resynthesis after strenuous running. Am J Clin Nutr. 1981;34:1831–6. doi:https://doi.org/10.1093/ajcn/34.9.1831.CAS Article PubMed Google Scholar
- 125.Parkin JA, Carey MF, Martin IK, Stojanovska L, Febbraio MA. Muscle glycogen storage following prolonged exercise: effect of timing of ingestion of high glycemic index food. Med Sci Sports Exerc. 1997;29:220–4. doi:https://doi.org/10.1097/00005768-199702000-00009.CAS Article PubMed Google Scholar
- 126.Ivy JL, Goforth HW Jr, Damon BM, McCauley TR, Parsons EC, Price TB. Early postexercise muscle glycogen recovery is enhanced with a carbohydrate-protein supplement. J Appl Physiol. 2002;93:1337–44. doi:https://doi.org/10.1152/japplphysiol.00394.2002.CAS Article PubMed Google Scholar
- 127.Branch JD. Effect of creatine supplementation on body composition and performance: a meta-analysis. Int J Sport Nutr Exerc Metab. 2003;13:198–226. doi:https://doi.org/10.1123/ijsnem.13.2.198.CAS Article PubMed Google Scholar
- 128.Chilibeck PD, Magnus C, Anderson M. Effect of in-season creatine supplementation on body composition and performance in rugby union football players. Appl Physiol Nutr Metab. 2007;32:1052–7. doi:https://doi.org/10.1139/H07-072.Article PubMed Google Scholar
- 129.Ziegenfuss TN, Lowery LM, Lemon PWR. Acute fluid volume changes in men during three days of creatine supplementation. J Exerc Physiol Online. 1998;1:1–9. http://www.asep.org/asep/asep/jan13d.htm.
- 130.Buford TW, Kreider RB, Stout JR, Greenwood M, Campbell B, Spano M, et al. International Society of Sports Nutrition position stand: creatine supplementation and exercise. J Int Soc Sports Nutr. 2007;4:6. doi:https://doi.org/10.1186/1550-2783-4-6.Article PubMed PubMed Central Google Scholar
- 131.Ziegenfuss TN, Rogers M, Lowery L, Mullins N, Mendel R, Antonio J, et al. Effect of creatine loading on anaerobic performance and skeletal muscle volume in NCAA Division I athletes. Nutrition. 2002;18:397–402. doi:https://doi.org/10.1016/s0899-9007(01)00802-4.CAS Article PubMed Google Scholar
- 132.Roberts PA, Fox J, Peirce N, Jones SW, Casey A, Greenhaff PL. Creatine ingestion augments dietary carbohydrate mediated muscle glycogen supercompensation during the initial 24 h of recovery following prolonged exhaustive exercise in humans. Amino Acids. 2016;48:1831–42. doi:https://doi.org/10.1007/s00726-016-2252-x.CAS Article PubMed PubMed Central Google Scholar
- 133.Green AL, Hultman E, Macdonald IA, Sewell DA, Greenhaff PL. Carbohydrate ingestion augments skeletal muscle creatine accumulation during creatine supplementation in humans. American Journal of Physiology-Endocrinology Metabolism. 1996;271:E821–6. doi:https://doi.org/10.1152/ajpendo.1996.271.5.e821.CAS Article Google Scholar
- 134.Vandenberghe K, Van Hecke P, Van Leemputte M, Vanstapel F, Hespel P. INHIBITION OF MUSCLE. PHOSPHOCREATINE RESYNTHESIS BY CAFFEINE AFTER CREATINE LOADING 1417. Medicine & Science in Sports & Exercise. 1997;29 Supplement:249. doi:https://doi.org/10.1097/00005768-199705001-01416.
- 135.Cooper R, Naclerio F, Allgrove J, Jimenez A. Creatine supplementation with specific view to exercise/sports performance: an update. J Int Soc Sports Nutr. 2012;9:33. doi:https://doi.org/10.1186/1550-2783-9-33.CAS Article PubMed PubMed Central Google Scholar
- 136.Syrotuik DG, Bell GJ. Acute creatine monohydrate supplementation: a descriptive physiological profile of responders vs. nonresponders. J Strength Cond Res. 2004;18:610–7. doi:https://doi.org/10.1519/12392.1.Article PubMed Google Scholar
- 137.Schiaffino S, Reggiani C. Fiber types in mammalian skeletal muscles. Physiol Rev. 2011;91:1447–531. doi:https://doi.org/10.1152/physrev.00031.2010.CAS Article PubMed Google Scholar
- 138.Andersen JL, Schjerling P, Saltin B. Muscle, genes and athletic performance. Sci Am. 2000;283:48–55. doi:https://doi.org/10.1038/scientificamerican0900-48.CAS Article PubMed Google Scholar
- 139.Burke DG, Chilibeck PD, Parise G, Candow DG, Mahoney D, Tarnopolsky M. Effect of creatine and weight training on muscle creatine and performance in vegetarians. Med Sci Sports Exerc. 2003;35:1946–55. doi:https://doi.org/10.1249/01.MSS.0000093614.17517.79.CAS Article PubMed Google Scholar
- 140.Lepretti M, Martucciello S, Burgos Aceves MA, Putti R, Lionetti L. Omega-3 Fatty Acids and Insulin Resistance: Focus on the Regulation of Mitochondria and Endoplasmic Reticulum Stress. Nutrients. 2018;10. doi:https://doi.org/10.3390/nu10030350.
- 141.Calder PC. Omega-3 fatty acids and inflammatory processes. Nutrients. 2010;2:355–74. doi:https://doi.org/10.3390/nu2030355.CAS Article PubMed PubMed Central Google Scholar
- 142.Brunton LL, Lazo JS, Parker K, Buxton I, Blumenthal D. Book, Review: Goodman and Gilman’s The Pharmacological Basis of Therapeutics: Digital Edition, 11th Edition. Annals of Pharmacotherapy. 2006;40:1218–1218. doi:https://doi.org/10.1345/aph.1g685.
- 143.Caldwell JE, Ahonen E, Nousiainen U. Differential effects of sauna-, diuretic-, and exercise-induced hypohydration. J Appl Physiol. 1984;57:1018–23. doi:https://doi.org/10.1152/jappl.1984.57.4.1018.CAS Article PubMed Google Scholar
- 144.Cadwallader AB, De La Torre X, Tieri A, Botrè F. The abuse of diuretics as performance-enhancing drugs and masking agents in sport doping: pharmacology, toxicology and analysis. Br J Pharmacol. 2010;161:1–16. doi:https://doi.org/10.1111/j.1476-5381.2010.00789.x.CAS Article PubMed PubMed Central Google Scholar
- 145.Clare BA, Conroy RS, Spelman K. The Diuretic Effect in Human Subjects of an Extract of Taraxacum officinale Folium over a Single Day. The Journal of Alternative Complementary Medicine. 2009;15:929–34. doi:https://doi.org/10.1089/acm.2008.0152.Article PubMed Google Scholar
- 146.Vitamin C. https://ods.od.nih.gov/factsheets/VitaminC-HealthProfessional/. Accessed 1 Apr 2021.
- 147.Mydlík M, Derzsiová K, Žemberová E. Influence of Water and Sodium Diuresis and Furosemide on Urinary Excretion of Vitamin B6, Oxalic Acid and Vitamin C in Chronic Renal Failure. Miner Electrolyte Metab. 1999;25:352–6. doi:https://doi.org/10.1159/000057474.Article PubMed Google Scholar
- 148.Kenawy MR, El-Nabawy, El-Mohandis MM, El -D, Rohayem HK, El-Sheehy AW. Studies on the diuretic action of vitamin C in normal animals and human beings, and its clinical value in pathological retention of water. Int Z Vitaminforsch. 1952;24:40–61. https://www.ncbi.nlm.nih.gov/pubmed/12999380.
- 149.Abbasy MA. The diuretic action of vitamin C. Biochem J. 1937;31:339–42. doi:https://doi.org/10.1042/bj0310339.CAS Article PubMed PubMed Central Google Scholar
- 150.Brennan CF, Martin E, Parkes WB. The effect of vitamin C on urinary excretion. Ir J Med Sci. 1956;31:329–33. https://link.springer.com/content/pdf/10.1007/BF02951118.pdf.
- 151.Goldsmith GA, Ellinger GF. ASCORBIC ACID IN BLOOD AND URINE AFTER ORAL ADMINISTRATION OF A TEST DOSE OF VITAMIN C: SATURATION TEST. Arch Intern Med. 1939;63:531–46. doi:https://doi.org/10.1001/archinte.1939.00180200100008.CAS Article Google Scholar
- 152.Hoyt CJ. Diarrhea from vitamin C. JAMA. 1980;244:1674. https://www.ncbi.nlm.nih.gov/pubmed/7411820.
- 153.Maughan RJ, Griffin J. Caffeine ingestion and fluid balance: a review. J Hum Nutr Diet. 2003;16:411–20. doi:https://doi.org/10.1046/j.1365-277x.2003.00477.x.CAS Article PubMed Google Scholar
- 154.Passmore AP, Kondowe GB, Johnston GD. Renal and cardiovascular effects of caffeine: a dose–response study. Clin Sci. 1987;72:749–56. https://portlandpress.com/clinsci/article-pdf/72/6/749/457997/cs0720749.pdf.
- 155.Nehlig A. Is caffeine a cognitive enhancer? J Alzheimers Dis. 2010;20(Suppl 1):85–94. doi:https://doi.org/10.3233/JAD-2010-091315.CAS Article Google Scholar
- 156.Astorino TA, Roberson DW. Efficacy of acute caffeine ingestion for short-term high-intensity exercise performance: a systematic review. J Strength Cond Res. 2010;24:257–65. doi:https://doi.org/10.1519/JSC.0b013e3181c1f88a.Article PubMed Google Scholar
- 157.O’Callaghan F, Muurlink O, Reid N. Effects of caffeine on sleep quality and daytime functioning. Risk Manag Healthc Policy. 2018;11:263–71. doi:https://doi.org/10.2147/RMHP.S156404.Article PubMed PubMed Central Google Scholar
- 158.Kerksick CM, Arent S, Schoenfeld BJ, Stout JR, Campbell B, Wilborn CD, et al. International society of sports nutrition position stand: nutrient timing. J Int Soc Sports Nutr. 2017;14:33. doi:https://doi.org/10.1186/s12970-017-0189-4.CAS Article PubMed PubMed Central Google Scholar
- 159.Beelen M, van Kranenburg J, Senden JM, Kuipers H, van Loon LJC. Impact of caffeine and protein on postexercise muscle glycogen synthesis. Med Sci Sports Exerc. 2012;44:692–700. doi:https://doi.org/10.1249/MSS.0b013e31823a40ef.CAS Article PubMed Google Scholar
- 160.Klosterbuer A, Roughead ZF, Slavin J. Benefits of dietary fiber in clinical nutrition. Nutr Clin Pract. 2011;26:625–35. doi:https://doi.org/10.1177/0884533611416126.Article PubMed Google Scholar
- 161.Monro JA. Faecal bulking index: A physiological basis for dietary management of bulk in the distal colon. Asia Pac J Clin Nutr. 2000;9:74–81. doi:https://doi.org/10.1046/j.1440-6047.2000.00155.x.CAS Article PubMed Google Scholar
- 162.Wu K-L, Rayner CK, Chuah S-K, Chiu K-W, Lu C-C, Chiu Y-C. Impact of low-residue diet on bowel preparation for colonoscopy. Dis Colon Rectum. 2011;54:107–12. doi:https://doi.org/10.1007/DCR.0b013e3181fb1e52.Article PubMed Google Scholar
- 163.Gibson PR, Shepherd SJ. Evidence-based dietary management of functional gastrointestinal symptoms: the FODMAP approach. J Gastroenterol Hepatol. 2010;25:252–8. https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1440-1746.2009.06149.x.
- 164.Giannini EG, Mansi C, Dulbecco P, Savarino V. Role of partially hydrolyzed guar gum in the treatment of irritable bowel syndrome. Nutrition. 2006;22:334–42. doi:https://doi.org/10.1016/j.nut.2005.10.003.CAS Article PubMed Google Scholar
- 165.Prior A, Whorwell PJ. Double blind study of ispaghula in irritable bowel syndrome. Gut. 1987;28:1510–3. doi:https://doi.org/10.1136/gut.28.11.1510.CAS Article PubMed PubMed Central Google Scholar
- 166.Macdougall JD, Ray S, Sale DG, Mccartney N, Lee P, Garner S. Muscle substrate utilization and lactate production during weightlifting. Can J Appl Physiol. 1999;24:209–15. https://www.nrcresearchpress.com/doi/abs/https://doi.org/10.1139/h99-017.
- 167.Robergs RA, Pearson DR, Costill DL, Fink WJ, Pascoe DD, Benedict MA, et al. Muscle glycogenolysis during differing intensities of weight-resistance exercise. J Appl Physiol. 1991;70:1700–6. doi:https://doi.org/10.1152/jappl.1991.70.4.1700.CAS Article PubMed Google Scholar
- 168.Pascoe DD, Gladden LB. Muscle glycogen resynthesis after short term, high intensity exercise and resistance exercise. Sports Med. 1996;21:98–118. doi:https://doi.org/10.2165/00007256-199621020-00003.CAS Article PubMed Google Scholar
- 169.Steffensen CH, Roepstorff C, Madsen M, Kiens B. Myocellular triacylglycerol breakdown in females but not in males during exercise. Am J Physiol Endocrinol Metab. 2002;282:E634–42. doi:https://doi.org/10.1152/ajpendo.00078.2001.CAS Article PubMed Google Scholar
- 170.Harber MP, Crane JD, Douglass MD, Weindel KD, Trappe TA, Trappe SW, et al. Resistance exercise reduces muscular substrates in women. Int J Sports Med. 2008;29:719–25. doi:https://doi.org/10.1055/s-2007-989442.CAS Article PubMed Google Scholar
- 171.Stannard SR, Thompson MW, Fairbairn K, Huard B, Sachinwalla T, Thompson CH. Fasting for 72 h increases intramyocellular lipid content in nondiabetic, physically fit men. Am J Physiol Endocrinol Metab. 2002;283:E1185–91. doi:https://doi.org/10.1152/ajpendo.00108.2002.CAS Article PubMed Google Scholar
- 172.Baumert P, Lake MJ, Stewart CE, Drust B, Erskine RM. Genetic variation and exercise-induced muscle damage: implications for athletic performance, injury and ageing. Eur J Appl Physiol. 2016;116:1595–625. doi:https://doi.org/10.1007/s00421-016-3411-1.Article PubMed PubMed Central Google Scholar
- 173.Chen TC. Variability in muscle damage after eccentric exercise and the repeated bout effect. Res Q Exerc Sport. 2006;77:362–71. doi:https://doi.org/10.1080/02701367.2006.10599370.Article PubMed Google Scholar
- 174.Del Coso J, Valero M, Salinero JJ, Lara B, Gallo-Salazar C, Areces F. Optimum polygenic profile to resist exertional rhabdomyolysis during a marathon. PLoS One. 2017;12:e0172965. doi:https://doi.org/10.1371/journal.pone.0172965.CAS Article PubMed PubMed Central Google Scholar
- 175.Meneghel AJ, Crisp AH, Verlengia R, Lopes CR. Review of the repeated bout effect in trained and untrained men. Int J Sports Sci Coach. 2013;3:107–8. http://www.academia.edu/download/53689082/10.5923.j.sports.20130305.02.pdf.
- 176.Tee JC, Bosch AN, Lambert MI. Metabolic consequences of exercise-induced muscle damage. Sports Med. 2007;37:827–36. doi:https://doi.org/10.2165/00007256-200737100-00001.Article PubMed Google Scholar
- 177.O’Reilly KP, Warhol MJ, Fielding RA, Frontera WR, Meredith CN, Evans WJ. Eccentric exercise-induced muscle damage impairs muscle glycogen repletion. J Appl Physiol. 1987;63:252–6. doi:https://doi.org/10.1152/jappl.1987.63.1.252.Article PubMed Google Scholar
- 178.Vila-Chã C, Hassanlouei H, Farina D, Falla D. Eccentric exercise and delayed onset muscle soreness of the quadriceps induce adjustments in agonist–antagonist activity, which are dependent on the motor task. Exp Brain Res. 2012;216:385–95. doi:https://doi.org/10.1007/s00221-011-2942-2.Article PubMed Google Scholar
- 179.Zehnder M, Muelli M, Buchli R, Kuehne G, Boutellier U. Further glycogen decrease during early recovery after eccentric exercise despite a high carbohydrate intake. Eur J Nutr. 2004;43:148–59. doi:https://doi.org/10.1007/s00394-004-0453-7.CAS Article PubMed Google Scholar
- 180.Paulsen G, Crameri R, Benestad HB, Fjeld JG, Mørkrid L, Hallén J, et al. Time course of leukocyte accumulation in human muscle after eccentric exercise. Med Sci Sports Exerc. 2010;42:75–85. doi:https://doi.org/10.1249/MSS.0b013e3181ac7adb.Article PubMed Google Scholar
- 181.Peake JM, Neubauer O, Della Gatta PA, Nosaka K. Muscle damage and inflammation during recovery from exercise. J Appl Physiol. 2017;122:559–70. doi:https://doi.org/10.1152/japplphysiol.00971.2016.CAS Article PubMed Google Scholar
- 182.Décombaz J, Schmitt B, Ith M, Decarli B, Diem P, Kreis R, et al. Postexercise fat intake repletes intramyocellular lipids but no faster in trained than in sedentary subjects. Am J Physiol Regul Integr Comp Physiol. 2001;281:R760–9. doi:https://doi.org/10.1152/ajpregu.2001.281.3.R760.Article PubMed Google Scholar
- 183.Hocking S, Samocha-Bonet D, Milner K-L, Greenfield JR, Chisholm DJ. Adiposity and insulin resistance in humans: the role of the different tissue and cellular lipid depots. Endocr Rev. 2013;34:463–500. doi:https://doi.org/10.1210/er.2012-1041.CAS Article PubMed Google Scholar
- 184.Stone MH, Fleck SJ, Triplett NT, Kraemer WJ. Health- and performance-related potential of resistance training. Sports Med. 1991;11:210–31. doi:https://doi.org/10.2165/00007256-199111040-00002.CAS Article PubMed Google Scholar
- 185.Kraemer WJ, Noble BJ, Clark MJ, Culver BW. Physiologic responses to heavy-resistance exercise with very short rest periods. Int J Sports Med. 1987;8:247–52. doi:https://doi.org/10.1055/s-2008-1025663.CAS Article PubMed Google Scholar
- 186.Morton RW, Sonne MW, Zuniga AF, Mohammad IYZ, Jones A, McGlory C, et al. Muscle fibre activation is unaffected by load and repetition duration when resistance exercise is performed to task failure. The Journal of Physiology. 2019;597:4601–13. doi:https://doi.org/10.1113/jp278056.CAS Article PubMed Google Scholar
- 187.Grgic J, Schoenfeld BJ. Higher effort, rather than higher load, for resistance exercise-induced activation of muscle fibres. The Journal of Physiology. 2019;597:4691–2. doi:https://doi.org/10.1113/jp278627.CAS Article PubMed Google Scholar
- 188.The correct interpretation of the size principle. and it’s practical appliction to resistance training – Научные статьи – Библиотека международной спортивной информации. http://bmsi.ru/doc/c33fb1e0-9e05-44fc-a4c7-ad36356db8ea. Accessed 7 Aug 2020.
- 189.Child RB, Saxton JM, Donnelly AE. Comparison of eccentric knee extensor muscle actions at two muscle lengths on indices of damage and anglespecific force production in humans. J Sports Sci. 1998;16:301–8. doi:https://doi.org/10.1080/02640419808559358.CAS Article PubMed Google Scholar
- 190.Roden M, Price TB, Perseghin G, Petersen KF, Rothman DL, Cline GW, et al. Mechanism of free fatty acid-induced insulin resistance in humans. Journal of Clinical Investigation. 1996;97:2859–65. doi:https://doi.org/10.1172/jci118742.CAS Article PubMed Central Google Scholar
- 191.Hunt JN, Knox MT. A relation between the chain length of fatty acids and the slowing of gastric emptying. The Journal of Physiology. 1968;194:327–36. doi:https://doi.org/10.1113/jphysiol.1968.sp008411.CAS Article PubMed PubMed Central Google Scholar
- 192.Collier G, O’Dea K. The effect of coingestion of fat on the glucose, insulin, and gastric inhibitory polypeptide responses to carbohydrate and protein. The American Journal of Clinical Nutrition. 1983;37:941–4. doi:https://doi.org/10.1093/ajcn/37.6.941.CAS Article PubMed Google Scholar
- 193.Gentilcore D, Chaikomin R, Jones KL, Russo A, Feinle-Bisset C, Wishart JM, et al. Effects of Fat on Gastric Emptying of and the Glycemic, Insulin, and Incretin Responses to a Carbohydrate Meal in Type 2 Diabetes. The Journal of Clinical Endocrinology Metabolism. 2006;91:2062–7. doi:https://doi.org/10.1210/jc.2005-2644.CAS Article PubMed Google Scholar
- 194.Zeevi D, Korem T, Zmora N, Israeli D, Rothschild D, Weinberger A, et al. Personalized Nutrition by Prediction of Glycemic Responses. Cell. 2015;163:1079–94. doi:https://doi.org/10.1016/j.cell.2015.11.001.CAS Article PubMed Google Scholar
- 195.Blom PC, Høstmark AT, Vaage O, Kardel KR, Maehlum S. Effect of different post-exercise sugar diets on the rate of muscle glycogen synthesis. Med Sci Sports Exerc. 1987;19:491–6. https://www.ncbi.nlm.nih.gov/pubmed/3316904.
- 196.Shi X, Passe DH. Water and solute absorption from carbohydrate-electrolyte solutions in the human proximal small intestine: a review and statistical analysis. Int J Sport Nutr Exerc Metab. 2010;20:427–42. doi:https://doi.org/10.1123/ijsnem.20.5.427.Article PubMed Google Scholar
- 197.Zawadzki KM, Yaspelkis BB, Ivy JL. Carbohydrate-protein complex increases the rate of muscle glycogen storage after exercise. J Appl Physiol. 1992;72:1854–9. doi:https://doi.org/10.1152/jappl.1992.72.5.1854.CAS Article PubMed Google Scholar
- 198.Alghannam A, Gonzalez J, Betts J. Restoration of Muscle Glycogen and Functional Capacity: Role of Post-Exercise Carbohydrate and Protein Co-Ingestion. Nutrients. 2018;10:253. doi:https://doi.org/10.3390/nu10020253.CAS Article PubMed Central Google Scholar
- 199.Roberts BM, Helms ER, Trexler ET, Fitschen PJ. Nutritional Recommendations for Physique Athletes. J Hum Kinet. 2020;71:79–108. doi:https://doi.org/10.2478/hukin-2019-0096.Article PubMed PubMed Central Google Scholar
- 200.Official Bodybuilding Rules. http://npcnewsonline.com/official-bodybuilding-rules/. Accessed 16 Oct 2020.
- 201.General Information. http://www.nabbasa.com/index.php/categories-judging/general-information. Accessed 16 Oct 2020.
- 202.Judging Criteria. https://www.worldnaturalbb.com/judging-criteria/. Accessed 16 Oct 2020.
- 203.Schoenfeld BJ, Contreras B. The muscle pump: potential mechanisms and applications for enhancing hypertrophic adaptations. Strength Conditioning Journal. 2014;36:21–5. https://journals.lww.com/nsca-scj/Fulltext/2014/06000/The_Muscle_Pump___Potential_Mechanisms_and.11.aspx.
- 204.Freitas EDS, Miller RM, Heishman AD, Ferreira-Júnior JB, Araújo JP, Bemben MG. Acute Physiological Responses to Resistance Exercise With Continuous Versus Intermittent Blood Flow Restriction: A Randomized Controlled Trial. Front Physiol. 2020;11. doi:https://doi.org/10.3389/fphys.2020.00132.
- 205.Freitas EDS, Poole C, Miller RM, Heishman AD, Kaur J, Bemben DA, et al. Time Course Change in Muscle Swelling: High-Intensity vs. Blood Flow Restriction Exercise. Int J Sports Med. 2017;38:1009–16. doi:https://doi.org/10.1055/s-0043-118342.Article PubMed Google Scholar
- 206.Armstrong LE, Maresh CM, Castellani JW, Bergeron MF, Kenefick RW, LaGasse KE, et al. Urinary Indices of Hydration Status. Int J Sport Nutr. 1994;4:265–79. doi:https://doi.org/10.1123/ijsn.4.3.265.CAS Article PubMed Google Scholar
- 207.Armstrong LE, Herrera Soto JA, Hacker FT, Casa DJ, Kavouras SA, Maresh CM. Urinary Indices during Dehydration, Exercise, and Rehydration. Int J Sport Nutr. 1998;8:345–55. doi:https://doi.org/10.1123/ijsn.8.4.345.CAS Article PubMed Google Scholar