Introduzione:

Se dovessero chiedermi quale sia stato il primo ormone verso il quale abbia volto il mio interesse e applicato ricerca, questo sarebbe il DHEA. E tutto ciò successe molto tempo prima che questo “pro-ormone” diventasse una moda da questa parte dell’Oceano Atlantico.
Tutto ebbe inizio nel lontano 2006 con la lettura del libro “La Zona Anti-Età” di Barry Sears, famoso inventore di quella complessa e fallimentare (nelle premesse teoriche) “Dieta a Zona”. Da quel momento, tramite le fonti bibliografiche presenti nella biblioteca medica della città dove all’epoca risiedevo, approfondì i potenziali vantaggi che questo androgeno surrenalico poteva offrire. Dopo tutto le premesse erano molte: potenziale miglioramento degli stati depressivi, miglioramento della risposta immunitaria, miglioramento dell’idratazione ed elasticità cutanea, aumento di Testosterone ed Estradiolo ecc ecc…
In Italia il DHEA non è mai stato liberamente commercializzato, ed ultimamente le leggi nei confronti della vendita e detenzione del suddetto si sono ampliamente inasprite nel “bel paese”.
Ora, non sono certamente un “liberalizzatore”, uno che follemente punta a far diventare una qualsivoglia molecola con alto potenziale di influenza psicofisica un qualcosa accessibile anche al semianalfabeta. Sono piuttosto un amante della giusta regolamentazione. E i miei studi sul DHEA non hanno affatto cambiato la mia posizione, anche per questa molecola che, a torto, viene considerata “blanda”.
Ma non perdiamoci in ulteriori chiacchiere e andiamo ad analizzare nel dettaglio il DHEA…
Caratteristiche della molecola:
Il Dehydroepiandrosterone (DHEA), noto anche come Androstenolone (androst-5-en-3β-olo-17-one), è un precursore degli ormoni steroidei endogeni.[1] È uno degli steroidi circolanti più abbondanti nell’uomo.[2] Il DHEA viene prodotto nelle ghiandole surrenali,[3] nelle gonadi e nel cervello. [4] Funziona come intermedio metabolico nella biosintesi degli steroidi sessuali androgeni ed estrogeni sia nelle gonadi che in vari altri tessuti.[1][5][6] Tuttavia, il DHEA ha anche una varietà di potenziali effetti biologici di per sé, legandosi a una serie di recettori nucleari e di superficie cellulare,[7] e agendo come neurosteroide e modulatore dei recettori dei fattori neurotrofici.[8]
Il DHEA, è uno steroide androstano presente in natura e un 17-chetosteroide.[9] È strettamente correlato strutturalmente all’Androstenediolo (androst-5-ene-3β,17β-diolo), all’Androstenedione (androst-4-ene-3,17-dione) e al Testosterone (androst-4-en-17β-olo-3-one). [9] Il DHEA è l’analogo 5-deidro dell’Epiandrosterone (5α-androstan-3β-ol-17-one) ed è noto anche come 5-deidroepiandrosterone o δ5-epiandrosterone.[9]

Il termine “Dehydroepiandrosterone” è ambiguo dal punto di vista chimico perché non include le posizioni specifiche all’interno dell’Epiandrosterone in cui mancano gli atomi di idrogeno. Il DHEA stesso è 5,6-dideidroepiandrosterone o 5-deidroepiandrosterone. Esiste anche una serie di isomeri presenti in natura che possono avere attività simili. Alcuni isomeri del DHEA sono l’1-deidroepiandrosterone (1-androsterone) e il 4-deidroepiandrosterone.[10] Anche questi isomeri sono tecnicamente “DHEA”, poiché sono Dehydroepiandrosteroni in cui gli idrogeni vengono rimossi dallo scheletro dell’Epiandrosterone.
Il Dehydroandrosterone (DHA) è il 3α-epimero del DHEA ed è anche un androgeno endogeno.
Il DHEA è stato isolato per la prima volta dalle urine umane nel 1934 da Adolf Butenandt e Kurt Tscherning (nel 1939 gli fu assegnato il Premio Nobel per la Chimica per il suo “lavoro sugli ormoni sessuali”). [10]
- Biochimica del DHEA
Il DHEA viene prodotto nella zona reticolare della corteccia surrenale sotto il controllo dell’ormone adrenocorticotropo (ACTH) e dalle gonadi sotto il controllo dell’ormone di rilascio delle gonadotropine (GnRH).[11][12] Viene prodotto anche nel cervello. [13] Il DHEA è sintetizzato dal colesterolo attraverso gli enzimi di scissione della catena laterale del colesterolo (CYP11A1; P450scc) e 17α-idrossilasi/17,20-liasi (CYP17A1), con Pregnenolone e 17α-idrossipregnenolone come intermedi. [14] Deriva principalmente dalla corteccia surrenale, con solo il 10% circa secreto dalle gonadi.[15][16][17] Circa il 50-70% del DHEA circolante proviene dalla desolfatazione del DHEA-S nei tessuti periferici.[15] Lo stesso DHEA-S proviene quasi esclusivamente dalla corteccia surrenale, con il 95-100% secreto dalla corteccia surrenale nelle donne.[11][18]
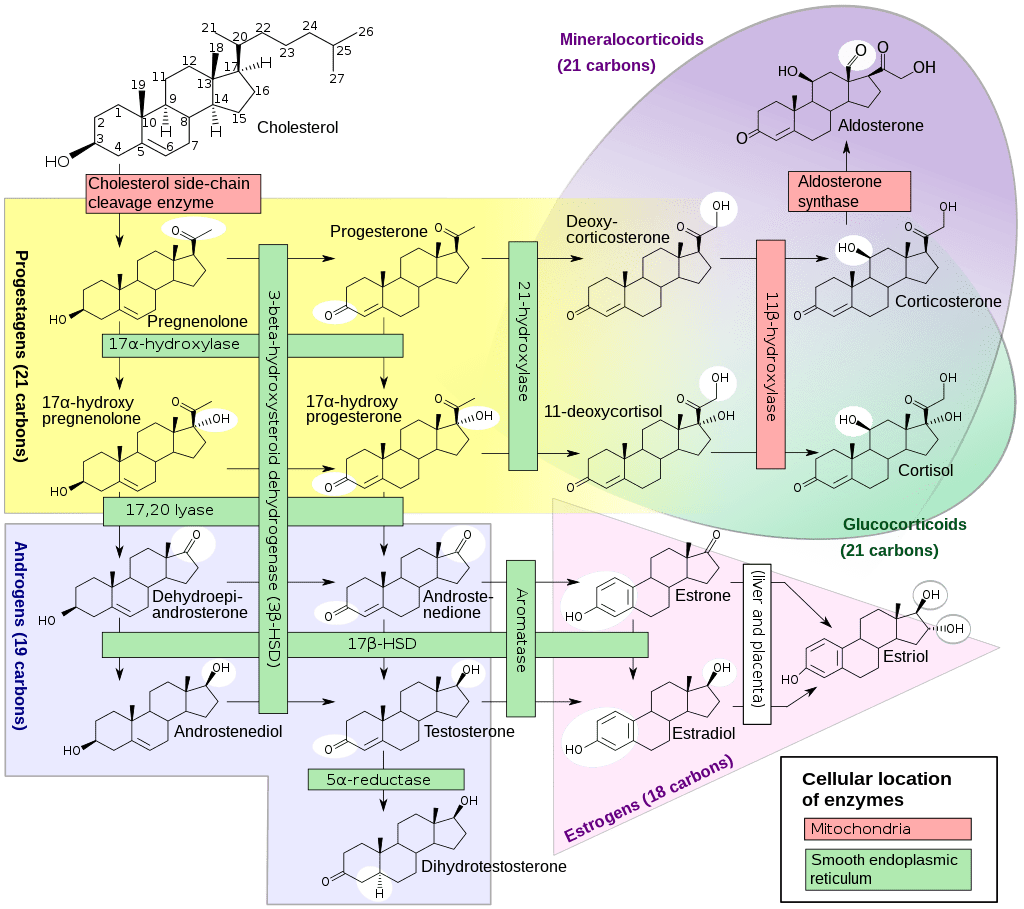
Il DHEA-S si forma, quindi, per solfatazione del DHEA in posizione C3β attraverso gli enzimi sulfotransferasi SULT2A1 e, in misura minore, SULT1E1. [19][20] Circa 10-15mg di DHEA-S sono secreti dalla corteccia surrenale al giorno nei giovani adulti.[21]
A differenza del DHEA, che è debolmente legato all’albumina, il DHEA-S è fortemente legato all’albumina (cioè con un’affinità molto elevata), e questo è il motivo della sua emivita terminale comparativa molto più lunga.[22][23] A differenza del DHEA, il DHEA-S non è legato in alcuna misura alla globulina legante gli ormoni sessuali (SHBG).[24]
Mentre il DHEA attraversa facilmente la barriera emato-encefalica nel sistema nervoso centrale,[24] il DHEA-S attraversa scarsamente la barriera emato-encefalica.[25]
Il DHEA-S può essere riconvertito in DHEA attraverso la steroide solfatasi (STS).[26] Nelle donne in premenopausa, il 40-75% del Testosterone circolante deriva dal metabolismo periferico del DHEA-S e nelle donne in postmenopausa oltre il 90% degli estrogeni, soprattutto Estrone, deriva dal metabolismo periferico del DHEA-S. [27] Uno studio ha rilevato che la somministrazione di DHEA-S esogeno in donne in gravidanza ha aumentato i livelli circolanti di Estrone ed Estradiolo.[28] Il DHEA-S funge da deposito per potenti androgeni come il Testosterone e il Diidrotestosterone.[28]

L’emivita di eliminazione del DHEA-S è di 7-10 ore, molto più lunga di quella del DHEA, che ha un’emivita di eliminazione di soli 15-30 minuti. Ed è principalmente per questo motivo che gli esami del sangue volti a valutare i livelli di DHEA in un individuo usino come marker di maggiore attendibilità il DHEA-S. Infatti, i livelli di DHEA-S in circolo sono circa 250-300 volte quelli del DHEA.[29] Il DHEA-S a sua volta può essere riconvertito in DHEA nei tessuti periferici tramite la steroide solfatasi (STS).[30][31] Poiché il DHEA-S può essere riconvertito in DHEA, funge da serbatoio circolante per il DHEA, prolungando così la durata del DHEA.[32][29]
Tornando nello specifico al DHEA, è noto che l’esercizio fisico regolare aumenta la produzione di questo androgeno nell’organismo.[33][34] È stato inoltre dimostrato che la restrizione calorica aumenta il DHEA nei primati.[35] Alcuni teorizzano che l’aumento del DHEA endogeno provocato dalla restrizione calorica sia in parte responsabile della maggiore aspettativa di vita che si sa essere associata alla restrizione calorica.[36]
In circolo, il DHEA è principalmente legato all’albumina, con una piccola quantità legata alla globulina legante gli ormoni sessuali (SHBG).[37][38] La piccola parte restante di DHEA non associata all’albumina o alla SHBG è libera in circolazione.[37]
Il DHEA attraversa facilmente la barriera emato-encefalica fino al sistema nervoso centrale.
I metaboliti del DHEA includono il DHEA-S, il 7α-idrossi-DHEA, il 7β-idrossi-DHEA, il 7-Keto-DHEA, il 7α-idrossi-epiandrosterone e il 7β-idrossi-epiandrosterone, nonché l’Androstenediolo e l’Androstenedione.[39]

Durante la gravidanza, il DHEA-S viene metabolizzato nel fegato fetale nei solfati di 16α-idrossi-DHEA e 15α-idrossi-DHEA, come intermedi nella produzione degli estrogeni Estriolo ed estetrol, rispettivamente[40].

Prima della pubertà, i livelli di DHEA e DHEA-S aumentano in seguito alla differenziazione della zona reticolare della corteccia surrenale.I livelli massimi di DHEA e DHEA-S si osservano intorno ai 20 anni, seguiti da un declino dipendente dall’età per tutta la vita, fino a ritornare alle concentrazioni prepuberali. I livelli plasmatici di DHEA negli uomini adulti sono compresi tra 10 e 25nM, nelle donne in premenopausa sono compresi tra 5 e 30nM e nelle donne in postmenopausa sono compresi tra 2 e 20nM. Al contrario, i livelli di DHEA-S sono di un ordine di grandezza superiore (1-10μM). I livelli di DHEA e DHEA-S diminuiscono fino a raggiungere gli intervalli nanomolari e micromolari inferiori negli uomini e nelle donne di età compresa tra 60 e 80 anni.[41]
I livelli medi di DHEA sono i seguenti:[42]
Uomini adulti: 180-1250 ng/dL
Donne adulte: 130-980 ng/dL
Donne in gravidanza: 135-810 ng/dL
Bambini in età prepuberale (<1 anno): 26-585 ng/dL
Bambini in età prepuberale (1-5 anni): 9-68 ng/dL
Bambini in età prepuberale (6-12 anni): 11-186 ng/dL
Ragazzi adolescenti (Tanner II-III): 25-300 ng/dL
Ragazze adolescenti (Tanner II-III): 69-605 ng/dL
Ragazzi adolescenti (Tanner IV-V): 100-400 ng/dL
Ragazze adolescenti (Tanner IV-V): 165-690 ng/dL
Poiché quasi tutto il DHEA deriva dalle ghiandole surrenali, le misurazioni ematiche di DHEA-S/DHEA sono utili per rilevare l’eccesso di attività surrenalica, come nel caso del cancro o dell’iperplasia surrenalica, comprese alcune forme di iperplasia surrenalica congenita. Le donne con sindrome dell’ovaio policistico tendono ad avere livelli elevati di DHEA-S.[43]
- Funzioni e attività biologiche del DHEA
Il DHEA e altri androgeni surrenali come l’Androstenedione, sebbene siano androgeni relativamente deboli, sono responsabili degli effetti androgeni dell’adrenarca, come la crescita precoce dei peli pubici e ascellari, l’odore corporeo di tipo adulto, l’aumento dell’untuosità dei capelli e della pelle e una lieve acne.[44][45][46] Il DHEA è potenziato localmente attraverso la conversione in Testosterone e Diidrotestosterone (DHT) nella pelle e nei follicoli piliferi. [Le donne con sindrome da insensibilità completa agli androgeni (CAIS), che hanno un recettore degli androgeni (AR) non funzionale e sono immuni agli effetti androgeni del DHEA e di altri androgeni, hanno peli pubici e ascellari assenti o radi/scarsi e peli corporei in generale, dimostrando il ruolo del DHEA e di altri androgeni nello sviluppo dei peli corporei sia all’adrenarca che al pubarca.[47][48][49][50]
Il DHEA è un estrogeno debole.[51] Inoltre, viene trasformato in estrogeni potenti come l’estradiolo in alcuni tessuti come la vagina, producendo così effetti estrogenici in tali tessuti.[4]
Come neurosteroide e neurotrofina, il DHEA ha effetti importanti sul sistema nervoso centrale.[52][53][54]

Sebbene funga da precursore endogeno di androgeni più potenti come il Testosterone e il DHT, è stato riscontrato che il DHEA possiede un certo grado di attività androgena di per sé, agendo come agonista parziale a bassa affinità (Ki = 1 μM) del recettore degli androgeni (AR). Tuttavia, la sua attività intrinseca sul recettore è piuttosto debole e per questo motivo, a causa della competizione per il legame con agonisti completi come il testosterone, può in realtà comportarsi più come un antagonista a seconda dei livelli circolanti di Testosterone e Diidrotestosterone (DHT), e quindi come un antiandrogeno. Tuttavia, la sua affinità per il recettore è molto bassa e per questo motivo è improbabile che sia di grande importanza in circostanze normali.[51][55]
Nota: sebbene in genere si pensasse che il percorso dai precursori steroidei surrenalici (vedi DHEA>Androstenedione>Testosterone>DHT) al DHT richiedesse la 5α-riduzione del Testosterone, dati recenti suggeriscono che esso comporti invece la conversione del Δ4-androstenedione da parte dell’isoenzima-1 SRD5A in 5α-androstanedione, seguita dalla successiva conversione in DHT. La via del 5α-androstenedione verso il DHT bypassa quindi completamente il Testosterone.
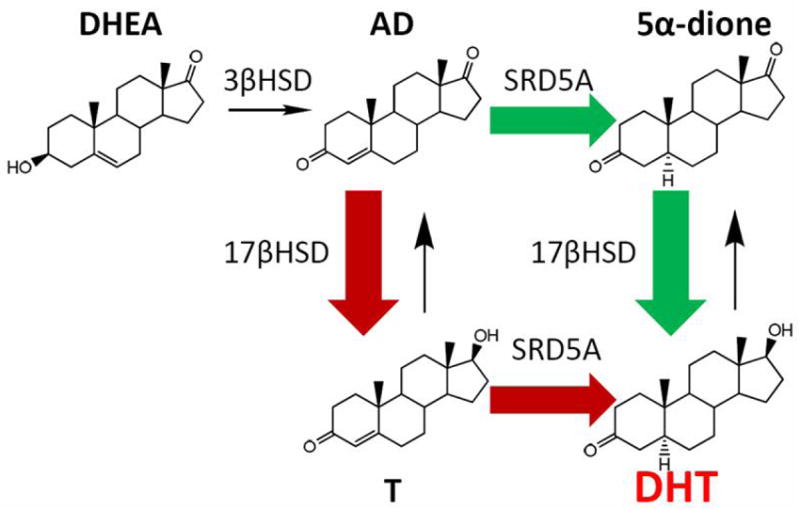
Oltre alla sua affinità per il recettore degli androgeni, il DHEA si è anche legato (e attivato) ai recettori degli estrogeni ERα ed ERβ con valori di Ki di 1,1 μM e 0,5 μM, rispettivamente, e valori di EC50 di >1 μM e 200 nM, rispettivamente. Sebbene sia risultato un agonista parziale dell’ERα con un’efficacia massima del 30-70%, le concentrazioni necessarie per questo grado di attivazione rendono improbabile che l’attività del DHEA su questo recettore sia fisiologicamente significativa. Tuttavia, è notevole che il DHEA agisca come agonista completo dell’ERβ con una risposta massima simile o addirittura leggermente superiore a quella dell’estradiolo, e che i suoi livelli in circolazione e nei tessuti locali del corpo umano siano sufficientemente elevati da attivare il recettore allo stesso livello di quello osservato con livelli di estradiolo circolante un po’ più alti delle loro concentrazioni massime non ovulatorie; in effetti, quando combinato con l’estradiolo, con entrambi a livelli equivalenti a quelli delle loro concentrazioni fisiologiche, l’attivazione complessiva dell’ERβ è stata raddoppiata.[10][51]
Il DHEA non si lega né attiva i recettori del progesterone, dei glucocorticoidi o dei mineralocorticoidi.[51][56] Altri recettori nucleari bersaglio del DHEA, oltre ai recettori degli androgeni e degli estrogeni, includono i recettori PPARα, PXR e CAR.[57] Tuttavia, mentre il DHEA è un ligando dei PPARα e PXR nei roditori, non lo è nell’uomo. [58] Oltre alle interazioni dirette, si ritiene che il DHEA regoli una manciata di altre proteine attraverso meccanismi genomici indiretti, tra cui gli enzimi CYP2C11 e 11β-HSD1 – quest’ultimo è essenziale per la biosintesi dei glucocorticoidi come il cortisolo ed è stato suggerito che sia coinvolto negli effetti antiglucocorticoidi del DHEA – e la proteina trasportatrice IGFBP1.[51][59]
È stato riscontrato che il DHEA agisce direttamente su diversi recettori neurotrasmettitoriali, tra cui agisce come modulatore allosterico positivo del recettore NMDA, come modulatore allosterico negativo del recettore GABAA e come agonista del recettore σ1.[60][57]
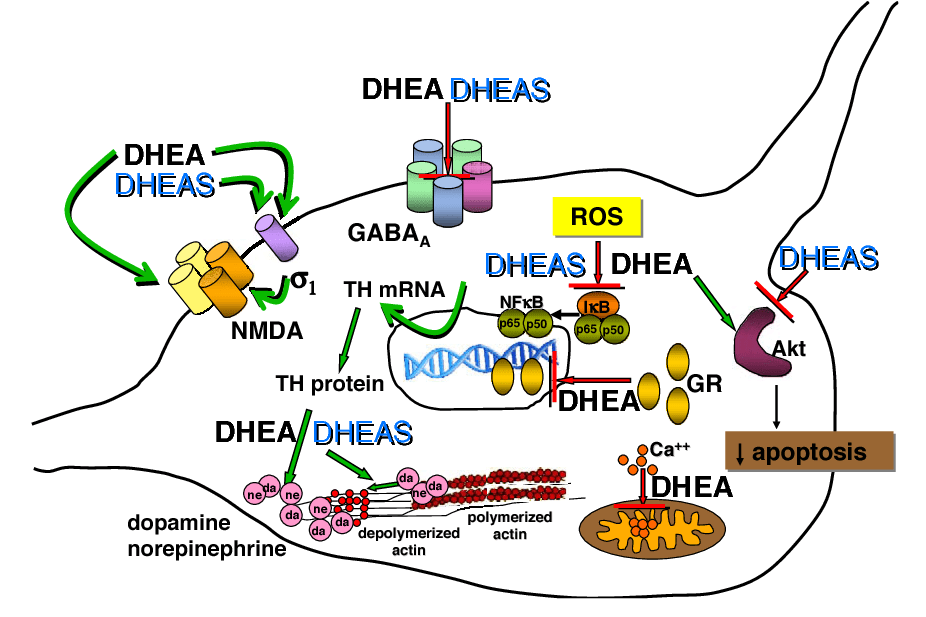
Nel 2011 è stata fatta la sorprendente scoperta che il DHEA, così come il suo estere solfato, il DHEA-S, si legano direttamente e attivano con elevata affinità i recettori TrkA e p75NTR, recettori di neurotrofine come il fattore di crescita nervoso (NGF) e il fattore neurotrofico derivato dal cervello (BDNF). [57][61] Successivamente si è scoperto che il DHEA si lega anche a TrkB e TrkC con elevata affinità, sebbene attivi solo TrkC e non TrkB.[25][30] Il DHEA e il DHEA-S si legano a questi recettori con affinità dell’ordine dei nanomolari (circa 5 nM), che sono tuttavia inferiori di circa due ordini di grandezza rispetto alle neurotrofine polipeptidiche altamente potenti come l’NGF (0,01-0,1 nM). [57][61][62] In ogni caso, il DHEA e il DHEA-S circolano entrambi alle concentrazioni necessarie per attivare questi recettori e sono stati quindi identificati come importanti fattori neurotrofici endogeni.[57][61] Da allora sono stati etichettati come “microneurotrofine steroidee”, a causa della loro natura di piccole molecole e di steroidi rispetto alle loro controparti neurotrofine polipeptidiche. [63] Ricerche successive hanno suggerito che il DHEA e/o il DHEA-S possano essere in realtà ligandi “ancestrali” filogeneticamente antichi dei recettori delle neurotrofine, risalenti all’inizio dell’evoluzione del sistema nervoso.[57][61] La scoperta che il DHEA si lega ai recettori delle neurotrofine e li attiva con potenza può spiegare l’associazione positiva tra la diminuzione dei livelli circolanti di DHEA con l’età e le malattie neurodegenerative legate all’età.[57][61]
Analogamente al pregnenolone, al suo derivato sintetico 3β-metossipregnenolone (MAP-4343) e al progesterone, è stato riscontrato che il DHEA si lega alla proteina 2 associata ai microtubuli (MAP2), in particolare al sottotipo MAP2C (Kd = 27 μM).[57] Tuttavia, non è chiaro se il DHEA aumenti il legame di MAP2 alla tubulina come il pregnenolone.[57]
Alcune ricerche hanno dimostrato che i livelli di DHEA sono troppo bassi nelle persone affette da ADHD e che il trattamento con metilfenidato o bupropione (farmaci di tipo stimolante) normalizza i livelli di DHEA. [64]
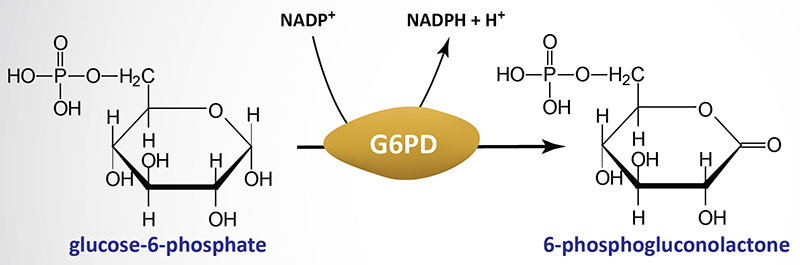
Il DHEA è un inibitore non competitivo della G6PDH (Ki = 17 μM; IC50 = 18,7 μM) ed è in grado di abbassare i livelli di NADPH e di ridurre la produzione di radicali liberi NADPH-dipendenti. [65][66] Si ritiene che questa azione possa essere responsabile di gran parte delle attività antinfiammatorie, antiiperplastiche, chemiopreventive, antiiperlipidemiche, antidiabetiche e antiobesiche, nonché di alcune attività immunomodulanti del DHEA (sono disponibili alcune prove sperimentali a sostegno di questa nozione). [65][66][67][68] Tuttavia, è stato anche detto che l’inibizione dell’attività della G6PDH da parte del DHEA in vivo non è stata osservata e che le concentrazioni necessarie al DHEA per inibire la G6PDH in vitro sono molto elevate, rendendo così incerto il possibile contributo dell’inibizione della G6PDH agli effetti del DHEA.[66]
Gli integratori di DHEA sono stati promossi come chemiopreventivi,[65][66][67][68] per le loro presunte proprietà di prevenzione del cancro. Esistono prove scientifiche a sostegno di queste affermazioni.[65][66][67]
È stato riscontrato che il DHEA inibisce in modo competitivo il TRPV1.[60]
Supplementazione di DHEA e sue applicazioni:

Come sappiamo, il DHEA e il suo coniugato DHEA-S sembrano essere correlati all’età, diminuendo sia negli uomini che nelle donne durante il processo di invecchiamento.[68][69] I livelli di DHEA sono relativamente alti dopo la nascita e scendono rapidamente fino alla pubertà, dove tornano a livelli apparentemente sovrafisiologici, rimanendo stabili fino a circa 25-35 anni di età, per poi diminuire costantemente. All’età di 70 anni, i livelli di DHEA sono circa il 20% di quelli di un venticinquenne medio.[70][68]
Un livello circolante di 4,1umol/L, o 1500ng/mL, è comunemente considerato vicino all’intervallo inferiore delle concentrazioni medie di DHEA per gli uomini giovani (15-39).[69] Molti studi che rilevano una “carenza di DHEA” negli uomini anziani utilizzano questo livello per definire la carenza.
L’integrazione di DHEA a un livello tale da ripristinare i livelli sierici di DHEA (50-100 mg al giorno) non sembra contrastare i comuni “effetti collaterali” dell’invecchiamento, come la perdita della libido o del metabolismo osseo; per la maggior parte i livelli di DHEA e i sintomi che chiamiamo “invecchiamento” non sono correlati. [71] La diminuzione del DHEA circolante con l’invecchiamento, a differenza della diminuzione dei livelli circolanti di L-carnitina o Creatina osservata in alcune popolazioni, non sembra essere indicativa di uno stato di carenza di DHEA che deve essere corretto.[72]
Il DHEA viene comunemente venduto come crema da applicare sulla pelle. Per la maggior parte degli scopi, questo è dovuto al fatto che il prodotto è destinato ad aiutare la qualità della pelle, ma la somministrazione topica influenza comunque i livelli ematici dell’ormone e l’impatto sistemico dello stesso.
In 36 donne anziane e sane (60-70 anni), 4g di crema (10%) o gel (10%) di DHEA applicati su un’area di 30x30cm sono stati confrontati con la somministrazione orale di 100 mg di DHEA. La somministrazione orale ha avuto una Cmax di 15,6+/-2,5ng/ml (dal valore basale di 2,3+/-0,3) con un Tmax di un’ora, misurando 5,7+/-0,5ng/ml a 6 ore e raggiungendo il valore basale a 24 ore. L’applicazione di un gel o di una crema ha raggiunto livelli di 8,2+/-2,0nmol/l e 8,0+/-1,2nmol/l a 12 ore, aumentando progressivamente fino a 24 ore, quando lo studio è terminato (valori superiori a quelli basali); le concentrazioni sieriche sembravano incrociarsi a 18 ore. [73] È interessante notare che non sono state osservate differenze nei livelli circolanti di DHEA, testosterone o estrogeni tra la crema e il gel, ma la crema ha prodotto una concentrazione di androstenedione significativamente più alta a 24 ore e la somministrazione topica in generale ha favorito il metabolismo degli androgeni più della somministrazione orale.[73] Per 14 giorni di applicazione, la crema è sembrata aumentare gli ormoni meglio del gel e non è stata osservata alcuna influenza sui livelli di DHEA-S con l’applicazione topica.[73]
La somministrazione topica mostra anche valori ematici più elevati di ormoni per un periodo di giorni; anche se suggestivo di un effetto potenziante, ciò può essere dovuto agli effetti del DHEA applicato topicamente che durano più di 24 ore.[73] Per un periodo di 12 mesi, i livelli sierici dell’applicazione quotidiana sono simili a quelli che sembrano misurati a 28 giorni.[74]
Nonostante le differenze riscontrate nella cinetica, la biodisponibilità complessiva della somministrazione topica e della somministrazione orale nel raggiungere il siero è paragonabile, con differenze minime nell’AUC, ad eccezione del DHEAS che non sembra essere significativamente aumentato con l’applicazione topica; lo è in una certa misura, ma solo in minima parte.[73][74]
I livelli più elevati di androgeni osservati con la somministrazione topica possono essere dovuti all’aggiramento della digestione enzimatica degli androgeni da parte degli enzimi UDP-Glucuronosiltransferasi[75][76] che sono maggiormente presenti nel tratto gastrointestinale e nel fegato. [77] Quando viene misurato nel sangue, l’androgeno più prevalente è in realtà il metabolita ADT-G (Androsterone Glucuronide), che costituisce fino al 90% di tutti gli androgeni dopo l’applicazione o nelle donne in post-menopausa, e raggiunge il 70% del valore dei controlli.[74][78] L’ADT-G è importante da notare nelle donne, poiché la maggior parte della sintesi di androgeni dal DHEA nelle donne avviene nei tessuti periferici, e può essere un biomarcatore più affidabile degli effetti androgeni rispetto al testosterone circolante.[79]
Il Tmax dell’integrazione di DHEA per via orale è estremamente variabile. Molti studi suggeriscono che grandi boli acuti hanno un Tmax di circa 1-3 ore,[73][80] ma a volte sono stati riportati valori di Tmax fino a 7-12.[80]
Nei giovani uomini (18-42 anni), l’integrazione di DHEA a 50 mg non è sufficiente a modificare in modo significativo i livelli circolanti di DHEA/DHEAS, mentre sembra che 200 mg siano in grado di farlo.[80] In questa stessa popolazione, il testosterone plasmatico e il DHT da DHEA non sono aumentati in modo significativo, mentre l’ADT-G sierico (metabolita degli androgeni) è aumentato in modo dose-dipendente da un’AUC media di 198ng/h/mL nelle 24 ore a 603 (dopo la somministrazione di 200 mg).[80]
Nota: Un metabolita del DHEA che esercita notevoli proprietà antinfiammatorie è il β-AET, altrimenti noto come Androstene-3β,7β,17β-triolo.[81]
È interessante notare che il declino del DHEA osservato con l’età si accompagna a un declino del cortisolo e al mantenimento di questo equilibrio; pertanto l’età potrebbe non essere di per sé causa di un equilibrio anormale.[82] Poiché il DHEA è meno volatile del cortisolo, è considerato un migliore biomarcatore dell’attività dell’adrenalina.[83][84]
I due esistono in un rapporto e le aberrazioni in questo rapporto si osservano negli stati patologici. Rapporti cortisolo:DHEA più elevati (più cortisolo, meno DHEA) si osservano nella depressione resistente,[85][86][87] nell’anoressia nervosa,[88] nel disturbo bipolare,[89] e, in misura minore, nella schizofrenia. [90][91] L’integrazione di DHEA a 100 mg per 6 settimane ha effettivamente dimostrato di aiutare i sintomi della schizofrenia, anche se non con la stessa potenza di un composto curativo;[92][93] si tratta di un’area di ricerca controversa.[94] È vero anche il lato opposto della relazione, con un elevato rapporto DHEA/cortisolo implicato nella sindrome da fatica cronica.[95]
Il rapporto cortisolo/DHEA può essere alla base della variabilità delle risposte al DHEA. Uno studio su schizofrenici ha osservato che gli effetti benefici erano maggiori nelle persone con livelli di cortisolo più elevati rispetto al DHEA, e minori in quelle con rapporti più stabili.[96]
Altri composti che sono stati chiamati in causa nel rapporto Cortisolo:DHEA sono la Melatonina, che ha dimostrato di aumentare il DHEA rispetto al cortisolo[97] e la L-Teanina che potrebbe essere più efficace negli schizofrenici che hanno un rapporto elevato tra cortisolo e DHEA.[98]
L’integrazione acuta di 50mg di DHEA prima dell’esercizio fisico è in grado di aumentare il Testosterone libero negli uomini di mezza età e di prevenire il successivo declino durante l’allenamento ad alta intensità.[99] E’ stata osservata una tendenza maggiore alla conversione in Estrone e Estradiolo in soggetti giovani di sesso maschile, mentre nei giovani di sesso femminile la conversione tendeva più al Testosterone.
Il DHEA può esercitare effetti protettivi diretti sull’endotelio (parete dei vasi sanguigni) e contribuire a mantenere la salute e la funzionalità dei vasi sanguinei.[100]
È dimostrato che il DHEA riduce le lipoproteine in modo potente, e questo può essere vicariato dalle azioni degli estrogeni. Tuttavia, sia le LDL che le HDL subiscono un calo, e il significato clinico del fatto che il DHEA sia cardioprotettivo in questo modo è discreditato.[101]
Uno studio suggerisce che l’allungamento dei telomeri avviene con una dose di 5-12,5 mg di DHEA al giorno, mentre dosaggi più elevati accorciano i telomeri;[102] tuttavia, l’analisi è stata effettuata tramite un test O-Ring bidirezionale e non si è dimostrata affidabile, poiché la convalida del test BDORT è stata pubblicata solo in una rivista, da un solo autore.[103][104] Al di là di queste informazioni, non ci sono altri studi che abbiano esaminato il DHEA supplementare e la lunghezza dei telomeri.
Gli studi a favore dell’idea che il DHEA migliori la sensibilità all’insulina hanno riscontrato miglioramenti a 50 mg al giorno per 6 mesi o più in individui di età superiore ai 65 anni con un’anomala eliminazione del glucosio, in cui l’AUC e la velocità di eliminazione del glucosio diminuiscono senza effetti significativi sull’insulina; ciò è indicativo della sensibilità all’insulina.[105][106] Questa dose in donne con alterata tolleranza al glucosio per 3 mesi ha dimostrato di attenuare gli effetti avversi con il tempo, anche se non ha portato benefici alla sensibilità all’insulina. [Uno studio con 25 mg al giorno ha mostrato benefici sulla sensibilità all’insulina in persone senza compromissione del glucosio,[107] e uno studio a breve termine sui meccanismi ha osservato un aumento della sensibilità all’insulina (ma nessun miglioramento nello smaltimento del glucosio) attraverso l’aumento del legame dei linfociti T con l’insulina.[108] Uno studio che ha utilizzato una crema al 10% di DHEA ha osservato che è stata in grado di ridurre i livelli di insulina (-17%) e di glucosio a digiuno (-11%).[109]
Anche 25 mg di DHEA al giorno in uomini con ipercolesterolemia hanno mostrato benefici sulla sensibilità all’insulina.[110]
I risultati benefici non sembrano essere correlati alla dose, in quanto un sovraccarico di 1600 mg di DHEA al giorno negli uomini non provoca effetti di sensibilizzazione all’insulina.[111]
Alcuni studi non riportano miglioramenti significativi nella sensibilità all’insulina: sono stati utilizzati 50 mg al giorno per 3 mesi in uomini anziani in sovrappeso, altrimenti sani, con un basso livello di DHEA (meno di 1500ng/mL); il DHEA non ha avuto nemmeno una tendenza verso la significatività e non è sembrato avere alcun effetto direzionale. [Questa mancanza di efficacia, con conseguente assenza di tendenza alla significatività, è stata notata altrove con dosi che normalmente dovrebbero funzionare.[112][113] Nelle donne in post-menopausa, in cui il DHEA non avrebbe mostrato efficacia, la combinazione di DHEA e di esercizi misti non ha creato efficacia del DHEA.[114]
Alcuni studi con risultati nulli notano tendenze verso la significatività, riducendo i livelli di insulina e l’AUC,[115]
Almeno due studi hanno notato un leggero aumento dei livelli di insulina senza cambiamenti nei livelli di glucosio nel siero con 50-75 mg al giorno, suggerendo una tendenza all’insulino-resistenza, anche se il grado di resistenza era minimo.[116][117]
È possibile che gli effetti di sensibilizzazione all’insulina siano più presenti negli uomini, a causa del maggiore stato degli androgeni circolanti dopo l’integrazione di DHEA. Gli androgeni si riducono con l’invecchiamento e sono inversamente correlati alla sensibilità all’insulina[106] e gli studi sulla sensibilità all’insulina dopo l’integrazione di DHEA, nonostante non vi sia consenso, sembrano essere più promettenti negli uomini che nelle donne (anche se questo potrebbe essere secondario al minor numero di studi esistenti negli uomini).[110][104] Questa ipotesi è in qualche modo rafforzata dal fatto che nelle donne sono stati osservati risultati migliori con l’integrazione topica di DHEA (crema),[109] e che la somministrazione topica favorisce il metabolismo degli androgeni nei tessuti periferici in misura maggiore rispetto alla somministrazione orale.[109]
Con 100-150 mg di DHEA sembrano aumentare i livelli di Testosterone nella maggior parte degli studi (senza consenso), ma questo non si traduce di per sé in un aumento della massa muscolare scheletrica. Mancano studi che combinino dosi efficaci di DHEA e sollevamento pesi nei giovani.[111]
È possibile che il DHEA riduca in modo indipendente l’apporto calorico, soprattutto di grassi, contribuendo così a qualsiasi riduzione del grasso corporeo osservata.[118]
Sembra abbastanza affidabile come agente di aumento dell’umore nei soggetti con insufficienza surrenalica, ma in individui altrimenti sani non sembra essere efficace. Negli uomini anziani con carenza di androgeni non c’è consenso sugli effetti del DHEA sull’umore, che appaiono contrastanti.[119]
Sebbene esistano basi biologiche per cui il DHEA e i suoi metaboliti (Testosterone, Diidrotestosterone) aumentino i livelli di antigene prostatico specifico (PSA) e aumentino il rischio di cancro alla prostata, non sembra che ciò avvenga a dosi moderate se assunto da uomini di età superiore ai 40 anni senza cancro alla prostata.[120]
Negli studi sui ratti in cui viene misurata la prostata, il DHEA a basse dosi per un lungo periodo di tempo non è associato a un aumento del peso della prostata, nonostante gli aumenti del Testosterone e del DHEA/DHEAS circolanti.[121]
- DHEA nelle donne:
Said review[122] ha raccolto 63 studi che hanno esaminato l’integrazione di DHEA nelle donne e ha rilevato che 11 studi non hanno avuto effetti significativi (17%), mentre 52 ne hanno tratto beneficio (83%). In questa revisione non sono stati riportati risultati negativi.
Gli studi neutrali (quelli che non hanno riscontrato benefici statisticamente significativi) hanno incluso la composizione corporea,[123] la capacità di esercizio fisico,[124] i sintomi della menopausa,[125] la massa ossea,[126] la sensibilità all’insulina,[127] l’umore,[128] l’immunologia,[129] la cognizione,[130] e la sessualità nell’insufficienza surrenalica[131]. Lo studio sulla sclerosi multipla (sperimentato anche sugli uomini) ha esaminato anche le donne con gli stessi risultati nulli.
Sono stati riscontrati benefici con il trattamento cutaneo applicato per via topica o orale,[132] i profili lipidici,[133] la salute cardiaca,[134] la densità minerale ossea,[135] la composizione corporea,[136] la sessualità,[137] l’umore,[138] la depressione,[139] la sensibilità apparente all’insulina,[140] e i sintomi della menopausa come le vampate di calore.[141]
Alcuni studi sono stati omessi perché riguardavano stati patologici specifici, come l’insufficienza surrenalica,[142] l’anoressia nervosa,[143] le persone ipopituitarie,[144] o il lupus.[145]
- Metaboliti e interazioni metaboliche del DHEA:
Androst-3,5-dien-7,17-dione è un ulteriore metabolita del 7-Keto DHEA, che si ottiene quando un singolo legame sull’anello A tra i carboni 3 e 4 viene trasformato in un doppio legame. In questo modo la denominazione 5-Androstene diventa 3,5-dien, poiché l’-en si riferisce a un doppio legame e il di si riferisce a due. Sorprendentemente, si tratta di un metabolita naturale che si trova nelle urine, poiché questo cambiamento da 7-Oxo (l’aggiunta di un doppio legame) sembra avvenire da qualche parte nell’organismo[146], forse nel fegato.[147] A volte questo metabolita viene indicato anche come 3-desossi-7-cheto DHEA. Indipendentemente dal nome colloquiale dato, il nome chimico allungato di questa molecola è (8R,9S,10R,13S,14S)-10,13-dimetil-2,8,9,11,12,14,15,16-ottaidro-1H-ciclopenta{a}fenantrene-7,17-dione. Due nomi “comuni” separati per riferirsi alla stessa molecola
Questo coniugato sembra possedere attività di inibizione competitiva dell’aromatasi, con un IC50 di 1,8uM e un Ki di 0,22uM.[148] L’inibizione è risultata dipendente dal tempo in modo pseudo-primo ordine, con un Kinact min-1 di 0,119.[148]
Non ancora scientificamente testato nell’uomo, ma sembra essere un potente inibitore dell’Aromatasi.
Possibili effetti collaterali da uso di DHEA:
Innanzi tutto, il potenziale utilizzatore dovrebbe considerare di evitare l’uso di DHEA se soffre di colesterolo alto e/o di alterati rapporti HDL:Colesterolo totale e/o HDL:Trigliceridi, o di una condizione che influisce sull’apporto di sangue al cuore (cardiopatia ischemica). Il DHEA può ridurre i livelli di lipoproteine ad alta densità (HDL).[https://www.cochranelibrary.com/]
L’uso di DHEA potrebbe inoltre peggiorare i disturbi psichiatrici e aumentare il rischio di mania nelle persone che soffrono di disturbi dell’umore.[https://onlinelibrary.wiley.com/]
L’uso del DHEA potrebbe, inizialmente, causare sintomi psichiatrici come eccessiva attivazione nervosa. In questi casi è necessario rivedere il dosaggio, la sua distribuzione durante la giornata e optare per un incremento graduale fino al raggiungimento di un dosaggio sufficiente a riportare in range ottimale i livelli ematici di DHEA/DHEA-S. Nel caso i problemi persistano, la terapia dovrebbe essere interrotta.[https://link.springer.com/]
Raramente il DHEA può anche causare pelle grassa, acne e crescita di peli indesiderati di tipo maschile nelle donne (irsutismo).
Il DHEA, convertendo in estrogeni e androgeni [vedi soprattutto Testosterone e Estradiolo] potrebbe causare una riduzione dell’attività dell’Asse HPT di natura regolatrice della compensazione ormonale indiretta [cioè della conversione del DHEA in Testosterone e E2].
Le possibili interazioni includono:
- Antipsicotici. L’uso di DHEA con antipsicotici come la Clozapina (Clozaril, Versacloz, altri) può ridurre l’efficacia del farmaco.
- Carbamazepina (Tegretol, Carbatrol, altri). L’uso di DHEA con questo farmaco usato per il trattamento di crisi epilettiche, dolore nervoso e disturbo bipolare potrebbe ridurre l’efficacia del farmaco.
- Estrogeni. Non usare il DHEA con gli estrogeni. La combinazione di DHEA ed estrogeni potrebbe causare i sintomi di un eccesso di estrogeni, come instabilità dell’umore, ritenzione idrica, accumulo di grasso con modello femminile, ginecomaztia, calo della libido, difficoltà a raggiungere e mantenere l’erezione, letargia, stanchezza, nausea, mal di testa e insonnia.
- Litio. L’uso di DHEA con il Litio può ridurre l’efficacia del farmaco.
- Inibitori Selettivi della Ricaptazione della Serotonina. L’uso di DHEA con questo tipo di antidepressivi può causare sintomi maniacali.
- Testosterone. Usare il DHEA con il Testosterone, se a regime non terapeutico o non controllato, può facilmente causare iperestrogenemia con effetti già riportati precedentemente.
- Triazolam (Halcion). L’uso di DHEA con questo sedativo potrebbe aumentare gli effetti di questo farmaco, causando una sedazione eccessiva e influenzando la respirazione e la frequenza cardiaca.
- Acido valproico. L’uso di DHEA con questo farmaco usato per il trattamento delle crisi epilettiche e del disturbo bipolare potrebbe ridurne l’efficacia. [https://www.ncaa.org/sport-science-institute/topics/2020-21-ncaa-banned-substances. ]
Conclusioni sul DHEA:
Che il DHEA non sia una molecola così blanda dovrebbe essere ormai ben chiaro a chiunque legga quanto da me scientificamente riportato.
Altresì, si palesa il perchè non sia personalmente favorevole ad una sua liberalizzazione di vendita. Visto che parliamo di un androgeno precursore di vie di conversione androgenica ed estrogenica, la molecola dovrebbe essere correttamente regolamentata e resa disponibile solo e soltanto quando il paziente o richiedente si dimostra idoneo al suo corretto utilizzo.
Sicuramente, le condizioni che potrebbero giustificare il suo utilizzo sono:
- Soggetto di sesso maschile con carenza di DHEA patologica o età correlata;
- Soggetto di sesso femminile in menopausa come parte di una HRT.
E tutti quelli che usano il DHEA in “sostituzione” di una base di Testosterone durante un protocollo con altri PEDs al fine di garantirsi una sufficiente soglia ematica di E2? Beh, innanzitutto, i tassi di conversione in E2 risultano tutto sommato variabili tra soggetto e soggetto. Ciò significa che, spesso, sono richiesti range di dosaggio medio-alti al fine di garantire una presenza sufficiente di E2. In questi casi, sono comuni le comparse di problemi della sfera psichica correlati ad un aumento della attività neurosteroidea del DHEA.
Ricordo, inoltre, che, in Italia, prima del 17 Giugno 2021, il DHEA galenico era prescrivibile in qualsiasi modo e forma. Con DM 1 Giugno 2021 è stata vietata la prescrizione di DHEA galenico ad uso sistemico. Resta possibile SOLO la prescrizione topica. Ciò significa che l’uso e la detenzione di altre forme di DHEA costituisce reato.
Per chi ancora non lo sapesse, il DHEA è presente nelle liste WADA e il suo uso nelle competizioni con controllo anti-doping è quindi vietato.
L’emivita del DHEA è di 15-38 minuti, mentre quella del DHEA-S è di 7-22 ore. L’escrezione renale [urine] rappresenta il 51-73% dell’eliminazione del DHEAS e dei suoi metaboliti. Si ritiene che sia perciò rilevabile entro 2 giorni dall’ultima assunzione orale.
Gabriel Bellizzi [CEO BioGenTech]
Riferimenti:
- Labrie F, Luu-The V, Bélanger A, Lin SX, Simard J, Pelletier G, Labrie C (November 2005). “Is dehydroepiandrosterone a hormone?”. J. Endocrinol. 187 (2): 169–96.
- William F Ganong MD, ‘Review of Medical Physiology’, 22nd Ed, McGraw Hill, 2005, p. 362.
- The Merck Index, 13th Edition, 7798
- Schulman RA, Dean C (2007). Solve It With Supplements. New York City: Rodale, Inc. p. 100. ISBN 978-1-57954-942-8.
DHEA (Dehydroepiandrosterone) is a common hormone produced in the adrenal glands, the gonads, and the brain.
- Jump up to:a b Mo Q, Lu SF, Simon NG (April 2006). “Dehydroepiandrosterone and its metabolites: differential effects on androgen receptor trafficking and transcriptional activity”. The Journal of Steroid Biochemistry and Molecular Biology. 99 (1): 50–8.
- Scott T (1996). Concise Encyclopedia Biology. Walter de Gruyter. p. 49. ISBN 978-3-11-010661-9. Retrieved 25 May 2012.
- Jump up to:a b c Webb SJ, Geoghegan TE, Prough RA, Michael Miller KK (2006). “The biological actions of dehydroepiandrosterone involves multiple receptors”. Drug Metabolism Reviews. 38 (1–2): 89–116.
- Friess E, Schiffelholz T, Steckler T, Steiger A (December 2000). “Dehydroepiandrosterone–a neurosteroid”. European Journal of Clinical Investigation. 30 Suppl 3: 46–50.
- Elks J (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 641.
- Edith Josephy; F. Radt (1 December 2013). Elsevier’s Encyclopaedia of Organic Chemistry: Series III: Carboisocyclic Condensed Compounds. Springer. pp. 2608.
- Erkkola R (2006). The Menopause. Elsevier. pp. 5.
- Kleine B, Rossmanith WG (11 February 2016). Hormones and the Endocrine System: Textbook of Endocrinology. Springer. pp. 264–265.
- Jump up to:a b Pizzorno JE (2013). Textbook of Natural Medicine. Elsevier Health Sciences. pp. 711.
- Jump up to:a b Rainey WE, Nakamura Y (February 2008). “Regulation of the adrenal androgen biosynthesis”. The Journal of Steroid Biochemistry and Molecular Biology. 108 (3–5): 281–6. doi:10.1016/j.jsbmb.2007.09.015. PMC 2699571. PMID 17945481.
- Jump up to:a b Adler RA (14 December 2009). Osteoporosis: Pathophysiology and Clinical Management. Springer Science & Business Media. pp. 387–. ISBN 978-1-934115-19-0.
- Schill W, Comhaire FH, Hargreave TB (26 August 2006). Andrology for the Clinician. Springer Science & Business Media. pp. 243.
- Jump up to:a b Linos DA, van Heerden JA (5 December 2005). Adrenal Glands: Diagnostic Aspects and Surgical Therapy. Springer Science & Business Media. pp. 161.
- Fima Lifshitz (26 December 2006). Pediatric Endocrinology: Growth, Adrenal, Sexual, Thyroid, Calcium, and Fluid Balance Disorders. CRC Press. pp. 289–. ISBN 978-1-4200-4272-6.
- Salhan S (1 August 2011). Textbook of Gynecology. JP Medical Ltd. pp. 94.
- Lavery JP, Sanfilippo JS (6 December 2012). Pediatric and Adolescent Obstetrics and Gynecology. Springer Science & Business Media. pp. 45.
- Chen F, Knecht K, Birzin E, Fisher J, Wilkinson H, Mojena M, Moreno CT, Schmidt A, Harada S, Freedman LP, Reszka AA (November 2005). “Direct agonist/antagonist functions of dehydroepiandrosterone”. Endocrinology. 146 (11): 4568–76.
- Weizman A (1 February 2008). Neuroactive Steroids in Brain Function, Behavior and Neuropsychiatric Disorders: Novel Strategies for Research and Treatment. Springer Science & Business Media. pp. 229–. ISBN 978-1-4020-6854-6.
- Gravanis AG, Mellon SH (24 June 2011). Hormones in Neurodegeneration, Neuroprotection, and Neurogenesis. John Wiley & Sons. pp. 349–. ISBN 978-3-527-63397-5.
- Sex difference in the human brain, their underpinnings and implications. Elsevier. 3 December 2010. pp. 127–. ISBN 978-0-444-53631-0.
- Gao W, Bohl CE, Dalton JT (September 2005). “Chemistry and structural biology of androgen receptor”. Chemical Reviews. 105 (9): 3352–70. doi:10.1021/cr020456u. PMC 2096617. PMID 16159155.
- Lindschau C, Kirsch T, Klinge U, Kolkhof P, Peters I, Fiebeler A (September 2011). “Dehydroepiandrosterone-induced phosphorylation and translocation of FoxO1 depend on the mineralocorticoid receptor”. Hypertension. 58 (3): 471–8.
- Prough RA, Clark BJ, Klinge CM (April 2016). “Novel mechanisms for DHEA action”. Journal of Molecular Endocrinology. 56 (3): R139–55.
- Watson RR (22 July 2011). DHEA in Human Health and Aging. CRC Press. pp. 208–.
- Lazaridis I, Charalampopoulos I, Alexaki VI, Avlonitis N, Pediaditakis I, Efstathopoulos P, Calogeropoulou T, Castanas E, Gravanis A (April 2011). “Neurosteroid dehydroepiandrosterone interacts with nerve growth factor (NGF) receptors, preventing neuronal apoptosis”. PLOS Biology.
- Morfin R (2 September 2003). DHEA and the Brain. CRC Press. pp. 28–.
- Karasek M (2006). Aging and Age-related Diseases: The Basics. Nova Publishers. pp. 66
- Kalimi MY, Regelson W (2000). Dehydroepiandrosterone (DHEA): Biochemical, Physiological and Clinical Aspects. Walter de Gruyter. pp. 41.
- Filaire E, Duché P, Lac G (October 1998). “Effects of amount of training on the saliva concentrations of cortisol, dehydroepiandrosterone and on the dehydroepiandrosterone: cortisol concentration ratio in women over 16 weeks of training”. European Journal of Applied Physiology and Occupational Physiology. 78 (5): 466–71.
- Copeland JL, Consitt LA, Tremblay MS (April 2002). “Hormonal responses to endurance and resistance exercise in females aged 19-69 years”. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 57 (4): B158–65.
- Mattison JA, Lane MA, Roth GS, Ingram DK (2003). “Calorie restriction in rhesus monkeys”. Experimental Gerontology. 38 (1–2): 35–46.
- Roberts E (February 1999). “The importance of being dehydroepiandrosterone sulfate (in the blood of primates): a longer and healthier life?”. Biochemical Pharmacology. 57 (4): 329–46.
- Jump up to:a b Alesci S, Manoli I, Blackman MR (29 December 2004). “Dehydroepiandrosterone (DHEA)”. In Coates PM, Blackman MR, Cragg GM, Levine M, Moss J, White JD (eds.). Encyclopedia of Dietary Supplements (Print). CRC Press. pp. 169–. ISBN 978-0-8247-5504-1.
- Becker KL (2001). Principles and Practice of Endocrinology and Metabolism. Lippincott Williams & Wilkins. pp. 712
- Mo Q, Lu SF, Simon NG (April 2006). “Dehydroepiandrosterone and its metabolites: differential effects on androgen receptor trafficking and transcriptional activity”. The Journal of Steroid Biochemistry and Molecular Biology. 99 (1): 50–8.
- Zbella, E. A.; Ilekis, J.; Scommegna, A.; Benveniste, R. (1986). “Competitive studies with dehydroepiandrosterone sulfate and 16 alpha-hydroxydehydroepiandrosterone sulfate in cultured human choriocarcinoma JEG-3 cells: effect on estrone, 17 beta-estradiol, and estriol secretion”. The Journal of Clinical Endocrinology and Metabolism. 63 (3): 751–757.
- Prough RA, Clark BJ, Klinge CM (April 2016). “Novel mechanisms for DHEA action”. Journal of Molecular Endocrinology. 56 (3): R139–55.
- https://www.questdiagnostics.com/hcp/intguide/EndoMetab/EndoManual_AtoZ_PDFs/DHEA.pdf[bare URL PDF]
- Banaszewska B, Spaczyński RZ, Pelesz M, Pawelczyk L (2003). “Incidence of elevated LH/FSH ratio in polycystic ovary syndrome women with normo- and hyperinsulinemia”. Roczniki Akademii Medycznej W Bialymstoku. 48: 131–4.
- Pescovitz OH, Eugster EA (2004). Pediatric Endocrinology: Mechanisms, Manifestations, and Management. Lippincott Williams & Wilkins. pp. 362–.
- Fima Lifshitz (26 December 2006). Pediatric Endocrinology: Growth, Adrenal, Sexual, Thyroid, Calcium, and Fluid Balance Disorders. CRC Press. pp. 289–.
- Salhan S (1 August 2011). Textbook of Gynecology. JP Medical Ltd. pp. 94–.
- Lavery JP, Sanfilippo JS (6 December 2012). Pediatric and Adolescent Obstetrics and Gynecology. Springer Science & Business Media. pp. 45–. .
- Nussbaum RL, McInnes RR, Willard HF (28 April 2015). Thompson & Thompson Genetics in Medicine. Elsevier Health Sciences. pp. 102–.
- Setchell ME, Hudson CN (4 April 2013). Shaw’s Textbook of Operative Gynaecology. Elsevier Health Sciences. pp. 129–.
- Bissonnette B, Dalens B (20 July 2006). Syndromes: Rapid Recognition and Perioperative Implications. McGraw Hill Professional. p. 184.
- Jump up to:a b c d e Chen F, Knecht K, Birzin E, Fisher J, Wilkinson H, Mojena M, Moreno CT, Schmidt A, Harada S, Freedman LP, Reszka AA (November 2005). “Direct agonist/antagonist functions of dehydroepiandrosterone”. Endocrinology.
- Weizman A (1 February 2008). Neuroactive Steroids in Brain Function, Behavior and Neuropsychiatric Disorders: Novel Strategies for Research and Treatment. Springer Science & Business Media. pp. 229–. .
- Gravanis AG, Mellon SH (24 June 2011). Hormones in Neurodegeneration, Neuroprotection, and Neurogenesis. John Wiley & Sons. pp. 349–. .
- Sex difference in the human brain, their underpinnings and implications. Elsevier. 3 December 2010. pp. 127–. .
- Gao W, Bohl CE, Dalton JT (September 2005). “Chemistry and structural biology of androgen receptor”. Chemical Reviews. 105 (9): 3352–70. .
- Lindschau C, Kirsch T, Klinge U, Kolkhof P, Peters I, Fiebeler A (September 2011). “Dehydroepiandrosterone-induced phosphorylation and translocation of FoxO1 depend on the mineralocorticoid receptor”. Hypertension. .
- Prough RA, Clark BJ, Klinge CM (April 2016). “Novel mechanisms for DHEA action”. Journal of Molecular Endocrinology. 56 (3): R139–55. .
- Watson RR (22 July 2011). DHEA in Human Health and Aging. CRC Press. pp. 208–.
- Kalimi M, Shafagoj Y, Loria R, Padgett D, Regelson W (February 1994). “Anti-glucocorticoid effects of dehydroepiandrosterone (DHEA)”. Molecular and Cellular Biochemistry. 131 (2): 99–104. .
- King SR (9 November 2012). Neurosteroids and the Nervous System. Springer Science & Business Media. pp. 15–16. ISBN 978-1-4614-5559-2.
- Lazaridis I, Charalampopoulos I, Alexaki VI, Avlonitis N, Pediaditakis I, Efstathopoulos P, Calogeropoulou T, Castanas E, Gravanis A (April 2011). “Neurosteroid dehydroepiandrosterone interacts with nerve growth factor (NGF) receptors, preventing neuronal apoptosis”. PLOS Biology. 9 (4): e1001051.
- Pediaditakis I, Iliopoulos I, Theologidis I, Delivanoglou N, Margioris AN, Charalampopoulos I, Gravanis A (January 2015). “Dehydroepiandrosterone: an ancestral ligand of neurotrophin receptors”. Endocrinology. 156 (1).
- Gravanis A, Calogeropoulou T, Panoutsakopoulou V, Thermos K, Neophytou C, Charalampopoulos I (October 2012). “Neurosteroids and microneurotrophins signal through NGF receptors to induce prosurvival signaling in neuronal cells”. Science Signaling. 5 (246): pt8.
- Lee, M. S.; Yang, J. W.; Ko, Y. H.; Han, C.; Kim, S. H.; Lee, M. S.; Joe, S. H.; Jung, I. K. (2008). “Effects of methylphenidate and bupropion on DHEA-S and cortisol plasma levels in attention-deficit hyperactivity disorder”. Child Psychiatry and Human Development. 39 (2): 201–209.
- Elks J (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 641–.
- Edith Josephy; F. Radt (1 December 2013). Elsevier’s Encyclopaedia of Organic Chemistry: Series III: Carboisocyclic Condensed Compounds. Springer. pp. 2608–.
- Schwartz AG, Pashko LL (2001). “Potential therapeutic use of dehydroepiandrosterone and structural analogs”. Diabetes Technology & Therapeutics. 3 (2): 221–4.
- Orentreich N, Brind JL, Vogelman JH, Andres R, Baldwin HLong-term longitudinal measurements of plasma dehydroepiandrosterone sulfate in normal menJ Clin Endocrinol Metab.(1992 Oct)
- Orentreich N, Brind JL, Rizer RL, Vogelman JHAge changes and sex differences in serum dehydroepiandrosterone sulfate concentrations throughout adulthoodJ Clin Endocrinol Metab.(1984 Sep)
- Bélanger A, Candas B, Dupont A, Cusan L, Diamond P, Gomez JL, Labrie FChanges in serum concentrations of conjugated and unconjugated steroids in 40- to 80-year-old menJ Clin Endocrinol Metab.(1994 Oct)
- Ponholzer A, Plas E, Schatzl G, Jungwirth A, Madersbacher S; Austrian Society of UrologyAssociation of DHEA-S and estradiol serum levels to symptoms of aging menAging Male.(2002 Dec)
- Arlt W, Callies F, Koehler I, van Vlijmen JC, Fassnacht M, Strasburger CJ, Seibel MJ, Huebler D, Ernst M, Oettel M, Reincke M, Schulte HM, Allolio BDehydroepiandrosterone supplementation in healthy men with an age-related decline of dehydroepiandrosterone secretionJ Clin Endocrinol Metab.(2001 Oct)
- Labrie F, Bélanger A, Labrie C, Candas B, Cusan L, Gomez JLBioavailability and metabolism of oral and percutaneous dehydroepiandrosterone in postmenopausal womenJ Steroid Biochem Mol Biol.(2007 Oct)
- Labrie F, Cusan L, Gomez JL, Martel C, Bérubé R, Bélanger P, Chaussade V, Deloche C, Leclaire JChanges in serum DHEA and eleven of its metabolites during 12-month percutaneous administration of DHEAJ Steroid Biochem Mol Biol.(2008 May)
- Bélanger A, Pelletier G, Labrie F, Barbier O, Chouinard SInactivation of androgens by UDP-glucuronosyltransferase enzymes in humansTrends Endocrinol Metab.(2003 Dec)
- Hum DW, Bélanger A, Lévesque E, Barbier O, Beaulieu M, Albert C, Vallée M, Guillemette C, Tchernof A, Turgeon D, Dubois SCharacterization of UDP-glucuronosyltransferases active on steroid hormonesJ Steroid Biochem Mol Biol.(1999 Apr-Jun)
- Turgeon D, Carrier JS, Lévesque E, Hum DW, Bélanger ARelative enzymatic activity, protein stability, and tissue distribution of human steroid-metabolizing UGT2B subfamily membersEndocrinology.(2001 Feb)
- Labrie F, Bélanger A, Bélanger P, Bérubé R, Martel C, Cusan L, Gomez J, Candas B, Chaussade V, Castiel I, Deloche C, Leclaire JMetabolism of DHEA in postmenopausal women following percutaneous administrationJ Steroid Biochem Mol Biol.(2007 Feb)
- Labrie F, Bélanger A, Bélanger P, Bérubé R, Martel C, Cusan L, Gomez J, Candas B, Castiel I, Chaussade V, Deloche C, Leclaire JAndrogen glucuronides, instead of testosterone, as the new markers of androgenic activity in womenJ Steroid Biochem Mol Biol.(2006 Jun)
- Acacio BD, Stanczyk FZ, Mullin P, Saadat P, Jafarian N, Sokol RZPharmacokinetics of dehydroepiandrosterone and its metabolites after long-term daily oral administration to healthy young menFertil Steril.(2004 Mar)
- Auci DL, Ahlem CN, Kennedy MR, Page TM, Reading CL, Frincke JMA potential role for 5-androstene-3β,7β,17β-triol in obesity and metabolic syndromeObesity (Silver Spring).(2011 Apr)
- Ahn RS, Lee YJ, Choi JY, Kwon HB, Chun SISalivary cortisol and DHEA levels in the Korean population: age-related differences, diurnal rhythm, and correlations with serum levelsYonsei Med J.(2007 Jun 30)
- Hucklebridge F, Hussain T, Evans P, Clow AThe diurnal patterns of the adrenal steroids cortisol and dehydroepiandrosterone (DHEA) in relation to awakeningPsychoneuroendocrinology.(2005 Jan)
- Matchock RL, Dorn LD, Susman EJDiurnal and seasonal cortisol, testosterone, and DHEA rhythms in boys and girls during pubertyChronobiol Int.(2007)
- Markopoulou K, Papadopoulos A, Juruena MF, Poon L, Pariante CM, Cleare AJThe ratio of cortisol/DHEA in treatment resistant depressionPsychoneuroendocrinology.(2009 Jan)
- Young AH, Gallagher P, Porter RJElevation of the cortisol-dehydroepiandrosterone ratio in drug-free depressed patientsAm J Psychiatry.(2002 Jul)
- Michael A, Jenaway A, Paykel ES, Herbert JAltered salivary dehydroepiandrosterone levels in major depression in adultsBiol Psychiatry.(2000 Nov 15)
- Lawson EA, Misra M, Meenaghan E, Rosenblum L, Donoho DA, Herzog D, Klibanski A, Miller KKAdrenal glucocorticoid and androgen precursor dissociation in anorexia nervosaJ Clin Endocrinol Metab.(2009 Apr)
- Gallagher P, Watson S, Smith MS, Young AH, Ferrier INPlasma cortisol-dehydroepiandrosterone (DHEA) ratios in schizophrenia and bipolar disorderSchizophr Res.(2007 Feb)
- Ritsner M, Maayan R, Gibel A, Strous RD, Modai I, Weizman AElevation of the cortisol/dehydroepiandrosterone ratio in schizophrenia patientsEur Neuropsychopharmacol.(2004 Aug)
- Strous RD, Maayan R, Lapidus R, Stryjer R, Lustig M, Kotler M, Weizman ADehydroepiandrosterone augmentation in the management of negative, depressive, and anxiety symptoms in schizophreniaArch Gen Psychiatry.(2003 Feb)
- Nachshoni T, Ebert T, Abramovitch Y, Assael-Amir M, Kotler M, Maayan R, Weizman A, Strous RDImprovement of extrapyramidal symptoms following dehydroepiandrosterone (DHEA) administration in antipsychotic treated schizophrenia patients: a randomized, double-blind placebo controlled trialSchizophr Res.(2005 Nov 15)
- Ritsner MS, Gibel A, Ratner Y, Tsinovoy G, Strous RDImprovement of sustained attention and visual and movement skills, but not clinical symptoms, after dehydroepiandrosterone augmentation in schizophrenia: a randomized, double-blind, placebo-controlled, crossover trialJ Clin Psychopharmacol.(2006 Oct)
- Cleare AJ, O’Keane V, Miell JPLevels of DHEA and DHEAS and responses to CRH stimulation and hydrocortisone treatment in chronic fatigue syndromePsychoneuroendocrinology.(2004 Jul)
- Ritsner M, Gibel A, Maayan R, Ratner Y, Ram E, Biadsy H, Modai I, Weizman ACortisol/dehydroepiandrosterone ratio and responses to antipsychotic treatment in schizophreniaNeuropsychopharmacology.(2005 Oct)
- Pawlikowski M, Kolomecka M, Wojtczak A, Karasek MEffects of six months melatonin treatment on sleep quality and serum concentrations of estradiol, cortisol, dehydroepiandrosterone sulfate, and somatomedin C in elderly womenNeuro Endocrinol Lett.(2002 Apr)
- Miodownik C, Maayan R, Ratner Y, Lerner V, Pintov L, Mar M, Weizman A, Ritsner MSSerum levels of brain-derived neurotrophic factor and cortisol to sulfate of dehydroepiandrosterone molar ratio associated with clinical response to L-theanine as augmentation of antipsychotic therapy in schizophrenia and schizoaffective disorder patientsClin Neuropharmacol.(2011 Jul-Aug)
- Liu TC, Lin CH, Huang CY, Ivy JL, Kuo CHEffect of acute DHEA administration on free testosterone in middle-aged and young men following high-intensity interval trainingEur J Appl Physiol.(2013 Feb 17)
- Komesaroff PAUnravelling the enigma of dehydroepiandrosterone: moving forward step by stepEndocrinology.(2008 Mar)
- Martina V, Benso A, Gigliardi VR, Masha A, Origlia C, Granata R, Ghigo EShort-term dehydroepiandrosterone treatment increases platelet cGMP production in elderly male subjectsClin Endocrinol (Oxf).(2006 Mar)
- 81-Kiechl S, Willeit J, Bonora E, Schwarz S, Xu QNo association between dehydroepiandrosterone sulfate and development of atherosclerosis in a prospective population study (Bruneck Study)Arterioscler Thromb Vasc Biol.(2000 Apr)
- Omura YBeneficial effects and side effects of DHEA: true anti-aging and age-promoting effects, as well as anti-cancer and cancer-promoting effects of DHEA evaluated from the effects on the normal and cancer cell telomeres and other parametersAcupunct Electrother Res.(2005)
- Omura Y, Losco M, Omura AK, Takeshige C, Hisamitsu T, Nakajima H, Soejima K, Yamamoto S, Ishikawa H, Kagoshima T, et alBi-directional transmission of molecular information by photon or electron beams passing in the close vicinity of specific molecules, and its clinical and basic research applications: 1) Diagnosis of humans or animal patients without any direct contact; 2) Light microscopic and electron microscopic localization of neuro-transmitters, heavy metals, Oncogen C-fos (AB2), etc. of intracellular fine structures of normal and abnormal single cells using light or electro-microscopic indirect Bi-Digital O-Ring TestAcupunct Electrother Res.(1992)
- Omura YElectro-magnetic resonance phenomenon as a possible mechanism related to the “bi-digital o-ring test molecular identification and localization method”Acupunct Electrother Res.(1986)
- Villareal DT, Holloszy JOEffect of DHEA on abdominal fat and insulin action in elderly women and men: a randomized controlled trialJAMA.(2004 Nov 10)
- Genazzani AD, Stomati M, Bernardi F, Pieri M, Rovati L, Genazzani ARLong-term low-dose dehydroepiandrosterone oral supplementation in early and late postmenopausal women modulates endocrine parameters and synthesis of neuroactive steroidsFertil Steril.(2003 Dec)
- Lasco A, Frisina N, Morabito N, Gaudio A, Morini E, Trifiletti A, Basile G, Nicita-Mauro V, Cucinotta DMetabolic effects of dehydroepiandrosterone replacement therapy in postmenopausal womenEur J Endocrinol.(2001 Oct)
- Casson PR, Faquin LC, Stentz FB, Straughn AB, Andersen RN, Abraham GE, Buster JEReplacement of dehydroepiandrosterone enhances T-lymphocyte insulin binding in postmenopausal womenFertil Steril.(1995 May)
- Diamond P, Cusan L, Gomez JL, Bélanger A, Labrie FMetabolic effects of 12-month percutaneous dehydroepiandrosterone replacement therapy in postmenopausal womenJ Endocrinol.(1996 Sep)
- Kawano H, Yasue H, Kitagawa A, Hirai N, Yoshida T, Soejima H, Miyamoto S, Nakano M, Ogawa HDehydroepiandrosterone supplementation improves endothelial function and insulin sensitivity in menJ Clin Endocrinol Metab.(2003 Jul)
- Nestler JE, Barlascini CO, Clore JN, Blackard WGDehydroepiandrosterone reduces serum low density lipoprotein levels and body fat but does not alter insulin sensitivity in normal menJ Clin Endocrinol Metab.(1988 Jan)
- Panjari M, Bell RJ, Jane F, Adams J, Morrow C, Davis SRThe safety of 52 weeks of oral DHEA therapy for postmenopausal womenMaturitas.(2009 Jul 20)
- Morales AJ, Nolan JJ, Nelson JC, Yen SSEffects of replacement dose of dehydroepiandrosterone in men and women of advancing ageJ Clin Endocrinol Metab.(1994 Jun)
- Igwebuike A, Irving BA, Bigelow ML, Short KR, McConnell JP, Nair KSLack of dehydroepiandrosterone effect on a combined endurance and resistance exercise program in postmenopausal womenJ Clin Endocrinol Metab.(2008 Feb)
- Jankowski CM, Gozansky WS, Van Pelt RE, Wolfe P, Schwartz RS, Kohrt WMOral dehydroepiandrosterone replacement in older adults: effects on central adiposity, glucose metabolism and blood lipidsClin Endocrinol (Oxf).(2011 Oct)
- Basu R, Dalla Man C, Campioni M, Basu A, Nair KS, Jensen MD, Khosla S, Klee G, Toffolo G, Cobelli C, Rizza RATwo years of treatment with dehydroepiandrosterone does not improve insulin secretion, insulin action, or postprandial glucose turnover in elderly men or womenDiabetes.(2007 Mar)
- Mortola JF, Yen SSThe effects of oral dehydroepiandrosterone on endocrine-metabolic parameters in postmenopausal womenJ Clin Endocrinol Metab.(1990 Sep)
- Kiechl S, Willeit J, Bonora E, Schwarz S, Xu QNo association between dehydroepiandrosterone sulfate and development of atherosclerosis in a prospective population study (Bruneck Study)Arterioscler Thromb Vasc Biol.(2000 Apr)
- Omura YBeneficial effects and side effects of DHEA: true anti-aging and age-promoting effects, as well as anti-cancer and cancer-promoting effects of DHEA evaluated from the effects on the normal and cancer cell telomeres and other parametersAcupunct Electrother Res.(2005)
- Omura Y, Losco M, Omura AK, Takeshige C, Hisamitsu T, Nakajima H, Soejima K, Yamamoto S, Ishikawa H, Kagoshima T, et alBi-directional transmission of molecular information by photon or electron beams passing in the close vicinity of specific molecules, and its clinical and basic research applications: 1) Diagnosis of humans or animal patients without any direct contact; 2) Light microscopic and electron microscopic localization of neuro-transmitters, heavy metals, Oncogen C-fos (AB2), etc. of intracellular fine structures of normal and abnormal single cells using light or electro-microscopic indirect Bi-Digital O-Ring TestAcupunct Electrother Res.(1992)
- Arnold JT, Le H, McFann KK, Blackman MRComparative effects of DHEA vs. testosterone, dihydrotestosterone, and estradiol on proliferation and gene expression in human LNCaP prostate cancer cellsAm J Physiol Endocrinol Metab.(2005 Mar)
- Traish AM, Kang HP, Saad F, Guay ATDehydroepiandrosterone (DHEA)–a precursor steroid or an active hormone in human physiologyJ Sex Med.(2011 Nov)
- Chung BC, Picado-Leonard J, Haniu M, Bienkowski M, Hall PF, Shively JE, Miller WLCytochrome P450c17 (steroid 17 alpha-hydroxylase/17,20 lyase): cloning of human adrenal and testis cDNAs indicates the same gene is expressed in both tissuesProc Natl Acad Sci U S A.(1987 Jan)
- Callies F, Fassnacht M, van Vlijmen JC, Koehler I, Huebler D, Seibel MJ, Arlt W, Allolio BDehydroepiandrosterone replacement in women with adrenal insufficiency: effects on body composition, serum leptin, bone turnover, and exercise capacityJ Clin Endocrinol Metab.(2001 May)
- Barnhart KT, Freeman E, Grisso JA, Rader DJ, Sammel M, Kapoor S, Nestler JEThe effect of dehydroepiandrosterone supplementation to symptomatic perimenopausal women on serum endocrine profiles, lipid parameters, and health-related quality of lifeJ Clin Endocrinol Metab.(1999 Nov)
- Genazzani AD, Stomati M, Strucchi C, Puccetti S, Luisi S, Genazzani AROral dehydroepiandrosterone supplementation modulates spontaneous and growth hormone-releasing hormone-induced growth hormone and insulin-like growth factor-1 secretion in early and late postmenopausal womenFertil Steril.(2001 Aug)
- Basu R, Dalla Man C, Campioni M, Basu A, Nair KS, Jensen MD, Khosla S, Klee G, Toffolo G, Cobelli C, Rizza RATwo years of treatment with dehydroepiandrosterone does not improve insulin secretion, insulin action, or postprandial glucose turnover in elderly men or womenDiabetes.(2007 Mar)
- Nair KS, Rizza RA, O’Brien P, Dhatariya K, Short KR, Nehra A, Vittone JL, Klee GG, Basu A, Basu R, Cobelli C, Toffolo G, Dalla Man C, Tindall DJ, Melton LJ 3rd, Smith GE, Khosla S, Jensen MDDHEA in elderly women and DHEA or testosterone in elderly menN Engl J Med.(2006 Oct 19)
- Casson PR, Santoro N, Elkind-Hirsch K, Carson SA, Hornsby PJ, Abraham G, Buster JEPostmenopausal dehydroepiandrosterone administration increases free insulin-like growth factor-I and decreases high-density lipoprotein: a six-month trialFertil Steril.(1998 Jul)
- Wolf OT, Neumann O, Hellhammer DH, Geiben AC, Strasburger CJ, Dressendörfer RA, Pirke KM, Kirschbaum CEffects of a two-week physiological dehydroepiandrosterone substitution on cognitive performance and well-being in healthy elderly women and menJ Clin Endocrinol Metab.(1997 Jul)
- Løvås K, Gebre-Medhin G, Trovik TS, Fougner KJ, Uhlving S, Nedrebø BG, Myking OL, Kämpe O, Husebye ESReplacement of dehydroepiandrosterone in adrenal failure: no benefit for subjective health status and sexuality in a 9-month, randomized, parallel group clinical trialJ Clin Endocrinol Metab.(2003 Mar)
- Calvo E, Luu-The V, Morissette J, Martel C, Labrie C, Bernard B, Bernerd F, Deloche C, Chaussade V, Leclaire J, Labrie FPangenomic changes induced by DHEA in the skin of postmenopausal womenJ Steroid Biochem Mol Biol.(2008 Dec)
- Mortola JF, Yen SSThe effects of oral dehydroepiandrosterone on endocrine-metabolic parameters in postmenopausal womenJ Clin Endocrinol Metab.(1990 Sep)
- Williams MR, Dawood T, Ling S, Dai A, Lew R, Myles K, Funder JW, Sudhir K, Komesaroff PADehydroepiandrosterone increases endothelial cell proliferation in vitro and improves endothelial function in vivo by mechanisms independent of androgen and estrogen receptorsJ Clin Endocrinol Metab.(2004 Sep)
- Nair KS, Rizza RA, O’Brien P, Dhatariya K, Short KR, Nehra A, Vittone JL, Klee GG, Basu A, Basu R, Cobelli C, Toffolo G, Dalla Man C, Tindall DJ, Melton LJ 3rd, Smith GE, Khosla S, Jensen MDDHEA in elderly women and DHEA or testosterone in elderly menN Engl J Med.(2006 Oct 19)
- Villareal DT, Holloszy JO, Kohrt WMEffects of DHEA replacement on bone mineral density and body composition in elderly women and menClin Endocrinol (Oxf).(2000 Nov)
- Hackbert L, Heiman JRAcute dehydroepiandrosterone (DHEA) effects on sexual arousal in postmenopausal womenJ Womens Health Gend Based Med.(2002 Mar)
- Morales AJ, Nolan JJ, Nelson JC, Yen SSEffects of replacement dose of dehydroepiandrosterone in men and women of advancing ageJ Clin Endocrinol Metab.(1994 Jun)
- Wolkowitz OM, Reus VI, Roberts E, Manfredi F, Chan T, Raum WJ, Ormiston S, Johnson R, Canick J, Brizendine L, Weingartner HDehydroepiandrosterone (DHEA) treatment of depressionBiol Psychiatry.(1997 Feb 1)
- Lasco A, Frisina N, Morabito N, Gaudio A, Morini E, Trifiletti A, Basile G, Nicita-Mauro V, Cucinotta DMetabolic effects of dehydroepiandrosterone replacement therapy in postmenopausal womenEur J Endocrinol.(2001 Oct)
- Barton DL, Loprinzi C, Atherton PJ, Kottschade L, Collins M, Carpenter P, Adjei A, Rummans TA, Shanafelt T, Christensen B, Sloan JDehydroepiandrosterone for the treatment of hot flashes: a pilot studySupport Cancer Ther.(2006 Jan 1)
- Johannsson G, Burman P, Wirén L, Engström BE, Nilsson AG, Ottosson M, Jonsson B, Bengtsson BA, Karlsson FALow dose dehydroepiandrosterone affects behavior in hypopituitary androgen-deficient women: a placebo-controlled trialJ Clin Endocrinol Metab.(2002 May)
- Gordon CM, Grace E, Emans SJ, Feldman HA, Goodman E, Becker KA, Rosen CJ, Gundberg CM, LeBoff MSEffects of oral dehydroepiandrosterone on bone density in young women with anorexia nervosa: a randomized trialJ Clin Endocrinol Metab.(2002 Nov)
- Brooke AM, Kalingag LA, Miraki-Moud F, Camacho-Hübner C, Maher KT, Walker DM, Hinson JP, Monson JPDehydroepiandrosterone improves psychological well-being in male and female hypopituitary patients on maintenance growth hormone replacementJ Clin Endocrinol Metab.(2006 Oct)
- van Vollenhoven RF, Engleman EG, McGuire JLAn open study of dehydroepiandrosterone in systemic lupus erythematosusArthritis Rheum.(1994 Sep)
- Schubert K, Wehrberger K, Hobe GAndrosta-3,5-diene-7,17-dione: isolation from urine and formation from 7-keto-dehydro-epiandrosterone sulphate under various conditions of hydrolysisEndocrinol Exp.(1971 Dec)
- Marwah A, Marwah P, Lardy HErgosteroids. VI. Metabolism of dehydroepiandrosterone by rat liver in vitro: a liquid chromatographic-mass spectrometric studyJ Chromatogr B Analyt Technol Biomed Life Sci.(2002 Feb 15)
- Numazawa M, Mutsumi A, Tachibana M, Hoshi KSynthesis of androst-5-en-7-ones and androsta-3,5-dien-7-ones and their related 7-deoxy analogs as conformational and catalytic probes for the active site of aromataseJ Med Chem.(1994 Jul 8)
