Se non avete ancora letto la prima parte di questa serie di articoli vi invito a farlo prima di procedere con la lettura di questa seconda parte: 1° Parte.
Informazioni base sull’IGF-1
Nella prima parte di questa serie di articoli ho esposto la storia e cronologia legate alla scoperta del GH e dll’IGF-1. Tuttavia, vorrei approfondire l’argomento riguardante i membri della famiglia dei fattori di crescita insulino-similimi, esponendo le loro caratteristiche e i loro ruoli nel processo ipertrofico. Gli IGF sono una famiglia di peptidi, in gran parte dipendenti dal GH, che mediano molte delle azioni di stimolo della crescita date dal GH.[121] Il fegato è il principale responsabile di tutta la produzione endocrina di IGF-1, con circa il 75% della sintesi a carico epatico sotto la regolazione del GH.[83,122-123] Ciò presuppone che ci sia un apporto macro-calorico sufficiente e livelli elevati di Insulina portale.[124-125] La sintesi autocrina di IGF-1 è anche regolata dal GH, in aggiunta ad altri fattori autocrini dipendenti dal tessuto.[126-128]

Alla famiglia degli IGF appartengono oltre dieci proteine strutturalmente simili tra cui IGF-1, IGF-2, Insulina, Relaxina e Pro-Insulina.[129] Sono tutti altamente omologhi sia nella struttura che nella funzione e gli effetti metabolici dell’IGF-1 sono stati definiti “insulino-simili” proprio a causa delle somiglianze e dei percorsi che condividono l’uno con l’altro. L’IGF-1 ha un’omologia di sequenza aminoacidica superiore al 50% con l’Insulina e il recettore del IGF-1 ha un’omologia della sequenza aminoacidica del 60% con il recettore dell’Insulina.[121,130-131] Gli evoluzionisti suppongono che la somiglianze nella struttura di questi peptidi sia dovuta al fatto che essi si siano evoluti da una singola molecola precursore trovata in vertebrati di oltre 60 milioni di anni fa.[132] Sia il rilascio di IGF-1 che quello di Insulina sono stimolati dall’assunzione di cibo, rilascio che viene inibito in condizioni di digiuno.[83]

A causa di queste somiglianze strutturali, i membri della famiglia IGF possono spesso legarsi con i recettori nativi in modo “incrociato”.[133] Per riassumere brevemente queste relazioni di legame, la molecola di IGF-1 si lega con il recettore del IGF-1 con un elevata affinità, tuttavia sia l’IGF-2 che l’Insulina possono legarsi al recettore del IGF-1, ma con una affinità significativamente inferiori. L’IGF-2 si lega al recettore del IGF-2 con una elevata affinità, e l’IGF-1 si lega a questo recettore con un’affinità inferiore mentre l’Insulina non presenta alcun legame con esso.

La famiglia dei recettori IGF ha densità che variano significativamente in base ai tipi di cellule in cui sono presenti.[132] Questo è uno dei motivi per cui l’Insulina e l’IGF-1 possono avere diverse azioni metaboliche nonostante siano strutturalmente simili. Cellule come gli epatociti e gli adipociti hanno molti più recettori dell’Insulina rispetto ai recettori del IGF-1. Al contrario, le cellule muscolari lisce vascolari situate nei vasi sanguigni hanno un numero significativamente più elevato di recettori del IGF-1 rispetto ai recettori dell’Insulina.

Poiché ho già fatto un’analisi approfondita in precedenza sulle basi chimiche che si verificano durante l’attivazione del GHR, non mi ripeterò su tale questione. Però, è necessario comprendere che la famiglia dei recettori IGF è anche attivata dalla Tirosina Chinasi che, come ora sappiamo, porta alla fosforilazione dei substrati, all’attivazione delle vie cellulari e infine all’espressione genica e alla sintesi proteica.[121] L’attivazione del recettore del IGF-1 sembra essere indipendente dall’isoforma da cui è stato prodotto l’IGF-1. Inoltre, si noti che entrambi i tipi di recettori IGF sono stati trovati nelle cellule muscolari umane.[134]
I livelli serici di IGF-1 sono stabili negli adulti sani e vi sono poche variazioni da un giorno all’altro, o anche da una settimana all’altra. In effetti, osservare i livelli serici di IGF-1 di un individuo può essere un indicatore abbastanza affidabile di eventuali problemi di sensibilità al GH in relazione ad intervalli ben definiti, corretti per età e sesso.[135] Naturalmente, quando si cerca di decidere se esistono reali problemi di sensibilità, è necessario prendere in considerazione aspetti come lo stato nutrizionale generale dell’individuo e la salute epatica.

Nel flusso sanguineo, l’IGF-1 esiste principalmente in forma legata a proteine leganti l’IGF (IGFBP). La superfamiglia IGFBP comprende sei proteine ad alta affinità che vanno dal IGFBP-1 al IGFBP-6, nonché un certo numero di proteine a bassa affinità denominate proteine legate all’IGFBP.[136] Quasi il 95% di tutto l’IGF-1 circolante esiste in forma legata, con circa il 75% legato specificamente con l’IGFBP-3.[137] Una piccola frazione di IGF-1 (normalmente inferiore al 5%) può anche esistere in forma libera, e queste molecole non legate agiscono come regolatore negativo della secrezione di GH.[104] Gli IGFBP possono legarsi con l’IGF-1 e l’IGF-2, ma non con l’insulina. [138]

L’IGF-1 legato esiste più comunemente in un complesso ternario da 150-kDa mentre è nel circolo ematico. Questo complesso ternario è costituito da una molecola di IGF-1, dal IGFBP-3 e dalla subunità labile acida (ALS) – sebbene possa esistere in un complesso binario con altri IGFBP.[139-140] Questi complessi servono a scopi come l’aumento della biodisponibilità degli IGF circolanti, estendendo la loro emivita serica, trasportando gli IGF alle cellule bersaglio e modulando l’interazione degli IGF con i loro rispettivi recettori di membrana posti sulla superficie delle cellule.[141-144] Ad esempio, nel plasma, il complesso ternario stabilizza IGF-1, aumentando significativamente la sua emivita da meno di 5 minuti a oltre 16 ore in alcuni casi.[137]
Gli IGFB sembrano normalmente inibire l’azione degli IGF, e questo perché competono con i recettori IGF per l’affinità di legame con gli IGF.[145] Tuttavia, non è sempre così, poiché gli IGFBP sono anche in grado di potenziare le azioni dell’IGF, potenzialmente facilitando la consegna dell’IGF al recettore.[146] Sebbene esista un’interazione piuttosto complessa, basti ricordare che il ruolo principale degli IGFBP è quello di trasportare gli IGF dal flusso ematico ai tessuti periferici. Una volta che ciò è avvenuto, gli IGFBP vengono rilasciati dai complessi binari e ternari mediante proteolisi o tramite legame alla matrice extracellulare del recettore del IGF-1.[147] Una volta rilasciate, le molecole di IGF-1 diventano libere, attive e possono quindi esplicare la loro azione.[137,143]
Una volta nei tessuti, gli IGFBP modulano le azioni dell’IGF in quanto hanno una maggiore affinità per il sito recettore rispetto all’IGF stesso [148], tuttavia essi possono anche esercitare effetti indipendenti dall’IGF.[149] Alcuni degli effetti diretti del IGFBP che sono già stati chiariti includono l’inibizione della crescita, l’induzione diretta dell’apoptosi e la modulazione degli effetti dei fattori di crescita non-IGF.[121]
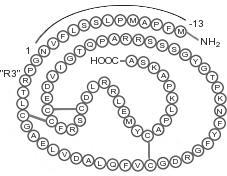
È anche noto che lo splicing alternativo del gene IGF-1 produce tre isoforme distinte nell’uomo che hanno sia azioni dirette che indirette che contribuiscono agli effetti di promozione della crescita del IGF-1.[150-151] Sebbene non siano richieste per la secrezione di IGF-1, queste isoforme possono aumentare la reale biodisponibilità del IGF-1 al suo sito recettore.[437] Le tre isoforme sono denominate IGF-1Ea, IGF-1Eb e IGF-1Ec. E’ corretto sottolineare il fatto che roditori e pesci posseggono solo due isoforme, e in questo articolo ci si riferirà solo alle isoforme umane, a meno che non sia chiaramente indicato diversamente, per spera in questo modo di creare meno confusione al lettore.
L’IGF-1Ea è simile all’isoforma IGF principale espressa dagli epatociti e ha l’esone 4 del gene IGF-1 maturo giuntato direttamente all’esone 6.[152] Si pensa che l’IGF-1Eb sia prevalentemente espresso nel fegato, ma il suo ruolo nei muscoli non è ancora del tutto chiaro.[153] Si estende più a valle dell’esone 5, ma solo i primi 17 aminoacidi di questa isoforma sono identici a quelli della variante finale dell’isoforma che tratterò a momenti[154]. Si ritiene che questa isoforma sia unica per i primati, e per l’uomo, in quanto non è stata trovata nei roditori o nei pesci.[155]

L’IGF-1Ec è anche chiamato Fattore di Crescita Maccanico (MGF) ed è chiamato così perché è espresso in risposta a tensione meccanica e stress.[156-157] Nella prima parte di questa serie di articoli ho riportato in breve come questi siano due dei principali meccanismi alla base del processo ipertrofico all’interno del muscolo scheletrico. Tratterò più nel dettaglio dell’MGF in seguito. Questa isoforma contiene parte dell’esone 5 giuntata all’esone 6 che si traduce in un frame-shift e questo dal mRNA è tradotto in una isoforma con una alternativa sequenza di 25 aminoacidi al C-terminale.[152] Nei roditore l’IGF-1Eb condivide un’alta omologia con l’MGF umano ed entrambi sono spesso usati in modo intercambiabile in letteratura.[158] Riporto ciò solamente perché può diventare forviante quando si esamina la letteratura scientifica trattante questa isoforma, specialmente quando si passa da modelli animali a umani.

L’MGF ha mostrato in modelli di colture cellulari di aumentare la proliferazione e la migrazione dei mioblasti, oltre ad essere coinvolto nell’attivazione delle cellule satelliti. Comunque sia, se ciò si verifichi in vivo è a tutt’oggi una fonte di contesa. Questo comportamento è stato visto anche in presenza dell’inattivazione del IGF-1, il che suggerisce che l’MGF abbia la capacità di operare indipendentemente dall’IGF-1 maturo.[438] Detto questo, tutte le isoforme di IGF-1 richiedono un recettore del IGF-1 funzionale per produrre effettivamente ipertrofia muscolare poiché tale recettore non viene influenzato in assenza di IGF-1 maturo.[439-440] La risposta effettiva al MGF si riscontra in un ambiente con un pool attivo di cellule satelliti, poiché i tessuti muscolari invecchiati sono normalmente in uno stato di dormienza. Infine, sebbene l’MGF iniettabile sia quasi una chimera nel ambiente del BodyBuilding, osservando la totalità del suo effetto sembra avere una minore attività muscolare rispetto all’IGF-1 maturo, quindi il suo valore intrinseco per i Bodybuilder può effettivamente essere stato sovrastimato.[442]
Somatopausa

Lo studio di soggetti anziani offre una prospettiva alquanto singolare dal momento che è noto come la sarcopenia, termine che sta ad indicare una degenerazione del tessuto muscolare, si manifesti con l’avanzare dell’età. È anche noto che i livelli di GH secreto e IGF-1 circolante diminuiscono gradualmente nel corso della vita dopo il picco della pubertà.[159-162] Il declino dei livelli ormonali è piuttosto marcato, con una diminuzione della secrezione di GH del 10-15% ogni decennio dopo i 20 anni.[163] Molti anni fa è stato suggerito che questi cambiamenti senescenti nella composizione corporea e nelle funzioni metaboliche sono direttamente correlati alla diminuzione dei livelli ormonali all’interno dell’Asse GH/IGF-1. La comunità scientifica ha coniato il termine “somatopausa” per descrivere questo fenomeno.[159,164]
In sintesi, i processi che caratterizzano l’”ipotesi della Somatopausa” [128] sono:
- I cambiamenti nello stile di vita e le predisposizioni genetiche promuovono l’accumulo di grasso corporeo con l’avanzare dell’età;
- Questa maggiore massa grassa aumenta la disponibilità di FFA e quindi induce insulino-resistenza;
- Livelli elevati di Insulina sopprimono l’IGFBP-1 determinando un aumento relativo dei livelli di IGF-1 liberi;
- Aumenti sistemici degli FFA, dell’Insulina e una soppressione del rilascio ipofisario di GH dato dal aumento del IGF-1, portano ad un ulteriore aumento della massa grassa;
- Il GH endogeno viene eliminato più rapidamente nei soggetti con maggiore massa grassa
Come si può vedere, il grasso corporeo aumenta con l’avanzare dell’età, di conseguenza si verifica un peggioramento dell’insulino-resistenza seguita da un aumento dei livelli di Insulina che, attraverso la soppressione del IGFBP-1 e all’aumento del IGF-1 libero, porta alla soppressione della secrezione di GH, che a sua volta peggiora la composizione corporea (vedi aumento della percentuale di grasso). È piuttosto interessante vedere che la frequenza degli impulsi di GH rimane essenzialmente intatta. L’attenuazione legata all’età è in realtà solo una marcata riduzione dell’ampiezza dell’impulso insieme ad un aumento della secrezione di SRIF.[165]
I cambiamenti associati alla somatopausa sono molto simili a quelli osservati negi giovani adulti con deficit dell’Ormone della Crescita (GHD). Sebbene simili, le persone anziane non sono normalmente così gravemente colpite da questa condizione rispetto agli individui con GHD e la somatopause non è considerata uno stato patologico.[160,166-167] Esempi di alcuni dei cambiamenti associati alla somatopausa includono la riduzione della massa muscolare e ossea, riduzione della forza, diminuzione dell’attività fisica e della capacità cardiaca, aumento del grasso corporeo (in particolare nella regione viscerale) e deterioramento cognitivo.
A causa del desiderio di invertire i molti effetti dannosi legati all’invecchiamento, vi è una diffusa ipotesi secondo cui la somministrazione di GH possa essere d’aiuto come parte di un programma di terapia ormonale sostitutiva completa (HRT). Una revisione completa riguardante HRT e anziani va oltre lo scopo di questo articolo, ma quelli che sono interessati possono trovare una discussione recente sull’argomento qui.[168]
L’ormone della crescita migliora le prestazioni atletiche?

L’emergere del GH come farmaco per il miglioramento delle prestazioni (PED), al di fuori dei circoli ristretti del BodyBuilding, è in gran parte attribuito al rilascio del famigerato “Underground Steroid Handbook” nei primi anni ’80.[169] Successivamente, il GH ha colpito l’opinione pubblica quando il vincitore della medaglia d’oro delle Olimpiadi del 1988, Ben Johnson, ammise di usarlo insieme agli AAS dopo essere stato privato del suo titolo in seguito alla positività del test anti-doping al quale era stato sottoposto.[170] Durante quel periodo, si credeva comunemente che l’uso del GH avrebbe aumentato la massa muscolare e contemporaneamente migliorato gli aspetti della prestazione atletica.[171] E, come risposta a questa convinzione, nel 1989 il CIO ha vietato l’uso del GH definendolo un PED e inserendolo come parte di una nuova classe di farmaci dopanti denominata “ormoni peptidici e analoghi”. Ha vietato l’uso del GH nonostante in quel momento vi fosse la mancanza di un test legittimo per la rilevazione del rHGH.[172] Nonostante tutto ciò, la domanda rimane ancora: anche con le prove che suggeriscono l’uso decennale del GH nell’atletica competitiva, questo ormone apporta veramente un significativo miglioramento delle prestazioni?
Ci sono state in realtà più revisioni sistematiche che hanno tentato di rispondere a questa domanda, ma sfortunatamente sono state tutt’altro che conclusive per quanto riguarda gli effetti ergogenici del GH.[173-175] E nonostante vari scandali nel corso degli anni, così come la prevalenza d’uso del GH da parte di atleti professionisti, ci sono ancora pochissime prove cliniche che suggeriscono che il GH da solo abbia un impatto significativo sull’aumento delle prestazioni sia negli adulti sani che nei soggetti giovani.[173,176- 179]
Sono stati svolti soltanto pochi studi strettamente controllati che più direttamente hanno tentato di cercare il reale impatto del GH sulle prestazioni fisiche in soggetti sani e allenati. Probabilmente il più interessante di questi ha dimostrato che dosi sovrafisiologiche di GH abbinate agli AAS non hanno apportato miglioramenti significativi del VO2max, nella forza o nella potenza esplosiva misurata attraverso l’altezza del salto.[180] E’ stato notato un leggero miglioramento nella capacità di sprint anaerobico, che era più evidente negli uomini e specialmente in quelli trattati con GH e AAS. Considerando ciò, in un evento sportivo nel quale le frazioni di secondo potrebbero significare la differenza tra vincere e perdere, questo dato ha una certa importanza.
Passando in rassegna il corpo della letteratura scientifica, non si osservano miglioramenti delle prestazioni aerobiche tramite l’uso di GH. Ciò si riscontra sia nel caso in cui il GH viene somministrato a dosi fisiologiche a soggetti sani [181-182] sia nel caso in cui viene somministrato in dosi sovrafisiologiche.[180,183-184] La capacità aerobica non è inoltre influenzata dalla somministrazione acuta di GH prima dell’allenamento.[185] Tutti gli aumenti delle prestazioni aerobiche del GH sembrano essere mediati tramite gli Androgeni, e questo è ulteriormente supportato dai risultati di uno studio che dimostrano come gli ex utilizzatori di AAS esprimano un aumento del VO2max. Sebbene fossero passati alcuni mesi dal loro ultimo utilizzo di AAS, tale lasso di tempo non era sufficiente affinchè l’effetto “di coda” dell’uso di questa categoria di farmaci fosse esaurito.[186]
Soggetti anziani sani a cui erano state somministrate dosi combinate di Testosterone e GH, calibrate affinchè si raggiungesse una soglia ematica nel range dell’età giovanile, hanno sperimentato in qualche misura il miglioramento dell’equilibrio e delle prestazioni fisiche.[187] Questi miglioramenti delle prestazioni sembrano essere più pronunciati negli uomini e, comunque, sono marginali, anche con i trattamenti combinati.[188] Come è stato discusso in precedenza, le dosi soprafisiologiche di GH possono aumentare la capacità anaerobica.[180] Questo è un effetto osservato anche in alcune occasioni in cui i soggetti GHD sono stati trattati con GH, ripristinando i “normali” intervalli dell’ormone.[182,189]
L’Asse GH/IGF-1 può anche svolgere un ruolo nella regolazione del tono vascolare, o nel grado di costrizione rispetto allo stato di massima dilatazione dei vasi sanguigni, regolando in tal modo la resistenza periferico.[190-191] L’IGF-1 è stato identificato come un potente vasodilatatore, un effetto parzialmente mediato dall’aumento dell’emissione di ossido nitrico dall’endotelio, il tessuto che forma uno strato di cellule che rivestono organi come il cuore e i vasi linfatici.[192-194] Questo potenziale di aumento della capacità del flusso sanguigno ha una miriade di benefici ipotetici sugli sforzi atletici.
Per concludere, nonostante la mancanza di prove convincenti in letteratura [434], gli atleti usano spesso dosi e protocolli che non vengono replicati durante gli studi. Detto ciò, si dovrebbe comunque essere cauti prima di liquidare completamente il GH come composto per il miglioramento delle prestazioni basandosi semplicemente su ciò che, al momento, il corpo della letteratura scientifica ci suggerisce. È molto probabile che eserciti un contributo significativo negli atleti di alto livello, e potrebbe farlo attraverso mezzi diretti o indiretti.
Nella terza parte di questa serie di articoli mi occuperò degli effetti diretti e indiretti del GH e del IGF-1 nell’ipertrofia muscolare, dell’uso degli AAS in combinazione con GH e IGF-1 analizzando, infine, il loro potenziale sinergico con l’Asse GH/IGF-1.
Stay tuned!
Gabriel Bellizzi
Riferimenti:
- Cohen P. Overview of the IGF-I system. Horm Res. 2006;65 Suppl 1:3-8. Epub 2006 Mar 2. Review.
- Yakar S, Liu JL, Stannard B, Butler A, Accili D, Sauer B, LeRoith D. Normal growth and development in the absence of hepatic insulin-like growth factor I. Proc Natl Acad Sci U S A. 1999 Jun 22;96(13):7324-9.
- Laron Z. Insulin-like growth factor 1 (IGF-1): a growth hormone. Molecular Pathology. 2001;54(5):311-316.
- Wurzburger MI, Prelevic GM, Sönksen PH, Balint-Peric LA, Wheeler M. The effect of recombinant human growth hormone on regulation of growth hormone secretion and blood glucose in insulin-dependent diabetes. J Clin Endocrinol Metab. 1993 Jul;77(1):267-72.
- Yakar S, Rosen CJ, Beamer WG, Ackert-Bicknell CL, Wu Y, Liu JL, Ooi GT, Setser J, Frystyk J, Boisclair YR, LeRoith D. Circulating levels of IGF-1 directly regulate bone growth and density. J Clin Invest. 2002 Sep;110(6):771-81.
- D’Ercole AJ, Stiles AD, Underwood LE. Tissue concentrations of somatomedin C: further evidence for multiple sites of synthesis and paracrine or autocrine mechanisms of action. Proc Natl Acad Sci U S A. 1984 Feb;81(3):935-9.
- Gosteli-Peter MA, Winterhalter KH, Schmid C, Froesch ER, Zapf J. Expression and regulation of insulin-like growth factor-I (IGF-I) and IGF-binding protein messenger ribonucleic acid levels in tissues of hypophysectomized rats infused with IGF-I and growth hormone. Endocrinology. 1994 Dec;135(6):2558-67.
- Gunawardane K, Krarup Hansen T, Sandahl Christiansen J, et al. Normal Physiology of Growth Hormone in Adults. [Updated 2015 Nov 12]. In: De Groot LJ, Chrousos G, Dungan K, et al., editors. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000-.
- Lu C, Lam HN, Menon RK. New members of the insulin family: regulators of metabolism, growth and now … reproduction. Pediatr Res. 2005 May;57(5 Pt 2):70R-73R.
- Yakar S, Sun H, Zhao H, Pennisi P, Toyoshima Y, Setser J, Stannard B, Scavo L, Leroith D. Metabolic effects of IGF-I deficiency: lessons from mouse models. Pediatr Endocrinol Rev. 2005 Sep;3(1):11-9. Review.
- Samani AA, Yakar S, LeRoith D, Brodt P. The role of the IGF system in cancer growth and metastasis: overview and recent insights. Endocr Rev. 2007 Feb;28(1):20-47. Epub 2006 Aug 24. Review.
- Clemmons DR. Metabolic actions of insulin-like growth factor-I in normal physiology and diabetes. Endocrinol Metab Clin North Am. 2012 Jun;41(2):425-43, vii-viii.
- Kim JJ, Accili D. Signalling through IGF-I and insulin receptors: where is the specificity? Growth Horm IGF Res. 2002 Apr;12(2):84-90. Review.
- Shimizu M, Webster C, Morgan DO, Blau HM, Roth RA. Insulin and insulin-like growth factor receptors and responses in cultured human muscle cells. Am J Physiol. 1986 Nov;251(5 Pt 1):E611-5.
- Buckway CK, Guevara-Aguirre J, Pratt KL, Burren CP, Rosenfeld RG. The IGF-I generation test revisited: a marker of GH sensitivity. J Clin Endocrinol Metab. 2001 Nov;86(11):5176-83.
- Hwa V, Oh Y, Rosenfeld RG. The insulin-like growth factor-binding protein (IGFBP) superfamily. Endocr Rev. 1999 Dec;20(6):761-87. Review.
- Firth SM, Baxter RC. Cellular actions of the insulin-like growth factor binding proteins. Endocr Rev. 2002 Dec;23(6):824-54. Review.
- Bach LA, Hsieh S, Sakano K, Fujiwara H, Perdue JF, Rechler MM. Binding of mutants of human insulin-like growth factor II to insulin-like growth factor binding proteins 1-6. J Biol Chem. 1993 May 5;268(13):9246-54.
- Boisclair YR, Rhoads RP, Ueki I, Wang J, Ooi GT. The acid-labile subunit (ALS) of the 150 kDa IGF-binding protein complex: an important but forgotten component of the circulating IGF system. J Endocrinol. 2001 Jul;170(1):63-70. Review.
- Duan C. Specifying the cellular responses to IGF signals: roles of IGF-binding proteins. J Endocrinol. 2002 Oct;175(1):41-54. Review.
- LeRoith D. Insulin-like growth factor receptors and binding proteins. Baillieres Clin Endocrinol Metab. 1996 Jan;10(1):49-73. Review.
- Rajaram S, Baylink DJ, Mohan S. Insulin-like growth factor-binding proteins in serum and other biological fluids: regulation and functions. Endocr Rev. 1997 Dec;18(6):801-31. Review.
- Monzavi R, Cohen P. IGFs and IGFBPs: role in health and disease. Best Pract Res Clin Endocrinol Metab. 2002 Sep;16(3):433-47. Review.
- Giustina A, Mazziotti G, Canalis E. Growth hormone, insulin-like growth factors, and the skeleton. Endocr Rev. 2008 Aug;29(5):535-59. Epub 2008 Apr 24. Review.
- Collett-Solberg PF, Cohen P. Genetics, chemistry, and function of the IGF/IGFBP system. Endocrine. 2000 Apr;12(2):121-36. Review.
- Wetterau LA, Moore MG, Lee KW, Shim ML, Cohen P. Novel aspects of the insulin-like growth factor binding proteins. Mol Genet Metab. 1999 Oct;68(2):161-81. Review.
- Parker A, Rees C, Clarke J, Busby WH Jr, Clemmons DR. Binding of insulin-like growth factor (IGF)-binding protein-5 to smooth-muscle cell extracellular matrix is a major determinant of the cellular response to IGF-I. Mol Biol Cell. 1998 Sep;9(9):2383-92.
- Velloso CP. Regulation of muscle mass by growth hormone and IGF-I. Br J Pharmacol. 2008 Jun;154(3):557-68. Review.
- Jones JI, Clemmons DR. Insulin-like growth factors and their binding proteins: biological actions. Endocr Rev. 1995 Feb;16(1):3-34. Review.
- Hameed M, Lange KH, Andersen JL, Schjerling P, Kjaer M, Harridge SD, Goldspink G. The effect of recombinant human growth hormone and resistance training on IGF-I mRNA expression in the muscles of elderly men. J Physiol. 2004 Feb 15;555(Pt 1):231-40. Epub 2003 Oct 17.
- Pfeffer LA, Brisson BK, Lei H, Barton ER. The insulin-like growth factor (IGF)-I E-peptides modulate cell entry of the mature IGF-I protein. Mol Biol Cell. 2009 Sep;20(17):3810-7.
- Zabłocka B, Goldspink PH, Goldspink G, Górecki DC. Mechano-Growth Factor: an important cog or a loose screw in the repair machinery? Front Endocrinol (Lausanne). 2012 Nov 1;3:131.
- Rotwein P. Two insulin-like growth factor I messenger RNAs are expressed in human liver. Proc Natl Acad Sci U S A. 1986 Jan;83(1):77-81.
- Siegfried JM, Kasprzyk PG, Treston AM, Mulshine JL, Quinn KA, Cuttitta F. A mitogenic peptide amide encoded within the E peptide domain of the insulin-like growth factor IB prohormone. Proc Natl Acad Sci U S A. 1992 Sep 1;89(17):8107-11.
- Barton ER, DeMeo J, Lei H. The insulin-like growth factor (IGF)-I E-peptides are required for isoform-specific gene expression and muscle hypertrophy after local IGF-I production. J Appl Physiol (1985). 2010 May;108(5):1069-76.
- Yang S, Alnaqeeb M, Simpson H, Goldspink G. Cloning and characterization of an IGF-1 isoform expressed in skeletal muscle subjected to stretch. J Muscle Res Cell Motil. 1996 Aug;17(4):487-95.
- McKoy G, Ashley W, Mander J, Yang SY, Williams N, Russell B, Goldspink G. Expression of insulin growth factor-1 splice variants and structural genes in rabbit skeletal muscle induced by stretch and stimulation. J Physiol. 1999 Apr 15;516 (Pt 2):583-92.
- Yang SY, Goldspink G. Different roles of the IGF-I Ec peptide (MGF) and mature IGF-I in myoblast proliferation and differentiation. FEBS Lett. 2002 Jul 3;522(1-3):156-60. Erratum in: FEBS Lett. 2006 May 1;580(10):2530.
- Rudman D, Kutner MH, Rogers CM, Lubin MF, Fleming GA, Bain RP. Impaired growth hormone secretion in the adult population: relation to age and adiposity. J Clin Invest. 1981 May;67(5):1361-9.
- Corpas E, Harman SM, Blackman MR. Human growth hormone and human aging. Endocr Rev. 1993 Feb;14(1):20-39. Review.
- Veldhuis JD, Liem AY, South S, Weltman A, Weltman J, Clemmons DA, Abbott R, Mulligan T, Johnson ML, Pincus S, et al. Differential impact of age, sex steroid hormones, and obesity on basal versus pulsatile growth hormone secretion in men as assessed in an ultrasensitive chemiluminescence assay. J Clin Endocrinol Metab. 1995 Nov;80(11):3209-22.
- Veldhuis JD, Iranmanesh A, Weltman A. Elements in the pathophysiology of diminished growth hormone (GH) secretion in aging humans. Endocrine. 1997 Aug;7(1):41-8. Review.
- Iranmanesh A, Lizarralde G, Veldhuis JD. Age and relative adiposity are specific negative determinants of the frequency and amplitude of growth hormone (GH) secretory bursts and the half-life of endogenous GH in healthy men. J Clin Endocrinol Metab. 1991 Nov;73(5):1081-8
- Rudman D. Growth hormone, body composition, and aging. J Am Geriatr Soc. 1985 Nov;33(11):800-7. Review.
- Russell-Aulet M, Jaffe CA, Demott-Friberg R, Barkan AL. In vivo semiquantification of hypothalamic growth hormone-releasing hormone (GHRH) output in humans: evidence for relative GHRH deficiency in aging. J Clin Endocrinol Metab. 1999 Oct;84(10):3490-7.
- Martin FC, Yeo AL, Sonksen PH. Growth hormone secretion in the elderly: aging and the somatopause. Baillieres Clin Endocrinol Metab. 1997 Jul;11(2):223-50. Review.
- Chertman LS, Merriam GR, Kargi AY. Growth Hormone in Aging. [Updated 2015 May 4]. In: De Groot LJ, Chrousos G, Dungan K, et al., editors. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000-.
- Sattler FR. Growth hormone in the aging male. Best Pract Res Clin Endocrinol Metab. 2013 Aug;27(4):541-55.
- Duchaine D. Underground steroid handbook. 1. California: HLR Technical Books; 1983. p. 84
- Sonksen PH. Insulin, growth hormone and sport. J Endocrinol. 2001 Jul;170(1):13-25. Review.
- Macintyre JG. Growth hormone and athletes. Sports Med. 1987 Mar-Apr;4(2):129-42. Review.
- Erotokritou-Mulligan I, Holt RI, Sönksen PH. Growth hormone doping: a review. Open Access Journal of Sports Medicine. 2011;2:99-111.
- Liu H, Bravata DM, Olkin I, Friedlander A, Liu V, Roberts B, Bendavid E, Saynina O, Salpeter SR, Garber AM, Hoffman AR. Systematic review: the effects of growth hormone on athletic performance. Ann Intern Med. 2008 May 20;148(10):747-58. Epub 2008 Mar 17. Review.
- Birzniece V, Nelson AE, Ho KK. Growth hormone and physical performance. Trends Endocrinol Metab. 2011 May;22(5):171-8. Mar 17. Review.
- Baumann GP. Growth hormone doping in sports: a critical review of use and detection strategies. Endocr Rev. 2012 Apr;33(2):155-86. Epub 2012 Feb 24. Review.
- Gibney J, Healy ML, Sönksen PH. The growth hormone/insulin-like growth factor-I axis in exercise and sport. Endocr Rev. 2007 Oct;28(6):603-24. Epub 2007 Sep 4. Review.
- Holt RI, Sönksen PH. Growth hormone, IGF-I and insulin and their abuse in sport. Br J Pharmacol. 2008 Jun;154(3):542-56. Epub 2008 Mar 31. Review.
- Barroso O, Mazzoni I, Rabin O. Hormone abuse in sports: the antidoping perspective. Asian J Androl. 2008 May;10(3):391-402.
- Frystyk J. Exercise and the growth hormone-insulin-like growth factor axis. Med Sci Sports Exerc. 2010 Jan;42(1):58-66.
- Meinhardt U, Nelson AE, Hansen JL, Birzniece V, Clifford D, Leung KC, Graham K, Ho KK. The effects of growth hormone on body composition and physical performance in recreational athletes: a randomized trial. Ann Intern Med. 2010 May 4;152(9):568-77.
- Wallace JD, Cuneo RC, Baxter R, Orskov H, Keay N, Pentecost C, Dall R, Rosén T, Jørgensen JO, Cittadini A, Longobardi S, Sacca L, Christiansen JS, Bengtsson BA, Sönksen PH. Responses of the growth hormone (GH) and insulin-like growth factor axis to exercise, GH administration, and GH withdrawal in trained adult males: a potential test for GH abuse in sport. J Clin Endocrinol Metab. 1999 Oct;84(10):3591-601.
- Chikani V, Ho KK. Action of GH on skeletal muscle function: molecular and metabolic mechanisms. J Mol Endocrinol. 2013 Dec 19;52(1):R107-23.
- Lange KH, Larsson B, Flyvbjerg A, Dall R, Bennekou M, Rasmussen MH, Ørskov H, Kjaer M. Acute growth hormone administration causes exaggerated increases in plasma lactate and glycerol during moderate to high intensity bicycling in trained young men. J Clin Endocrinol Metab. 2002 Nov;87(11):4966-75.
- Berggren A, Ehrnborg C, Rosén T, Ellegård L, Bengtsson BA, Caidahl K. Short-term administration of supraphysiological recombinant human growth hormone (GH) does not increase maximum endurance exercise capacity in healthy, active young men and women with normal GH-insulin-like growth factor I axes. J Clin Endocrinol Metab. 2005 Jun;90(6):3268-73. Epub 2005 Mar 22.
- Irving BA, Patrie JT, Anderson SM, Watson-Winfield DD, Frick KI, Evans WS, Veldhuis JD, Weltman A. The effects of time following acute growth hormone administration on metabolic and power output measures during acute exercise. J Clin Endocrinol Metab. 2004 Sep;89(9):4298-305. Epub 2004 Aug 24.
- Graham MR, Baker JS, Evans P, Kicman A, Cowan D, Hullin D, Davies B. Evidence for a decrease in cardiovascular risk factors following recombinant growth hormone administration in abstinent anabolic-androgenic steroid users. Growth Horm IGF Res. 2007 Jun;17(3):201-9. Epub 2007 Feb 26.
- Brill KT, Weltman AL, Gentili A, Patrie JT, Fryburg DA, Hanks JB, Urban RJ, Veldhuis JD. Single and combined effects of growth hormone and testosterone administration on measures of body composition, physical performance, mood, sexual function, bone turnover, and muscle gene expression in healthy older men. J Clin Endocrinol Metab. 2002 Dec;87(12):5649-57.
- Blackman MR, Sorkin JD, Münzer T, Bellantoni MF, Busby-Whitehead J, Stevens TE, Jayme J, O’Connor KG, Christmas C, Tobin JD, Stewart KJ, Cottrell E, St Clair C, Pabst KM, Harman SM. Growth hormone and sex steroid administration in healthy aged women and men: a randomized controlled trial. JAMA. 2002 Nov 13;288(18):2282-92.
- Chikani V, Cuneo RC, Hickman I, Ho KK. Growth hormone (GH) enhances anaerobic capacity: impact on physical function and quality of life in adults with GH deficiency. Clin Endocrinol (Oxf). 2016 Oct;85(4):660-8.
- Saccà L, Cittadini A, Fazio S. Growth hormone and the heart. Endocr Rev. 1994 Oct;15(5):555-73. Review.
- Svensson J, Tivesten A, Isgaard J. Growth hormone and the cardiovascular function. Minerva Endocrinol. 2005 Mar;30(1):1-13. Review.
- Copeland KC, Nair KS. Recombinant human insulin-like growth factor-I increases forearm blood flow. J Clin Endocrinol Metab. 1994 Jul;79(1):230-2.
- Pete G, Hu Y, Walsh M, Sowers J, Dunbar JC. Insulin-like growth factor-I decreases mean blood pressure and selectively increases regional blood flow in normal rats. Proc Soc Exp Biol Med. 1996 Nov;213(2):187-92.
- Walsh MF, Barazi M, Pete G, Muniyappa R, Dunbar JC, Sowers JR. Insulin-like growth factor I diminishes in vivo and in vitro vascular contractility: role of vascular nitric oxide. Endocrinology. 1996 May;137(5):1798-803.
- Hermansen K, Bengtsen M, Kjær M, Vestergaard P, Jørgensen JOL. Impact of GH administration on athletic performance in healthy young adults: A systematic review and meta-analysis of placebo-controlled trials. Growth Horm IGF Res. 2017 Jun;34:38-44.