Introduzione alla Anabolico:Androgeno ratio
Chi segue il sito e legge con attenzione i miei lavori, si ricorderà certamente che l’argomento della Anabolico:Androgeno ratio era già stato toccato nell’articolo di analisi dettagliata sul Methenolone. Visto che la questione alzò una non indifferente reazione da parte degli “irriducibili” del “ribattere con banalità”, e che la lettura di certi validi testi in lingua inglese sembra per i più ostica, ho deciso di trattare con minuzia di dettagli questo tanto dibattuto argomento. Ovviamente, chi vive di convinzioni basate sul nulla difficilmente potrà accettare quanto mi accingerò a riportare. Per tutti gli altri sarà un altra occasione per imparare qualcosa di nuovo e potenzialmente utile.
Ma andiamo avanti…
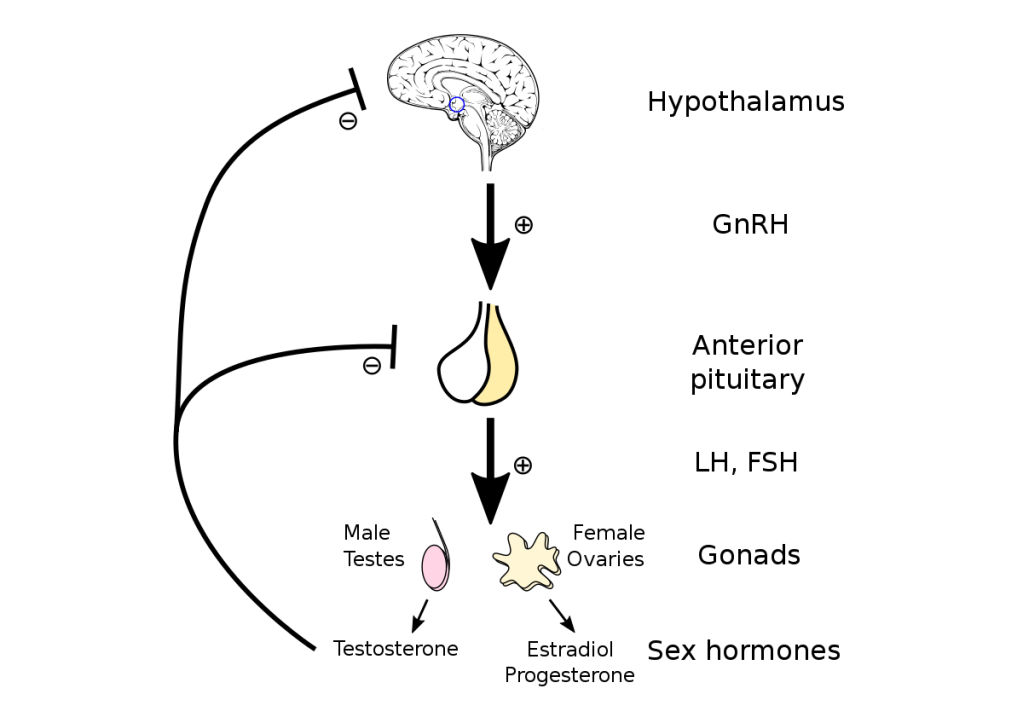
Tutti noi sappiamo che gli Steroidi Androgeni Anabolizzanti (AAS) hanno proprietà anaboliche e androgene, da cui il nome. In generale, per proprietà anaboliche si indica l’effetto di costruzione muscolare e l’effetto stimolante sulla densità minerale ossea (BMD). Gli altri effetti sono considerati effetti Androgeni, come l’impatto sulla ipertrofia prostatica, sullo stimolo del midollo osseo, sul cuore, sull’ipotalamo e sull’ipofisi, ecc. In generale, questi effetti sono considerati indesiderati. Ad esempio, una meta-analisi ha rilevato che un aumento dell’ematocrito (la % del volume di sangue occupato dagli eritrociti) è l’effetto avverso più frequente associato alla Terapia Sostitutiva del Testosterone (TRT).[1] Un altro problema degli androgeni è che sono in grado di indurre, in particolari circostanze, la crescita del cancro alla prostata. In quanto tale, una delle terapie utilizzate per il trattamento del cancro alla prostata è la terapia di deprivazione androgenica. Tuttavia, è importante notare che esiste un limite alla capacità degli androgeni di stimolare la crescita del cancro alla prostata. Ciò significa che, fino a una certa concentrazione, gli androgeni ne stimoleranno la crescita, ma al di sopra di essa avranno poco o nessun ulteriore effetto. Da qui sono nate alcune ipotesi tra le quali quella del “modello di saturazione dei recettori degli androgeni” [2], un modello dibattuto e tutt’altro che dimostrato. Comunque sia, questo effetto sulla riduzione dell’attività ipertrofica prostatica è in realtà qualcosa che sembra già avvenire a basse concentrazioni di Testosterone, nel intervallo basso classico del soggetto ipogonadico. Avremo comunque tempo di ritornare nuovamente su questo punto più tardi, quando parlerò di un rinomato test che viene utilizzato per valutare il rapporto tra potenza anabolica e androgena.
Lo scopo della Androgeno:Anabolico ratio è quello di fornire dati numerici al fine di dividere i diversi AAS in termini di potenza anabolica e androgena. Quindi, ad esempio, si potrebbe prendere il Testosterone come AAS di “paragone”, assegnandogli una Anabolico/Androgeno ratio di 100 e 100 (o solo 1). Quindi, attraverso alcuni esperimenti, viene determinato che un altro AAS ha un rapporto pari a 400:200 (o solo 2) Ciò implicherebbe che questo AAS è 4 volte più anabolico del Testosterone, pur essendo solo due volte più androgena.
Se le cose stessero in questo modo, allora, volendo ridurre al minimo il rischio di effetti collaterali androgeni, si potrebbe semplicemente scegliere un AAS con una Anabolico-Androgeno ratio molto favorevole e il problema non sussisterebbe. Tuttavia, ci sono così tanti problemi e variabili sia con il concetto stesso di Anabolico:Androgeno, ratio sia con il modo in cui esso è determinato sperimentalmente, che tutti questi rapporti che si trovano online o in letteratura sono praticamente inutili.
Il test di Hershberger
Un test molto comune utilizzato per determinare la Anabolico:Androgeno ratio è il cosiddetto test di Hershberger. Il test è stato descritto per la prima volta nel 1953 da Hershberger e dai suoi colleghi dell’Università del Wisconsin.[3] Come già accennato nell’articolo sul Methenolone, il test funziona come segue. Si prendono dei ratti e li si castra. La castrazione assicura che si abbia pochissimo Testosterone endogeno nell’animale e che ciò possa influenzare i risultati del test. Successivamente, si somministra l’AAS di cui si vuole conoscere il rapporto tra potenza anabolico e androgena all’animale. Successivamente si attende un po’ di tempo (8 giorni nel caso del originale test di Hershberger) e si procede con l’uccisione dei ratti trattati per sezionarli e pesarne il muscolo levator ani, la prostata ventrale e le vescicole seminali. L’aumento di peso de levator ani sarebbe quindi indicativo dell’attività anabolica dell’AAS, mentre quello della prostata ventrale e delle vescicole seminali sarebbe indicativo della sua attività androgena.
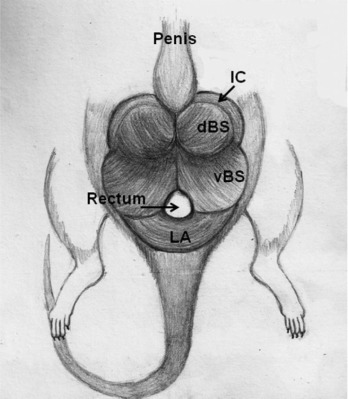
Anche se questo test può sembra un metodo ragionevolmente valido, in esso vi sono una serie di problemi. Un primo punto su cui vorrei soffermarmi riguarda il muscolo levator ani, che, appunto, è il muscolo bulbocavernoso dorsale.[4] È un muscolo che fa parte del sistema riproduttivo maschile e quindi non dovrebbe essere considerato in alcun modo rappresentativo del muscolo scheletrico. È un muscolo fortemente androgeno-dipendente e dopo la castrazione subisce un tasso di diminuzione del peso simile a quello dell’atrofia da denervazione nei muscoli scheletrici.[5] Proprio questa informazione da sola garantisce già che il lato anabolico dell'”equazione” sia imperfetto. Un altro problema è che il muscolo bulbocavernoso dorsale e le vescicole seminali rispondono in modo diverso a una diminuzione della concentrazione di AAS all’interno del range fisiologico.[6] Di conseguenza, il rapporto determinato sperimentalmente dipenderà dalla dose utilizzata e dal momento in cui vengono effettuate le misurazioni. Ciò è ben illustrato nella figura sottostante tratta da una pubblicazione di van der Vies.[6] Durante i primi 3 giorni, la concentrazione di AAS (Nandrolone in questo caso) è abbastanza alta da stimolare la crescita sia delle vescicole seminali che del muscolo bulbocavernoso dorsale. Tuttavia, dopo tre giorni la concentrazione non è abbastanza elevata da sostenere questa crescita per le vescicole seminali, che diminuiscono nuovamente di dimensioni. Tuttavia, il muscolo bulbocavernoso è ancora sufficientemente stimolato per continuare a crescere di dimensioni. Pertanto, se determinassi il rapporto anabolico/androgeno il giorno 3, esso sarebbe molto diverso rispetto al risultato che rileverei se la misurazione venisse fatta il giorno 7, nonostante sia utilizzato lo stesso composto.

Ciò evidenzia anche che i diversi organi rispondono semplicemente in modo diverso a seconda della concentrazione della molecola. E anche se ci fosse un modo accurato per determinare una anabolico:androgeno ratio, estrapolarlo oltre le concentrazioni fisiologiche sarebbe completamente errato.
Un altro difetto è l’ipotesi che la crescita della prostata ventrale o delle vescicole seminali sia rappresentativa di tutti gli altri effetti androgeni. Non ci sono mai state prove a sostegno di questa ipotesi. I tessuti androgeni variano molto in risposta l’uno dall’altro e non ci si deve assolutamente aspettare che un tessuto risponda nella stessa misura di un altro. In effetti, ricordate quanto menzionato nell’introduzione sulla prostata? Gli androgeni sembrano già smettere di stimolare ulteriormente la crescita della prostata oltre l’intervallo ipogonadico basso. Infatti, il volume della prostata rimane invariato quando a uomini sani vengono somministrati 600mg di Testosterone Enantato (pari a 432mg di Testosterone) settimanalmente per 20 settimane.[7] Eppure sappiamo per certo che altri effetti collaterali androgeni iniziano a comparire quando il dosaggio comincia ad essere elevato! Comunque, questo mette in luce anche la questione del concetto stesso di rapporto tra potenza anabolica e androgena. Un singolo rapporto non è mai in grado di catturare le risposte differenziali dei vari tessuti sensibili agli androgeni o la complessità della risposta androgena all’interno di un tessuto specifico, per essere di valore. Diversi tessuti rispondono in modo diverso ad un AAS, come sarà mai possibile rappresentarlo con un singolo numero?
Naturalmente, il test di Hershberger viene eseguito sui ratti, non sugli esseri umani. È un altro errore è quello di presumere che i tessuti omologhi nell’uomo rispondano allo stesso modo osservato in un ratto trattato con AAS. L’intero test di Hershberger è semplicemente pieno di falle, e nonostante ciò viene attualmente utilizzato per lo screening di potenziali Modulatori Selettivi del Recettore degli Androgeni (SARM). Ad esempio, GlaxoSmithKline ha valutato la selettività tissutale del proprio SARM GSK2881078 utilizzando il classico test di Hershberger.[8]

Test di affinità di legame relativo (RBA)
Mentre il test di Hershberger viene eseguito in un organismo vivente, i saggi di affinità di legame relativa (RBA) vengono eseguiti in una sorta di piastra di Petri. Viene quindi esaminata l’affinità di legame dei composti per il Recettore degli Androgeni (AR). In questo contesto, l’affinità di legame si riferisce alla forza con cui un AAS si lega all’AR. L’RBA mostra quindi quanto fortemente un AAS si lega all’AR rispetto ad un altro. O in altre parole: relativamente l’uno all’altro.
Il principio alla base è abbastanza semplice. Si prende un AAS di riferimento, comunemente il Methyltrienolone (R1811), e si misura la sua affinità di legame. Successivamente si misura l’affinità di legame di altri AAS e si esprimono i dati relativi all’AAS di riferimento. Quindi al Methyltrienolone viene assegnato un RBA di 1, essendo il composto di riferimento, e quindi se qualche altra molecola si lega con una potenza maggiore di due volte gli viene assegnato un RBA di 2. Allo stesso modo, se un’altra molecola si lega due volte più debolmente le viene assegnato un RBA di 0,5. Si potrebbero fare queste misurazioni in diversi tipi di cellule. Una che rappresenta il muscolo scheletrico e un altra che rappresenta in qualche modo i suoi effetti androgeni (ad esempio le cellule della prostata). Come tale, anche in questo caso si possono porre alcune delle stesse obiezioni del test Hershberger descritte sopra.
Ad ogni modo, l’immagine seguente raccoglie gli RBA di una selezione di AAS popolari misurati nei tessuti di ratto e coniglio.[9] Se dovessimo ottenere questi risultati, il Testosterone avrebbe un rapporto anabolico-androgeno più favorevole rispetto al Nandrolone. È un po’ l’opposto di quello che si osserva nei test di Hershberger. È anche un po’ sorprendente, dato che gli effetti androgeni del Testosterone sono amplificati nei tessuti che esprimono la 5α-reduttasi, a causa della conversione all’androgenicamente più potente DHT. Al contrario, l’azione androgena del Nandrolone è indebolita nei tessuti che esprimono questo enzima, a causa della conversione al meno potente androgeno Dihydronandrolone (DHN).[10]
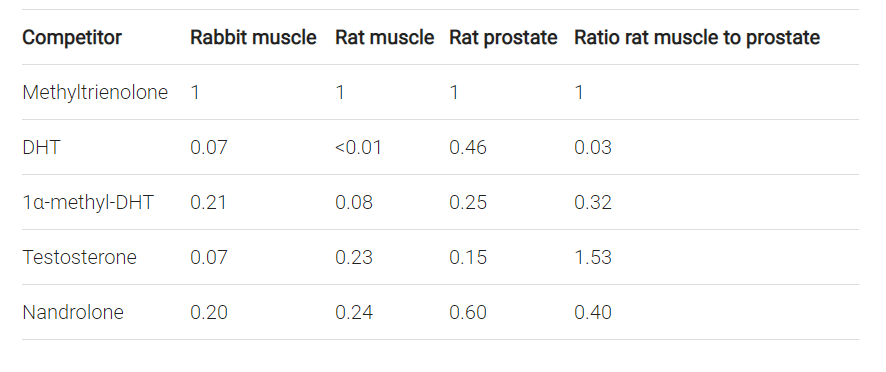
Un’altra cosa che questi dati rivelano in modo appropriato sono le differenze interspecie dei valori RBA. Nel muscolo di ratto, l’1α-methyl DHT si lega all’AR circa 3 volte più debolmente del Testosterone. Se si osservano i dati provenienti dall’analisi del muscolo di coniglio, fondamentalmente si vede un risultato contrario: 1α-methyl-DHT si lega con una forza all’incirca 3 volte maggiore all’AR come il Testosterone. L’estrapolazione da una specie animale a un’altra è (altamente) problematica, e quindi anche l’estrapolazione dal ratto, coniglio o qualsiasi altro animale, all’uomo.
Nel caso ti stia chiedendo perché il DHT dimostri un RBA così basso nel muscolo di coniglio e ratto, questo è probabilmente dovuto alla sua rapida degradazione nel tessuto muscolare. Il DHT costituisce un eccellente substrato per l’enzima 3α-HSD. Questo enzima lo scompone in 3α-androstanediolo, il quale si lega molto debolmente all’AR.[11] Questo accade anche negli esseri umani [12], e questo è uno dei motivi per cui non si vedono protocolli basati sull’uso di DHT.
Un ultimo punto che deve essere evidenziato è che l’affinità di legame non determina la potenza del AAS nel modulare anche l’espressione genica. Che è alla fine ciò che più interessa. Tuttavia, questo è possibilmente valutabile per via sperimentale. Si tratta del test del gene reporter responsivo agli androgeni (dosaggi biologici AR). Questi test biologici, per quanto ne so, sono stati inizialmente utilizzati per lo screening di nuovi androgeni di design nei campioni di urina per contrastare l’uso di doping. Un test biologico AR è essenzialmente in grado di dimostrare se un campione contiene qualcosa che riesce ad attivare il recettore degli androgeni e avviare la trascrizione genica. Per contrastare il doping, questo è molto utile. Dopotutto, puoi dimostrare che un campione di urina contiene qualcosa che attiva l’AR senza conoscere la struttura chimica del composto utilizzato.
Ad ogni modo, uno di questi test è stato sviluppato da un team di scienziati olandesi. [13] I ricercatori hanno utilizzato un test chiamato test biologico della LUciferasi attivata da sostanze chimiche reattive agli androgeni (AR CALUX). Hanno preso una linea cellulare di osteosarcoma umano e l’hanno co-trasfettata con l’AR umano e un gene reporter della luciferasi che è sotto il controllo trascrizionale degli elementi di risposta agli androgeni (ARE). Ciò significa che quando l’AR viene attivato, l’enzima luciferasi arriva all’espressione. Questo enzima produce bioluminescenza, o per dirla semplicemente: luce. E la luce può essere misurata. Quindi il grado di bioluminescenza è il grado in cui avviene l’attivazione del recettore degli androgeni.
I ricercatori hanno quindi proceduto a testare una varietà di AAS noti con il test biologico AR CALUX. Simile all’RBA, con esso si può calcolare la potenza relativa in termini di attivazione del recettore (REP). E non è solo stato fatto per l’AR, ma lo hanno fatto anche per il recettore del progesterone (PR), entrambe le isoforme del recettore degli estrogeni (ERα e ERβ) e il recettore dei glucocorticoidi (GR). Nella tabella seguente sono elencati gli REP di alcuni (popolari) AAS.
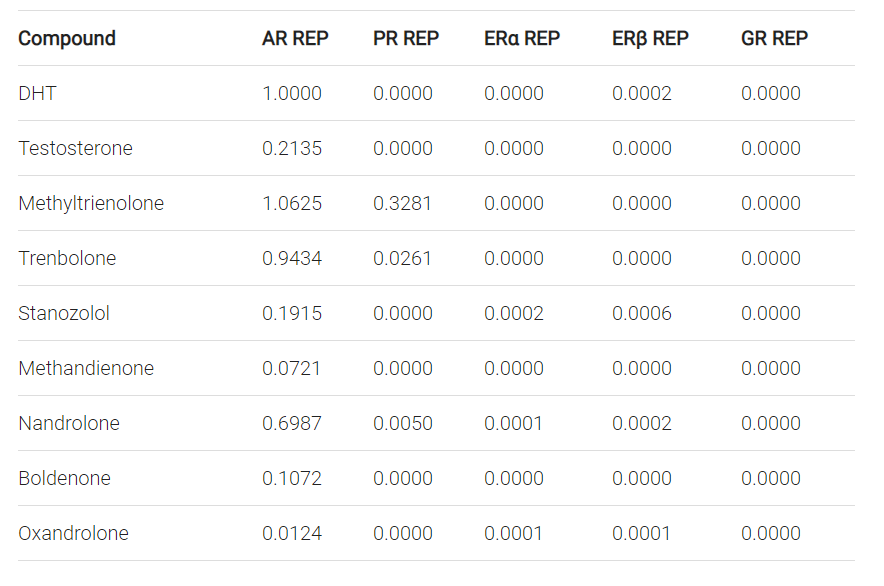
Permettetemi di evidenziare il REP del Testosterone e del DHT per l’AR. Il REP del Testosterone è circa 5 volte inferiore al REP del DHT. Cosa ci dice questo? Semplicemente che quel DHT non è stato degradato enzimaticamente nella linea cellulare che hanno usato come sarebbe successo nel mondo reale se si fosse legato al AR del muscolo scheletrico. Il metabolismo che di solito avviene nel muscolo scheletrico non sembra quindi avvenire in questa linea cellulare. Questo problema invalida i risultati di questo test biologico per quegli AAS che sono metabolizzati nel muscolo scheletrico, come il DHT, ma probabilmente anche il Methenolone (Primobolan). Un altro problema è che l’espressione genica è complessa (e dirlo è un eufemismo). L’AR regola un vasto numero di geni. Se due composti aumentano la trascrizione genica di un determinato gene in misura simile, non significa necessariamente che questi due composti modulino in modo comparabile la trascrizione genica di altri geni. Sicuramente non sarebbe sorprendente se ci fosse una correlazione in un modo o nell’altro, ma questi test biologici dipingono solo un quadro approssimativo. Anche se è probabile che questa immagine approssimativa sia più accurata di quella degli RBA. Tuttavia, fino ad oggi, i biotest AR non sono stati eseguiti in più linee cellulari di vari tessuti (sensibili agli androgeni) per fornirci “nuovi” rapporti tra il potenziale anabolico e androgeno.
Conclusioni
Sia il test di Hershberger che gli studi che valutano gli RBA dell’AAS in vari tessuti sono irrimediabilmente inaffidabili. Inoltre, il concetto di numero che cattura la complessità delle proprietà anabolizzanti e di quelle androgene dovrebbe essere abbandonato. Un singolo rapporto è semplicemente incapace di descrivere le risposte differenziali di vari tessuti agli androgeni, così come la complessità della risposta androgena all’interno di un tessuto specifico, per essere di valore. Forse sarebbe più appropriato un “profilo di attività” che descriva l’azione androgenica su base tissutale. Qualcosa di simile è stato proposto per descrivere come dovrebbe essere un SARM ideale per il trattamento di una condizione specifica. Tuttavia, è estremamente difficile quantificare l’azione androgena per tessuto, se non impossibile. Forse i biotest AR eseguiti su linee cellulari di tessuti di interesse potrebbero avere un valore clinico predittivo. Alla fine, dopo tutto, sono necessari studi clinici per dimostrare (il grado di) eventi avversi che si verificano con l’uso di un determinato composto.
Ovviamente, e lo dico per i tordi che affermano “e allora perchè con l’Oxandrolone gli effetti androgeni sono bassi come descritto dalla sua anabolico:androgeno ratio?” Bambino caro, l’Oxandrolone, come altri composti steroidei testati nel corso degli ultimi sessant’anni, hanno passato trial clinici dove gli effetti sono stati documentati anche nel caso di trattamento di donne in pre e post-menopausa. Ma non sono mai stati effettuati confronti di potenziale ed estrapolate ratio anabolico:androgeno. Semplicemente hanno osservato il miglioramento clinico dei pazienti trattati per svariate patologie e condizioni come, ad esempio, soggetti ustionati o gravemente sottopeso (vedi malati di HIV). Sono state effettuate biopsie, controlli della ritenzione d’azoto ma nessun test comparativo. Così facendo, puoi basarti sul grado di trofismo indotto dalla molecola e dal grado di espressione dei caratteri androgeni, ma, lo ribadisco, nessuna ratio di confronto!
Ricordate, inoltre, che per i soggetti sensibili l’espressione degli effetti androgeno-correlati avviene anche con le molecole con la ratio più bassa… Fatevene una ragione…

Gabriel Bellizzi
Riferimenti:
- Calof, Olga M., et al. “Adverse events associated with testosterone replacement in middle-aged and older men: a meta-analysis of randomized, placebo-controlled trials.” The Journals of Gerontology Series A: Biological Sciences and Medical Sciences 60.11 (2005): 1451-1457.
- Morgentaler, Abraham, and Abdulmaged M. Traish. “Shifting the paradigm of testosterone and prostate cancer: the saturation model and the limits of androgen-dependent growth.” European urology 55.2 (2009): 310-321.
- Hershberger, L. G., Elva G. Shipley, and Roland K. Meyer. “Myotrophic activity of 19-nortestosterone and other steroids determined by modified levator ani muscle method.” Proceedings of the Society for Experimental Biology and Medicine 83.1 (1953): 175-180.
- Hayes, Keith J. “The so-called ‘levator ani’ of the rat.” European Journal of Endocrinology 48.3 (1965): 337-347.
- Gori, Zina, C. Pellegrino, and Maria Pollera. “The castration atrophy of the dorsal bulbocavernosus muscle of rat: an electron microscopic study.” Experimental and molecular pathology 6.2 (1967): 172-198.
- Van der Vies, J. “Implications of basic pharmacology in the therapy with esters of nandrolone.” European Journal of Endocrinology 110.3_Suppla (1985): S38-S44.
- Bhasin, Shalender, et al. “Effect of testosterone supplementation with and without a dual 5α-reductase inhibitor on fat-free mass in men with suppressed testosterone production: a randomized controlled trial.” Jama 307.9 (2012): 931-939.
- Neil, David, et al. “GSK2881078, a SARM, produces dose-dependent increases in lean mass in healthy older men and women.” The Journal of Clinical Endocrinology & Metabolism 103.9 (2018): 3215-3224.
- Saartok, Tönu, Erik Dahlberg, and JAN-ÅKE GUSTAFSSON. “Relative binding affinity of anabolic-androgenic steroids: comparison of the binding to the androgen receptors in skeletal muscle and in prostate, as well as to sex hormone-binding globulin.” Endocrinology 114.6 (1984): 2100-2106.
- Bergink, E. W., et al. “Comparison of the receptor binding properties of nandrolone and testosterone under in vitro and in vivo conditions.” Journal of steroid biochemistry 22.6 (1985): 831-836.
- Jin, Yi, and Trevor M. Penning. “Steroid 5α-reductases and 3α-hydroxysteroid dehydrogenases: key enzymes in androgen metabolism.” Best Practice & Research Clinical Endocrinology & Metabolism 15.1 (2001): 79-94.
- Becker, H., et al. “In vivo uptake and metabolism of 3H-testosterone and 3H-5α-dihydrotestosterone by human benign prostatic hypertrophy.” European Journal of Endocrinology 71.3 (1972): 589-599.
- Houtman, Corine J., et al. “Detection of anabolic androgenic steroid abuse in doping control using mammalian reporter gene bioassays.” Analytica chimica acta 637.1-2 (2009): 247-258.