Nonostante siano stati scritti diversi articoli, e messi in rete altrettanti video, di una certa qualità e credibilità scientifica riguardanti il confronto tra regimi ipocalorici “Low Carb” e “Low Fat”, la confusione e il rifiuto della realtà oggettiva continuano a scatenare diatribe tra “discepoli della supercazzola” e ricercatori/divulgatori che, lasciandosi alle spalle vecchie convinzioni e bias, hanno approfondito avvalendosi della più accreditata letteratura scientifica.
Non sono di certo il tipo di divulgatore che riporta argomenti già trattati esaustivamente in altre sedi, odiando le ripetizioni, ma in questo caso ho intenzione di esporre l’argomento in modo sufficientemente dettagliato e tale da permettere al lettore di riflettere e arrivare con facilità ad accettare quanto la ricerca e la divulgazione seria ha riportato in questi ultimi anni.
Iniziamo con una serie di 24 studi randomizzati controllati (posizione centrale nella piramide delle evidenze scientifiche).
Dettagli: a 63 individui è stata assegnata casualmente una dieta “Low Fat” o una dieta “Low Carb”. Il gruppo “Low Fat” era in regime ipocalorico controllato mentre il gruppo “Low Carb” aveva una dieta a libitum . Questo studio è durato 12 mesi.
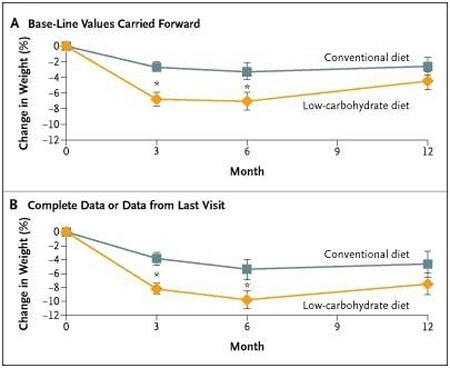
Perdita di peso e conclusioni : il gruppo “Low Carb” aveva perso più peso, il 7,3% del peso corporeo totale, rispetto al gruppo “Low Fat”, che ha perso il 4,5% del peso corporeo totale. La differenza era statisticamente significativa a 3 e 6 mesi, ma non a 12 mesi. La massiva perdita di acqua e glicogeno e l’effetto saziante di regimi con un buon apporto proteico potrebbe spiegare la maggior perdita di peso corporeo totale (e sottolineo “totale”; quindi non la massa grassa nello specifico). Il gruppo “Low Carb” ha avuto maggiori miglioramenti nei livelli ematici di Trigliceridi e di HDL, ma altri bio-marker erano simili tra i due gruppi.
Dettagli: a 132 soggetti con obesità grave (BMI medio di 43) e stata fatta seguire una dieta “Low Fat” ipocalorica o una dieta “Low Carb” a libitum. Molti dei soggetti presentavano sindrome metabolica o diabete di tipo II. La durata dello studio è stata di 6 mesi.
Perdita di peso e conclusioni: il gruppo che aveva seguito una dieta “Low Carb” ha perso in media 5,8 kg (12,8 libbre) mentre il gruppo che aveva seguito una dieta “Low Fat” ha perso una media di 1,9 kg (4,2 libbre). La differenza era statisticamente significativa ma i limiti dello studio sono i medesimi esposti per il precedente.
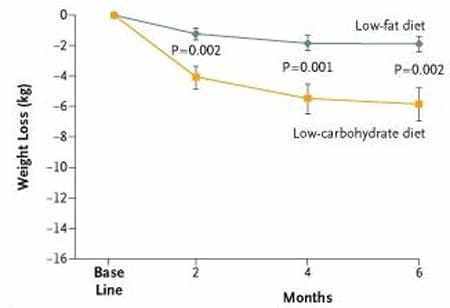
C’era anche una differenza statisticamente significativa in diversi biomarker:
- I trigliceridi sono diminuiti di 38mg/dL nel gruppo LC, rispetto ai 7mg/dL del gruppo LF.
- La sensibilità all’insulina è migliorata nel gruppo LC, ed è leggermente peggiorata con LF (probabile fattore determinato da una condizione patologica cronica o borderline del soggetto date le condizioni dei partecipanti all’esperimento).
- La glicemia a digiuno è scesa di 26mg/dL nel gruppo LC, e di 5mg/dL nel gruppo LF.
- I livelli di insulina sono diminuiti del 27% nel gruppo LC, ma sono leggermente aumentati nel gruppo LF (vedi specifiche di probabile causa precedentemente esposte).
Nel complesso, sembrerebbe che la dieta “Low Carb” ha avuto effetti significativamente più benefici sul peso e sui biomarker base della salute in questo gruppo di soggetti gravemente obesi.
Dettagli: 30 adolescenti in sovrappeso sono stati divisi in due gruppi, un gruppo ha seguito una dieta “Low Carb” mentre l’altro a seguito una dieta “Low Fat”. La durata dello studio è stata di 12 settimane. Nessuno dei due gruppi ha ricevuto indicazioni sulla quantità delle calorie giornaliere da consumare.

Perdita di peso e conclusioni: il gruppo LC ha perso 9,9 kg (21,8 libbre), mentre il gruppo LF ha perso 4,1 kg (9 libbre). La differenza nella perdita di peso era statisticamente significativa ma le variabili in gioco limitanti erano le medesime dei precedenti due studi con l’aggiunta del mancato controllo calorico del gruppo LF che, essendo composto da soggetti sovrappeso, quasi certamente con un certo grado di insulino resistenza a livello ipotalamico con la consequenziale alterazione del senso di fame, con tutta probabilità ha consumato una quota calorica maggiore del gruppo LC, avente un controllo maggiore sull’appetito per via della quota proteica e dei corpi chetonici.
Il gruppo LC ha mostrato una riduzioni significative di Trigliceridi e del Colesterolo Non-HDL. Il Colesterolo totale e LDL è diminuito solo nel gruppo LF.
Dettagli: 53 soggetti obesi (ma ancora “sani”) di sesso femminile sono stati divisi in due gruppi ognuno dei quali riceveva o una dieta “Low Carb” o una dieta “Low Fat”. Il gruppo “Low Fat” ha seguito un regime alimentare ipocalorico mentre il gruppo “Low Carb” mangiava a libitum. Lo studio ha avuto una durata di 6 mesi.
Perdita di peso e conclusioni: le donne del gruppo LC hanno perso in media 8,5kg (18,7 libbre), mentre il gruppo “LF” ha perso in media 3,9kg (8,6 libbre). Anche qui la differenza era statisticamente significativa ma, come per i precedenti studi, le variabili limitanti comuni (es. mancata stima delle quantità di cibo consumato dai soggetti del gruppo LF ecc) sono addizionate dal noto dimorfismo sessuale sul tasso di attività delle vie energetiche tra uomini e donne (queste ultime presentano una maggiore attività del metabolismo lipidico) .
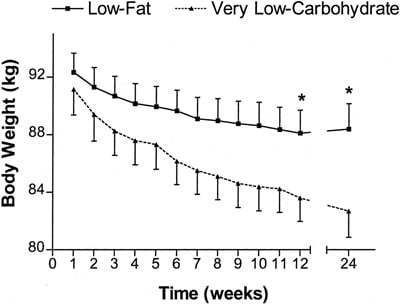
Il gruppo a LC ha mostrato una riduzioni significative dei Trigliceridi ematici. L’HDL è leggermente migliorato in entrambi i gruppi.
Dettagli: 60 soggetti in sovrappeso sono stati divisi in due gruppi, uno nel quale i soggetti seguivano una dieta “Low Carb” ricca di grassi monoinsaturi, e un altro nel quale i soggetti seguivano una dieta “Low Fat” basata sulle direttive del National Cholesterol Education Program (NCEP).
Entrambi i gruppi erano in regime ipocalorico e lo studio è durato 12 settimane.
Perdita di peso e conclusioni: il gruppo LC ha perso in media 6,2kg (13,6 libbre), mentre il gruppo LF ha perso 3,4 kg (7,5 libbre). La differenza era statisticamente significativa.
Ci sono stati anche diversi cambiamenti nei biomarker che vale la pena riportare:
- Il rapporto vita-fianchi è un marker per il grasso addominale. Questo marker è leggermente migliorato nel gruppo LC, ma non nel gruppo LF.
- Il colesterolo totale è migliorato in entrambi i gruppi.
- I Trigliceridi sono diminuiti di 42mg/dL nel gruppo LC, rispetto ai 15,3mg/dL nel gruppo LF.
- La dimensione delle particelle LDL è aumentata di 4,8 nm e la percentuale di VLDL è diminuita del 6,1% nel gruppo LC, mentre non vi era alcuna differenza significativa nel gruppo LF.
Nel complesso, il gruppo a basso contenuto di carboidrati ha perso più peso e ha avuto miglioramenti molto maggiori in diversi importanti fattori di rischio per le malattie cardiovascolari. Ricordiamoci però che parliamo di soggetti in sovrappeso e con una significativa insulino resistenza, tornerà utile per le conclusioni alla fine di questo articolo.
Dettagli: 120 soggetti in sovrappeso con dislipidemia sono stati divisi in due gruppi, uno seguiva una dieta “Low Carb” a libitum mentre l’altro seguiva una dieta “Low Fat” in regime ipocalorico. Lo studio è durato 24 settimane.
Perdita di peso e conclusioni: il gruppo LC ha perso una media di 9,4kg (20,7 libbre) del proprio peso corporeo totale (quindi non solo la massa grassa), rispetto ai 4,8kg (10,6 libbre) persi dal gruppo LF. Il gruppo LC ha avuto maggiori miglioramenti nei livelli dei Trigliceridi ematici e del Colesterolo HDL.
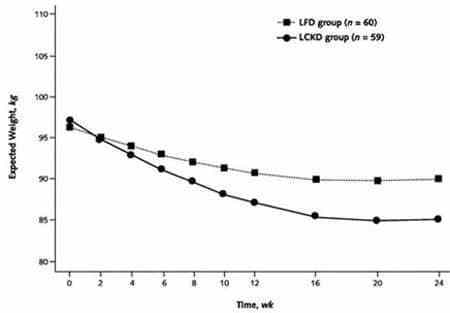
Le limitazioni di questo studio le abbiamo già viste in precedenza, quindi non è necessario dilungarsi oltre ed essere ripetitivi.
Dettagli: si tratta di uno studio in crossover randomizzato con 28 individui di ambo i sessi in sovrappeso/obesi. Lo studio è durato 30 giorni (per le donne) e 50 giorni (per gli uomini) per ogni regime dietetico, ovvero una dieta “Low Carb” e una dieta “Low Fat”. Entrambi i regimi alimentari erano ipocalorici.
Perdita di peso e conclusioni: gli autori riportano che il gruppo LC ha perso molto più peso, specialmente gli uomini. Ciò nonostante il fatto che alla fine abbiano mangiato più calorie rispetto al gruppo LF. I soggetti di sesso maschile che seguivano una dieta LC hanno perso tre volte più grasso addominale rispetto ai soggetti dello stesso sesso che seguivano una LF.

La variabile dei giorni di durata dell’esperimento per gli uomini e le donne e la poca cura di assicurare una adeguata quota proteica al gruppo LF (~20% Proteine/~25% Grassi/~55% Carboidrati contro il ~30% Proteine/~60% Grassi/~10% Carboidrati del gruppo LC), posso aver influito non poco sui risultati dell’esperimento. Inoltre, questo studio è stato supportato da una sovvenzione della Fondazione Dr. Robert C. Atkins, New York, NY.
Dettagli: a 40 soggetti in sovrappeso è stata assegnata per 10 settimane o una dieta “Low Carb” o una dieta “Low Fat”. Le calorie erano uguali in entrambi i gruppi.
Perdita di peso e conclusioni : il gruppo LC ha perso 7,0 kg (15,4 libbre) mentre il gruppo LF ha perso 6,8 kg (14,9 libbre). La differenza non era statisticamente significativa dal momento che entrambi i gruppi hanno perso una quantità simile di peso.
Alcune altre notevoli differenze nei biomarker:
- La pressione sanguigna è diminuita in entrambi i gruppi, sia sistolica che diastolica.
- Il colesterolo totale e LDL è diminuito solo nel gruppo LF.
- I Trigliceridi sono diminuiti in entrambi i gruppi.
- Il colesterolo HDL è aumentato nel gruppo LC, ma è diminuito nel gruppo LF.
- La glicemia è diminuita in entrambi i gruppi, ma solo il gruppo LC ha mostrato una riduzione dei livelli di Insulina, indicando una migliore sensibilità all’insulina.
9° Studio: Nickols-Richardson SM, et al. Perceived hunger is lower and weight loss is greater in overweight premenopausal women consuming a low-carbohydrate/high-protein vs high-carbohydrate/low-fat diet. Journal of the American Dietetic Association, 2005.
Dettagli: 28 donne in premenopausa e in sovrappeso hanno seguito una dieta “Low Carb” o “Low Fat” per 6 settimane. Il gruppo “Low Fat” seguiva un regime ipocalorico mentre il gruppo “Low Carb” mangiava a libitum.
Perdita di peso e conclusioni: le donne nel gruppo LC hanno perso 6,4 kg (14,1 libbre) rispetto al gruppo LF che ha perso 4,2 kg (9,3 libbre). I risultati sono stati statisticamente significativi ma i limiti di questo tipo di modalità comparativa sono già stati esposti in precedenza (caratteristiche metaboliche degli individui di sesso femminile, condizione base di insulino resistenza, effetto saziante dato da un buon quantitativo di proteine ecc…). Gli stessi autori riportano che le donne sottoposte ad una dieta LC presentavano una riduzione del senso di fame rispetto ai soggetti del gruppo LF.
10° Studio: Daly ME, et al. Short-term effects of severe dietary carbohydrate-restriction advice in Type 2 diabetes. Diabetic Medicine, 2006.
Dettagli: a 102 pazienti con diabete di tipo 2 è stata data da seguire una dieta “Low Carb” o una dieta “Low Fat” per 3 mesi. Al gruppo “Low Fat” sono state date indicazioni al fine di ridurre le dimensioni delle porzioni di cibo da consumare mentre i soggetti del gruppo “Low Carb” non erano sottoposti a limitazioni.
Perdita di peso e conclusioni: il gruppo LC ha perso 3,55 kg (7,8 libbre), mentre il gruppo LF ha perso solo 0,92 kg (2 libbre). La differenza era statisticamente significativa ma anche qui i limiti sono evidenti e aggiuntivi di altri già precedentemente visti (vedi, appunto, generiche indicazioni sulle dimensioni delle porzioni di cibo da consumare a soggetti fortemente insulino resistenti e con un controllo dell’appetito non ottimale).
Si noti comunque che il gruppo LC ha avuto maggiori miglioramenti nel rapporto colesterolo totale / HDL. Non c’era differenza nei Trigliceridi, nella pressione sanguigna o nell’HbA1c (emoglobina glicata A1c) tra i gruppi.
11° Studio: McClernon FJ, et al. The effects of a low-carbohydrate ketogenic diet and a low-fat diet on mood, hunger, and other self-reported symptoms.Trusted Source Obesity (Silver Spring), 2007.
Dettagli: a 119 individui in sovrappeso è stata assegnata una dieta “Low Carb” (Chetogenica) a libitum o una dieta “Low Fat” in restrizione calorica per 6 mesi.
Perdita di peso e conclusioni: il gruppo LC ha perso 12,9 kg (28,4 libbre), mentre il gruppo LF ha perso solo 6,7 kg (14,7 libbre). Il gruppo LC ha perso quasi il doppio del peso e ha visto ridursi il senso di fame. I limiti di questo studio sono già stati esposti per altri studi similari esposti in precedenza.
12° Studio: Gardner CD, et al. Comparison of the Atkins, Zone, Ornish, and LEARN diets for change in weight and related risk factors among overweight premenopausal women: the A TO Z Weight Loss Study.Trusted Source The Journal of The American Medical Association, 2007.
Dettagli: 311 donne in premenopausa sovrappeso/obese sono state divise in quattro gruppi e sottoposte a quattro differenti regimi alimentari:
- Dieta Atkins a basso contenuto di carboidrati;
- Dieta Ornish vegetariana a basso contenuto di grassi;
- Dieta a Zona;
- Dieta LEARN.
I regimi alimentari Zona e LEARN erano ipocalorici.

Perdita di peso e conclusioni: il gruppo Atkins ha perso la maggior parte del peso a 12 mesi (4,7 kg – 10,3 libbre) rispetto a gruppo Ornish (2,2 kg – 4,9 libbre), Zona (1,6 kg – 3,5 libbre) e LEARN (2,6 kg – 5,7 libbre). Tuttavia, la differenza non era statisticamente significativa a 12 mesi. Il gruppo Atkins ha quindi perso più peso, anche se la differenza non era statisticamente significativa. Il gruppo Atkins ha avuto anche i maggiori miglioramenti nella pressione sanguigna, nei Trigliceridi e nell’HDL. I gruppi LEARN e Ornish (a basso contenuto di grassi) hanno mostrato una riduzione dell’LDL a 2 mesi, ma gli effetti sono diminuiti con il tempo.
13° Studio: Halyburton AK, et al. Low- and high-carbohydrate weight-loss diets have similar effects on mood but not cognitive performance.Trusted Source American Journal of Clinical Nutrition, 2007.
Dettagli: 93 individui sovrappeso/obesi sono stati divisi in due gruppi e sottoposti o ad una dieta “Low Carb and High Fat” o ad una dieta “Low Fat and High Carb” per 8 settimane. Entrambi i gruppi erano in regime ipocalorico.

Perdita di peso e conclusioni: il gruppo LCHF ha perso 7,8 kg (17,2 libbre), mentre il gruppo HCLF ha perso 6,4 kg (14,1 libbre). La differenza nella perdita di peso (1,4Kg) non risulta così significativa valutando le variabili in gioco le quali sono già state esposte per i precedenti studi. Entrambi i gruppi hanno avuto miglioramenti simili nell’umore, ma la velocità di elaborazione (una misura delle prestazioni cognitive) è migliorata ulteriormente nella dieta a basso contenuto di grassi.
14° Studio: Dyson PA, et al. A low-carbohydrate diet is more effective in reducing body weight than healthy eating in both diabetic and non-diabetic subjects. Diabetic Medicine, 2007.
Dettagli: 13 diabetici e 13 non diabetici sono stati sottoposti o ad una dieta “Low Carb” o ad una dieta “Low Fat” che seguiva le raccomandazioni del Diabetes UK (una dieta ipocalorica a basso contenuto di grassi). Lo studio è durato 3 mesi.

Perdita di peso e conclusioni: il gruppo LC ha perso 6,9 kg (15,2 libbre), rispetto ai 2,1 kg (4,6 libbre) del gruppo LF. Non c’era differenza in nessun altro marker tra i gruppi. Stesse limitazioni derivanti dal mancato rapporto calorico tra i gruppi e dalle condizioni variabili dei partecipanti.
15° Studio: Westman EC, et al. The effect of a low-carbohydrate, ketogenic diet versus a low-glycemic index diet on glycemic control in type 2 diabetes mellitus.Trusted Source Nutrion & Metabolism (London), 2008.
Dettagli: 84 soggetti obesi e diabetici di tipo 2 sono stati sottoposti ad una dieta “Low Carb” (Chetogenica) o a una dieta ipocalorica “Low glycemic index”. Lo studio è durato 24 settimane.
Perdita di peso e conclusioni: il gruppo LCK ha perso 11,1kg (24,4 libbre) rispetto al gruppo LGI 6,9 kg (15,2 libbre).
Tra i due gruppi sono emerse altre differenze:
- L’emoglobina A1c è diminuita dell’1,5% nel gruppo LC, rispetto allo 0,5% nel gruppo LGI.
- Il colesterolo HDL è aumentato solo nel gruppo LC, di 5,6 mg / dL.
- I farmaci per il diabete sono stati ridotti o eliminati nel 95,2% dei soggetti del gruppo LC, rispetto al 62% del gruppo LGI.
- Molti altri indicatori della salute come la pressione sanguigna e i Trigliceridi sono migliorati in entrambi i gruppi, ma la differenza tra i gruppi non era statisticamente significativa.
16° Studio: Shai I, et al. Weight loss with a low-carbohydrate, Mediterranean, or low-fat diet. New England Journal of Medicine, 2008.
Dettagli: 322 individui obesi sono stati sottoposti a tre differenti regimi alimentari:
- Dieta “Low Carb”
- Dieta ipocalorica “Low Fat”
- Dieta Mediterranea ipocalorica.
Lo studio è durato 2 anni.
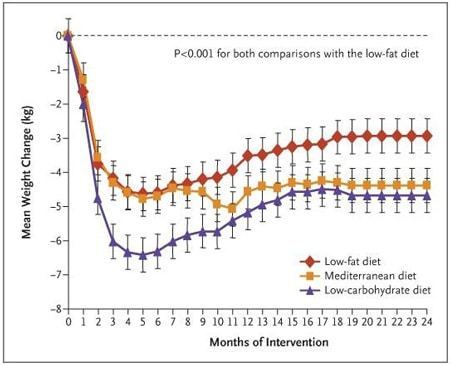
Perdita di peso e conclusioni: il gruppo LC ha perso 4,7kg (10,4 libbre), il gruppo LF ha perso 2,9kg (6,4 libbre) e il gruppo “Dieta Mediterranea” ha perso 4,4kg (9,7 libbre). Differenze significative sulla perdita del peso si sono avute solamente tra il gruppo LC e il gruppo LF (vedi variabili di risposta dei soggetti obesi, e insulino resistenti, già esposta in precedenza). I miglioramenti del gruppo LC hanno interessato anche il Colesterolo HDL e i Trigliceridi.
17° Studio: Keogh JB, et al. Effects of weight loss from a very-low-carbohydrate diet on endothelial function and markers of cardiovascular disease risk in subjects with abdominal obesity.Trusted Source American Journal of Clinical Nutrition, 2008.
Dettagli: 107 soggetti con obesità addominale sono stati sottoposti o ad una dieta “Low Carb” o ad una dieta “Low Fat”. Entrambi i gruppi erano ipocalorici e lo studio è durato 8 settimane.
Perdita di peso e conclusioni: il gruppo LC ha perso il 7,9% del peso corporeo (nota bene, peso corporeo non solo grasso), rispetto al gruppo LF che ha perso il 6,5% del peso corporeo. Il gruppo LC ha perso un po’ più di peso ma non vi era alcuna differenza tra i gruppi sulla dilatazione flusso-mediata o qualsiasi altro indicatore della funzione dell’endotelio (rivestimento dei vasi sanguigni). Non vi era inoltre alcuna differenza nei fattori di rischio comuni tra i gruppi.
18° Studio: Tay J, et al. Metabolic effects of weight loss on a very-low-carbohydrate diet compared with an isocaloric high-carbohydrate diet in abdominally obese subjects. Journal of The American College of Cardiology, 2008.
Dettagli: 88 soggetti con obesità addominale sono stati sottoposti ad una dieta “Low Carb” o ad una dieta “Low Fat” per 24 settimane. Entrambi i regimi alimentari erano ipocalorici.
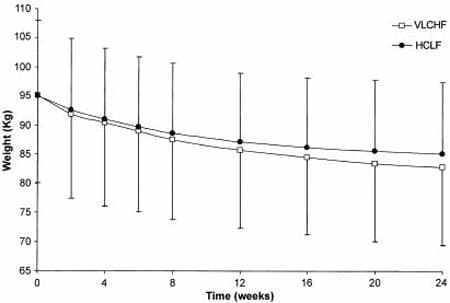
Perdita di peso e conclusioni: il gruppo LC ha perso in media 11,9kg (26,2 libbre), mentre il gruppo LF ha perso 10,1 kg (22,3 libbre). La differenza non era statisticamente significativa. Trigliceridi, HDL, proteina C-reattiva, insulina, sensibilità all’insulina e pressione sanguigna sono migliorati in entrambi i gruppi. Il Colesterolo totale e LDL è migliorato solo nel gruppo LF.
19° Studio: Volek JS, et al. Carbohydrate restriction has a more favorable impact on the metabolic syndrome than a low fat diet. Lipids, 2009.
Dettagli: 40 soggetti con elevati fattori di rischio per malattie cardiovascolari sono stati sottoposti a una dieta “Low Carb” o ad una dieta “Low Fat” per 12 settimane. Entrambi i gruppi seguivano regimi ipocalorici.
Perdita di peso e conclusioni: il gruppo LC ha perso 10,1kg (22,3), mentre il gruppo a basso contenuto di grassi ha perso 5,2kg (11,5 libbre). Strano a dirsi, il gruppo LC ha perso quasi il doppio della quantità di peso rispetto al gruppo LF, nonostante entrambi i gruppi abbiano consumato la stessa quantità di calorie. Peccato però che le variabili di risposta indotte dalle condizioni non in fisiologia dei soggetti presi in esame ci spiega in gran parte il perché del risultato ottenuto, senza contare le variabili come la quota proteica.
Questo studio può essere comunque particolarmente interessante dal momento che si è abbinato l’introito calorico dei gruppi e si sono misurati i cosiddetti marker lipidici “avanzati”. Vale la pena notare diverse cose:
- I Trigliceridi sono diminuiti di 107mg/dL nel gruppo LC, e di 36mg/dL nel gruppo LF.
- Il Colesterolo HDL è aumentato di 4mg/dL nel gruppo LC, ed è diminuito di 1mg/dL nel gruppo LF.
- Apolipoprotein B è sceso di 11 punti su LC, ma solo 2 punti su LF.
- La dimensione delle LDL è aumentata nel gruppo LC, ma è rimasta invariata nel gruppo LF.
- Con la dieta LC, le particelle VLDL sono diminuite mentre, in piccola parte, sono aumentate nel gruppo LF.
20° Studio: Brinkworth GD, et al. Long-term effects of a very-low-carbohydrate weight loss diet compared with an isocaloric low-fat diet after 12 months.Trusted Source American Journal of Clinical Nutrition, 2009.
Dettagli: 118 persone con obesità addominale sono state sottoposte ad una dieta “Low Carb” o ad una dieta “Low Fat” per 1 anno. Entrambe le diete erano ipocaloriche.

Perdita di peso e conclusioni: il gruppo LC ha perso 14,5kg (32 libbre), mentre il gruppo LF ha perso 11,5kg (25,3 libbre) ma la differenza non era statisticamente significativa. Il gruppo LC ha avuto maggiori riduzioni dei Trigliceridi e maggiori aumenti del Colesterolo HDL e LDL, rispetto al gruppo LF.
21° Studio: Hernandez, et al. Lack of suppression of circulating free fatty acids and hypercholesterolemia during weight loss on a high-fat, low-carbohydrate diet.Trusted Source American Journal of Clinical Nutrition, 2010.
Dettagli: 32 adulti obesi sono stati sottoposti ad una dieta “Low Carb” o “Low Fat” ipocalorica per 6 settimane.
Perdita di peso e conclusioni: il gruppo LC ha perso 6,2 kg (13,7 libbre) mentre il gruppo LF ha perso 6,0 kg (13,2 libbre). La differenza non era statisticamente significativa. Il gruppo LC ha mostrato una maggiore riduzione dei Trigliceridi (43,6 mg / dL) rispetto al gruppo LF (26,9 mg / dL). Sia LDL che HDL sono diminuiti solo nel gruppo LF.
22° Studio: Krebs NF, et al. Efficacy and safety of a high protein, low carbohydrate diet for weight loss in severely obese adolescents.Trusted Source Journal of Pediatrics, 2010.
Dettagli: 46 adolescenti gravemente obesi sono stati sottoposti ad una dieta “Low Carb” o “Low Fat” per 36 settimane. Il gruppo “Low Fat” era in regime ipocalorico mentre il gruppo “Low Carb” mangiava a libitum.

Perdita di peso e conclusioni: il gruppo LC ha perso più peso e ha avuto una maggiore riduzione del BMI rispetto al gruppo LF. Vari biomarker sono migliorati in entrambi i gruppi, ma non vi è stata alcuna differenza significativa tra i gruppi.
23° Studio: Guldbrand, et al. In type 2 diabetes, randomization to advice to follow a low-carbohydrate diet transiently improves glycaemic control compared with advice to follow a low-fat diet producing a similar weight loss. Diabetologia, 2012.
Dettagli: 61 soggetti con diabete di tipo 2 sono stati sottoposti ad una dieta “Low Carb” o “Low Fat” per 2 anni. Entrambe i regimi alimentari erano ipocalorici.
Perdita di peso e conclusioni: il gruppo LC ha perso 3,1kg (6,8 libbre), mentre il gruppo LF ha perso 3,6kg (7,9 libbre). La differenza non era statisticamente significativa. Oltre alla perdita di peso non vi è stata nei fattori di rischio comuni tra i gruppi. Vi è stato un significativo miglioramento del controllo glicemico a 6 mesi per il gruppo LC, ma la compliance era scarsa e gli effetti diminuivano a 24 mesi poiché gli individui avevano aumentato l’assunzione di carboidrati.
24° Studio: Effects of Short-Term Carbohydrate Restrictive and Conventional Hypoenergetic Diets and Resistance Training on Strength Gains and Muscle Thickness. Claudia M. Meirelles, Paulo S.C. Gomes. ©Journal of Sports Science and Medicine (2016 )15 ,578 – 584.
Dettagli: 21 soggetti con un BMI superiore a 25 sono stati divisi in due gruppi ognuno dei quali seguiva o una dieta “Low Carb” o una dieta dimagrante tradizionale (15% proteine, 30% grassi, 55% carboidrati) per un periodo di 8 settimane. Tutti i partecipanti avevano almeno 3 mesi di esperienza nella pratica di allenamenti contro resistenza e hanno svolto sedute allenanti con i pesi durante l’esperimento. Per le prime quattro settimane dell’esperimento il gruppo LC ha consumato 30g di carboidrati al giorno, dopo di che è stato permesso ai soggetti di questo gruppo di aumentare l’apporto di carboidrati ogni settimana di 10g. I soggetti di questo gruppo non hanno contato le calorie. I soggetti del gruppo “dieta dimagrante tradizionale” hanno ridotto la loro assunzione calorica del 30% rispetto al loro fabbisogno giornaliero.
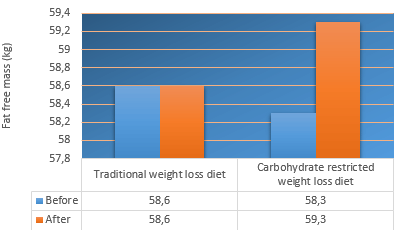


Perdita di peso e conclusioni: Il gruppo LC ha guadagnato 1Kg di massa magra; la massa magra del gruppo “dieta dimagrante tradizionale” è rimasta stabile. Tuttavia, le differenze tra i gruppi non erano statisticamente significative. La percentuale di grasso e la circonferenza della vita sono diminuite in misura similare in entrambi i gruppi. Entrambi i gruppi hanno compiuto all’incirca gli stessi progressi nelle prestazioni durante gli allenamenti contro resistenza nel corso dell’esperimento. Nella figura seguente si può notare come i partecipanti del gruppo “dieta dimagrante tradizionale” sono riusciti ad ottenere progressi leggermente migliori rispetto al gruppo LC, ma le differenze tra i gruppi non sono statisticamente significative.

La quantità ridotta di proteine del gruppo “dieta dimagrante tradizionale” e la mancata supervisione calorica del gruppo LC sono sicuramente fattori limitanti per questo studio.
Quali conclusioni trarre dagli studi riportati?
Il grafico qui di seguito mostra la differenza nella perdita di peso tra 23 degli studi riportati. 21 dei 23 studi hanno riportato il peso perso:
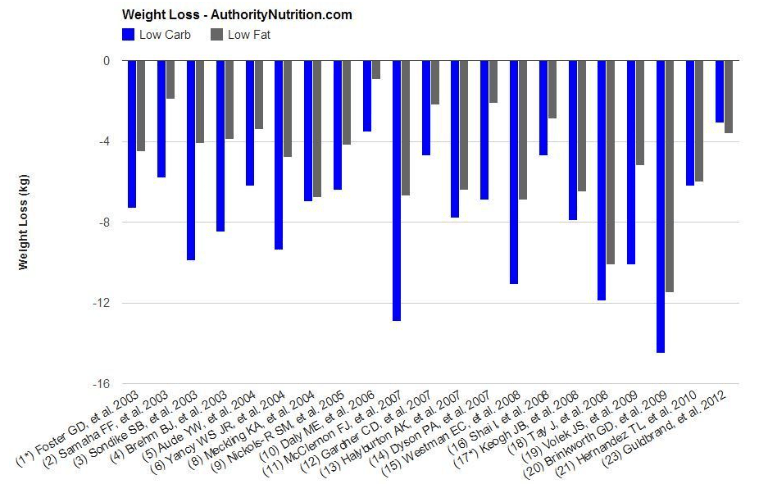
Se ci limitassimo a valutare i risultati degli studi solo sul fattore della perdita di peso, senz’altro noteremmo che la maggior parte degli studi ha riportato differenze statisticamente significative nella perdita di peso sempre a favore dei regimi “Low Carb”. Ma, come già accennato in precedenza, vi sono diverse limitazioni per buona parte degli studi e che vale la pena notare:
- I gruppi LC che hanno mostrato una perdita di peso statisticamente significativa erano accumunati dalla mancanza di conteggio calorico per il gruppo in questione, mancata considerazione dello stato metabolico dei soggetti trattati e variabili di sesso tra i medesimi. In definitiva, leggere che il gruppo LC, non sottoposto a restrizione calorica volontaria ma soggetto all’effetto anoressizzante dato da una dieta ricca in proteine, tanto per fare un esempio, ha perso 2-3 volte più peso del gruppo LF non c’è da gridare al “miracolo alimentare”.
- Quando sia il gruppo LC che il gruppo LF venivano sottoposti ad una restrizione calorica la risultante, tranne in tre casi (vedi studio numero5, 7 supportato da una sovvenzione della Fondazione Dr. Robert C. Atkins, New York, NY e 19) era una differenza statisticamente non significativa nella perdita di peso.
- L’iniziale e repentina perdita di peso che si è osservata in molti studi, riscontrate nei gruppi LC, è ovviamente da attribuirsi ad una considerevole perdita di liquidi e glicogeno, una risposta “classica” in questi regimi alimentari. E’ da notare anche che molti dei soggetti che hanno sperimentato questo effetto nel lungo periodo avevano la tendenza a riguadagnare il peso perso e ad abbandonare la dieta.
- Quando i ricercatori hanno esaminato direttamente il grasso viscerale, le diete LC mostravano un chiaro vantaggio. Ma, però, si tratta di un vantaggio dipendente dalla condizione dei soggetti trattati. Infatti, il grasso viscerale risulta correlato in misura significativa all’insulino–resistenza, condizione che caratterizzava i soggetti sovrappeso/obesi presi in esame. Una volta migliorato il parametro suddetto per via della iniziale riduzione glucidica la riduzione del grasso viscerale è risultata maggiore. Tale risposta non sembra esserci stata nei soggetti dei gruppi LF perché, sebbene in ipocalorica, presentavano difficoltà nel migliorare il metabolismo glucidico e con sequenzialmente lo stato di insulino resistenza.
- Il fattore proteico è stato determinante nei risultati dei diversi studi. Gli effetti sulla soppressione dell’appetito durante la dieta ha portato ad una riduzione involontaria dell’apporto calorico. Inoltre, gli studi nei quali entrambi i gruppi avevano il monte calorico ristretto ma presentavano differenze significative nella perdita di peso a favore del regime LC, avevano come costante una quota proteica bassa nel gruppo LF.
- Il 3° e il 10° studio hanno un fattore in più che li rende del tutto forvianti al fine di farsi un idea concreta sulla questione della risposta ai due regimi alimentari. Mentre il 10° studio dava indicazioni piuttosto grossolane sulle porzioni da consumare da parte dei soggetti del gruppo LF, nel 3° studio i partecipanti di questo gruppo non erano soggetti a limitazioni caloriche! Non è difficile giungere alla conclusione che soggetti sovrappeso/obesi, con un certo grado di insulino resistenza sistemica e ipotalamica, quindi con un controllo della fame non ottimale, sottoposti ad un regime alimentare con una quota considerevole di carboidrati, possano aver ecceduto con le calorie piuttosto facilmente rispetto ai soggetti del gruppo LC che avevano il non trascurabile vantaggio di godere dell’effetto saziante delle proteine, fattore che gli induceva a consumare meno calorie.
- Le risposte nei marker lipidici sono state nell’insieme contenute e per lo più non così distanti a livello statistico. Le variazioni positive dei lipidi ematici sono primariamente dipendenti da una restrizione calorica, indipendentemente dalla percentuale dei macronutrienti, fatta eccezione per soggetti con condizioni di insulino resistenza marcata o in regimi alimentari cronicamente bassi in grassi e/o con poca cura della qualità di questi; in questo caso le modifiche potrebbero non essere soddisfacenti se il soggetto segue regimi dietetici “High Carb” ipocalorici.
- Per ricollegarci al concetto prima esposto sulla variabile di risposta ad un regime alimentare a seconda delle condizioni del soggetto (sovrappeso/obeso ecc…), basti notare che nei non diabetici, i livelli glicemici e insulinici sono migliorati sia seguendo diete LC che LF, con una differenze tra i gruppi generalmente piccola.
- Nell’ultimo studio riportato, è emerso un vantaggio prestativo nei soggetti alimentati con una dieta per dimagrire tradizionale rispetto al gruppo LC, sebbene le differenze non sono statisticamente significative.
- La pressione arteriosa ha subito riduzioni comparabili in entrambi i gruppi.
- Un problema comune negli studi sulla perdita di peso è che molte persone abbandonano la dieta e lo studio prima che questo sia completato. Facendo una analisi della percentuale di persone che hanno raggiunto la fine dello studio in ciascun gruppo emerge che in 19 di 23 studi la percentuale media di persone che sono arrivate alla fine di questi sono:
– Media per i gruppi a basso contenuto di carboidrati: 79,51%
-Media per i gruppi a basso contenuto di grassi: 77,72%
Non è una grande differenza, ma sembra chiaro da questi risultati che la sostenibilità di regimi “Low Carb” da parte di persone in sovrappeso/obese è maggiore rispetto a regimi “Low Fat”. Non sottovalutiamo l’impatto psicologico derivante dal seguire un regime alimentare privo di limitazioni caloriche ma che, per via dei fattori intrinseci nei regimi LC, porta l’individuo comunque a consumare una quantità di calorie ridotte rispetto al mantenimento. Al contrario, nelle diete LF con limitazioni caloriche imposte si richiede alle persone di pesare il proprio cibo e contare le calorie, e a ciò si aggiunge la possibile difficoltà a resistere al regime alimentare per via della regolazione della fame non funzionale. Questo può essere un semplice vantaggio iniziale e temporaneo, ma non determina di certo un vantaggio universale dei regimi LC.
Come già accennato all’inizio dell’articolo, tutti questi studi sono studi randomizzati controllati, il che significa che hanno una certa autorevolezza scientifica. Ma, nonostante ciò e il fatto che tutti sono stati pubblicati in riviste mediche rispettabili e sottoposte a revisione paritaria, i limiti per una loro esaustiva e onesta valutazione non mancano, come si è potuto appurare.

Ancora confusi? Bene! Per mettere a tacere gli ultimi dubbi sull’argomento, comprese le critiche dei “soliti haters “ all’esposizione degli studi sopra citati, ci viene in aiuto una autorevole meta-analisi, pubblicata nel febbraio 2017 su Gastroenterology (1), che ha analizzato diversi studi, tutti realizzati controllando in maniera precisa le calorie consumate e la selezione degli alimenti, in modo da garantire un identico apporto calorico ma con differente contenuto in carboidrati e grassi e un apporto costante di proteine: in questo modo è stato possibile confrontare variazioni di spesa energetica e massa grassa in funzione del tipo di dieta proposto. I risultati sono molto interessanti e sconfessano molte delle popolari teorie che spesso sono citate, purtroppo anche da professionisti, o presunti tali, del settore.
L’intento degli autori della meta-analisi, Hall e Guo, era quello di indagare i meccanismi fisiologici che controllano il peso e la composizione corporea e di verificare se una diversa modulazione della dieta in macronutrienti (carboidrati, grassi e proteine) possa influenzare tali meccanismi, la spesa metabolica complessiva e la riduzione della massa grassa. Il tutto applicato al dimagrimento di soggetti obesi.
Come sappiamo, ci sono quattro diverse componenti che determinano la spesa energetica di un individuo:
- Termogenesi indotta dalla dieta. Per Termogenesi indotta dalla dieta (TID), chiamata anche Azione dinamico specifica (ADS) degli alimenti, Termogenesi alimentare, Termogenesi postprandiale, o Effetto termico del cibo (TEF), si intende un processo metabolico, sottoprocesso della termogenesi, legato alla spesa energetica/calorica a cui fa seguito l’ingestione dei diversi macronutrienti (carboidrati, proteine, grassi, alcol), ovvero i nutrienti calorici, a cui è correlato un aumento del consumo di ossigeno e quindi una maggiore dispersione di calore (extracalore) dovuto alla loro digestione, assorbimento, stoccaggio e loro utilizzo. Questo processo costituisce mediamente il 10 % (tra il 7 e il 15%) della spesa calorica totale con una differenza significativa per le proteine che hanno una ADS media del 22,5%. Per i carboidrati la media del ADS è del 7,5% mentre per i grassi la media è del 3,5%. [2]
- Metabolismo basale. Il metabolismo basale (MB), o BMR, dall’inglese Basal metabolic rate, è il dispendio energetico di un organismo vivente a riposo, comprendente dunque l’energia necessaria per le funzioni metaboliche vitali (respirazione, circolazione sanguigna, digestione, attività del sistema nervoso, ecc.). Rappresenta circa il 45-75% del dispendio energetico totale nella giornata. Esso è In relazione lineare sia con la massa magra che con la massa grassa di un soggetto, tanto più elevato, quanto più il soggetto è pesante. In effetti, contrariamente a quanto si crede, il metabolismo basale di un soggetto obeso è più elevato di quello di un soggetto magro. Una parte importante del metabolismo basale è poi determinato dalla spesa energetica dei principali organi, accanto ad età e a fattori particolari, quali il flusso di substrati lungo le principali vie metaboliche. Si ricordi in oltre che il muscolo rappresenta il 40% del peso corporeo ma consuma solo il 18-20% delle calorie. Questo ci fa capire che un aumento della massa muscolare non è così rilevante per aumentare il dispendio giornaliero, ma ha un impatto sulla ricomposizione corporea.
- Termogenesi indotta dall’esercizio: La Termogenesi indotta dall’esercizio (TIE), chiamata anche Termogenesi da attività fisica (TAF), dall’inglese Exercise activity thermogenesis (EAT), o Exercise-induced thermogenesis (EIT), è un processo metabolico, sottoprocesso della termogenesi. La EAT rappresenta il dispendio energetico indotto dall’attività fisico-sportiva. Talvolta alcune ricerche denominano questo evento come Physical Activity Energy Expenditure (PAEE) o Exercise-induced Energy Expenditure (EIEE), cioè dispendio energetico dell’attività fisica o indotto da attività fisica, riferendosi nello specifico al consumo energetico piuttosto che all’evento termogenico. dipende da tipo, frequenza e intensità dell’attività sportiva condotta dall’individuo. Ad esempio, un esercizio di resistenza intenso impone un dispendio energetico di circa il 66% rispetto ad un esercizio aerobico intenso a parità di durata. Sotto questo aspetto, il dispendio calorico diretto indotto dall’attività aerobica è maggiore rispetto a quella dell’attività anaerobica lattacida.
- Termogenesi da attività non associabile all’esercizio fisico: La termogenesi da attività non attribuibile all’esercizio fisico (NEAT) rappresenta il dispendio energetico di tutte le attività fisiche diverse da quelle volitive e programmate, ovvero le attività fisico-sportive. In altre parole, rappresenta il dispendio energetico che non riguarda il metabolismo basale, o gesti come il dormire, il mangiare, e l’attività fisica. La NEAT comprende attività che coinvolgono il corpo, ma che non sono associabili alla vera e propria attività fisica, ad esempio camminare, muoversi, parlare, stare in piedi, salire le scale, scrivere, accovacciarsi, cucinare, allacciarsi le scarpe, lavare i piatti, fare lavori manuali, agitarsi ecc, ovvero tutti i movimenti ordinari e quotidiani che vengono eseguiti abitualmente. L’ammontare del NEAT che compie L’uomo rappresenta il risultato della quantità e del tipo di attività fisiche (non fisico-sportive) e il costo energetico di ogni attività. Il NEAT può costituire dal 15 fino al 50% del dispendio calorico quotidiano. Assieme alla termogenesi da attività fisica (EAT), il NEAT rappresenta l’ammontare del dispendio energetico associato all’attività generale svolta durante la giornata (EEPA, Energy Expenditure due to Physical Activity), a loro volta inclusi nel calcolo o stima del metabolismo totale (MT) o del dispendio calorico giornaliero.
Tornando allo studio, nel valutare l’influenza di diversi tipi di dieta sulla spesa energetica totale gli autori hanno preso in considerazione 28 studi che soddisfacevano gli stringenti requisiti individuati: apporto calorico strettamente controllato, apporto di proteine fisso, apporto di carboidrati o grassi variabile. Il risultato finale ha indicato una spesa energetica leggermente superiore per diete con un contenuto di carboidrati più elevato, circa 26 kcal al giorno in più rispetto a diete con un contenuto in grassi più alto. Un valore significativo, ma del tutto trascurabile dal punto di vista pratico, e soprattutto un risultato che indica un potenziale leggero “vantaggio metabolico” a favore di diete con elevato apporto di carboidrati. Un vantaggio minimo, del tutto ininfluente nella vita di ogni giorno, quando l’alimentazione varia per apporto calorico e composizione da un giorno all’altro.
Per analizzare la perdita di grasso gli autori hanno individuato 20 studi idonei. Il risultato della meta-analisi indica che la perdita di massa grassa è molto simile per diete isocaloriche con contenuto diverso di carboidrati e grassi. Anche qui è stata registrata una perdita leggermente superiore per diete ad elevato contenuto di carboidrati rispetto a quelle ricche in grassi, circa 16g in più al giorno, una differenza più grande di quella che si potrebbe predire in base alla maggior spesa energetica nelle medesime condizioni, ma in definitiva del tutto trascurabile in situazioni non controllate in maniera così rigida.
A tutti gli effetti pratici questa meta-analisi mostra che in definitiva che “una caloria è una caloria”, sia che provenga da grassi, sia che provenga da carboidrati, a parità di calorie assunte. I risultati sono addirittura opposti a quelli previsti in base alla popolare, e fallimentare, “ipotesi dell’insulina” che prevede che diete ricche in carboidrati possano portare ad un maggior aumento della massa grassa inducendo una elevata secrezione di Insulina, a sua volta in grado di promuovere l’accumulo di grassi nel tessuto adiposo, riducendone al contempo l’ossidazione nei tessuti metabolicamente attivi.
Il pregio di questa meta-analisi è che finalmente si può affermare che un egual apporto calorico, che provenga da grassi o che sia frutto di una dieta ricca di carboidrati, avrà effetti praticamente simili sulla spesa energetica totale e sulla perdita di massa grassa, con un lievissimo “vantaggio metabolico” per diete ricche in carboidrati, vantaggio che a tutti gli effetti è trascurabile soprattutto per una dieta fasica.
Dovrebbe essere ormai chiaro che manipolando il rapporto tra carboidrati e grassi nella dieta non si ottiene come risultante una modifica della spesa energetica dell’organismo o favorire la perdita di massa grassa. Non è nemmeno più accettabile che qualcuno affermi che i carboidrati di per sé possano avere un effetto deprimente sul metabolismo, favorendo l’accumulo di grasso: dalla meta-analisi (vertice della piramide delle evidenze scientifiche) si evince il contrario.
Questo non significa che la composizione della dieta non possa avere conseguenze anche importanti per la salute del soggetto e la qualità totale della composizione corporea: diversi apporti dei nutrienti potrebbero l’alterazione della composizione di membrana, interferenze con i processi di controllo dello stress ossidativo — che a lungo andare potrebbero essere tra i fattori causali di diverse patologie.
Inoltre la composizione in macronutrienti della dieta potrebbe influenzare i soggetti sottoposti a mantenersi o meno in linea con le direttive del piano nutrizionale a seconda delle loro condizioni di partenza: se atleti al 10% circa o soggetti in sovrappeso o obesi che toccano il 20% di bf. In questi ultimi, caratterizzati da una insulino resistenza più o meno marcata, un approccio “Low Fat” potrebbe rivelarsi fallimentare per via della non ottimale affinità con il glucosio e l’alterazione del senso di fame portato dalla resistenza insulinica ipotalamica (accompagnata da una resistenza leptinica). Spesso, gli individui con queste caratteristiche, rispondono bene a regimi ipocalorici “Low Carb” grazie all’effetto saziante delle proteine e dei corpi chetonici, cosa che porta facilmente ad una riduzione dell’introito calorico. Al contrario, soggetti con una body fat di circa il 10% intenti ad abbassarla ulteriormente, avendo una buona affinità con il glucosio e una insulino sensibilità elevata, avranno generalmente più vantaggi nel tagliare le calorie dai grassi mantenendo cospicua la quota di carboidrati e mantenendo una adeguata assunzione proteica.

Per le donne il discorso è un po’ diverso (vedi differenze metaboliche tra i sessi) e vorrei trattarlo a parte in una altro articolo.
Comunque sia, gli studi sul tema sembrano indicare che sul lungo periodo diete con diverso apporto di macronutrienti possano determinare una perdita analoga di peso, senza differenze realmente rilevanti. [3, 4]
Alla fine il messaggio risulta sempre il solito: per perdere peso, e migliorare la propria composizione corporea, bisogna calcolare il monte calorico necessario allo scopo, valutare le percentuali di macronutrienti a seconda del soggetto e modificarle una volta raggiunta una condizione fisica-metabolica idonea per applicare modifiche funzionali al programma alimentare.
Gabriel Bellizzi
Riferimenti:
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5568065/
- https://onlinelibrary.wiley.com/doi/epdf/10.1002/j.1550-8528.1997.tb00584.x
- http://thelancet.com/journals/lancet/article/PIIS0140-6736(16)31338-1/fulltext
- https://onlinelibrary.wiley.com/doi/full/10.1038/oby.2004.279