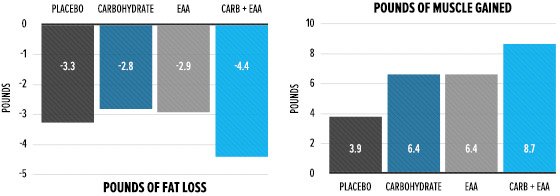
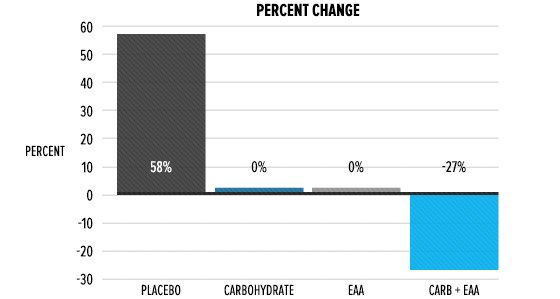
Introduzione:
I Glucocorticoidi (o, meno comunemente, glucocorticosteroidi) sono una classe di corticosteroidi, ovvero una classe di ormoni steroidei. I Glucocorticoidi sono corticosteroidi che si legano al recettore dei glucocorticoidi[1], presente in quasi tutte le cellule animali vertebrate. Il nome “Glucocorticoide” è un portmanteau (glucosio + corteccia + steroide) ed è composto dal suo ruolo nella regolazione del metabolismo del glucosio, dalla sintesi nella corteccia surrenale e dalla sua struttura steroidea.
I Glucocorticoidi fanno parte del meccanismo di feedback del sistema immunitario, che riduce alcuni aspetti della funzione immunitaria, come l’infiammazione. Sono quindi utilizzati in medicina per trattare le malattie causate da un sistema immunitario iperattivo, come allergie, asma, malattie autoimmuni e sepsi. I Glucocorticoidi hanno molti effetti diversi, come la pleiotropia, tra cui effetti collaterali potenzialmente dannosi.[2] Inoltre, interferiscono con alcuni meccanismi anomali delle cellule tumorali, per cui vengono utilizzati in dosi elevate per il trattamento del cancro. Ciò include effetti inibitori sulla proliferazione dei linfociti, come nel trattamento di linfomi e leucemie, e l’attenuazione degli effetti collaterali dei farmaci antitumorali.
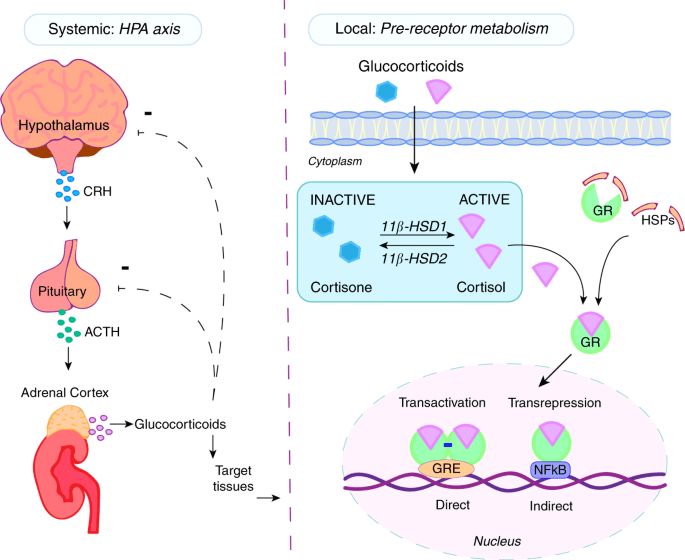
I glucocorticoidi agiscono sulle cellule legandosi al Recettore dei Glucocorticoidi (GR). Il complesso recettore glucocorticoide-glucocorticoide attivato regola l’espressione di proteine antinfiammatorie nel nucleo (processo noto come transattivazione) e reprime l’espressione di proteine pro-infiammatorie nel citosol impedendo la traslocazione di altri fattori di trascrizione dal citosol al nucleo (transrepressione).[2]
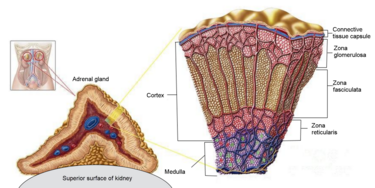
I glucocorticoidi si distinguono dai mineralocorticoidi e dagli steroidi sessuali per i loro specifici recettori, cellule bersaglio ed effetti. In termini tecnici, il termine “corticosteroide” si riferisce sia ai glucocorticoidi che ai mineralocorticoidi (poiché entrambi sono mimici degli ormoni prodotti dalla corteccia surrenale), ma è spesso usato come sinonimo di “glucocorticoide”. I glucocorticoidi sono prodotti principalmente nella zona fascicolata della corteccia surrenale, mentre i mineralocorticoidi sono sintetizzati nella zona glomerulosa.
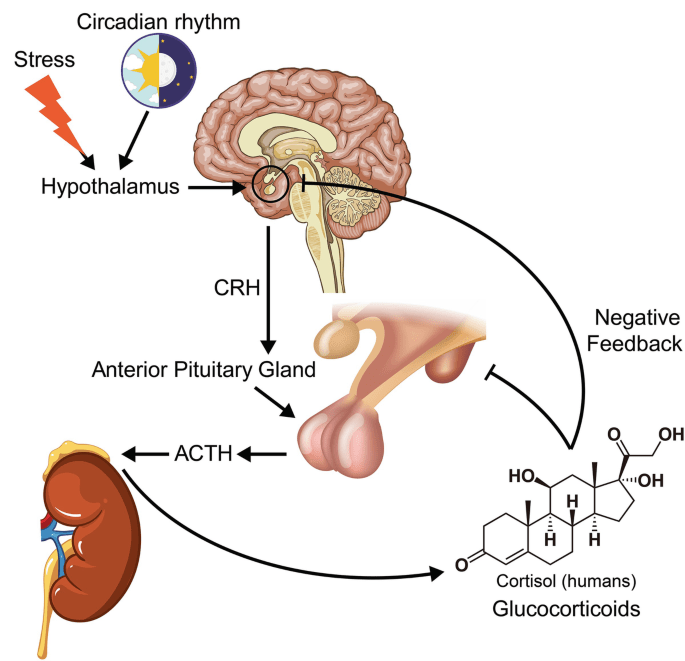
Il Cortisolo (o idrocortisone) è il più importante glucocorticoide umano. È essenziale per la vita e regola o supporta una serie di importanti funzioni cardiovascolari, metaboliche, immunologiche e omeostatiche. Gli aumenti delle concentrazioni di glucocorticoidi sono parte integrante della risposta allo stress e sono i biomarcatori più comunemente utilizzati per misurare lo stress.[3] I glucocorticoidi hanno anche numerose funzioni non correlate allo stress e le concentrazioni di glucocorticoidi possono aumentare in risposta al piacere o all’eccitazione.[4] Sono disponibili diversi glucocorticoidi sintetici, ampiamente utilizzati nella pratica medica generale e in numerose specialità, come terapia sostitutiva in caso di carenza di glucocorticoidi o per sopprimere il sistema immunitario dell’organismo.
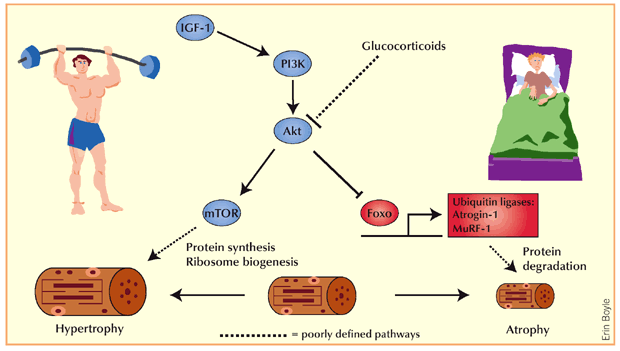
Si sospetta che gli atleti utilizzino i Glucocorticoidi per migliorare le prestazioni atletiche fin dagli anni ’60 (5). I glucocorticoidi possono migliorare le prestazioni fisiche attraverso diverse vie, tra cui una maggiore disponibilità di substrati metabolici attraverso un aumento della lipolisi (6), della proteolisi (7) e della disponibilità di glucosio (5). I Glucocorticoidi possono anche avere effetti immunosoppressivi e antinfiammatori che possono impedire al sistema immunitario di reagire in modo eccessivo a seguito di danni muscolari indotti dall’esercizio fisico (8), e il Cortisolo sembra preparare l’organismo per l’esercizio successivo (9). Inoltre, i glucocorticoidi possono stimolare i recettori cerebrali dei glucocorticoidi, determinando una riduzione del dolore muscolare durante l’esercizio, un aumento della soglia della fatica e risposte edoniche positive, che possono tradursi in un aumento delle prestazioni fisiche (10). I glucocorticoidi hanno un elevato potenziale di effetti avversi, tra cui il deperimento muscolare, e questi effetti dipendono da molteplici fattori come il tipo di glucocorticoide, la durata del trattamento, la dose e la via di somministrazione (11). Pertanto, gli atleti che assumono glucocorticoidi per migliorare le prestazioni probabilmente preferiscono periodi di somministrazione più brevi.
L’Associazione Mondiale Antidoping (WADA) aggiorna annualmente la sua lista proibita, un elenco di sostanze e metodi vietati negli sport d’élite. La lista proibita, in vigore dal 1° gennaio 2022, vieta tutti i glucocorticoidi nelle competizioni quando sono somministrati per via orale, rettale o iniettabile, poiché queste forme di somministrazione sono considerate ad effetto sistemico. Altre vie di somministrazione, come l’applicazione topica per inalazione e le iniezioni locali, sono approvate nelle competizioni, poiché si ritiene che abbiano un minore potenziale di miglioramento delle prestazioni. L’uso dei glucocorticoidi al di fuori delle competizioni è approvato (12). Per aiutare i medici a curare gli atleti e a rispettare le norme antidoping, dal 2022 la WADA raccomanda specifici periodi di wash out (tempo dall’ultima dose al giorno prima della competizione) per i diversi tipi di glucocorticoidi e le diverse vie di somministrazione. Dal 2022 la WADA ha anche introdotto livelli di segnalazione urinaria specifici per i diversi tipi di glucocorticoidi, in quanto i diversi glucocorticoidi hanno un’ampia variazione nel tempo di eliminazione (13).
Dagli anni 90 si è studiato l’effetto dei glucocorticoidi sulla frequenza cardiaca e sul consumo di ossigeno durante intervalli di corsa ad alta intensità. Da allora diversi studi RCT hanno analizzato l’effetto dei glucocorticoidi sulla prestazione fisica submassimale e massimale. Poiché le modalità di somministrazione, il tipo di glucocorticoide, la durata del trattamento, la dose, la popolazione e il protocollo di esercizio possono variare tra gli studi, essi giungono a conclusioni diverse per quanto riguarda l’effetto dei glucocorticoidi sulla prestazione fisica, tuttavia sono soprattutto gli studi che indagano l’effetto di alte dosi orali somministrate nel tempo sulla resistenza in bicicletta fino all’esaurimento a mostrare effetti. L’effetto dei glucocorticoidi sulla prestazione fisica e sul metabolismo dei soggetti sani è stato esaminato in precedenza (5, 10), ma senza una ricerca sistematica della letteratura e senza combinare i risultati degli studi inclusi nell’analisi statistica. Pertanto, in tale sede, cercherò anche di fare chiarezza sull’effetto dei glucocorticoidi sulla prestazione massimale o submassimale in soggetti sani.
Steroidogenesi dei Glucocorticoidi:
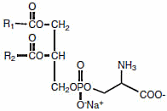
La steroidogenesi è il processo biologico attraverso il quale gli steroidi vengono generati dal colesterolo e trasformati in altri steroidi.[14] Le vie della steroidogenesi differiscono tra le specie. Le principali classi di ormoni steroidei, con i loro membri e le loro funzioni principali, sono i progestinici, i corticosteroidi (corticoidi), gli androgeni e gli estrogeni.[15][16] La steroidogenesi umana dei corticosteroidi avviene nella Corteccia Surrenale.
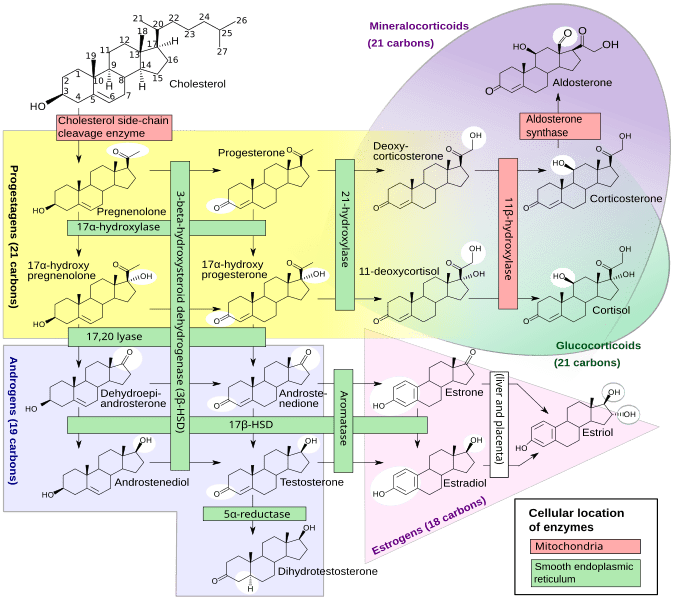
La Corteccia Surrenale è la regione più esterna e anche la parte più grande della ghiandola surrenale. È divisa in tre zone distinte: zona glomerulosa, zona fascicolata e zona reticolare. Ogni zona è responsabile della produzione di ormoni specifici. È anche un sito secondario di sintesi degli androgeni.[17]
- Zona Glomerulosa
Lo strato più esterno, la zona glomerulosa, è il sito principale per la produzione di aldosterone, un mineralcorticoide. La sintesi e la secrezione di aldosterone sono regolate principalmente dal sistema renina-angiotensina-aldosterone. Le cellule della zona glomerulosa esprimono un enzima specifico, l’aldosterone sintasi (noto anche come CYP11B2).[18][19] L’aldosterone è ampiamente responsabile della regolazione a lungo termine della pressione sanguigna. [Gli effetti dell’aldosterone si manifestano nel tubulo contorto distale e nel dotto collettore del rene, dove provoca un aumento del riassorbimento del sodio e una maggiore escrezione di potassio (da parte delle cellule principali) e di ioni idrogeno (da parte delle cellule intercalate del dotto collettore).[20] La ritenzione di sodio è anche una risposta del colon distale e delle ghiandole sudoripare alla stimolazione dei recettori dell’aldosterone. Sebbene la produzione sostenuta di aldosterone richieda un ingresso persistente di calcio attraverso canali del Ca2+ attivati a basso voltaggio, le cellule isolate della zona glomerulosa sono considerate non eccitabili, con tensioni di membrana registrate troppo iperpolarizzate per consentire l’ingresso di canali del Ca2+.[21]
La secrezione di aldosterone è stimolata anche dall’ormone adrenocorticotropo (ACTH).[22]
Le cellule della zona glomerulosa non esprimono l’11β-idrossilasi e la 17α-idrossilasi. Per questo motivo la zona glomerulosa non può sintetizzare cortisolo, corticosterone o ormoni sessuali (androgeni). [23] L’espressione di proteine specifiche per i neuroni nelle cellule della zona glomerulosa dei tessuti adrenocorticali umani è stata prevista e riportata da diversi autori [24][25][26] ed è stato suggerito che l’espressione di proteine come la molecola di adesione delle cellule neuronali (NCAM) nelle cellule della zona glomerulosa rifletta la caratteristica rigenerativa di queste cellule, che perderebbero l’immunoreattività della NCAM dopo essersi spostate nella zona fascicolata. [24][27] Tuttavia, insieme ad altri dati sulle proprietà neuroendocrine delle cellule della zona glomerulosa, l’espressione di NCAM potrebbe riflettere una differenziazione neuroendocrina di queste cellule.[24]
- Zona Fasciculata
Situate tra la glomerulosa e la reticolare, le cellule della zona fascicolata sintetizzano e secernono glucocorticoidi (come l’11-deossicorticosterone, il corticosterone e il cortisolo), oltre a piccole quantità di androgeni ed estrogeni surrenalici.[28] La zona fascicolata ha una maggiore attività di 3β-idrossisteroide deidrogenasi rispetto alla zona reticolare. Pertanto, la zona fascicolata produce più 11-deossicorticosterone, corticosterone e cortisolo.[23] Il principale ormone che stimola la secrezione di cortisolo nell’uomo è l’ACTH, rilasciato dall’ipofisi anteriore.[22] È stato dimostrato che la capacità steroidogenica della zona fascicolata aumenta durante la malattia nei neonati.[22]
- Zona Reticolare
La zona reticolare, lo strato corticale più interno, produce gli androgeni surrenalici, oltre a piccole quantità di estrogeni e alcuni glucocorticoidi.[28] La zona reticolare possiede una quantità maggiore di cofattori necessari per l’attività della 17,20-liasi della 17α-idrossilasi rispetto alla zona fascicolata. Pertanto, la zona reticolare produce più androgeni,[23] soprattutto deidroepiandrosterone (DHEA), DHEA solfato (DHEA-S) e androstenedione (il precursore del Testosterone e DHT) nell’uomo. La secrezione di DHEAS è stimolata anche dall’ACTH.[22]
Come abbiamo visto, I glucocorticoidi sono prodotti principalmente nella Zona Fascicolata.[23]
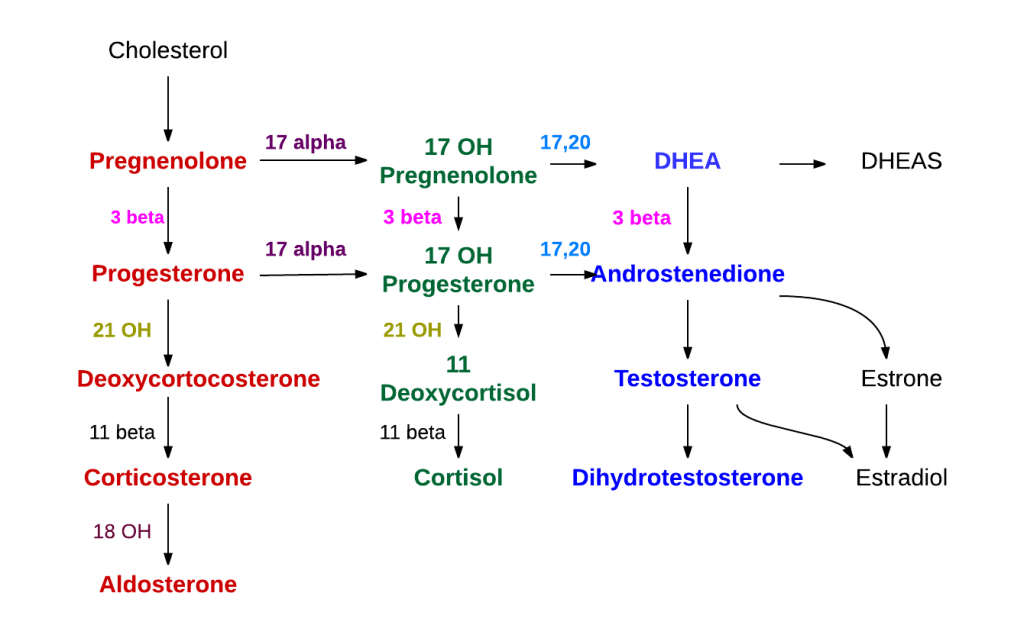
Il precursore degli steroidi sintetizzati nella corteccia surrenale è il colesterolo che viene immagazzinato nelle vescicole. Il colesterolo può essere sintetizzato de novo nella corteccia surrenale. Tuttavia, la fonte principale di colesterolo sembra essere il colesterolo assunto dalle lipoproteine circolanti. [29]
I passaggi fino a questo punto avvengono in molti tessuti produttori di steroidi. Le fasi successive per generare aldosterone e cortisolo, tuttavia, avvengono principalmente nella corteccia surrenale:
- Progesterone → (idrossilazione a C21) → 11-Deossicorticosterone → (due ulteriori idrossilazioni a C11 e C18) → Aldosterone
- Progesterone → (idrossilazione a C17) → 17-alfa-idrossiprogesterone → (idrossilazione a C21) → 11-Deossicortisolo → (idrossilazione a C11) → Cortisolo
Effetto sistemico dei Glucocorticoidi:
Gli effetti dei glucocorticoidi possono essere ampiamente classificati in due categorie principali:
- immunologici
- metabolici.
Inoltre, i glucocorticoidi svolgono ruoli importanti nello sviluppo fetale e nell’omeostasi dei fluidi corporei.
- Immunità
Come già accennato, i glucocorticoidi funzionano anche attraverso l’interazione con il recettore dei glucocorticoidi:
- Aumentano l’espressione di proteine antinfiammatorie.
- Riducono l’espressione di proteine pro-infiammatorie.
È stato dimostrato che i glucocorticoidi svolgono un ruolo nello sviluppo e nell’omeostasi dei linfociti T. Questo è stato dimostrato in transgenici. Ciò è stato dimostrato in topi transgenici con una maggiore o minore sensibilità della linea delle cellule T ai glucocorticoidi.[30]
- Metabolismo
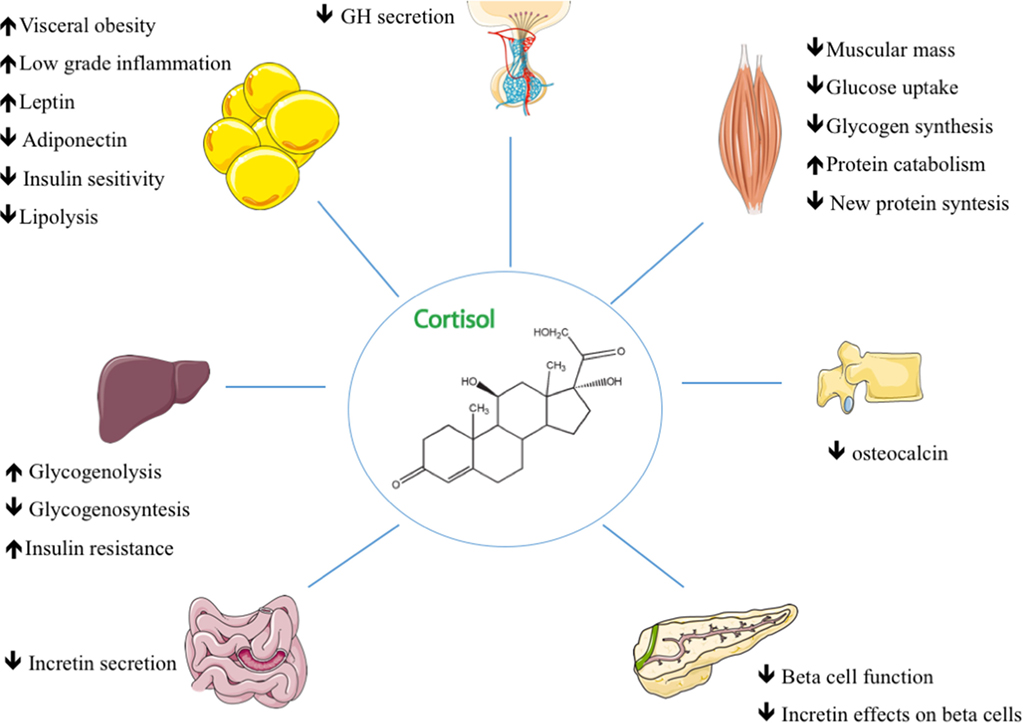
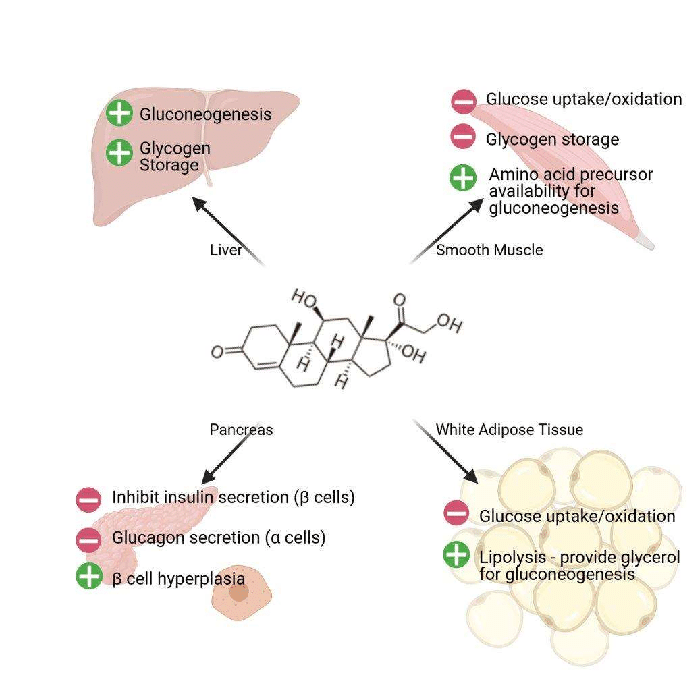
Nello stato di digiuno, il cortisolo stimola diversi processi che servono collettivamente ad aumentare e mantenere le normali concentrazioni di glucosio nel sangue.
Effetti metabolici:
- Stimolazione della gluconeogenesi, in particolare nel fegato: Questa via porta alla sintesi del glucosio a partire da substrati non esosi, come gli aminoacidi e il glicerolo proveniente dalla scissione dei trigliceridi, ed è particolarmente importante nei carnivori e in alcuni erbivori. L’aumento dell’espressione degli enzimi coinvolti nella gluconeogenesi è probabilmente la funzione metabolica più nota dei glucocorticoidi.
- Mobilitazione di aminoacidi dai tessuti extraepatici: Questi servono come substrati per la gluconeogenesi.
- Inibizione della captazione del glucosio nel tessuto muscolare e adiposo: Un meccanismo per conservare il glucosio
- Stimolazione della demolizione dei grassi nel tessuto adiposo: Gli acidi grassi rilasciati dalla lipolisi vengono utilizzati per la produzione di energia in tessuti come il muscolo e il glicerolo rilasciato fornisce un altro substrato per la gluconeogenesi.
- L’aumento della ritenzione di sodio e dell’escrezione di potassio porta a ipernatremia e ipokaliemia[31].
- Aumento della concentrazione di emoglobina, probabilmente dovuto all’ostacolo dell’ingestione di globuli rossi da parte di macrofagi o altri fagociti[32].
- Aumento dell’acido urico urinario[33]
- Aumento del calcio urinario e ipocalcemia[34]
- Alcalosi[35]
- Leucocitosi[36]
Livelli eccessivi di glucocorticoidi derivanti dalla somministrazione di farmaci o dall’iperadrenocorticismo hanno effetti su molti sistemi. Alcuni esempi includono l’inibizione della formazione ossea, la soppressione dell’assorbimento del calcio (entrambi possono portare all’osteoporosi), il ritardo nella guarigione delle ferite, la debolezza muscolare e l’aumento del rischio di infezioni. Queste osservazioni suggeriscono una moltitudine di ruoli fisiologici meno drammatici per i glucocorticoidi.[30]
- Eccitazione e sfera cognitiva
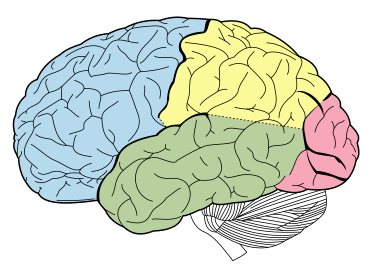
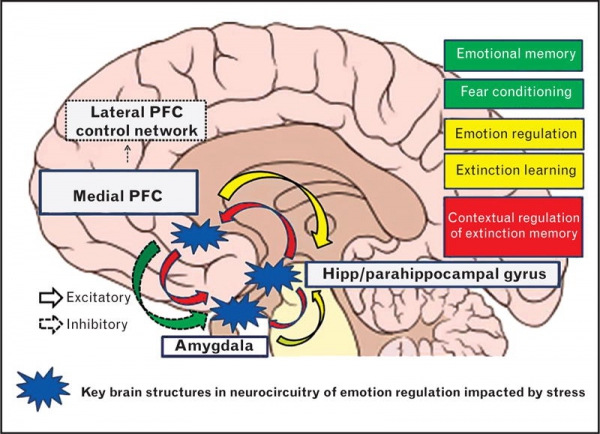
I glucocorticoidi agiscono sull’ippocampo, sull’amigdala e sui lobi frontali. Insieme all’adrenalina, favoriscono la formazione di ricordi flashbulb di eventi associati a forti emozioni, sia positive che negative.[36] Ciò è stato confermato da studi in cui il blocco dell’attività dei glucocorticoidi o della noradrenalina ha compromesso il richiamo di informazioni emotivamente rilevanti. Ulteriori fonti hanno dimostrato che i soggetti il cui apprendimento della paura è stato accompagnato da alti livelli di cortisolo hanno avuto un migliore consolidamento di questa memoria (questo effetto è stato più importante negli uomini). L’effetto che i glucocorticoidi hanno sulla memoria può essere dovuto a un danno specifico all’area CA1 della formazione dell’ippocampo.
In diversi studi sugli animali, lo stress prolungato (che causa aumenti prolungati dei livelli di glucocorticoidi) ha mostrato la distruzione dei neuroni nell’area dell’ippocampo del cervello, che è stata collegata a prestazioni di memoria inferiori.[32][37][33]
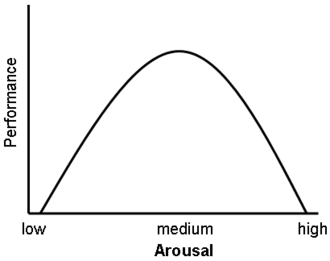
È stato inoltre dimostrato che i glucocorticoidi hanno un impatto significativo sulla vigilanza (disturbo da deficit di attenzione) e sulla cognizione (memoria). Questo sembra seguire la curva di Yerkes-Dodson, in quanto gli studi hanno dimostrato che i livelli circolanti di glucocorticoidi rispetto alle prestazioni della memoria seguono un andamento a U rovesciata, proprio come la curva di Yerkes-Dodson. Ad esempio, il potenziamento a lungo termine (LTP, il processo di formazione dei ricordi a lungo termine) è ottimale quando i livelli di glucocorticoidi sono leggermente elevati, mentre si osserva una significativa riduzione dell’LTP dopo la surrenalectomia (stato di basso livello di glucocorticoidi) o dopo la somministrazione di glucocorticoidi esogeni (stato di alto livello di glucocorticoidi). Livelli elevati di glucocorticoidi migliorano la memoria per gli eventi emotivamente eccitanti, ma portano più spesso a una scarsa memoria per il materiale non correlato alla fonte di stress/eccitazione emotiva.[38] In contrasto con gli effetti di potenziamento dose-dipendenti dei glucocorticoidi sul consolidamento della memoria, è stato dimostrato che questi ormoni dello stress inibiscono il recupero di informazioni già memorizzate. [È stato dimostrato che l’esposizione a lungo termine a farmaci glucocorticoidi, come quelli contro l’asma e gli antinfiammatori, crea deficit di memoria e attenzione sia durante che, in misura minore, dopo il trattamento,[39][40] una condizione nota come “demenza da steroidi”.[41]
- Omeostasi dei fluidi corporei
I glucocorticoidi potrebbero agire a livello centrale e periferico per contribuire alla normalizzazione del volume dei liquidi extracellulari regolando l’azione dell’organismo nei confronti del peptide natriuretico atriale (ANP). A livello centrale, i glucocorticoidi potrebbero inibire l’assunzione di acqua indotta dalla disidratazione;[42] a livello periferico, i glucocorticoidi potrebbero indurre una potente diuresi.[43]
Meccanismi d’azione dei Glucocorticoidi:
- Transattivazione
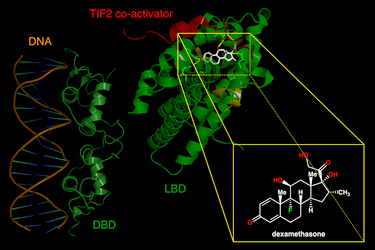
I glucocorticoidi si legano al recettore citosolico dei glucocorticoidi, un tipo di recettore nucleare che viene attivato dal legame con il ligando. Dopo che un ormone si lega al recettore corrispondente, il complesso appena formato si trasloca nel nucleo della cellula, dove si lega agli elementi di risposta ai glucocorticoidi nella regione promotrice dei geni bersaglio, determinando la regolazione dell’espressione genica. Questo processo viene comunemente definito attivazione trascrizionale o transattivazione.[44][45]
Le proteine codificate da questi geni regolati hanno un’ampia gamma di effetti, tra cui, ad esempio:[45]
- Antinfiammatori – lipocortina I, proteina legante p11/calpactina, inibitore secretorio della proteasi leucocitaria 1 (SLPI) e fosfatasi della proteina chinasi attivata dal mitogeno (MAPK fosfatasi).
- Aumento della gluconeogenesi – glucosio 6-fosfatasi e tirosina aminotransferasi
- Transrepressione
Il meccanismo opposto è chiamato repressione trascrizionale o transrepressione. Secondo la concezione classica di questo meccanismo, il recettore dei glucocorticoidi attivato si lega al DNA nello stesso sito in cui si legherebbe un altro fattore di trascrizione, impedendo la trascrizione di geni che vengono trascritti tramite l’attività di quel fattore.[44][45] Sebbene ciò avvenga, i risultati non sono coerenti per tutti i tipi di cellule e per tutte le condizioni; non esiste un meccanismo generale e generalmente accettato per la transrepressione.[45]
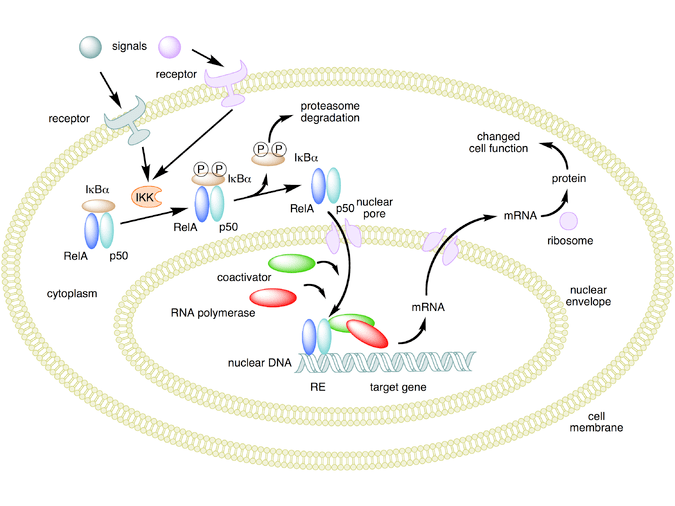
Si stanno scoprendo nuovi meccanismi in cui la trascrizione viene repressa, ma il recettore dei glucocorticoidi attivato non interagisce con il DNA, bensì direttamente con un altro fattore di trascrizione, interferendo con esso, o con altre proteine che interferiscono con la funzione di altri fattori di trascrizione. Quest’ultimo meccanismo sembra essere il modo più probabile in cui il recettore glucocorticoide attivato interferisce con NF-κB, ossia reclutando istone deacetilasi, che deacetilano il DNA nella regione del promotore portando alla chiusura della struttura cromatinica in cui NF-κB deve legarsi.[44][45]
- Attività non-genomica
Il recettore glucocorticoide attivato ha effetti che, come è stato dimostrato sperimentalmente, sono indipendenti da qualsiasi effetto sulla trascrizione e possono essere dovuti solo al legame diretto del recettore glucocorticoide attivato con altre proteine o con l’mRNA.[44][45]
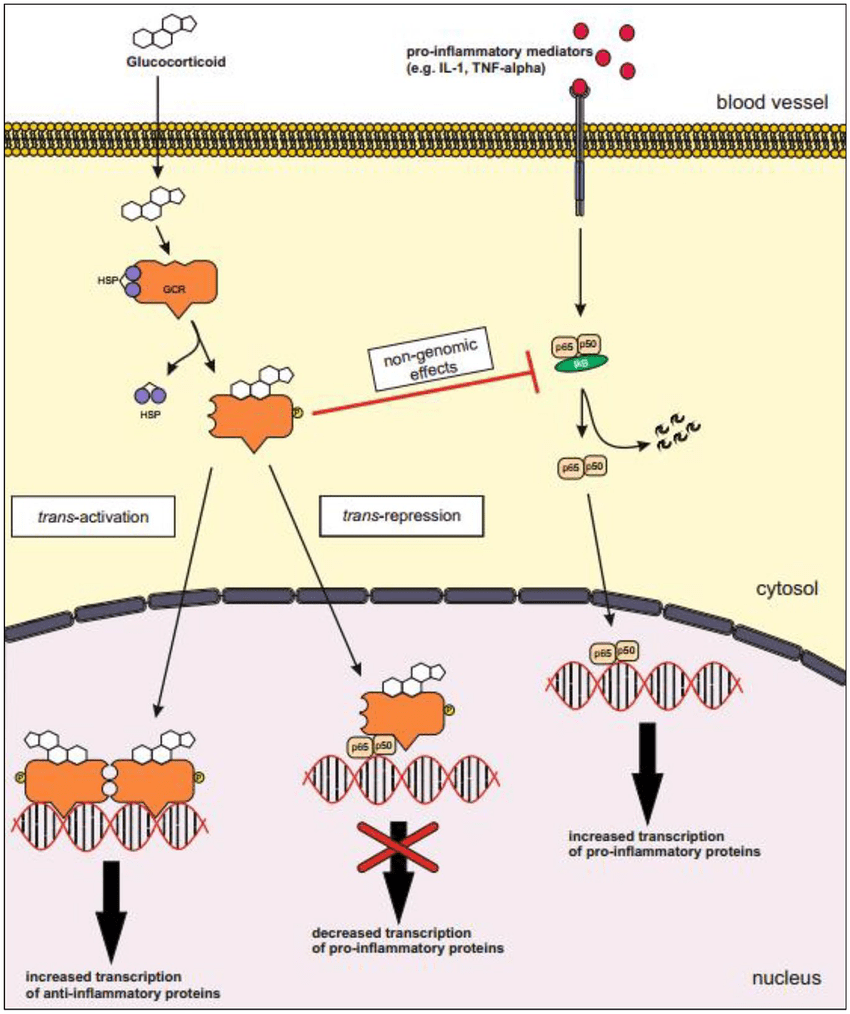
Ad esempio, la chinasi Src, che si lega al recettore glucocorticoide inattivo, viene rilasciata quando un glucocorticoide si lega al recettore glucocorticoide e fosforila una proteina che a sua volta sposta una proteina adattatrice da un recettore importante nell’infiammazione, il fattore di crescita epidermico, riducendone l’attività, che a sua volta si traduce in una riduzione della creazione di acido arachidonico, una molecola proinfiammatoria chiave. Questo è uno dei meccanismi con cui i glucocorticoidi hanno un effetto antinfiammatorio.[44]
Farmacologia dei Glucocorticoidi:
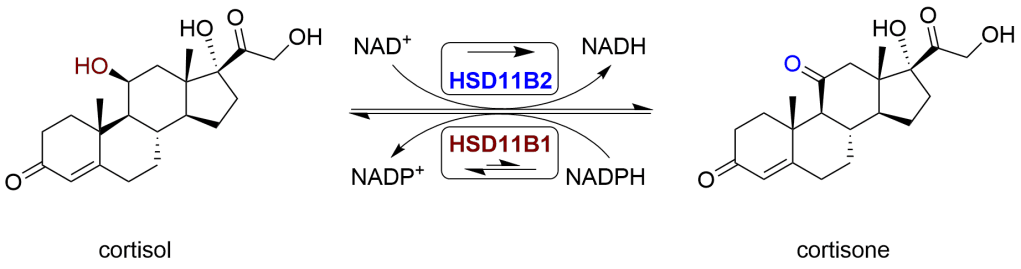
Per uso terapeutico sono stati creati diversi Glucocorticoidi sintetici, alcuni molto più potenti del Cortisolo. Si differenziano sia per la farmacocinetica (fattore di assorbimento, emivita, volume di distribuzione, clearance) che per la farmacodinamica (ad esempio la capacità di attività mineralcorticoide: ritenzione di sodio (Na+) e acqua; fisiologia renale). Poiché permeano facilmente l’intestino, vengono somministrati principalmente per os (per bocca), ma anche con altri metodi, ad esempio per via topica sulla pelle. Oltre il 90% di essi lega diverse proteine plasmatiche, anche se con una diversa specificità di legame. I glucocorticoidi endogeni e alcuni corticoidi sintetici hanno un’elevata affinità con la proteina Transcortina (detta anche globulina legante i corticosteroidi), mentre tutti legano l’albumina. Nel fegato, vengono rapidamente metabolizzati mediante coniugazione con un solfato o un acido glucuronico e vengono secreti nelle urine.
La potenza dei Glucocorticoidi, la durata dell’effetto e la sovrapposizione della potenza dei mineralocorticoidi variano. Il cortisolo è lo standard di confronto per la potenza dei glucocorticoidi. Idrocortisone è il nome utilizzato per le preparazioni farmaceutiche di cortisolo.
I dati riportati di seguito si riferiscono alla somministrazione orale. La potenza orale può essere inferiore a quella parenterale perché quantità significative (fino al 50% in alcuni casi) possono non raggiungere la circolazione. Il Fludrocortisone Acetato e il desossicorticosterone acetato sono, per definizione, mineralocorticoidi piuttosto che glucocorticoidi, ma hanno una potenza glucocorticoide minore e sono inclusi in questa tabella per fornire una prospettiva sulla potenza dei mineralocorticoidi.
Usi terapeutici:
I Glucocorticoidi possono essere utilizzati a basse dosi nell’insufficienza surrenalica. A dosi molto più elevate, i glucocorticoidi per via orale o inalatoria sono utilizzati per sopprimere vari disturbi allergici, infiammatori e autoimmuni. I glucocorticoidi per via inalatoria sono il trattamento di seconda linea per l’asma. Sono anche somministrati come immunosoppressori post-trapianto per prevenire il rigetto acuto del trapianto e la malattia del trapianto contro l’ospite. Tuttavia, non prevengono un’infezione e inibiscono anche i successivi processi riparativi. Nuove evidenze hanno dimostrato che i glucocorticoidi potrebbero essere utilizzati nel trattamento dell’insufficienza cardiaca per aumentare la responsività renale ai diuretici e ai peptidi natriuretici. I glucocorticoidi sono storicamente utilizzati per alleviare il dolore nelle condizioni infiammatorie.[46][47][48] Tuttavia, i corticosteroidi mostrano un’efficacia limitata nell’alleviare il dolore e potenziali eventi avversi per il loro uso nelle tendinopatie.[49]
- Terapia Sostitutiva
Qualsiasi glucocorticoide può essere somministrato in una dose che fornisce all’incirca gli stessi effetti glucocorticoidi della normale produzione di cortisolo; si parla di dosaggio fisiologico, sostitutivo o di mantenimento. Si tratta di circa 6-12mg/m2/die di Idrocortisone (m2 si riferisce all’area di superficie corporea (BSA), ed è una misura delle dimensioni del corpo; la BSA di un uomo medio è di 1,9 m2).
Gli usi clinici dei glucocorticoidi comprendono quindi:
- Terapia Immunosoppressiva: I glucocorticoidi causano immunosoppressione e la componente terapeutica di questo effetto è principalmente la diminuzione della funzione e del numero di linfociti, compresi i linfociti B e i linfociti T.
- Terapia Anti-Infiammatoria: I glucocorticoidi sono potenti antinfiammatori, indipendentemente dalla causa dell’infiammazione; il loro meccanismo antinfiammatorio primario è la sintesi della lipocortina-1 (annexin-1). La lipocortina-1 sopprime la fosfolipasi A2, bloccando così la produzione di eicosanoidi, e inibisce vari eventi infiammatori dei leucociti (adesione epiteliale, emigrazione, chemiotassi, fagocitosi, esplosione respiratoria, ecc.) In altre parole, i glucocorticoidi non solo sopprimono la risposta immunitaria, ma inibiscono anche i due principali prodotti dell’infiammazione, le prostaglandine e i leucotrieni. Inibiscono la sintesi delle prostaglandine a livello della fosfolipasi A2 e a livello della cicloossigenasi/PGE isomerasi (COX-1 e COX-2),[50] quest’ultimo effetto è molto simile a quello dei FANS, potenziando così l’effetto antinfiammatorio. Inoltre, i glucocorticoidi sopprimono anche l’espressione della ciclossigenasi.[51]
- Trattamento del Iperaldosteronismo: I glucocorticoidi possono essere utilizzati nella gestione dell’iperaldosteronismo familiare di tipo 1. Non sono efficaci, tuttavia, per l’uso nella condizione di tipo 2.
- Trattamento insufficienza cardiaca: I glucocorticoidi possono essere utilizzati nel trattamento dell’insufficienza cardiaca scompensata per potenziare la reattività renale ai diuretici, in particolare nei pazienti con insufficienza cardiaca con resistenza diuretica refrattaria a dosi elevate di diuretici dell’ansa.[52][53][54][55][56][57][58]
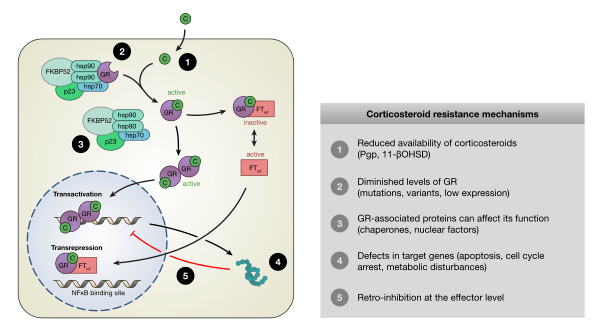
La resistenza agli usi terapeutici dei glucocorticoidi può verificarsi in un certo numero di pazienti e presentare delle difficoltà; ad esempio, il 25% dei casi di asma grave può non rispondere agli steroidi. Questo può essere il risultato di una predisposizione genetica, dell’esposizione continua alla causa dell’infiammazione (come gli allergeni), di fenomeni immunologici che bypassano i glucocorticoidi, di disturbi farmacocinetici (assorbimento incompleto o escrezione o metabolismo accelerati) e di infezioni respiratorie virali e/o batteriche.[59][60]
Glucocorticoidi e Sport:
Come abbiamo visto, i Glucocorticoidi sono una delle classi di farmaci più ampiamente utilizzate ed efficaci nella popolazione generale e sono disponibili in una varietà di formulazioni farmaceutiche (ad esempio, iniezioni, compresse, creme, colliri, gocce auricolari, inalatori e spray nasali). Somministrati sia per i loro effetti sistemici che locali, i Glucocorticoidi sono utilizzati a livello globale in una vasta gamma di specialità cliniche, principalmente per le loro proprietà antinfiammatorie e immunosoppressive. In alcuni contesti, l’uso medico dei Glucocorticoidi orali sembra essere aumentato negli ultimi anni poiché questi sono un’alternativa accessibile e conveniente ai farmaci mirati ma più costosi. La prevalenza dell’uso sistemico prevalentemente per uso a breve termine varia tra l’1% e il 3%, sebbene abbia raggiunto il 17,1% in un recente studio sugli adulti in Francia.(https://bjsm.bmj.com) Nelle popolazioni di atleti, vi è una maggiore prevalenza di lesioni muscoloscheletriche e asma, e pertanto un frequente uso legittimo di Glucocorticoidi terapeutici non sarebbe sorprendente. Tuttavia, vi è una scarsità di stime di prevalenza nelle popolazioni di atleti. Un’analisi di TUE abbreviate in cui il CIO è stato informato dell’uso di Glucocorticoidi da parte degli atleti prima dei Giochi olimpici negli anni ’90 e nei primi anni 2000 suggerisce che almeno il 5% al 12% degli atleti d’élite competitivi è stato trattato con Glucocorticoidi tramite tutte le vie, prevalentemente inalatoria. In un recente sondaggio internazionale non pubblicato di medici che lavorano con atleti d’élite, oltre l’85% ha riferito di aver somministrato almeno occasionalmente Glucocorticoidi iniettabili come parte della loro normale pratica (comunicazione personale, Dr David Hughes, Australian Institute of Sport).
I Glucocorticoidi, somministrati tramite determinate vie, sono stati proibiti per la prima volta nello sport dal CIO nel 1985 e sono stati proibiti dalla WADA sin dalla sua Lista iniziale, pubblicata nel 2004. Le sostanze o i metodi sono considerati per l’inclusione nella Lista se soddisfano due dei tre criteri seguenti come stabilito dal Codice mondiale antidoping:
- potenziale di migliorare o migliorano le prestazioni sportive;
- rappresentano un rischio effettivo o potenziale per la salute dell’atleta;
- violano lo spirito dello sport. I Glucocorticoidi sono proibiti in competizione quando somministrati tramite vie “sistemiche” (orali, rettali, intramuscolari o endovenose).[https://www.wada-ama.org/] La somministrazione tramite tutte le altre vie (incluse le iniezioni intra-articolari e altre periarticolari) è considerata somministrazione locale e non è proibita in competizione. La somministrazione di Glucocorticoidi tramite qualsiasi via non è proibita fuori competizione (OOC).
Indipendentemente dalla sostanza specifica del Glucocorticoidi e dalle sue singole caratteristiche farmacologiche, un presunto riscontro analitico avverso (AAF) viene segnalato dai laboratori accreditati WADA quando i livelli urinari dei campioni in gara superano un livello di segnalazione di 30ng/mL. La farmacocinetica dei Glucocorticoidi è complessa e influenzata dalla formulazione, dal tipo di esterificazione e sale, dalla via di somministrazione, dal sito e dal metodo di somministrazione. Di conseguenza, mentre il limite di segnalazione del laboratorio può dimostrare la presenza di un Glucocorticoidi , non può necessariamente indicare se la somministrazione è avvenuta in gara o OOC o se è probabile che abbia un effetto farmacologico o ergogenico. Qualsiasi medico o atleta non sarà sicuro di quando interrompere l’uso di GC sistemici prima del periodo in gara per evitare di superare il limite di segnalazione. Per complicare ulteriormente il quadro farmacocinetico, le iniezioni intra-articolari possono dare origine a livelli sistemici e i medici possono inavvertitamente caratterizzare erroneamente il sito di iniezione in assenza di guida radiologica o ecografica. La definizione di limiti di segnalazione specifici per sostanza è un’area di discussione e ricerca attiva tra gli esperti nominati dalla WADA e va oltre lo scopo del presente documento.
- Glucocorticoidi sistemici e performance
Alcuni atleti hanno indubbiamente tentato di sfruttare i presunti effetti di miglioramento delle prestazioni dei Glucocorticoidi sistemici che ritengono benefici nella loro particolare disciplina sportiva. Tuttavia, i meccanismi complessi e pleiotropici dell’azione dei Glucocorticoidi suggeriscono che questi farmaci sono uno strumento poco maneggevole per l’atleta che cerca di ottenere un vantaggio nelle prestazioni e sono considerati una componente meno popolare dei regimi di doping rispetto al passato.[ https://cyclingtips.com/] Alcuni pazienti e atleti hanno riferito di aver sperimentato euforia dopo la somministrazione sistemica.[ http://www.cyclingnews.com] Tuttavia, le prove scientifiche a supporto dell’euforia misurabile nelle popolazioni cliniche sono ambigue e l’interpretazione dei dati è complicata dall’associazione del dolore cronico confondente.[https://bjsm.bmj.com/]
Sembrerà starno, ma non vi è alcuna prova incontrovertibile di effetti di miglioramento delle prestazioni derivanti dall’uso a breve termine di Glucocorticoidi sistemici.[https://bjsm.bmj.com/] Esistono studi randomizzati in doppio cieco cross-over che suggeriscono che gli atleti possono sfruttare cicli di Glucococrticoidi orali ad alto dosaggio della durata di una settimana per migliorare le loro prestazioni di esercizio di intensità submassimale per brevi periodi di tempo.[https://bjsm.bmj.com/] Questi dosaggi sarebbero facilmente rilevati durante i test antidoping, se assunti in gara. Il meccanismo preciso di questo effetto non è chiaro, ma si suggerisce che derivi da una combinazione di effetti sul metabolismo energetico, sui muscoli, sull’infiammazione e sul sistema nervoso. Questo effetto del farmaco è stato dimostrato in uno studio su atleti maschi il cui allenamento era strettamente periodizzato insieme all’uso di Glucocorticoidi orali.[https://bjsm.bmj.com/] Sfruttare questo tipo di regime di miglioramento delle prestazioni evitando efficacemente l’insufficienza surrenalica e il rilevamento tramite controlli antidoping standard in gara richiederebbe una meticolosa supervisione medica. Potrebbe anche richiedere una manipolazione farmacologica più complessa ed esotica dell’asse ipotalamo-ipofisi-surrene rispetto a quella offerta dai Glucocorticoidi prescritti.[https://bjsm.bmj.com/]
Atleti e dottori hanno descritto metodi inappropriati con cui l’uso sistemico di Glucocorticoidi, un’alimentazione limitata e un allenamento a bassa intensità potrebbero essere combinati OOC per perdere peso e preservare la massa muscolare.[ https://www.nytimes.com/]Tuttavia, date le funzioni cataboliche proteiche ampiamente riconosciute dei Glucocorticoidi,[https://bjsm.bmj.com/] questo meccanismo di doping rimane speculativo e controverso. Inoltre, l’efficacia potrebbe dipendere dall’uso di Glucocorticoidi come parte di un cocktail complesso che include altri ormoni proibiti ma scarsamente rilevati come l’insulina.[https://bjsm.bmj.com/]

Recenti resoconti sulla presunta potenza dei Glucocorticoidi sistemici provengono da atleti che hanno anche confessato l’uso concomitante di altri metodi e sostanze per migliorare le prestazioni, tra cui agenti anabolizzanti come il testosterone.[https://bjsm.bmj.com/] Tali regimi di Glucocorticoidi potrebbero avere rilevanza solo in un piccolo sottoinsieme di discipline sportive, come nelle ripide tappe di montagna dei Grandi Giri del ciclismo, dove gli atleti potrebbero essere disposti ad accettare compromessi nei loro regimi di allenamento o potenza assoluta in uscita nel perseguimento di un rapporto potenza/peso superiore. L’uso di OOC richiederebbe comunque una continuazione prolungata dell’uso di Glucocorticoidi nel periodo di gara per evitare l’insufficienza surrenalica dovuta a meccanismi di feedback. L’uso prolungato di Glucocorticoidi comporta rischi medici ben noti, alcuni dei quali potrebbero ridurre in modo permanente le prestazioni atletiche.[https://bjsm.bmj.com/]
- Rischi per la salute, eventi avversi ed effetti negativi sulle prestazioni
Il trattamento con Glucocorticoidi per molte condizioni ha una lunga storia e un profilo di sicurezza ragionevole. Dosi elevate o uso cronico di Glucocorticoidi sistemici presentano un certo rischio per la salute dell’atleta. Un esame attento, una diagnosi e una deliberazione da parte del medico sono fondamentali e i benefici del trattamento devono essere soppesati rispetto ai potenziali rischi ed effetti avversi. L’uso potenziale per migliorare le prestazioni, descritto sopra e ritenuto limitato a contesti sportivi specifici con uso di GC ad alto dosaggio, è anche potenzialmente associato a rischi significativi per la salute di un atleta.
Gli eventi avversi con associazioni causali ben consolidate all’uso clinicamente appropriato di GC toccano praticamente ogni sistema umano, vanno da esiti negativi sulla salute acuti a cronici e includono insufficienza surrenalica, immunodeficienza, osteoporosi, atrofia muscolare, cedimento di tendini/fasce, necrosi avascolare della testa femorale, vari squilibri elettrolitici, nutrizionali e metabolici, glaucoma e cataratta. Forse perché i GC sono farmaci così comuni e clinicamente versatili, alcuni medici potrebbero sopravvalutare il loro valore terapeutico e sottostimare la gravità degli eventi avversi associati.[https://bjsm.bmj.com/] Anche una singola iniezione intra-articolare potrebbe causare un’insufficienza surrenalica clinicamente significativa che porta a malessere, squilibrio elettrolitico e immunosoppressione per diverse settimane.[https://bjsm.bmj.com/]
È importante sottolineare che l’eziologia di questi sintomi potrebbe non essere riconosciuta dall’atleta e dal personale medico, in particolare in un contesto sportivo in cui gli atleti si allenano ad alta intensità e i sintomi possono mascherarsi da affaticamento correlato al sovrallenamento. Inoltre, un atleta che subisce un trauma o un infortunio grave potrebbe essere a maggior rischio di crisi surrenalica a causa della soppressione ipotalamo-ipofisi-surrene dovuta al precedente utilizzo di GC. Ciò potrebbe essere particolarmente problematico se l’atleta non rivela questo precedente utilizzo.
Sia l’efficacia che il potenziale danno delle iniezioni intra-articolari sono ampiamente dibattuti. Le prove di un recente studio prospettico controllato con placebo su pazienti con osteoartrite hanno suggerito che frequenti iniezioni di triamcinolone al ginocchio, somministrate secondo un programma prestabilito, non sono riuscite a gestire efficacemente il dolore a lungo termine e hanno portato a una riduzione statisticamente significativa dello spessore della cartilagine.[https://bjsm.bmj.com/]Tuttavia, le raccomandazioni della società medica, così come una meta-analisi completa, supportano l’efficacia e la sicurezza dello stesso intervento,[https://bjsm.bmj.com/l] suggerendo fortemente che un uso giudizioso di iniezioni intra-articolari in pazienti e circostanze appropriate può produrre risultati positivi. Vi è una mancanza di prove pubblicate sulla sicurezza o il danno dell’uso di GC intra-articolari nelle popolazioni di atleti e sono urgentemente necessarie ulteriori ricerche a causa dell’uso onnipresente di GC intra-articolari.
- Politiche per garantire l’uso appropriato dei GC
Nonostante le preoccupazioni di un possibile abuso per un vantaggio competitivo o potenziali effetti dannosi sulla salute degli atleti, i GC sono ampiamente utilizzati nello sport per legittime ragioni terapeutiche. Considerando che l’elenco è armonizzato in tutti gli sport, dal tiro con l’arco al wakeboard, il doping con i GC non è un problema laddove i presunti benefici dell’uso di GC ad alto dosaggio (potenza prolungata a intensità di esercizio submassimali o gestione aggressiva del peso catabolico) difficilmente miglioreranno le prestazioni. Pertanto, un AAF per i GC non sarebbe probabilmente associato a nessun intento di doping. L’uso di GC sistemici in molti sport deve essere considerato sotto una luce diversa rispetto agli sport ad alto rischio come il ciclismo, dove l’abuso è ben documentato e le prove scientifiche forniscono un certo supporto.
Consapevoli delle sfide specifiche poste dall’uso di GC nello sport, le organizzazioni sportive e antidoping hanno introdotto politiche innovative e stanno rafforzando le normative esistenti per affrontare l’uso terapeutico ragionevole dei GC.
Conclusioni su Glucocorticoidi e prestazioni sportive:
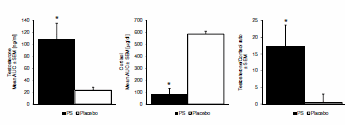
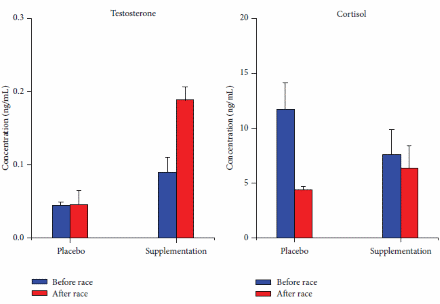
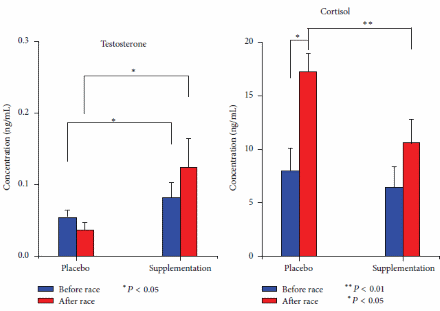
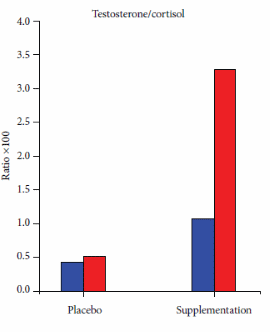
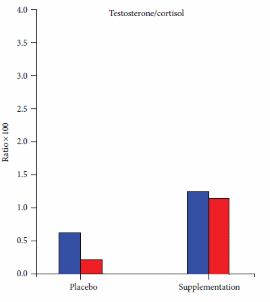
Da recenti review, sappiamo che l’uso dei Glucocorticoidi sistemici può migliorare la prestazione fisica massima rispetto al placebo (SDM 0,300, 95% CI 0,080-0,520). In una recente review [https://www.frontiersin.org/], l’SDM per i 13 confronti inclusi non era eterogeneo (I2 = 35%, p = 0,099). L’analisi di sensibilità escludendo i due studi con alto rischio di bias ha mostrato un effetto simile (SDM 0,349, 95% CI 0,071-0,626). Con la meta-regressione si è scoperto che la durata del trattamento, la via di somministrazione e il tipo di esercizio non hanno influenzato (p > 0,124) l’SDM. Nell’analisi stratificata il trattamento prolungato e l’ingestione orale hanno migliorato la prestazione fisica (p = 0,003). Il trattamento acuto e l’inalazione non hanno avuto alcun effetto sulla prestazione fisica (p > 0,564), l’analisi di sensibilità con studi ad alto rischio di bias rimossi o solo un trattamento per gruppo di controllo, ha mostrato un effetto simile all’analisi completa con SDM 0,334, 95% CI 0,075-0,592 e SDM 0,296 0,059-0,532, rispettivamente. L’analisi di sensibilità escludendo i sei confronti con meno di 10 coppie di dati non ha indicato alcun effetto dei Glucocorticoidi sulla prestazione fisica (p = 0,070). I Glucocorticoidi hanno migliorato la prestazione aerobica (SDM 0,348, 95% CI 0,129-0,567). Tre confronti hanno testato l’effetto dei Glucocorticoidi sulla prestazione anaerobica massima e la meta-analisi dei confronti non ha mostrato alcun effetto (p = 0,573) sulla prestazione fisica. L’effetto è rimasto non statisticamente significativo dopo aver incluso i due studi che misuravano la prestazione anaerobica all’interno di un test di prestazione aerobica (p = 0,491) e quando tutti i risultati della prestazione anaerobica negli studi inclusi (anche più risultati dello stesso studio) sono stati meta-analizzati (p = 0,177). Non è stato trovato alcun effetto dei Glucocorticoidi sulla spesa energetica durante la prestazione submassimale (SDM 0,-332, 95% CI −0,785 a 0,121).
In una review narrativa del 2016, Collomp et al. hanno mirato a riassumere le attuali conoscenze sugli effetti ergogenici dei glucocorticoidi negli esseri umani. Hanno riferito che un effetto ergogenico (sull’esercizio di endurance) dei Glucocorticoidi sistemici a breve termine è stato chiaramente dimostrato e che gli effetti a breve termine (4,5 giorni) e a lungo termine (4 settimane) dell’assunzione di Glucocorticoidi non hanno avuto alcun effetto sul VO2-max o sulla potenza massima in uscita durante protocolli di esercizio graduati. Hanno anche il test sul campo come categoria di test delle prestazioni, ma fanno riferimento solo allo studio di Casuso et al. che riporta un miglioramento delle prestazioni nella corsa a navetta, ma nessun cambiamento nelle prestazioni nello sprint. I risultati successivi supportano e rafforzano la conclusione di Collomp et al. ( per quanto riguarda l’esercizio di endurance poiché scopriamo anche che il trattamento prolungato con glucocorticoidi migliora le prestazioni aerobiche. Tuttavia, a differenza di Collomp et al. nelle ultime review sono stati inclusi sia test di esercizio graduati che test sul campo (della durata di 1 minuto o più) nella definizione di prestazione aerobica e quindi, più studi che hanno aggiunto potenza statistica alla analisi. Non è stato trovato alcun effetto dei Glucocorticoidi sulla prestazione anaerobica quando è stato analizzato secondo il protocollo di studio, tuttavia sono stati inclusi solo tre studi che testavano la prestazione anaerobica. Per aumentare la potenza statistica, è stato anche incluso la prestazione anaerobica all’interno di test aerobici e più test anaerobici dallo stesso studio, ma ancora non era evidente alcun effetto dei glucocorticoidi. Questo approccio può diminuire la validità dell’analisi poiché la prestazione anaerobica all’interno di test aerobici può testare altre abilità rispetto ai test anaerobici e la meta-analisi di più risultati dagli stessi soggetti e l’intervento non è raccomandato dal Cochrane Handbook. Collomp et al. concludono che non è chiaro se i Glucocorticoidi migliorino la prestazione durante l’esercizio breve-intenso. Questa conclusione è ancora valida poiché solo pochi studi hanno indagato l’effetto dei glucocorticoidi sull’esercizio anaerobico/breve intenso. Tuttavia, quando meta-analizziamo tutte le prove disponibili, sembra che i Glucocorticoidi non migliorino le prestazioni anaerobiche. I Glucocorticoidi non hanno influenzato le prestazioni submassimali aumentando l’energia totale spesa e/o il VO2max a un carico fisso, ma questa conclusione dovrebbe anche essere interferita con cationi poiché l’analisi include solo 35 soggetti, il che fornisce una potenza statistica limitata.
L’uso di Glucocorticoidi nello sport è una questione altamente complessa a causa del loro uso diffuso in medicina, delle numerose formulazioni e vie di somministrazione con farmacocinetica variabile, effetti negativi sulla salute e potenziali associazioni di doping.
In definitiva, da quanto recentemente emerso attraverso il riassunto delle migliori prove scientifiche disponibili, i Glucocorticoidi migliorano le prestazioni aerobiche e massime, ma non influenzano le prestazioni anaerobiche nei soggetti sani.
Gabriel Bellizzi [CEO BioGenTech]
Riferimenti:
- Pelt AC (2011). Glucocorticoids: effects, action mechanisms, and therapeutic uses. Hauppauge, N.Y.: Nova Science. ISBN 978-1617287589.[page needed]
- Jump up to:a b c Rhen T, Cidlowski JA (Oct 2005). “Antiinflammatory action of glucocorticoids–new mechanisms for old drugs”. The New England Journal of Medicine. 353 (16): 1711–1723. doi:10.1056/NEJMra050541. PMID 16236742. S2CID 5744727.
- Botía M, Escribano D, Martínez-Subiela S, Tvarijonaviciute A, Tecles F, López-Arjona M, et al. (January 2023). “Different Types of Glucocorticoids to Evaluate Stress and Welfare in Animals and Humans: General Concepts and Examples of Combined Use”. Metabolites. 13 (1): 106. doi:10.3390/metabo13010106. PMC 9865266. PMID 36677031.
- Ralph CR, Tilbrook AJ (February 2016). “INVITED REVIEW: The usefulness of measuring glucocorticoids for assessing animal welfare”. Journal of Animal Science. 94 (2): 457–470. doi:10.2527/jas.2015-9645. PMID 27065116.
- Collomp K, Arlettaz A, Buisson C, Lecoq AM, Mongongu C. Glucocorticoid administration in athletes: performance, metabolism and detection. Steroids. (2016) 115:193–202. doi: 10.1016/j.steroids.2016.09.008 PubMed Abstract | CrossRef Full Text | Google Scholar
- Fain JN, Cheema P, Tichansky DS, Madan AK. Stimulation of human omental adipose tissue lipolysis by growth hormone plus dexamethasone. Mol Cell Endocrinol. (2008) 295(1):101–5. doi: 10.1016/j.mce.2008.05.014PubMed Abstract | CrossRef Full Text | Google Scholar
- Thomasson R, Rieth N, Jollin L, Amiot V, Lasne F, Collomp K. Short-term glucocorticoid intake and metabolic responses during long-lasting exercise. Horm Metab Res. (2011) 43(3):216–22. doi: 10.1055/s-0030-1269919 PubMed Abstract | CrossRef Full Text | Google Scholar
- Duclos M, Guinot M, Le Bouc Y, Cortisol GH. Odd and controversial ideas. Appl Physiol Nutr Metab. (2007) 32(5):895–903. doi: 10.1139/h07-064PubMed Abstract | CrossRef Full Text | Google Scholar
- Sapolsky RM, Romero LM, Munck AU. How do glucocorticoids influence stress responses? Integrating permissive, suppressive, stimulatory, and preparative actions. Endocr Rev. (2000) 21(1):55–89. doi: 10.1210/edrv.21.1.0389PubMed Abstract | CrossRef Full Text | Google Scholar
- Duclos M. Evidence on ergogenic action of glucocorticoids as a doping agent risk. Phys Sportsmed. (2010) 38(3):121–7. doi: 10.3810/psm.2010.10.1817PubMed Abstract | CrossRef Full Text | Google Scholar
- Strehl C, Bijlsma JWJ, de Wit M, Boers M, Caeyers N, Cutolo M, et al. Defining conditions where long-term glucocorticoid treatment has an acceptably low level of harm to facilitate implementation of existing recommendations: viewpoints from an EULAR task force. Ann Rheum Dis. (2016) 75(6):952–7. doi: 10.1136/annrheumdis-2015-20891PubMed Abstract | CrossRef Full Text | Google Scholar
- WADA. The prohibited list. Available at: https://www.wada-ama.org/en/prohibited-list#search-anchor (Accessed March 4, 2022).
- Ventura R, Daley-Yates P, Mazzoni I, Collomp K, Saugy M, Buttgereit F, et al. A novel approach to improve detection of glucocorticoid doping in sport with new guidance for physicians prescribing for athletes. Br J Sports Med. (2021) 55(11):631–42. doi: 10.1136/bjsports-2020-103512
- Hanukoglu I (December 1992). “Steroidogenic enzymes: structure, function, and role in regulation of steroid hormone biosynthesis”. The Journal of Steroid Biochemistry and Molecular Biology. 43 (8): 779–804. doi:10.1016/0960-0760(92)90307-5. PMID 22217824. S2CID 112729. Archived from the original on 26 April 2021. Retrieved 20 April 2018.
- Miller WL, Auchus RJ (February 2011). “The molecular biology, biochemistry, and physiology of human steroidogenesis and its disorders”. Endocr Rev. 32 (1): 81–151. doi:10.1210/er.2010-0013. PMC 3365799. PMID 21051590.
- Oestlund I, Snoep J, Schiffer L, Wabitsch M, Arlt W, Storbeck KH (February 2024). “The glucocorticoid-activating enzyme 11β-hydroxysteroid dehydrogenase type 1 catalyzes the activation of testosterone”. J Steroid Biochem Mol Biol. 236: 106436. doi:10.1016/j.jsbmb.2023.106436. PMID 38035948.
- “IUPAC-IUB Joint Commission on Biochemical Nomenclature (JCBN). The nomenclature of steroids. Recommendations 1989, chapter 3S-4.9”. European Journal of Biochemistry. 186 (3): 429–458. December 1989. doi:10.1111/j.1432-1033.1989.tb15228.x. PMID 2606099. Archived from the original on 19 February 2024. Retrieved 19 February 2024.
3S‐4.9. Trivial names of important steroids Examples of trivial names retained for important steroid derivatives, these being mostly natural compounds of significant biological activity, are given in Table 2
- Curnow KM, Tusie-Luna MT, Pascoe L, et al. (October 1991). “The product of the CYP11B2 gene is required for aldosterone biosynthesis in the human adrenal cortex”. Mol. Endocrinol. 5 (10): 1513–22. doi:10.1210/mend-5-10-1513. PMID 1775135.
- Zhou M, Gomez-Sanchez CE (July 1993). “Cloning and expression of a rat cytochrome P-450 11 beta-hydroxylase/aldosterone synthase (CYP11B2) cDNA variant”. Biochem. Biophys. Res. Commun. 194 (1): 112–7. doi:10.1006/bbrc.1993.1792. PMID 8333830.
- Marieb Human Anatomy & Physiology 9th edition, chapter:16, page:629, question number:14
- Hu C, Rusin CG, Tan Z, Guagliardo NA, Barrett PQ (June 2012). “Zona glomerulosa cells of the mouse adrenal cortex are intrinsic electrical oscillators”. J. Clin. Invest. 122 (6): 2046–53. doi:10.1172/JCI61996. PMC 3966877. PMID 22546854.
- Hanukoglu A, Fried D, Nakash I, Hanukoglu I (Nov 1995). “Selective increases in adrenal steroidogenic capacity during acute respiratory disease in infants”. Eur J Endocrinol. 133 (5): 552–6. doi:10.1530/eje.0.1330552. PMID 7581984. S2CID 44439040.
- Barrett, Kim E. (2019). Ganong’s review of medical physiology. Susan M. Barman, Heddwen L. Brooks, Jason X.-J. Yuan, William F. Preceded by: Ganong (26th ed.). [New York]. p. 337. ISBN 9781260122404. OCLC 1076268769.
- Ehrhart-Bornstein M, Hilbers U (1998). “Neuroendocrine properties of adrenocortical cells”. Horm. Metab. Res. 30 (6–7): 436–9. doi:10.1055/s-2007-978911. PMID 9694576. S2CID 260169208.
- Lefebvre H, Cartier D, Duparc C, et al. (March 2002). “Characterization of serotonin(4) receptors in adrenocortical aldosterone-producing adenomas: in vivo and in vitro studies”. J. Clin. Endocrinol. Metab. 87 (3): 1211–6. doi:10.1210/jcem.87.3.8327. PMID 11889190.
- Ye P, Mariniello B, Mantero F, Shibata H, Rainey WE (October 2007). “G-protein-coupled receptors in aldosterone-producing adenomas: a potential cause of hyperaldosteronism”. J. Endocrinol. 195 (1): 39–48. doi:10.1677/JOE-07-0037. PMID 17911395.
- Haidan A, Bornstein SR, Glasow A, Uhlmann K, Lübke C, Ehrhart-Bornstein M (February 1998). “Basal steroidogenic activity of adrenocortical cells is increased 10-fold by coculture with chromaffin cells”. Endocrinology. 139 (2): 772–80. doi:10.1210/endo.139.2.5740. PMID 9449652.
- Hall, John E. (2021). Guyton and Hall textbook of medical physiology. Michael E. Hall (14th ed.). Philadelphia, PA. p. 956. ISBN 978-0-323-59712-8. OCLC 1129099861.
- London E, Wassif CA, Horvath A, Tatsi C, Angelousi A, Karageorgiadis AS, Porter FD, Stratakis CA (2015). “Cholesterol Biosynthesis and Trafficking in Cortisol-Producing Lesions of the Adrenal Cortex”. J Clin Endocrinol Metab. 100 (10): 3660–7. doi:10.1210/jc.2015-2212. PMC 4596036.
- Pazirandeh A, Xue Y, Prestegaard T, Jondal M, Okret S (May 2002). “Effects of altered glucocorticoid sensitivity in the T cell lineage on thymocyte and T cell homeostasis”. FASEB Journal. 16 (7): 727–729. doi:10.1096/fj.01-0891fje. PMID 11923224. S2CID 23891076.
- Carlson NR (2010). Physiology of Behavior (11th ed.). New York: Allyn & Bacon. p. 605. ISBN 978-0-205-23939-9.
- Sapolsky RM (October 1994). “Glucocorticoids, stress and exacerbation of excitotoxic neuron death”. Seminars in Neuroscience. 6 (5): 323–331. doi:10.1006/smns.1994.1041.
- de Quervain DJ, Roozendaal B, McGaugh JL (Aug 1998). “Stress and glucocorticoids impair retrieval of long-term spatial memory”. Nature. 394 (6695): 787–790. Bibcode:1998Natur.394..787D. doi:10.1038/29542. PMID 9723618. S2CID 4388676.
- Lupien SJ, McEwen BS, Gunnar MR, Heim C (Jun 2009). “Effects of stress throughout the lifespan on the brain, behaviour and cognition”. Nature Reviews. Neuroscience. 10 (6): 434–445. doi:10.1038/nrn2639. PMID 19401723. S2CID 205504945.
- Cahill L, McGaugh JL (Jul 1998). “Mechanisms of emotional arousal and lasting declarative memory”. Trends in Neurosciences. 21 (7): 294–299. doi:10.1016/s0166-2236(97)01214-9. PMID 9683321. S2CID 29839557.
- Belanoff JK, Gross K, Yager A, Schatzberg AF (2001). “Corticosteroids and cognition”. Journal of Psychiatric Research. 35 (3): 127–145. doi:10.1016/S0022-3956(01)00018-8. PMID 11461709.
- Lupien SJ, Maheu F, Tu M, Fiocco A, Schramek TE (Dec 2007). “The effects of stress and stress hormones on human cognition: Implications for the field of brain and cognition”. Brain and Cognition. 65 (3): 209–237. doi:10.1016/j.bandc.2007.02.007. PMID 17466428. S2CID 5778988.
- Wolkowitz OM, Lupien SJ, Bigler ED (Jun 2007). “The ‘steroid dementia syndrome’: a possible model of human glucocorticoid neurotoxicity”. Neurocase. 13 (3): 189–200. doi:10.1080/13554790701475468. PMID 17786779. S2CID 39340010.
- Norra C, Arndt M, Kunert HJ (Jan 2006). “Steroid dementia: an overlooked diagnosis?”. Neurology. 66 (1): 155, author reply 155. doi:10.1212/01.wnl.0000203713.04232.82. PMID 16401879. S2CID 11524545.
- Varney NR, Alexander B, MacIndoe JH (Mar 1984). “Reversible steroid dementia in patients without steroid psychosis”. The American Journal of Psychiatry. 141 (3): 369–372. doi:10.1176/ajp.141.3.369. PMID 6703100.
- Liu C, Guan J, Kang Y, Xiu H, Chen Y, Deng B, et al. (2010). “Inhibition of dehydration-induced water intake by glucocorticoids is associated with activation of hypothalamic natriuretic peptide receptor-A in rat”. PLOS ONE. 5 (12): e15607. Bibcode:2010PLoSO…515607L. doi:10.1371/journal.pone.0015607. PMC 3004933. PMID 21187974.
- Liu C, Chen Y, Kang Y, Ni Z, Xiu H, Guan J, et al. (Oct 2011). “Glucocorticoids improve renal responsiveness to atrial natriuretic peptide by up-regulating natriuretic peptide receptor-A expression in the renal inner medullary collecting duct in decompensated heart failure”. The Journal of Pharmacology and Experimental Therapeutics. 339 (1): 203–209. doi:10.1124/jpet.111.184796. PMID 21737535. S2CID 1892149.
- Revollo JR, Cidlowski JA (Oct 2009). “Mechanisms generating diversity in glucocorticoid receptor signaling”. Annals of the New York Academy of Sciences. 1179 (1): 167–178. Bibcode:2009NYASA1179..167R. doi:10.1111/j.1749-6632.2009.04986.x. PMID 19906239. S2CID 28995545.
- Newton R, Holden NS (Oct 2007). “Separating transrepression and transactivation: a distressing divorce for the glucocorticoid receptor?”. Molecular Pharmacology. 72 (4): 799–809. doi:10.1124/mol.107.038794. PMID 17622575. S2CID 52803631.
- Tarner IH, Englbrecht M, Schneider M, van der Heijde DM, Müller-Ladner U (2012). “The role of corticosteroids for pain relief in persistent pain of inflammatory arthritis: a systematic literature review”. The Journal of Rheumatology. Supplement. 90: 17–20. doi:10.3899/jrheum.120337. PMID 22942324. S2CID 31663619.
- Haywood A, Good P, Khan S, Leupp A, Jenkins-Marsh S, Rickett K, et al. (2015). “Corticosteroids for the management of cancer-related pain in adults” (PDF). The Cochrane Database of Systematic Reviews. 2021 (4): CD010756. doi:10.1002/14651858.CD010756.pub2. hdl:10072/134448. PMC 8127040. PMID 25908299.
- Chowdhury R, Naaseri S, Lee J, Rajeswaran G (2014). “Imaging and management of greater trochanteric pain syndrome”. Postgraduate Medical Journal. 90 (1068): 576–581. doi:10.1136/postgradmedj-2013-131828. PMID 25187570. S2CID 24344273.
- Mohamadi A, Chan JJ, Claessen FM, Ring D, Chen NC (January 2017). “Corticosteroid Injections Give Small and Transient Pain Relief in Rotator Cuff Tendinosis: A Meta-analysis”. Clinical Orthopaedics and Related Research. 475 (1): 232–243. doi:10.1007/s11999-016-5002-1. PMC 5174041. PMID 27469590.
- Goppelt-Struebe M, Wolter D, Resch K (Dec 1989). “Glucocorticoids inhibit prostaglandin synthesis not only at the level of phospholipase A2 but also at the level of cyclo-oxygenase/PGE isomerase”. British Journal of Pharmacology. 98 (4): 1287–1295. doi:10.1111/j.1476-5381.1989.tb12676.x. PMC 1854794. PMID 2514948.
- Jun SS, Chen Z, Pace MC, Shaul PW (Feb 1999). “Glucocorticoids downregulate cyclooxygenase-1 gene expression and prostacyclin synthesis in fetal pulmonary artery endothelium”. Circulation Research. 84 (2): 193–200. doi:10.1161/01.RES.84.2.193. PMID 9933251.
- Flower R, Rang HP, Dale MM, Ritter JM (2007). Rang & Dale’s pharmacology. Edinburgh: Churchill Livingstone. ISBN 978-0-443-06911-6.
- Mizokami T, Hamada K, Maruta T, Higashi K, Tajiri J (September 2016). “Painful Radiation Thyroiditis after 131I Therapy for Graves’ Hyperthyroidism: Clinical Features and Ultrasonographic Findings in Five Cases”. European Thyroid Journal. 5 (3): 201–206. doi:10.1159/000448398. PMC 5091234. PMID 27843811.
- Rado JP, Blumenfeld G, Hammer S (Nov 1959). “The effect of prednisone and 6-methylprednisolone on mercurial diuresis in patients with refractory cardiac edema”. The American Journal of the Medical Sciences. 238 (5): 542–551. doi:10.1097/00000441-195911000-00003. PMID 14435747. S2CID 38687480.
- Riemer AD (Apr 1958). “Application of the newer corticosteroids to augment diuresis in congestive heart failure”. The American Journal of Cardiology. 1 (4): 488–496. doi:10.1016/0002-9149(58)90120-6. PMID 13520608.
- Newman DA (Feb 1959). “Reversal of intractable cardiac edema with prednisone”. New York State Journal of Medicine. 59 (4): 625–633. PMID 13632954.
- Zhang H, Liu C, Ji Z, Liu G, Zhao Q, Ao YG, et al. (Sep 2008). “Prednisone adding to usual care treatment for refractory decompensated congestive heart failure”. International Heart Journal. 49 (5): 587–595. doi:10.1536/ihj.49.587. PMID 18971570.
- Liu C, Liu G, Zhou C, Ji Z, Zhen Y, Liu K (Sep 2007). “Potent diuretic effects of prednisone in heart failure patients with refractory diuretic resistance”. The Canadian Journal of Cardiology. 23 (11): 865–868. doi:10.1016/s0828-282x(07)70840-1. PMC 2651362. PMID 17876376.
- Liu C, Chen H, Zhou C, Ji Z, Liu G, Gao Y, et al. (Oct 2006). “Potent potentiating diuretic effects of prednisone in congestive heart failure”. Journal of Cardiovascular Pharmacology. 48 (4): 173–176. doi:10.1097/01.fjc.0000245242.57088.5b. PMID 17086096. S2CID 45800521.
- Massari F, Mastropasqua F, Iacoviello M, Nuzzolese V, Torres D, Parrinello G (Mar 2012). “The glucocorticoid in acute decompensated heart failure: Dr Jekyll or Mr Hyde?”. The American Journal of Emergency Medicine. 30 (3): 517.e5–10. doi:10.1016/j.ajem.2011.01.023. PMID 21406321.
- Henderson I, Caiazzo E, McSharry C, Guzik TJ, Maffia P (October 2020). “Why do some asthma patients respond poorly to glucocorticoid therapy?”. Pharmacological Research. 160: 105189. doi:10.1016/j.phrs.2020.105189. PMC 7672256. PMID 32911071.