La Melatonina (chimicamente N-acetil-5-metossitriptammina; formula bruta o molecolare C13H16N2O2) è un ormone prodotto dalla ghiandola pineale (o epifisi), ghiandola posta alla base del cervello. Agisce sull’ipotalamo e ha la principale funzione di regolare il ciclo sonno-veglia. Oltre che negli esseri umani, essa è prodotta da specie animali, piante (Fitomelatonina) e microorganismi.[1][2]

Nel 1917, McCord e Allen avevano notato (J. exp. zool.[3], 1917) che l’estratto delle ghiandole pineali delle mucche schiariva la pelle delle rane.[4][5] Si noti, infatti, che la Melatonina è coinvolta nel meccanismo con il quale alcuni anfibi e rettili cambiano il colore della propria pelle e pertanto fu scoperta in relazione a questo suo ruolo biologico.[6][7] Quindi, la sostanza responsabile (Melatonina) fu isolata nel 1958 dall’urina di topo, dal professore di dermatologia Aaron B. Lerner, insieme a suoi colleghi dell’Università di Yale, in ricerche mosse dall’aspettativa che la sostanza presente nella ghiandola pineale potesse essere utile nel trattamento di affezioni della pelle.[8] Questi stessi ricercatori coniarono il nome Melatonina.[9]
Verso la metà degli anni settanta, Lynch et al. dimostrarono[10] che la produzione di Melatonina da parte della ghiandola pineale umana segue un ritmo circadiano. La scoperta delle proprietà antiossidanti della Melatonina è del 1993.[11] Il primo brevetto per il suo impiego a basse dosi nel trattamento dell’insonnia fu accordato a Richard Wurtman del MIT nel 1995.[12] Nello stesso periodo la Melatonina apparve spesso sulla stampa, anche e soprattutto in quella a diffusione non settoriale, come possibile trattamento per varie malattie.[13] Famoso è l’impiego della Melatonina nel “Metodo Di Bella” insieme ad altre molecole biologiche.[14]
In questo articolo il mio intento è quello di analizzare i potenziali effetti sulla Leptina e il tessuto adiposo in generale legati alla supplementazione di Melatonina.

Uno studio sull’uomo nel quale è stata utilizzata Melatonina integrativa e sono state fatte misurazioni della Leptina sierica, ha osservato che, in una popolazione di 11 persone con ulcere allo stomaco idiopatica, la Leptina è aumentata da 6,2-7,0ng/ml a 12,2-16,2ng/ml dopo 7 giorni, mantenendo questo livello fino a 21 giorni dopo l’assunzione di 5 mg di Melatonina due volte al giorno, mattina e sera.[15] La stessa dose (10 mg) nelle persone con epatopatia grassa non alcolica per 28 giorni con Leptina elevata ha causato un ulteriore aumento di quest’ultima del 33%.[16] Questi effetti sono stati osservati anche nei ratti a 25mcg/mL miscelati nell’acqua potabile (circa 500mcg al giorno) per 9 settimane con una dieta ad alto contenuto di grassi (35% di grassi, 35% di carboidrati) o un basso contenuto di grassi (4% di grassi, 60 % di carboidrati), in cui l’area sotto la curva della Leptina era aumentata, ma solo se misurata dalla mattina presto alla sera presto, senza differenze significative in qualsiasi momento della sera.[17] Un altro studio sui ratti che utilizzava una dose inferiore di 10mcg/mL (alla fine era di 35mcg al giorno) sempre disciolti in acqua ha anche riscontrato influenze sulla Leptina circolante, in cui i livelli erano aumentati a circa il 150% rispetto al gruppo di controllo (dati derivati dal grafico) dopo un mese. Questo studio ha anche riscontrato un aumento dello Zinco circolante. [18] Risultati simili sono stati osservati in casi di eccessiva somministrazione di Melatonina (3 mg/kg nei topi tramite I.V), in cui la Leptina è aumentata al 127% rispetto al controllo per 6 mesi. [19]

Quando si esaminano le cellule adipose isolate (dove viene prodotta la maggior parte della Leptina), la quantità di Leptina secreta non viene significativamente aumentata quando incubata con Melatonina 1nM.[18] Tuttavia, ciò può essere dovuto all’incubazione con la sola Melatonina, poiché altri studi che accoppiano la Melatonina con l’Insulina mostrano che la Melatonina può aumentare la secrezione di leptina indotta dall’Insulina, poiché nessuna delle due ha indotto la secrezione di leptina in vitro da sola, mentre la combinazione ha causato un aumento della secrezione del 120% e del 50% quella del contenuto di mRNA. L’aggiunta di Desametasone alla combinazione ha aumentato questi livelli rispettivamente al 250% e al 100%. [20] La Melatonina è stata in grado di sopprimere una marcata sotto regolazione indotta dal Adenosina Monofosfato Ciclico (cAMP) del rilascio di Leptina e svolgere un ruolo sinergico nell’attivazione del recettore dell’Insulina e del suo bersaglio, la proteina chinasi B (Akt). I suoi effetti furono soppressi quando venne impedita l’azione del MT1.[20] Questi effetti sono stati successivamente replicati dallo stesso gruppo di ricerca, con la stessa potenza, quando gli adipociti sono stati incubati con un protocollo di “12 ore on/12 ore off ” per imitare il ritmo circadiano.[21]

L’aumento della Leptina può essere un meccanismo di feedback negativo dovuto alla segnalazione della Melatonina. La Melatonina è stata studiata per le sue interazioni con l’obesità, poiché i ratti privi di ghiandole pineale che secerne la Melatonina (ratti che hanno subito una pinealectomia) sperimentano un aumento della lipogenesi e una riduzione della lipolisi. [22] L’abbinamento di una mancanza di secrezione e sintesi di Melatonina con l’aumento di peso suggerisce che la Melatonina può essere anti-obesogenica (riduce l’aumento di grasso) o induttiva della perdita di grasso.
La Melatonina sembra essere in qualche modo un regolatore negativo della fisiologia degli adipociti, essendo in grado di influenzare la differenziazione delle cellule staminali mesenchimali (MSC) lontano dagli adipociti e promuovere la crescita delle cellule osteogeniche secondaria all’inibizione del Recettore Attivato dai Proliferatori Perossisomiali (PPAR) [23] mentre sopprime la proliferazione di adipociti maturi 3T3-L1, secondari alla soppressione dell’attività trascrizionale C/EBPbeta. [24] Se trattata in preadipociti 3T3-L1, la Melatonina è in grado di indurre proliferazione. Questo sembra agire attraverso l’attivazione del recettore MT1. [25]
In un modello di adipociti PAZ6 (la linea cellulare dei preadipociti bruni umani)
[26]), è stato riscontrato che esisteva l’mRNA per entrambi i recettori della Melatonina e, tramite i recettori MT2, sopprimeva la traslocazione dei GLUT4 e l’assorbimento del glucosio di circa il 25% in 14 giorni di incubazione, ma non riusciva a ridurre significativamente l’attività dopo un giorno. [26] In questo studio, gli adipociti bruni e bianchi sono stati entrambi testati e sebbene quelli bianchi avessero meno MT1 rispetto agli adipociti bruni, quelli bianchi non esprimevano MT2. [26] Uno studio che utilizzava Luzindole (un agonista per lo più degli MT2 ma con una certa affinità con gli MT1) ha dimostrato che era meno efficace della Melatonina nel creare questi effetti, supportando la mancanza o una relativa assenza di MT2 attivo sugli adipociti bianchi.[25] L’attivazione dei recettori della Melatonina sembra essere associata alla soppressione dell’Adenil Ciclasi e ad una diminuzione dei livelli di Cortisolo-indotta dell’Aromatasi (cAMP). [25] [24] Questa riduzione dei livelli di cAMP (associata alla proteina Gi accoppiata ai recettori della Melatonina) può sopprimere la lipolisi indotta dalla stimolazione beta-2 adrenergica. [27]

Quando si studia l’ossidazione, l’incubazione dei preadipociti con la Melatonina è associata ad un aumento dei livelli di Rame, Zinco, Manganese e Superossido Dismutasi (SOD). È stato osservato un aumento della catalasi dopo un’incubazione di 24 ore. Queste tendenze si sono invertite dopo 48 ore di incubazione.
Quando i ratti vengono trattati con 500mcg di Melatonina al giorno attraverso l’acqua potabile e contemporaneamente vengono sottoposti ad una dieta ricca di grassi (35%), il tasso di aumento di peso viene attenuato, indipendentemente dalle variazioni delle calorie. [17] Questo è stato replicato con 0,4mcg/mL, dove è stata registrata una riduzione del 7% del peso corporeo e una massa adiposa intra-addominale inferiore del 16%. [28] Quando 5mg di Melatonina vengono somministrati 2 ore prima di coricarsi a un campione di persone con sindrome metabolica, è stata osservata una piccola ma statisticamente significativa riduzione dell’IMC (da 29 a 28,8) nell’arco di due mesi, che si correla con miglioramenti della pressione sanguigna e profilo antiossidante.[29]
Fino a questo punto le informazioni esposte sono senza dubbio interessanti e applicabili in diversi contesti, dal soggetto obeso/sovrappeso all’atleta in regime ipocalorico prolungato (vedi calo della Leptina e sue conseguenze sistemiche in condizioni di ipoalimentazione). Ma gli effetti collaterali? Ovviamente esistono sebbene hanno un incidenza piuttosto contenuta se la supplementazione si limita ai dosaggi comunemente indicati (1-10mg/die max).
Quindi, la Melatonina sembra causare pochissimi effetti collaterali come osservato nei test sul breve termine, fino a tre mesi, e a basse dosi [vedi soglia variabile sopra esposta]. Due reviews sistematiche non hanno riscontrato effetti avversi della Melatonina esogena in numerosi studi clinici e studi comparativi hanno riscontrato che gli effetti collaterali quali mal di testa, vertigini, nausea e sonnolenza sono stati riportati in egual misura sia per la Melatonina che per il placebo. [30] [31] La Melatonina a rilascio prolungato è sicura con un uso a lungo termine fino a 12 mesi. [32] Sebbene non sia raccomandato per un uso a lungo termine oltre a questo lasso di tempo, la Melatonina a basso dosaggio è generalmente più sicura e un’alternativa migliore, rispetto a molte prescrizioni farmaceutiche da banco e non per indurre il sonno con necessità d’uso per un lungo periodo di tempo e con rischio di sviluppare dipendenza. Le basse dosi di Melatonina sono generalmente sufficienti per produrre un effetto ipnotico nella maggior parte delle persone. Dosi più elevate non sembrano produrre un effetto più forte, ma sembrano invece provocare sonnolenza per un periodo di tempo più lungo.[33]
La Melatonina può causare nausea, irritabilità il giorno successivo e irritabilità. [34] Negli anziani, il suo uso può causare una riduzione del flusso sanguigno e ipotermia. [35] [necessità di aggiornamento] Nei disturbi autoimmuni, l’evidenza è in conflitto se l’integrazione di Melatonina può migliorare o esacerbare i sintomi dovuti all’immunomodulazione. [36] [37] [necessità di aggiornamento]
La Melatonina può abbassare i livelli dell’ormone follicolo-stimolante. [38] Gli effetti della Melatonina sulla riproduzione umana rimangono poco chiari. [39]
In quelli che assumono warfarin, alcune prove suggeriscono che potrebbe esistere una potente interazione farmacologica, aumentando l’effetto anticoagulante del warfarin e il rischio di sanguinamento. [40]
Comunque sia, in base ai dati ad oggi disponibili, la supplementazione di Melatonina al fine di coadiuvare la perdita di peso in soggetti obesi o sovrappeso, o per mantenere livelli più alti di Leptina in periodi prolungati di ipocalorica (con tutti i vantaggi del caso, specie in un Natural), necessita di un dosaggio tra i 5 ed i 10mg al giorno somministrati in una o due dosi giornaliere. Ovviamente si tratta di una pratica attualmente sperimentale sebbene i presupposti per una sua azione a grado soddisfacente non sono così scarse.
Gabriel Bellizzi
Riferimenti:
1- Caniato R et al., Melatonin in plants, in Adv. Exp. Med. Biol., Advances in Experimental Medicine and Biology, vol. 527, 2003, pp. 593–7, DOI:10.1007/978-1-4615-0135-0_68, ISBN 978-0-306-47755-3, PMID 15206778.
2- Paredes SD et al., Phytomelatonin: a review, in J. Exp. Bot., vol. 60, nº 1, 2009, pp. 57–69, DOI:10.1093/jxb/ern284, PMID 19033551.
3- The journal of experimental zoology.
4- Paul M. Coates, Marc R. Blackman; Gordon M. Cragg; Mark Levine; Joel Moss; Jeffrey D. White, Encyclopedia of dietary supplements, CRC Press, 2005, p. 819, ISBN 978-0-8247-5504-1. URL consultato il 16 febbraio 2012.
5- Paul M. Coates, M. Coates Paul, Marc Blackman, Marc R. Blackman, Gordon M. Cragg, Mark Levine, Jeffrey D. White, Joel Moss e Mark A. Levine, Encyclopedia of Dietary Supplements, su books.google.it. URL consultato il 12 giugno 2018.
«However, the finding did indicate that the pineal contained e compound with at least some biological activity, and it provided a way of identifying tue active compound, using assays based on the ability of purified extracts to aggregate the melanin granules in the frog’s pigment cells. In 1958, Lerner et al.[2] discovered the compound’s chemical structure to be 5-methoxy-N-acetyltryptamine and named melatonin.».
6- Ana Maria Caliman Filadelfi, Castrucci, Ana Maria de Lauro, Comparative aspects of the pineal/melatonin system of poikilothermic vertebrates, in Journal of Pineal Research, vol. 20, nº 4, 1996, pp. 175–86, DOI:10.1111/j.1600-079X.1996.tb00256.x, PMID 8836950.
7- David Sugden, Davidson, Kathryn; Hough, Kate A;Teh, Muy-Teck, Melatonin, Melatonin Receptors and Melanophores: A Moving Story, in Pigment Cell Research, vol. 17, nº 5, 2004, pp. 454–60, DOI:10.1111/j.1600-0749.2004.00185.x, PMID 15357831.
8- Hing-Sing Yu, Russel J. Reiter, Melatonin: Biosynthesis, Physiological Effects, and Clinical Applications, CRC Press, 1993, p. 550, ISBN 978-0-8493-6900-1.
9- A.B. Lerner, Case, J.D. Takahashi, Y., Isolation of melatonin and 5-methoxyindole-3-acetic acid from bovine pineal glands, in The Journal of biological chemistry, vol. 235, 1960, pp. 1992–7, PMID 14415935.
10- H. Lynch, Wurtman, R. Moskowitz, M. Archer, M. Ho, M., Daily rhythm in human urinary melatonin, in Science, vol. 187, nº 4172, 1975, pp. 169–71, DOI:10.1126/science.1167425, PMID 1167425.
11- D. X. Tan, Chen, L. D. Poeggeler, B. Manchester, L. C. Reiter, R. J., Melatonin: a potent, endogenous hydroxyl radical scavenger, in Endocrine J, vol. 1, 1993, pp. 57-60.
12- Methods of inducing sleep using melatonin, Patent Genius. URL consultato l’11 giugno 2018 (archiviato dall’url originale il 4 febbraio 2018).
«Brevetto USA #5449683».
13- J. Arendt, Melatonin: Characteristics, Concerns, and Prospects, in Journal of Biological Rhythms, vol. 20, nº 4, 2005, pp. 291-303, DOI:10.1177/0748730405277492, PMID 16077149.
«There is very little evidence in the short term for toxicity or undesirable effects in humans. The extraordinary “hype” of the miraculous powers of melatonin in the recent past did a disservice to acceptance of its genuine benefits».
14- http://www.metododibella.org/it/Melatonina.html
15- Celinski K, et al. Melatonin or L-tryptophan accelerates healing of gastroduodenal ulcers in patients treated with omeprazole.
J Pineal Res (2011)
16- Gonciarz M, et al. Plasma insulin, leptin, adiponectin, resistin, ghrelin, and melatonin in nonalcoholic steatohepatitis patients treated with melatonin.
J Pineal Res (2012)
17- Ríos-Lugo MJ, et al. Melatonin effect on plasma adiponectin, leptin, insulin, glucose, triglycerides and cholesterol in normal and high fat-fed rats.
J Pineal Res (2010)
18- Song YM, Chen MD. Effects of melatonin administration on plasma leptin concentration and adipose tissue leptin secretion in mice.
Acta Biol Hung (2009)
19- Baltaci AK, Mogulkoc R. Pinealectomy and melatonin administration in rats: their effects on plasma leptin levels and relationship with zinc.
Acta Biol Hung (2007)
20- Alonso-Vale MI, et al. Melatonin enhances leptin expression by rat adipocytes in the presence of insulin.
Am J Physiol Endocrinol Metab (2005)
21- Alonso-Vale MI, et al. Intermittent and rhythmic exposure to melatonin in primary cultured adipocytes enhances the insulin and dexamethasone effects on leptin expression.
J Pineal Res (2006)
22- Borges-Silva CN, et al. Reduced lipolysis and increased lipogenesis in adipose tissue from pinealectomized rats adapted to training.
J Pineal Res (2005)
23- Zhang L, et al. Melatonin inhibits adipogenesis and enhances osteogenesis of human mesenchymal stem cells by suppressing PPARγ expression and enhancing Runx2 expression.
J Pineal Res (2010)
24- Alonso-Vale MI, et al. Adipocyte differentiation is inhibited by melatonin through the regulation of C/EBPbeta transcriptional activity.
J Pineal Res (2009)
25- Zwirska-Korczala K, et al. Influence of melatonin on cell proliferation, antioxidative enzyme activities and lipid peroxidation in 3T3-L1 preadipocytes–an in vitro study.
J Physiol Pharmacol (2005)
26- Kazantzis M, et al. PAZ6 cells constitute a representative model for human brown pre-adipocytes.
Front Endocrinol (Lausanne) (2012)
27- Zalatan F, Krause JA, Blask DE. Inhibition of isoproterenol-induced lipolysis in rat inguinal adipocytes in vitro by physiological melatonin via a receptor-mediated mechanism.
Endocrinology (2001)
28- Wolden-Hanson T, et al. Daily melatonin administration to middle-aged male rats suppresses body weight, intraabdominal adiposity, and plasma leptin and insulin independent of food intake and total body fat.
Endocrinology (2000)
29- Koziróg M, et al. Melatonin treatment improves blood pressure, lipid profile, and parameters of oxidative stress in patients with metabolic syndrome.
J Pineal Res (2011)
30- Buscemi N, Vandermeer B, Hooton N, Pandya R, Tjosvold L, Hartling L, et al. (December 2005). “The efficacy and safety of exogenous melatonin for primary sleep disorders. A meta-analysis”. Journal of General Internal Medicine. 20 (12): 1151–8. doi:10.1111/j.1525-1497.2005.0243.x. PMC 1490287. PMID 16423108.
31- Buscemi N, Vandermeer B, Hooton N, Pandya R, Tjosvold L, Hartling L, et al. (February 2006). “Efficacy and safety of exogenous melatonin for secondary sleep disorders and sleep disorders accompanying sleep restriction: meta-analysis”. BMJ. 332 (7538): 385–93. doi:10.1136/bmj.38731.532766.F6. PMC 1370968. PMID 16473858.
32- Lyseng-Williamson KA (November 2012). “Melatonin prolonged release: in the treatment of insomnia in patients aged ≥55 years”. Drugs & Aging. 29 (11): 911–23. doi:10.1007/s40266-012-0018-z. PMID 23044640.
33- Database of Abstracts of Reviews of Effects (DARE): Quality-assessed Reviews [Internet]. York (UK): Centre for Reviews and Dissemination (UK); 1995. Optimal dosages for melatonin supplementation therapy in older adults: a systematic review of current literature. 2014.
34- Brent Bauer, M.D. “Melatonin side effects: What are the risks?”. Mayo Clinic. Retrieved 17 August 2011.
35- Zhdanova IV, Wurtman RJ, Regan MM, Taylor JA, Shi JP, Leclair OU (October 2001). “Melatonin treatment for age-related insomnia”. The Journal of Clinical Endocrinology and Metabolism. 86 (10): 4727–30. doi:10.1210/jc.86.10.4727. PMID 11600532.
36- Morera AL, Henry M, de La Varga M (2001). “[Safety in melatonin use]” [Safety in melatonin use]. Actas Espanolas de Psiquiatria (in Spanish). 29 (5): 334–7. PMID 11602091.
37- Terry PD, Villinger F, Bubenik GA, Sitaraman SV (January 2009). “Melatonin and ulcerative colitis: evidence, biological mechanisms, and future research”. Inflammatory Bowel Diseases. 15 (1): 134–40. doi:10.1002/ibd.20527. PMID 18626968.
38- Juszczak M, Michalska M (2006). “[The effect of melatonin on prolactin, luteinizing hormone (LH), and follicle-stimulating hormone (FSH) synthesis and secretion]” [The effect of melatonin on prolactin, luteinizing hormone (LH), and follicle-stimulating hormone (FSH) synthesis and secretion]. Postepy Higieny I Medycyny Doswiadczalnej (in Polish). 60: 431–8. PMID 16921343.
39- Srinivasan V, Spence WD, Pandi-Perumal SR, Zakharia R, Bhatnagar KP, Brzezinski A (December 2009). “Melatonin and human reproduction: shedding light on the darkness hormone”. Gynecological Endocrinology. 25 (12): 779–85. doi:10.3109/09513590903159649. PMID 19905996.
40- Shane-McWhorter L. Melatonin. Merck Manual Professional Version. October 2018. Accessed 22 April 2019.




 La scorsa volta ho trattato una nuova forma di derivati del Testosterone denominati A-nor-steroidi. La singolare modifica all’anello A dello scheletro carbossilico non conferiva però un potenziale anabolico particolarmente accentuato, infatti questi composti mostrano un valore anabolizzante simile a quello del Testosterone anche se con una attività androgena sensibilmente inferiore. Le molecole in questione potrebbero diventare interessanti per il mercato grigio dei SARM e dei pochi PH ancora reperibili negli store online. Tale settore si trova in una doppia crisi, da una parte molti paesi ne stanno vietando la vendita e dall’altra la penuria delle polveri di massiva provenienza cinese (vedi accordo Cina-USA). Tralasciando quest’ultimo aspetto e tornando alla questione base di questo articolo, non è così improbabile un debutto dei A-nor-steroidi come estrema ratio di un mercato border line messo alle strette.
La scorsa volta ho trattato una nuova forma di derivati del Testosterone denominati A-nor-steroidi. La singolare modifica all’anello A dello scheletro carbossilico non conferiva però un potenziale anabolico particolarmente accentuato, infatti questi composti mostrano un valore anabolizzante simile a quello del Testosterone anche se con una attività androgena sensibilmente inferiore. Le molecole in questione potrebbero diventare interessanti per il mercato grigio dei SARM e dei pochi PH ancora reperibili negli store online. Tale settore si trova in una doppia crisi, da una parte molti paesi ne stanno vietando la vendita e dall’altra la penuria delle polveri di massiva provenienza cinese (vedi accordo Cina-USA). Tralasciando quest’ultimo aspetto e tornando alla questione base di questo articolo, non è così improbabile un debutto dei A-nor-steroidi come estrema ratio di un mercato border line messo alle strette.




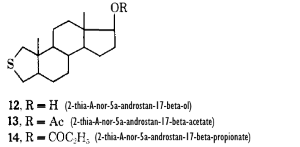

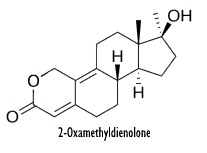
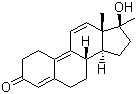


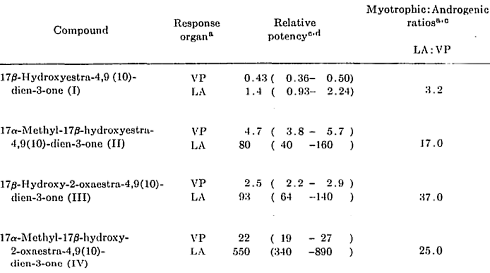

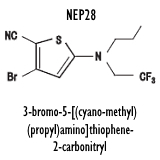

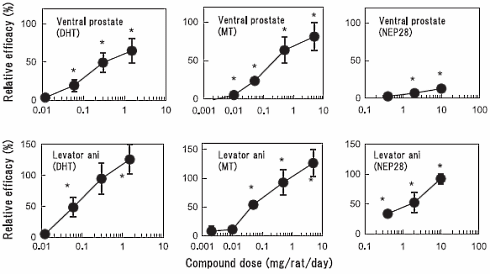


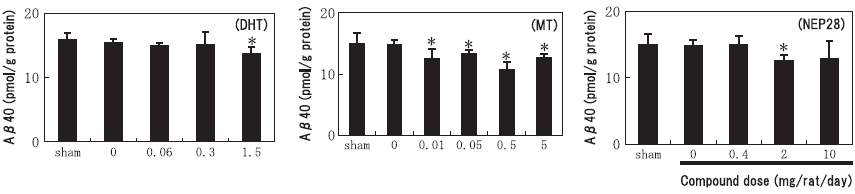

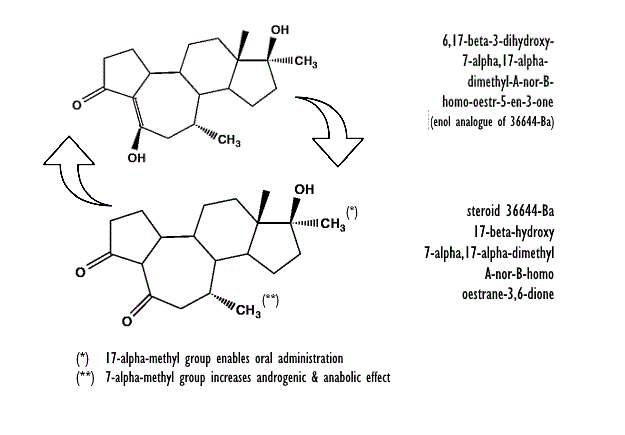 La prima formula strutturale mostrata di seguito è quella ufficiale, la seconda è il metabolita in cui il composto progenitore 36644-Ba si converte per poi ritornare alla forma di partenza.
La prima formula strutturale mostrata di seguito è quella ufficiale, la seconda è il metabolita in cui il composto progenitore 36644-Ba si converte per poi ritornare alla forma di partenza.




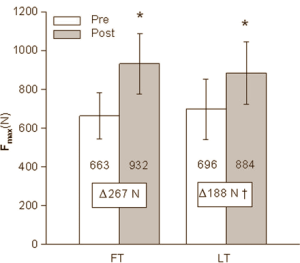

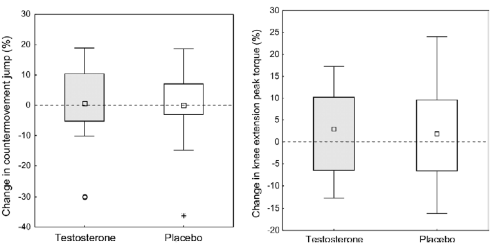
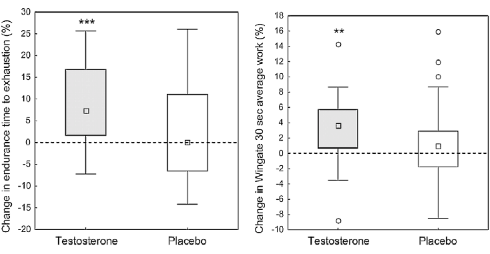
 Recentemente, è stato pubblicato uno studio sul “British Journal of Sports Medicine” da parte di ricercatori svedesi i quali hanno sottoposto delle donne a trattamento topico a base di 10mg di Testosterone al giorno. Tale dosaggio lungi dal poter far raggiungere la soglia ematica di Testosterone riscontrabile in un uomo, ma è stata sufficiente a portare un aumento della massa muscolare, un calo della massa grassa e il miglioramento della resistenza.(1)
Recentemente, è stato pubblicato uno studio sul “British Journal of Sports Medicine” da parte di ricercatori svedesi i quali hanno sottoposto delle donne a trattamento topico a base di 10mg di Testosterone al giorno. Tale dosaggio lungi dal poter far raggiungere la soglia ematica di Testosterone riscontrabile in un uomo, ma è stata sufficiente a portare un aumento della massa muscolare, un calo della massa grassa e il miglioramento della resistenza.(1)