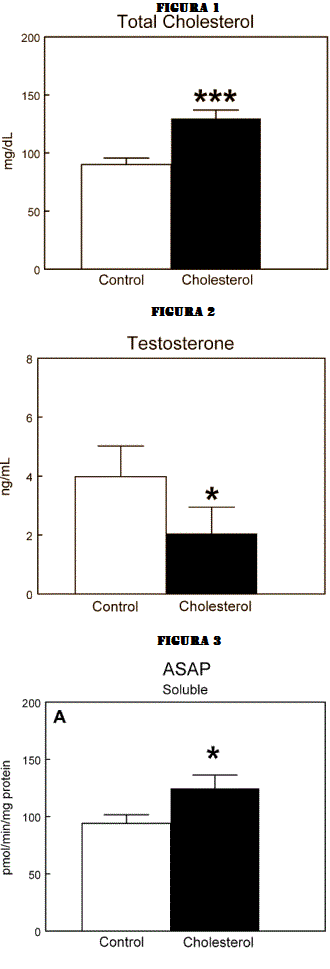
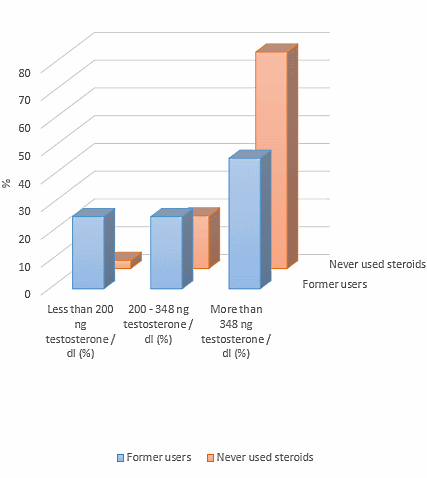
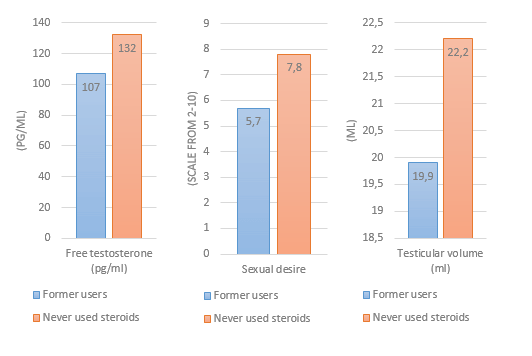
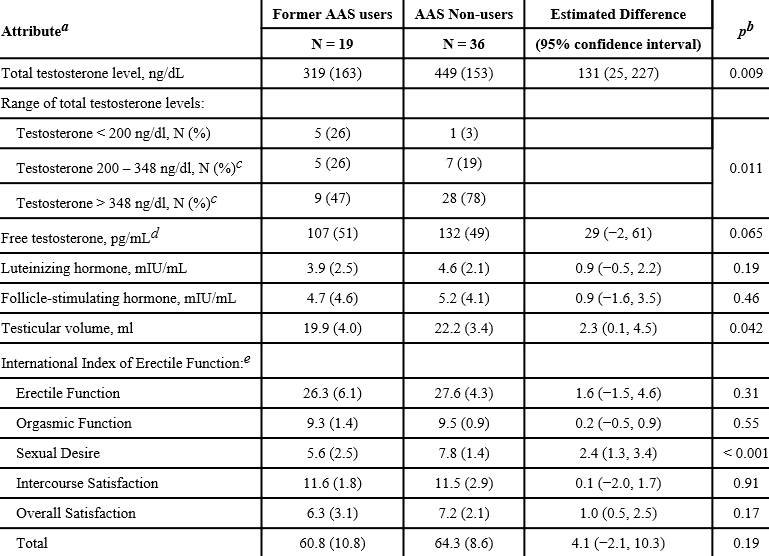
Le teorie nel mondo della supplementazione farmacologica, in ambito soprattutto cucluristico, sono diverse e si dividono tra intuizioni con basi più o meno solide e speculazioni fini a se stesse…oltre a ciò vi sono, fortunatamente, i dati scientifici.
In passato, usando come fonte le informazioni di un “guru” della chimica ormai scomparso, affermai che durante un ciclo di GH la miglior scelta fosse l’uso della Triiodotironnina (T3)… ma è realmente così ?
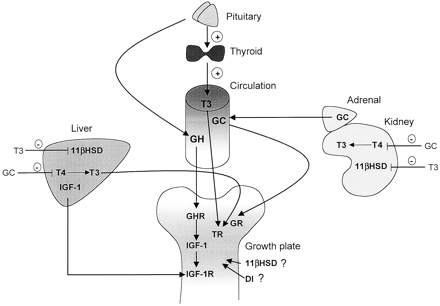
La ghiandola tiroidea secerne due ormoni che sono di primaria importanza per la comprensione dell’interazione tiroide/GH. Il primo è la Tiroxina (T4) e il secondo è la Triiodotironina (T3). Il T3 è spesso considerato l’ormone fisiologicamente attivo, e conseguentemente quello sul quale si concentrano la maggior parte delle attenzioni degli atleti. Il T4, d’altra parte, viene convertito nei tessuti periferici in T3 dagli enzimi del gruppo deiodinasi. Nell’organismo ne sono presenti 3 tipi, D1, D2 e D3, distribuiti in modo diverso nei tessuti. La D1 è più presente nei reni e nel fegato e permette, sia la trasformazione del T4 in T3, che il recupero dello iodio dagli ormoni eliminati. In tiroide, ipofisi, sistema nervoso centrale, muscolo, cuore e tessuto adiposo bruno si trova più D2, che serve a produrre, a partire dal T4, la maggior parte del T3 presente nel sangue. Il ruolo della D3, presente nella pelle e nel cervello, è meno chiaro, ma sembra prevalentemente quello del recupero dello iodio dalle molecole di T3 e T4 da eliminare. La maggior parte del T3 nel corpo (circa l’80%) proviene da questa conversione tramite i primi due tipi di deiodinasi, mentre la conversione allo stato inattivo è compiuta, come detto pocanzi, dal terzo tipo.

E’ importante notare che non tutto il T4 nel corpo viene convertito in T3 – alcune molecole restano non convertite. La secrezione di T4 è controllata dall’ormone tireostimolante (TSH, acronimo dell’inglese Thyroid-stimulating hormone) che è prodotto dalla ghiandola pituitaria. La secrezione del TSH è a sua volta controllato attraverso il rilascio dell’ormone di rilascio della tireotropina (TRH, acronimo dall’inglese thyrotropin releasing hormone) che viene prodotta nell’ipotalamo. Così, quando i livelli di T3 salgono, la secrezione di TSH viene soppressa, grazie al sistema di auto regolazione del corpo conosciuto come “ciclo di feedback negativo”. Questo è anche il meccanismo con cui l’ormone tiroideo esogeno sopprime la produzione dell’ormone tiroideo endogeno. Tuttavia, va notato che il TSH (come tutti gli altri ormoni) non può funzionare a vuoto. Il TSH richiede anche la presenza di Insulina o del Fattore di Crescita Insulino-Simile per stimolare la funzione tiroidea. (1) Quando l’ormone tiroideo è presente senza né insulina o IGF-1, non ha effetto fisiologico (ibid).
La maggior parte delle persone pensa che il T3 sia solo un ormone fisiologicamente attivo che regola il setpoint del grasso corporeo e che ha alcuni effetti anabolizzanti minori, ma in realtà, in alcuni casi di ritardo della crescita nei bambini, il T3 è in realtà troppo basso, mentre i livelli di GH sono normali, e questo ha un effetto limitante sulla crescita di diversi tessuti. (2) Ciò potrebbe essere dovuto alla capacità del T3 di stimolare la proliferazione del IGF-1 mRNA in molti tessuti (che, ovviamente, è anabolizzante), o potrebbe essere dovuto all’effetto sinergico che il T3 ha sul GH, in particolare sulla regolazione del gene dell’ormone della crescita. Anche se è stato dimenticato nel mondo del miglioramento delle prestazioni, la regolazione della risposta dell’ormone della crescita è prevalentemente determinata dal controllo positivo della trascrizione genica dell’ormone della crescita che è proporzionale alla concentrazione dei complessi tiroidei ormone-recettore, che sono influenzati dai livelli di T3.
A questo punto, solo per dare una migliore comprensione di quello di cui stiamo parlando, credo che sia giusto dare anche una breve spiegazione dell’ormone della crescita (GH).
Il GH nel corpo è regolato da molti fattori interni, quali ormoni ed enzimi. Un cambiamento nel livello di produzione del GH nel corpo inizia nell’ipotalamo con la Somatostatina (SS) e l‘ormone di rilascio della somatotropina (GHRH, Growth hormone releasing hormone). La Somatostatina esercita il suo effetto sulla pituitaria per diminuire la produzione di GH, mentre il GHRH agisce sulla pituitaria per aumentare la produzione di GH. Insieme, questi ormoni regolano il livello di GH nel corpo. In molti casi, un deficit di GH si presenta con un basso livello di T3, e un livello di T4 normale (4). Questo avviene naturalmente, perché la conversione del T4 in T3 dipende in parte dal GH (e il GH converte in IGF-1), e la sua capacità di stimolare il processo di conversione del T4 in T3.
È interessante notare che l’ipotalamo non è l’unico luogo in cui è contenuta la Somatostatina; anche la ghiandola tiroidea contiene le cellule deputate alla produzione di Somatostatina. Ciò è di particolare interesse, perché nel caso della tiroide, è stato osservato che alcuni ormoni che in precedenza erano solo considerati governare la secrezione di GH possono anche influenzare la produzione di ormoni tiroidei. La Somatostatina può agire direttamente per inibire la secrezione di TSH o può agire sull’ ipotalamo per inibire la secrezione di TRH. Così, quando si inietta GH esogeno, il corpo rilascia Somatostatina, perché esso non ha più bisogno di produrre il proprio approvvigionamento di GH … e purtroppo, il rilascio di Somatostatina ha il potenziale per inibire il TSH, e quindi limitare la quantità di T4 sintetizzato nel corpo.
Ma non è l’unica interazione che possiamo osservare tra la tiroide e l’Ormone della Crescita.
Inoltre, come la produzione di IGF-I è aumentata nell’ipotalamo dopo somministrazione di T3, il T3 può partecipare alla mediazione del IGF-1 nel feedback negativo del GH innescato dall’aumento della somatostatina che causa la diminuzione della produzione di GHRH (6). L’IGF-I, curiosamente, ha la capacità di mediare alcuni degli effetti del T3 indipendentemente dal GH, ma non allo stesso grado del GH. (7) Infatti, la produzione di IGF-I è aumentata nell’ipotalamo dopo il T3, e la somministrazione può plausibilmente partecipare al feedback negativo attivando o aumentando il livello di Somatostatina e / o diminuendo la produzione di GHRH. Così sappiamo che il GH abbassa il T4, ma un aumento del T3 sovra-regola i recettori del GH (8) e del IGF-1. (9,10)
Come si è detto in precedenza, a causa della capacità del GH di convertire il T4 poco attivo in T3 molto attivo, la somministrazione di GH negli atleti sani ci mostra un aumento dei livelli medi di T3 libero (fT3), e una diminuzione dei livelli medi di T4 libero(fT4). (11)
Così, con l’uso di GH, ciò che vediamo è un aumento della conversione del T4 in T3, e un possibile inibizione del TRH da parte della Somatostatina, e pertanto anche se i livelli di T3 possono aumentare, non v’è alcun aumento del T4 (logicamente, ne vediamo una diminuzione). Ora, come si è potuto vedere, esiste una spiccata sinergia tra il GH e il T3 nel corpo e, se si è prestata attenzione fino a questo punto, si noterà che il fattore limitante sulla capacità del GH di esercitare molti dei suoi effetti, è mediata dalla quantità di T3 nel corpo.
Come osservato in precedenza, il T3 aumenta molti degli effetti del GH attraverso diversi meccanismi, inclusi (ma non limitati a): aumento dei livelli di IGF-1, dei livelli di IGF-1 mRNA, e infine dal fattore mediante il controllo del processo di trascrizione del gene dell’Ormone della Crescita come illustrato di seguito:
Comparazione della cinetica del legame L-T3-recettore nell’abbondanza del tasso di trascrizione del gene del GH. (3)
In origine, avevo affermato che il T3 era sinergico con il GH, mentre in seguito ho affermato che il T3 effettivamente riduceva gli effetti anabolici del GH – ora mi rendo conto che avevo ragione in entrambe le affermazioni. Questo è emerso in seguito alla lettura di diversi studi. Si osserva infatti che anche durante una terapia ormonale con il GH, i livelli necessari di T3 dovevano essere elevati per trattare diverse condizioni causate da una carenza dell’Ormone della Crescita naturale. E anche se il paziente era in terapia con GH, i livelli di T3 necessitavano ancora di essere alzati. E quello che ho notato è che questi livelli sono stati elevati con successo utilizzando T4 supplementare, ma non T3.
Ecco il motivo per cui penso che:
Tutto questo spiegherebbe aneddoticamente perché vediamo molti culturisti che fanno uso di T3 perdere molta massa muscolare, se non utilizzano un adeguata copertura anabolica (AAS) – non stanno utilizzando l’enzima che regolano alcune delle capacità del T3 di stimolare la sintesi proteica, mentre viene contemporaneamente segnalato all’organismo di produrre maggiore enzima inibitorio (D3). Ricordate, che per decenni i Bodybuilder che sono stati a dieta per una gara sono stati convinti che avrebbero perso meno massa muscolare con l’utilizzo del T4, ma che è meno efficace per perdere grasso rispetto al T3? Beh, come abbiamo visto, senza qualcosa (GH in questo caso) per supportare il processo di conversione, sarebbe chiaramente meno efficace! Poiché l’enzima deiodinasi si trova anche nel fegato, e vediamo una diminuzione della clearance dell’azoto epatico con GH + T3, sembrerebbe che l’enzima D3 eserciti i suoi effetti inibitori, ma in assenza degli effetti dei primi due enzimi deiodinasi, rimane incontrollato e limitante, e non solo sulla capacità di ritenzione di azoto del GH.
In altre parole, se si utilizza abbastanza GH affinché esso sia d’aiuto nella conversione sovrafisiologica di T4 in T3, ma abbiamo già un livello (esogeno) di T3 elevato, il GH sarà limitato nella conversione di qualsiasi eccesso di T4 in T3…almeno fino ad un certo punto – il che sarebbe un fattore limitante sugli effetti anabolici del GH, quando accoppiato con l’aumento della D3 per inibire la sinergia T3 / GH necessaria.
Come ulteriore prova, quando si guarda a certi tipi di crescita cellulare (cellula cartilagine in questo caso) vediamo che aumenti di GH inducono aumenti di IGF-I che ne stimolano la proliferazione, mentre il T3 è responsabile per la differenziazione ipertrofica. Quindi sembrerebbe che in alcuni tessuti, l’IGF-1 stimola la sintesi di nuove cellule, mentre il T3 le rende più grandi. In questo particolare caso, è da notare il fatto che il T4 e la D1 siano una componente attiva in questo sistema. I ricercatori indicano chiaramente (parafrasando) che: “il T4 viene convertito in T3 dalla deiodinasi (5′-DI tipo 1) nei tessuti periferici … [inoltre] il GH stimola la conversione del T4 in T3, suggerendo che alcuni effetti del GH possono coinvolgere questo percorso “. La cosa che i ricercatori voglio far notare è che in questo percorso di conversione è probabilmente coinvolto il GH, e non la semplice presenza del T3. (15)
Inoltre, questo stesso studio osserva che il T3 ha la capacità di stimolare l’espressione del IGF-I nei tessuti mentre il GH non ha tale effetto (ibid).
Allora, cosa si sta facendo quando si aggiunge T3 al GH? Si sta effettivamente arrestando il percorso di conversione che è responsabile di alcuni degli effetti del GH! E aggiungendo il T4 invece del T3? Così facendo sarà valorizzato il percorso, consentendo al GH esogeno di aumentare la conversione del T4 in T3, ottenendo così più di un effetto dal GH che si sta assumendo. L’aggiunta del T4 nei cicli di GH consentirà effettivamente di ottenere di più dal GH utilizzandolo in modo efficace!
Bisogna ricordare che, l’elemento che catalizza il processo di conversione è l’enzima deiodinasi. Questo sembrerebbe anche il motivo per cui con basse quantità di T3 (ancora una volta, dal aneddotica dei culturisti) si può essere in grado di aumentare leggermente la sintesi proteica e avere un effetto anabolizzante – non usandone abbastanza per far si che il corpo fermi o rallenti la produzione dell’enzima deiodinasi. Lo stato tiroideo può anche influenzare l’espressione del IGF-I nei tessuti diversi dal fegato. Quindi, quello che abbiamo qui è un problema. Quando si assume GH, si abbassano i livelli di T3 … ma abbiamo bisogno del T3 per mantenere i nostri livelli di sovra regolazione del recettore del GH in modo ottimale. Inoltre, sappiamo che molti degli effetti anabolici del GH sono legati alla sua conversione in IGF-1, e per mantenere i recettori del IGF sovra regolati si necessita di mantenere livelli adeguati di T3. Ma, come abbiamo appena visto, l’aggiunta di T3 esogeno insieme al GH arresterà la funzionale clearance dell’azoto epatica dell’ Ormone della Crescita, probabilmente attraverso l’effetto di riduzione della biodisponibilità di IGF-1. (12)
Quindi si vogliono sufficienti livelli di T3 quando si somministra GH esogeno, o il suo effetto anabolico non sarà vicino al pieno potenziale. E ora sappiamo che non solo abbiamo bisogno di sufficienti livelli di T3 , ma si vuole che il processo di conversione del T4 in T3 ne prenda il posto, perché è la presenza di quegli enzimi mediatori che permetteranno al T3 di essere sinergico con il GH, invece di essere inibitorio come si osserva quando il T3 viene semplicemente aggiunto ad un ciclo di GH. Ed è bene ricordare che si vogliono non solo adeguati livelli di T3, ma si vuole anche la presenza di adeguate quantità della D1 e della D2 – e quando si assume T3 esogeno, ciò non accade … in tal modo tutto ciò che accade è che la D3 si eleva inibendo gli effetti benefici del T3 quando combinato con il GH.
Quindi, se si utilizza il GH senza il T4, si spreca metà delle proprie finanze – e se si utilizza con il T3, si spreca tempo. Iniziare a utilizzare il T4 con il GH, e si otterranno sempre risultati completi dal proprio investimento.
Gabriel Bellizzi
Riferimenti: