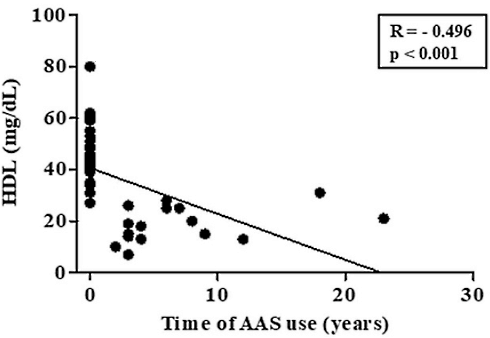
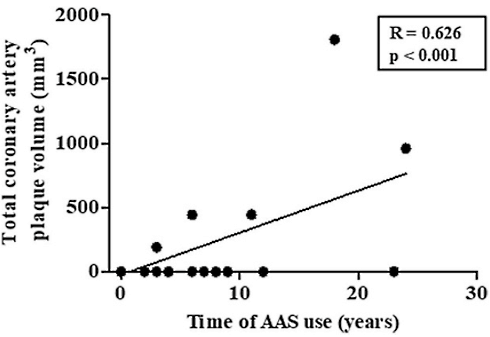
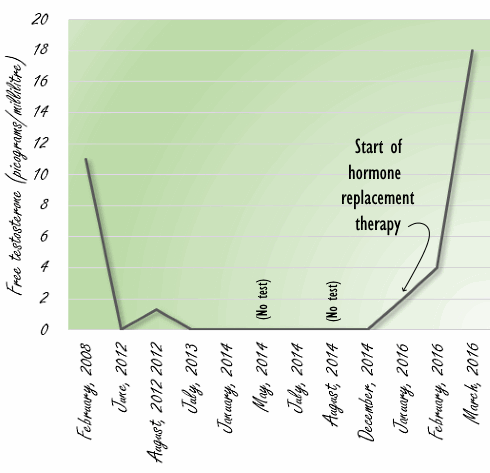
Introduzione
L’1-Testosterone ( noto anche come Dihydroboldenone o, più semplicemente, come DHB) ha suscitato molto interesse negli ultimi anni* tra gli appartenenti alla comunità del Bodybuilding. La continua ricerca di nuove molecole dai maggiori potenziali spinge molti atleti facenti parte di questa “sottocultura” a sperimentare nuovi farmaci e/o diversi protocolli di applicazione di questi. Come ovvio che sia, per mancanza di preparazione degli interessati, queste sperimentazioni, e ciò accade molto spesso, si traducono in diffusione di dati non contestualizzati e privi di prove concretamente riconducibili al test su una specifica molecola. Fortunatamente, esiste una piccolissima percentuale di ricercatori indipendenti all’interno di questa comunità ed essi si preoccupano di valutare tutte le variabili in gioco, dalla certezza della molecola testata alla sua contestualizzazione d’uso (es. se essa è usata in mono-terapia o in co-somministrazione ecc…).

*In vero, il DHB è stato venduto legalmente online negli Stati Uniti, in forma prevalentemente orale, forma dalla scarsa biodisponibilità, dal 2002, anno in cui il brevetto del farmaco venne rilasciato per la vendita nel mercato degli integratori alimentari. Anche se tecnicamente la sua legalità era discutibile, la popolarità del nuovo composto è stata rapida e innumerevoli prodotti OTC come “Xtreme” ebbero largo seguito. Ciò durò fino al 2005, quando venne riclassificato come farmaco e inserito all’interno del Controlled Substances Act.
Tornando al punto originario del discorso, il quale ha la finalità di introdurre il lettore all’argomento trattato in questo articolo, il DHB, se attentamente analizzato, risulta decisamente ridimensionato nelle sue potenzialità e valutato sotto un altra luce in riferimento ai suoi possibili effetti avversi rispetto a quanto riportato dai comuni articolisti di settore. Motivo per cui, ora, torno nuovamente sull’argomento DHB, molecola da me già trattata tempo fa su questo sito, in modo maggiormente analitico su alcuni ed essenziali punti.
Ma iniziamo con ordine…
Caratteristiche base del 1-Testosterone
L’1-Testosterone (abbreviato in 1-Testo, 1-T), chiamato anche (nome IUPAC) 4,5α-dihydro-δ1-testosterone (Δ1-DHT) o 5α-androst-1-en-17β-ol-3-one, è uno steroide androgeno-anabolizzante (AAS), uno steroide androstano sintetico, che si differenzia dal Testosterone per l’aggiunta di un doppio legame in posizione C1-C2 e la mancanza del doppio legame in posizione C4-C5 nell’anello A. Il DHB è descrivibile più semplicemente, anche se pur sempre in modo incompleto, come il metabolita 5α-ridotto del Boldenone. [1] Venne sintetizzato negli anni 60 del XX Secolo e descritto per la prima volta nella letteratura medica occidentale nell’anno 1962.[2]

Il doppio legame in C1-C2 presente nello scheletro carbossilico del DHB stabilizza il ketogruppo in C3, essenziale per il legame androgeno.
Due proormoni del 1-Testosterone sono l’1-Androstenediolo e l’1-Androstenedione, l’ultimo dei quali può essere sintetizzato dallo Stanolone Acetato.[3]
Il Mesabolone è un chetale a base di 1-Testosterone.

L’1-Testosterone è anche noto per essere usato per sintetizzare il Metanolone e il Metenolone (comunemente noto come Primoboloan/Rimobolan).

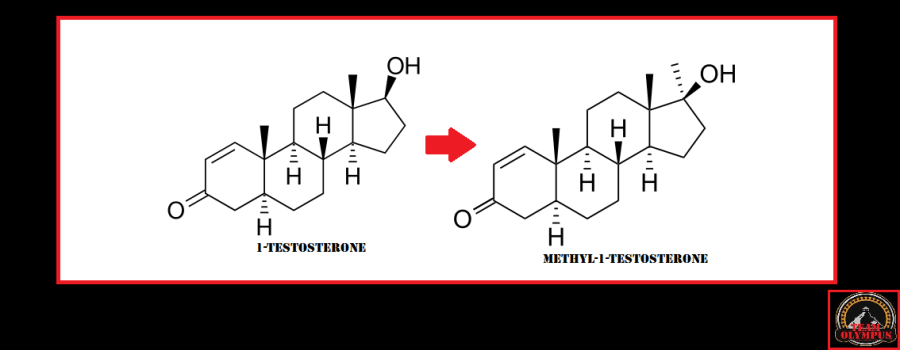
L’aggiunta di un metile in posizione C17 da come risultato la molecola di Methyl-1-Testosterone.
Per via delle sue caratteristiche strutturali, l’1-Testosterone non converte in estrogeno, anche se non ci sono prove che all’interno del corpo (quindi in vivo) possa essere inserito un doppio legame in C4. [4,5] Ciò che sappiamo proviene dai dati aneddotici i quali suggeriscono che l’1-Testosterone sia un AAS con una attività estrogenica irrilevante. Effetti collaterali estrogeno-dipendenti, come ginecomastia, accumuli di grasso con modello femminile e maggiore ritenzione idrica non sono generalmente osservati quando il DHB viene somministrato in mono-terapia.
Essendo un AAS 5α-ridotto, esso non è soggetto all’enzima 5α-reduttasi e, di conseguenza, la sua attività androgena non può essere manipolata dall’uso di inibitori enzimatici con bersaglio l’enzima precedentemente indicato. Quindi, l’androgenicità relativa del 1-Testostosterone non è influenzata dall’uso di Finasteride o Dutasteride).
La Anabolico/Androgeno ratio dell’1-Testosterone riporta un valore pari a 200/100 in riferimento al Testosterone Propionato 100/100. Tale rapporto risulta però dubbio anche per il semplice fatto che il metodo attraverso il quale è stato estrapolato non è chiaro. Ma su questo ritorneremo più avanti.
I più sapranno sicuramente che il Boldenone è un derivato del Testosterone il quale è stato sintetizzato modificando la struttura del substrato di derivazione aggiungendo un doppio legame tra gli atomi di carbonio 1 e 2 dell’anello A dello scheletro carbossilico.
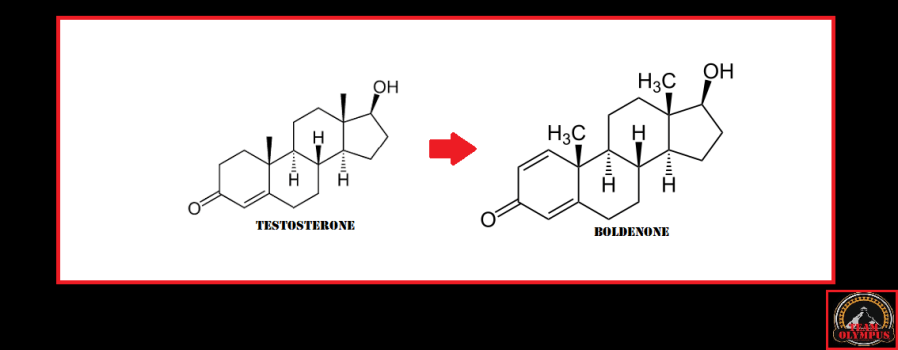
Questo legame rallenta drasticamente l’aromatizzazione della molecola rendendola e un substrato scarsamente affina anche per la 5α-reduttasi.
Sebbene il Boldenone rimanga un substrato affine alla 5α-reduttasi potendo essere quindi convertito in DHB, anche con la somministrazione di elevati dosaggi la quantità del metabolita derivante non è sostanziale.
La malsana pratica di utilizzare mega-dosaggi di Boldenone nel tentativo di ottenere concentrazioni sieriche moderate di DHB è stata applicata da molti culturisti in passato.
Poiché l’ormone progenitore (Boldenone) è un substrato così scarsamente affine per la 5α-reduttasi, un numero crescente di culturisti ha iniziato a optare semplicemente per l’uso diretto del DHB.
La scarsa e poco incoraggiante letteratura scientifica sul DHB
Esistono pochissimi dati clinici che valutano l’efficacia o il profilo di sicurezza del DHB.
C’è solo uno studio [6] a cui possiamo fare riferimento il quale mostra in realtà come il DHB sia paragonabile al Testosterone in un ambiente clinico controllato.

Questo studio è stato condotto sul 1-Testosterone (DHB) dopo che esso venne classificato come sostanza sottoposta a controllo e non più commercializzabile negli Stati Uniti.
L’obiettivo dello studio era stabilire che il DHB non è un “proormone”, come era stato affermato da molte società di integratori prima del suo ritiro dal mercato della supplementazione OTC.
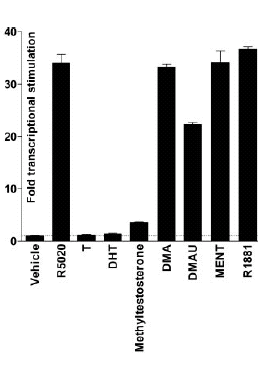
Valutando l’effetto del DHB sui tessuti sensibili agli androgeni nel corpo attraverso il Recettore degli Androgeni (AR), lo studio ha stabilito che il DHB è a tutti gli effetti uno Steroide Androgeno Anabolizzante.
Mentre la premessa dello studio aveva lo scopo di esplorare semplicemente la transattivazione dipendente dall’AR mediata dal DHB, l’effetto misurato attraverso l’azione della molecola su vari tessuti del corpo rispetto al Testosterone ha fatto luce su quanto sia selettivo ed efficace il DHB.
Dopo essere stati orchiectomizzati (rimozione chirurgica dei testicoli), i ratti castrati , prima di essere utilizzati per l’esperimento, sono stati lasciati nelle loro gabbie per 7 giorni al fine di consentire un sufficiente declino ormonale.
Questo processo consente ai ricercatori di ridurre le variabili influenti la valutazione della ricerca e di somministrare androgeni esogeni, quindi di pesare diversi organi del corpo e misurare il grado di impatto di un farmaco specifico sul tessuto muscolare, sui tessuti sensibili agli androgeni come la prostata e sugli organi vitali.
Ai ratti dello studio è stato somministrato giornalmente per via sottocutanea un placebo, 1mg/kg/bw/giorno di Testosterone Propionato (TP) o 1mg/kg/bw/giorno di DHB (1-Testo).
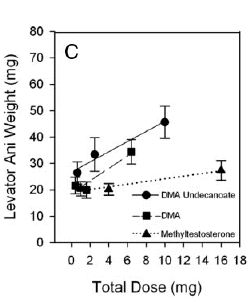
Milligrammo per milligrammo, il DHB ha dimostrato di indurre una crescita muscolare leggermente inferiore rispetto al Testosterone, stimolando altrettanto la prostata e la vescicola seminale.

Ciò significa che per replicare lo stesso livello di crescita muscolare, il DHB dovrebbe essere somministrato a dosi più elevate del Testosterone.
Tornando alla precedentemente introdotta questione della presunta Anabolico/Androgeno ratio, l’ipotetico valore di 200/100 non si sa bene da dove provenga e come sia stato ricavato. Ciò che risulta piuttosto chiaro è che gli unici dati clinici che ho potuto trovare, e attraverso i quali mi è stato possibile valutare la selettività dei tessuti da parte del DHB, certamente non riflettono tale potenziale.
In effetti sembra essere meno selettivo a livello dei tessuti rispetto al Testosterone e complessivamente un po’ meno anabolico.
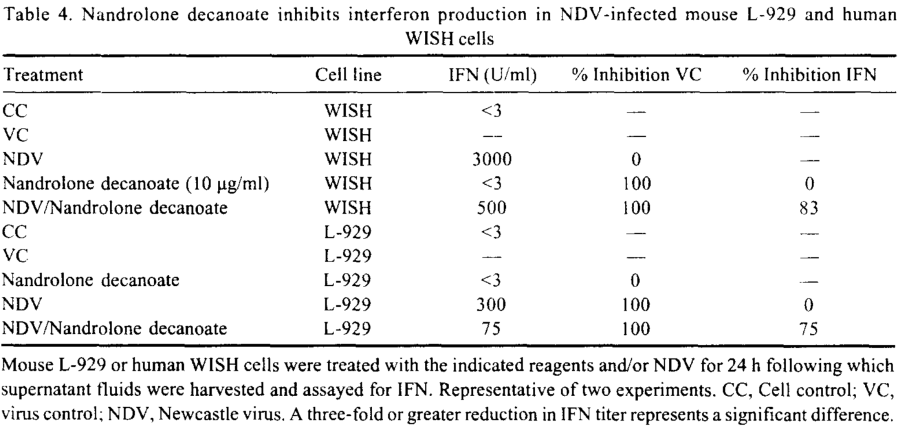
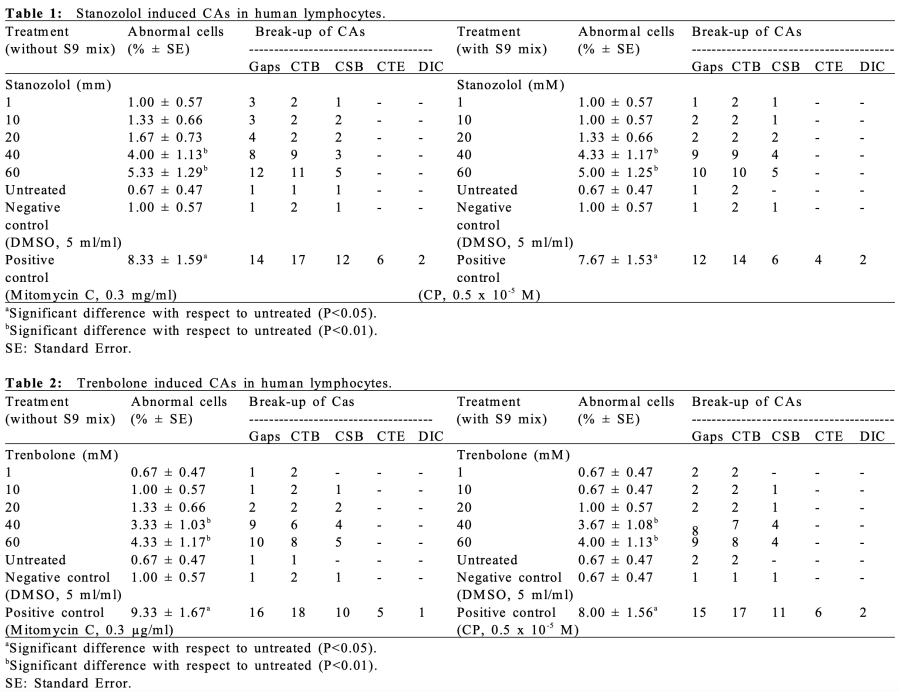
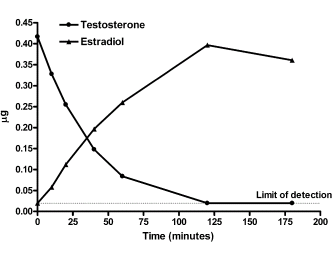
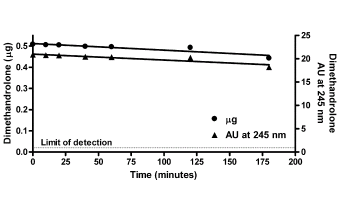
Osservando la struttura molecolare del DHB si evince una bassa resistenza alla disattivazione epatica di primo passaggio dovuta alla mancanza di modifiche atte a alterare il metabolismo dell’AAS. Sappiamo che la tossicità epatica si presenta a livelli significativi con l’uso di AAS metilati in C17, anche se molecole come il Trenbolone, aventi per modifiche strutturali non correlate a metilazione, presentano una certa resistenza alla disattivazione epatica causando un certo grado di tossicità potenziale.
I segni chiave della epatotossicità comprendono l’elevazione degli enzimi epatici e, in alcuni casi, persino l’ingrossamento del fegato.
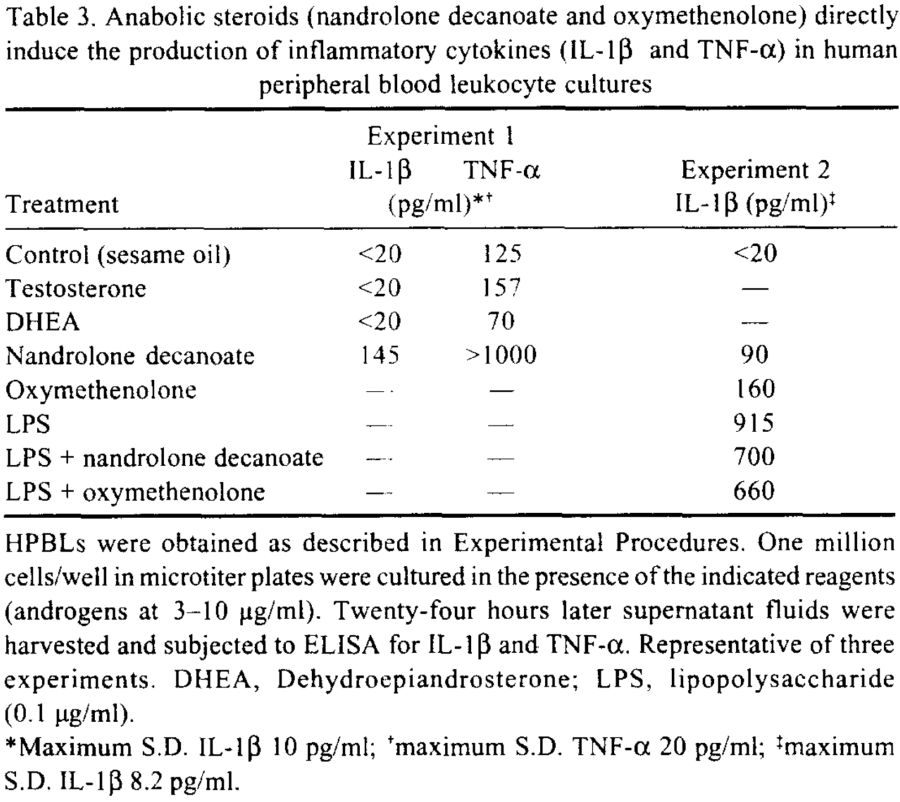
Nello studio qui discusso, il gruppo di topi trattati con Testosterone Propionato non ha mostrato alcun segno di tossicità epatica. Tuttavia, il gruppo trattato con DHB ha avuto un aumento significativo del peso del fegato.
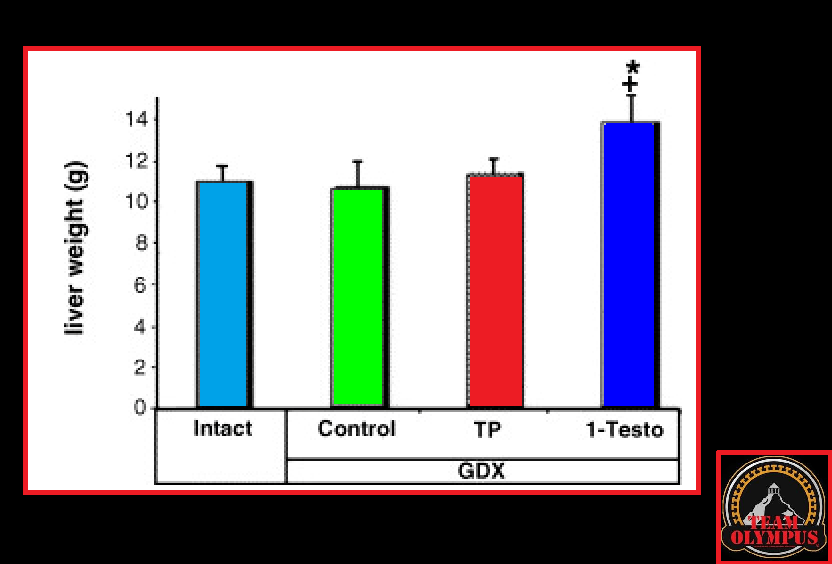
Anche se quanto riscontrato a livello epatico nei topi trattati con DHB non sia una prova assoluta della potenziale tossicità del DHB, l’ipertrofia epatica potrebbe compromettere il funzionamento dell’organo se cronicizzata. Come accennaio tempo a dietro nella scheda tecnica del 1-Testosterone, qualcuno ipotizza (senza documentazione a convalidarlo) che l’ipertrofia epatica DHB-dipendente non è dovuta a fenomeni steatosici (“fegato grasso”) o tumorali, ma semplicemente alla capacità dell’1-Testosterone di legarsi ai recettori androgeni epatici; caratteristica comune ad uno dei prima citati anabolizzanti usatio come substrato di sintesi per il DHB, il Metenolone il quale in passato era ampiamente usato nella cura delle lesioni causate dalla cirrosi epatica.
Valutazione della molecola
Come valutare il DHB alla luce della (scarsa) letteratura disponibile e dei dati aneddotici provenienti dagli atleti (per lo meno quelli affidabili)?
Una cosa che si nota particolarmente nella scelta degli AAS da parte dei bodybuilder è che questi ultimi tendono a optare per molecole non aromatizzabili, terrorizzati dall’ignoranza che aleggia sugli estrogeni e sulla loro corretta gestione. Sebbene un AAS non aromatizzabile si dimostri discretamente più gestibile sotto alcuni aspetti, la mancanza di attività estrogenica indiretta può causare una serie di problemi che vanno dalla sfera psicologica alla disfunzione erettile. Tali effetti sono semplicemente evitabili, insieme a quelli legati ad una condizione di iperestrogenemia, gestendo i fattori estrogenici attraverso dosaggi intelligentemente settati e, nel caso, l’inserimento di anti aromatase e/o SERM. La scelta di una molecola dovrebbe basarsi maggiormente sui potenziali che potrebbero offrire sotto l’aspetto della sicurezza e potenza in rapporto alle altre molecole disponibili. In breve, AAS che sono più selettivi nei tessuti bersaglio e anabolizzanti del Testosterone.
Sebbene il DHB non sia un substrato soggetto all’enzima aromatasi, ciò non è, per esempio, particolarmente vantaggioso per un suo ipotetico uso in monoterapia, poiché richiederebbe la somministrazione esogena di Estradiolo (o di un substrato soggetto alla conversione in esso) al fine di evitare la comparsa di effetti collaterali psicofisici dovuti ad un basso livello estrogenico.
In conclusione, non vi sono dati certi sull’effetto che il DHB può avere sul corpo umano fatta eccezione per le testimonianze raccolta nei forum e, questa volta con qualche valenza in più, dai dati registrati dai ricercatori indipendenti che alternano i libri alla ghisa. Gli unici dati “certi” che abbiamo provengono, come visto, dal modello preclinico di roditori, e non sono nemmeno così promettenti.
Sebbene io non sia contrario alla sperimentazione indipendente, con questa molecola tale pratica può permettersela soltanto chi è in possesso di approfondite conoscenze in campo medico con particolarità nell’Endocrinologia, Andrologia e Farmacologia. I meno esperti, e meno portati, dovrebbero limitarsi alla scelta di molecole con effetti terapeutici riportati basati sul profilo preclinico registrato e anche in sperimentazione umana.
Il DHB nella pratica si è dimostrato una molecola discreta in “Cut” con una capacità miotropica stimabile con quella del Metenolone e del Boldenone.
Ma le sue limitazioni ad oggi persistono e sono:
- Nessuno studio svolto su esseri umani e sul/i quale/i poter fare riferimento;
- Leggermente meno anabolico e selettivo a livello tissutale rispetto al Testosterone, almeno in base agli studi sui topi;
- Potenzialmente deleterio per il fegato sul lungo termine anche in forma iniettabile.
Occorrerebbe svolgere studi più approfonditi, ma dubito che qualcuno con mezzi adegiuati e possibilità maggiori rispetto ad un piccolo ricercatore indipendente si possa muovere in tal senso, anche perché non vi sono necessità che spingerebbero a ciò.
Gabriel Bellizzi
Riferimenti:
1- William Llewellyn (2009). Anabolics (9 ed.). Molecular Nutrition. p. 22,135.
2- Friedel A, Geyer H, Kamber M, Laudenbach-Leschowsky U, Schänzer W, Thevis M, Vollmer G, Zierau O, Diel P (August 2006). “17beta-hydroxy-5alpha-androst-1-en-3-one (1-testosterone) is a potent androgen with anabolic properties”. Toxicol. Lett. 165 (2): 149–55.
3- Zhang H, Qiu Z (December 2006). “An efficient synthesis of 5α-androst-1-ene-3,17-dione”. Steroids. 71 (13–14): 1088–90.
4- 358. K. J. Ryan. Acta Endocrinol. 35, Suppl. 51,697 (1960).
5- C. Gual, T. Morato, M. Gut, R.1. Dorfman, Endocrinology 71,920 (1962). 17beta-hydroxy-5alpha-androst-1-en-3-one (l-testosterone) is a potent androgen with anabolic properties. Friedel A, Geyer H, Kamber M.
6- https://www.ncbi.nlm.nih.gov/pubmed/16621347.





















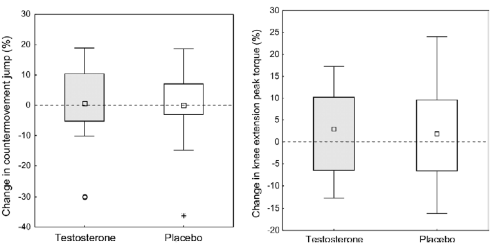
 Recentemente, è stato pubblicato uno studio sul “British Journal of Sports Medicine” da parte di ricercatori svedesi i quali hanno sottoposto delle donne a trattamento topico a base di 10mg di Testosterone al giorno. Tale dosaggio lungi dal poter far raggiungere la soglia ematica di Testosterone riscontrabile in un uomo, ma è stata sufficiente a portare un aumento della massa muscolare, un calo della massa grassa e il miglioramento della resistenza.(1)
Recentemente, è stato pubblicato uno studio sul “British Journal of Sports Medicine” da parte di ricercatori svedesi i quali hanno sottoposto delle donne a trattamento topico a base di 10mg di Testosterone al giorno. Tale dosaggio lungi dal poter far raggiungere la soglia ematica di Testosterone riscontrabile in un uomo, ma è stata sufficiente a portare un aumento della massa muscolare, un calo della massa grassa e il miglioramento della resistenza.(1)
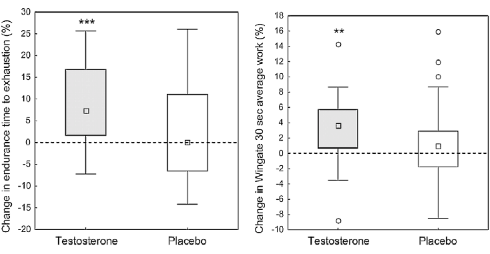
 Secondo uno studio su animali svolto da fisiologi rumeni presso l’Università di Medicina e Farmacia Carol Davila e pubblicato su “Medicina”, la supplementazione di Taurina potrebbe offrire protezione cardiovascolare agli utilizzatori di AAS.(1)
Secondo uno studio su animali svolto da fisiologi rumeni presso l’Università di Medicina e Farmacia Carol Davila e pubblicato su “Medicina”, la supplementazione di Taurina potrebbe offrire protezione cardiovascolare agli utilizzatori di AAS.(1)