Se non avete letto ancora la prima parte di questa serie di articoli vi invito a farlo.
- Acido Alfa Lipoico: caratteristiche e possibili applicazioni.

L’Acido Alfa Lipoico (ALA), denominato anche come Acido Lipoico (LA) o Acido Tiottico, fu isolato per la prima volta nel 1951 dal tessuto epatico ad opera dei biochimico americani L.J. Reed e I.C. Gunsalus i quali riuscirono ad ottenerne solo pochi milligrammi partendo da grandi quantità di tessuto.
L’ALA è un composto presente in natura con il nome chimico di acido 1,2-ditiolan-3-pentanoico, a volte indicato come Acido Tiottico.(1)
L’ALA si trova in diversi alimenti, principalmente nelle frattaglie e in alcuni frutti e verdure. (2)(3) Alcuni di questi alimenti con contenuto specifico includono:
- Spinaci a 3.14 +/- 1.11mcg/g di peso secco come lipoillisina (4)(5)
- Rene a 2,64 +/- 1,23mcg/g di peso secco come lipoillisina (4)(5)
- Fegato a 1,51 +/- 0,75mcg/g di peso secco come lipoillisina (4)(5)
- Broccoli a 0,94 +/- 0,25 mcg/g di peso secco come lipoillisina (4)(5)
- Tessuto cardiaco a 0,86 +/- 0,33mcg/g di peso a secco come lipoillisina (4)(5)
- Pomodori a 0,56 +/- 0,23mcg/g di peso secco come lipoillisina (4)(5)
La lipoillisina, un coenzima coinvolto nel funzionamento del complesso della piruvato deidrogenasi, è formata dalla coniugazione tra Acido Lipoico e un residuo di Lisina, che avviene grazie ad un legame di tipo ammidico, ed è una forma di conservazione dell’Acido Alfa Lipoico legato alle proteine.(6) È scisso in AL e Lisina attraverso l’azione dell’enzima glicoproteico lipoamidasi (a volte indicato come lipoillisina idrolasi), che circola nel siero umano.(7)
Anche se l’ALA è presente in varie fonti alimentari, come visto precedentemente, le sue concentrazioni negli alimenti tendono ad essere significativamente inferiori alle dosi standard per la supplementazione.
L’ALA è un composto ditiolo presente in natura sintetizzato nei mitocondri a partire dall’Acido Ottanoico, con un buon livello di sintesi che si verifica nei mitocondri degli epatociti.(8)(3)
Il suo principale ruolo biologico è quello di cofattore di enzimi mitocondriali come l’Alfa-chetoglutarato deidrogenasi e il piruvato deidrogenasi.(9) L’ALA sembra essere coinvolto nella produzione di acetil-CoA, attraverso la decarbossilazione ossidativa del piruvato.(10)
È stato dimostrato che l’integrazione fornisce benefici protettivi contro l’ossidazione, l’infiammazione, il diabete e il declino cognitivo.(9)
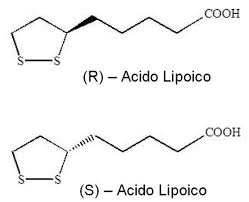
L’ALA possiede un carbonio centro chirale e quindi può esistere in un isomero S o R. L’ALA non specificato è una soluzione ‘racemica’ di entrambi, mentre l’R-ALA, spesso venduto come integratore alimentare, è comunemente legato al sodio (Na-R-ALA). L’R-ALA è la forma naturale di Acido Lipoico biologicamente attiva.
Il legame disolfuro del ALA può essere scisso omoliticamente attraverso l’esposizione ai raggi UV e/o ad una fonte di calore (11)(12) durante la quale la struttura dell’anello ditiolano forma due radicali tiili e si auto-polimerizza in una catena lineare di disolfuri nota come PBCPD. Il nome completo è poli {3- (n-butano acido carbossilico) propil] disolfuro.(13) Questa polimerizzazione è vista come reversibile, con riconversione in ALA in soluzione alcalina o con coincubazione con agenti riducenti come il ditiotreitolo e il β-mercaptoetanolo.(14) È stato suggerito che l’ALA presente in natura può essere una miscela racemica che include un contenuto di PBCPD.(15)

In vivo, l’ALA può essere ridotto alla forma ditiol (dove la struttura dell’anello è rotta), denominata Acido Diidrolipoico (DHLA). (3) Nelle cellule provviste di mitocondri, questa riduzione è mediata dalla lipoamida deidrogenasi ed è una reazione NADH-dipendente. Nelle cellule sprovviste di mitocondri, questa riduzione avviene tramite NADPH con glutatione e tioredossina riduttasi.(16)
L’ALA ha un punto di fusione di 63 ° C quando in soluzione racemica e di 50 ° C come isomero R-ALA e l’associazione con sali con punti di ebollizione più elevati può migliorarne la stabilità.(17)(18)
L’ALA ingerito per via orale viene rapidamente assorbito nell’intestino in modo dipendente dal pH dei trasportatori dell’Acido Monocarbossilico (MCT). La sua coingestione con Acidi Monocarbossilici come i Trigliceridi a Catena Media o l’Acido Benzoico ne inibisce l’assorbimento.(19) Esiste anche la possibilità che l’ALA venga assorbito dal sistema di trasporto multivitaminico sodio-dipendente (SMVT). (20)(21) Nell’intestino, alcune molecole di ALA si convertono in Acido Diidrolipoico. La biodisponibilità complessiva della supplementazione di ALA è di circa il 30% (22)(9) a causa dell’elevata estrazione epatica.(23) La forma di ALA Na-R-ALA è completamente solubile in acqua.(24) Sebbene l’enantiomero R abbia tassi di assorbimento intestinale più elevati in vivo (25), l’enantiomero S può stabilizzare l’assorbimento prevenendo la polimerizzazione.(9)
La farmacocinetica sistemica dell’ALA è abbastanza rapida. Dopo un veloce assorbimento intestinale, l’ALA viene rapidamente suddiviso nei tessuti che lo assorbono (cervello, cuore e muscoli) , il che include un deposito transitorio nel fegato.(9)(26) L’ALA si accumula nel cervello dopo appena un’ora dall’ingestione (27) e viene immagazzinato in varie regioni dell’organo.(28)
Dopo ingestione orale di una miscela racemica di ALA da 600mg, la Cmax sembra essere di 6,86+/-1,29μg/mL con un Tmax di 50,8 minuti e una AUC complessiva di 8 ore di 5,65 ± 0,79μg/mL/h.(29)
Nelle cellule, l’ALA viene principalmente metabolizzata attraverso la beta-ossidazione. (30) I principali metaboliti sono il Bisnorlipoato, il Tetranorlipoato, il β-idrossi-bisnorlipoato o i mercapto derivati bis-metilati di questi composti (26) e l’Acido Diidrolipoico, che subisce una rapida escrezione cellulare.(16)
L’ALA viene anche espulso rapidamente per filtrazione renale, con il 98% di ALA assorbito escreto entro 24 ore.(23) Tuttavia, la maggior parte dell’ALA ingerito per via orale viene persa nell’escrezione fecale prima che avvenga l’assorbimento intestinale.(30) Per questi motivi, l’ALA non è immagazzinato a lungo termine. Secondo Shay et al. (9) l’AUC media è di circa 160+/-35mcg/ml/min e la Cmax media è di 2,8+/-1,5 per una dose orale di 600mg di entrambi gli enantiomeri. Questi risultati rivaleggiano con il Na-R-ALA per la AUC (nonostante l’R-ALA mostri valori di picco più elevati ed escrezione più rapida), ma sono ben superiori rispetto all’S-ALA da solo.(25)

L’ALA può indurre l’espressione della lipasi trigliceridica nelle cellule epatiche (responsabile della diminuzione delle sequenze di trigliceridi in queste cellule (31)) secondarie all’attivazione dell’AMPK, che ha ridotto l’accumulo di lipidi in vitro. (32) L’AMPK è stato attivato in modo tempo e concentrazione-dipendente ed è stato in grado di farlo nonostante le concentrazioni elevate di glucosio (30 mM) e palmitato (0,1 mM) a concentrazioni di 0,25-1 mM.(32) Queste interazioni del AMPK sono indipendenti dalle proteine Sirtuine e sembrano aggirare le azioni dell’Insulina sul fattore di trascrizione nucleare FOXO1 prevenendo l’esclusione nucleare, che sembra essere secondaria anche all’AMPK.(32) Quando somministrato il 2,4% di ALA per 5 settimane attraverso la dieta a ratti geneticamente obesi, (circa 40mg/kg di peso corporeo in questo studio dopo il controllo della biodisponibilità del 20%) si è osservata una riduzione dell’accumulo di trigliceridi nel tessuto epatico (-26%) e un aumento del contenuto di glicogeno (+ 27%). Rispetto ai ratti trattati con una alimentazione caloricamente limitata, il gruppo dei ratti trattati con ALA presentava fegati più grandi ma senza biomarcatori anormali, probabilmente a causa del aumentato contenuto di glicogeno. (33)
Anche la produzione di anione superossido nel fegato dei ratti alimentati con l’1% di ALA sembra essere ridotta rispetto al gruppo di controllo e l’aumento della produzione di superossido in risposta all’aggiunta di glucosio alla dieta, per la maggior parte, è stato soppresso.(34)

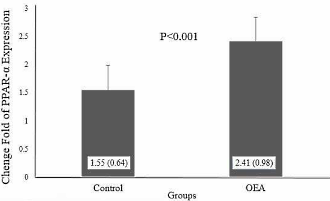
L’AMPK non è l’unico meccanismo in grado di ridurre l’accumulo di grasso nel fegato, è infatti possibile farlo attraverso l’inibizione dell’azione genetica delle proteine pro-lipogeniche LXR e delle proteine specifiche 1.(35) L’ALA può aumentare il numero dei recettori PPARα quando viene inserito all’1% del contenuto della dieta per un periodo di 14 settimane ed è stato negativamente correlato (r = 0,8) con livelli di acidi grassi liberi nel sangue.(34)
Sebbene gli effetti benefici dell’ALA sulla fisiologia epatica nei modelli sopra citati siano ben stabiliti, uno studio che confronta gli effetti della supplementazione di ALA a lungo e breve termine in topi sani suggerisce che l’integrazione regolare a lungo termine può causare danni epatici.(36)

Per esaminare l’effetto della supplementazione di ALA a breve e lungo termine sul fegato, i topi “black 6” (C57BL6 / J, un ceppo comune di topi da laboratorio) sono stati trattati con ALA a 20mg/kg per 4 o 74 settimane.(36) Dopo il periodo di trattamento, i topi sono stati sottoposti ad eutanasia, seguita da analisi del tessuto epatico per il metabolismo dei lipidi e del colesterolo. L’integrazione di ALA a breve e a lungo termine ha causato un aumento della β-ossidazione e una diminuzione della lipogenesi. Al contrario, sia il trattamento a breve che a lungo termine aumentava il contenuto di colesterolo epatico del 70% e del 110%, rispettivamente, e aumentava i livelli di trigliceridi, inducendo trigliceridemia sistemica. Inoltre, nonostante il fatto che il trattamento a breve termine con ALA abbia diminuito l’espressione lipogenica, ha anche causato l’accumulo di grasso nel fegato. I topi trattati a lungo termine con ALA mostravano un fenotipo peggiore, con un ampio accumulo di grasso che portava alla steatosi epatica e ad un esteso danno epatico.(36)

In particolare, lo studio di cui sopra risulta l’unico ad aver studiato gli effetti del trattamento con ALA a lungo termine in topi sani. Al contrario, altri studi che hanno mostrato un effetto benefico del trattamento a lungo termine con ALA sono stati condotti su modelli animali malati, inclusi ratti grassi nutriti con una alimentazione ricca di grassi (35) e ratti Zucker grassi e diabetici (ZDF).(37) Pertanto, il trattamento a lungo termine di ALA in modelli animali sani può essere tossico per il fegato, causando un fenotipo che ricorda da vicino quello della steatosi epatica non alcolica. (38) (39) Va notato che la dose di ALA utilizzata nello studio sui topi sani (36) (20mg/kg) è equivalente a circa 1,8g/giorno in un uomo di 90Kg. Sebbene si tratti di una dose relativamente alta di ALA, è abbastanza vicina alle dosi standard utilizzate nell’uomo e, per tale motivo, il loro utilizzo sul lungo termine richiede una certa cautela.
L’ALA ha effetti potenti sulla riduzione dell’appetito. Tuttavia, l’ALA sembra indurre qualche forma di perdita di peso oltre a quella legata alla semplice soppressione dell’appetito (sebbene la soppressione dell’appetito sembri essere il fattore di influenza più potente).(40) Almeno uno studio pair-fed (gruppo di controllo, gruppo supplementato con ALA, e gruppo alimentato con la quantità di calorie che gli animali del gruppo trattato con ALA ha voluto consumare) ha osservato che la statisticamente significativa perdita di peso diventava irrilevante tra il gruppo trattato con ALA e il gruppo nutrito con lo stesso monte calorico.(33)
Il fattore più significativo che influenza gli effetti di riduzione del peso dati dall’uso di ALA è la riduzione dell’appetito e gli studi pair-fed suggeriscono che ciò può rappresentare l’80-90% (stima approssimativa derivata dai grafici) degli effetti complessivi della riduzione del peso secondari all’uso dell’ALA.
In vitro, l’ALA è stato in grado di indurre la secrezione di apelina dalle cellule adipose (una adipokina che può regolare il metabolismo del glucosio), ma è stato ritenuto non correlato ai cambiamenti osservati in vivo.(41)

Per quanto riguarda l’AMPK, almeno uno studio ha riportato risultati che suggeriscono che l’inibizione del AMPK potrebbe verificarsi negli adipociti 3T3-L1, ma lo studio non è stato progettato per rispondere a queste domande.(41) Altri due studi sottolineano che nel tessuto adiposo bianco avviene sia una attivazione dell’AMPK che una sovraregolazione del mRNA.(42)(43)

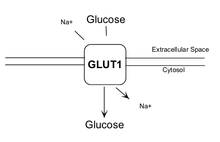
Quando si studiano le interazioni dell’ALA con l’assorbimento dei nutrienti, la sua supplementazione per 56 giorni è stata in grado di ridurre l’assorbimento dei carboidrati secondario all’inibizione del trasportatore SGLT1 (trasportatore del glucosio sodio-dipendente) di circa un terzo, quando il jujenum è stato asportato e testato in vitro con alfa- metilglucosio. (44) Se testati in vivo allo 0,5% di ALA, tuttavia, non vi sono differenze significative nel contenuto calorico delle feci (valutato mediante bomba calorimetrica).(45)
Quindi, l’ALA ha il potenziale per inibire l’assorbimento dei nutrienti, ma non sembra abbastanza potente da creare un impatto significativo.

Negli animali alimentati con una dose di ALA del 0,5% dell’assunzione di cibo, quando l’apporto calorico era controllato (ricordiamoci che l’ALA può sopprimere l’appetito), il dispendio energetico valutato mediante calorimetria indiretta aumentava dal giorno 3 e continuava ad essere elevato per i 21 giorni del test.(46) Questi ratti hanno mostrato una maggiore espressione del UCP1 nel tessuto adiposo bruno e nell’espressione ectopica del UCP1 nel tessuto adiposo bianco, ritenuta una ragione dell’aumento del tasso metabolico.(46) Nei ratti più anziani trattati con ALA allo 0,75% per 4 settimane, è stato osservato un aumento del tasso metabolico attraverso un meccanismo AMPK / PGC-1° dipendente. Questo tasso metabolico (associato ad una riduzione del 18% dell’assunzione di cibo) ha comportato una perdita di peso totale del 15,8%.(47) Il consumo di ossigeno e la produzione di anidride carbonica in questi ratti anziani alimentati con ALA allo 0,75% sono aumentati rispettivamente del 27% e del 38%.(47)
In uno studio condotto su 228 persone (360 all’inizio con un alto tasso di abbandono), che erano obese o sovrappeso e con anomalie metaboliche (sindrome metabolica), trattate con 1.2g o 1.8g di ALA (divisi in tre dosi giornaliere prima dei pasti) per 20 settimane è stata osservata una significativa riduzione del peso nel gruppo trattato con 1.8g quando tutti i gruppi erano soggetti a un deficit di 600kcal.(48) La perdita di peso media è stata di 0,94+/-0,45kg nel gruppo placebo, 1,49+/-0,38kg nel gruppo trattato con 1,2g e di 2,76+/-0,53kg nel gruppo trattato con 1,8g.(48)
Nei ratti anziani, i miglioramenti nel contenuto del mRNA di GLUT4 e PGC-1a sono aumentati del 105% e dell’80% (rispettivamente) dopo 4 settimane di assunzione di ALA allo 0,75%. (47)
Uno studio sui ratti ha osservato che con iniezioni di ALA di 30mg/kg, le proteine da shock termico 72 e 25 sono state indotte nella dieta ad alto contenuto di grassi (60%) ma non in quella a basso contenuto di grassi (10%), condizione che è stata in grado di ridurre la segnalazione proinfiammatoria via JNK e NF-kB (riportata altrove (49) (50)) e di migliorare la resistenza all’insulina indotta dagli acidi grassi.(51) L’ALA è stato precedentemente implicato (insieme ad altri antiossidanti, Vitamina C e Vitamina E) nella riduzione dell’attività del IRS-1 e nel miglioramento della sensibilità all’insulina attraverso questo meccanismo.(52)
Sono stati osservati anche aumenti dei marker del metabolismo lipidico, cioè un aumento della fosforilazione di AMPK, ACC, FAS e ATGl. L’effetto di questa aumentata β-ossidazione è stata la diminuzione dell’accumulo di lipidi.(53) Un’aumentata espressione del SIRT1 è stata osservata nei miotubi in modo secondario all’AMPK e ad un aumento del rapporto NAD/NADH, tuttavia il knockdown del SIRT1 con siRNA riduce la β-ossidazione indotta dall’AMPK in queste cellule. (53) Questi effetti non erano significativamente più potenti del Resveratrolo, un noto inibitore della PDE4 che influenza l’AMPK.(53) L’ALA allo 0,5% della dieta ha dimostrato di ridurre l’accumulo di lipidi nelle cellule adipose, ma questo studio ha attribuito ciò agli effetti anoressizzanti (soppressione dell’appetito) piuttosto che attraverso l’azione dell’AMPK.(45)
Osservando il meccanismo della sovraregolazione dell’AMPK, è stato dimostrato che questo può verificarsi indipendentemente dal rapporto AMP: ATP (contrastando uno studio precedente che suggeriva come causa l’attivazione del LKB1 (53)) e secondario all’aumento della concentrazione di calcio intracellulare a 200 μM e 500um.(54) Il calcio intracellulare chelante può inibire gli effetti dell’ALA sull’AMPK, così come può inibire l’enzima CaMKK, che rilascia il calcio nei miociti.(54)
Uno studio ha osservato che, nei ratti alimentati con una dieta al 10% di grassi l’ALA non era in grado di stimolare l’assorbimento del glucosio nelle cellule muscolari in vivo, ma era in grado di migliorare la riduzione del 54,7% dell’assorbimento di glucosio osservata nei ratti alimentati con una dieta ricca di grassi (60%) del 55,7%.(51)
La supplementazione orale di 1.8g di ALA per 2 settimane non sembra influenzare i tassi di secrezione di Insulina in uomini sani anche se sovrappeso o obesi.(55)
L’alterazione della sensibilità all’insulina osservata in condizioni di ipertrigliceridemia non sembra subire miglioramenti con l’uso giornaliero di 1,8g di ALA per 2 settimane.(55)
L’ALA è stato studiato per uso orale a dosi di 300, 600, 900 e 1.200mg di una miscela racemica per un periodo di assunzione di 6 mesi in soggetti con diabete di tipo II confermato (alcune in terapia anti-iperglicemica). I ricercatori hanno osservato una tendenza dose-dipendente nella riduzione della glicemia a digiuno e del HbA1c ad ogni dosaggio indicato, e una riduzioni significative quando tutti i gruppi sono stativagliati nell’insieme e quando i soggetti sono stati confrontati con il basale. (56) Uno studio più lungo durato 4 anni con una somministrazione giornaliera di 600mg di ALA ha mostrato una maggiore diminuzione del HbA1c associata all’ALA (0,67 ± 1,41%) rispetto al placebo (0,48 ± 1,46%), ma non ha raggiunto un impatto significativo.(57)
L’ALA, sopprimendo l’AMPK ipotalamico ma attivando l’AMPK periferico, presenta somiglianze meccanicistiche con l’ormone Leptina. Tuttavia, quando testato sui topi, sia gli animali con recettori della Leptina che quelli privi di tali recettori hanno mostrato questi effetti, suggerendo che l’ALA agisce come un Leptina-mimetico nei risultati (ma non nei meccanismi) e può aiutare a superare la resistenza alla Leptina bypassando il recettore.(46)
Quando somministrato a ratti soggetti a steatosi epatica non alcolica (NAFLD), l’ALA può sopprimerne la patogenesi e l’aumento previsto della Leptina (58) e aumentare i livelli di Leptina in un modello di diabete di tipo I, condizione quest’ultima che causa una riduzione della Leptina. (59) Se somministrato allo 0,25% della dieta in ratti sani, si osserva una diminuzione della Leptina circolante e dell’mRNA della Leptina dopo 8 settimane di assunzione ed è stata correlata (r = 0,908) con i livelli di tessuto adiposo bianco. (60) Adipociti isolati da questi ratti dopo 8 settimane soggetti a 250uM di ALA hanno aumentato la conversione del glucosio in lattato (con un significativo aumento del lattato del 44% a 500 μM) e questo aumento del lattato è stato correlato con una diminuzione della secrezione di Leptina.(60) L’ALA sembra essere associato ad una aumentata fosforilazione del Sp1, un fattore di trascrizione nucleare indotto dal glucosio che stimola la Leptina. La sua fosforilazione impedisce le sue azioni nel nucleo e le azioni dell’ALA sono state imitate dagli inibitori del PI3K.(60)

L’ALA è stato correlato ad un aumento dell’assorbimento di Creatina in seguito ad uno studio di Burke et al. (2003), nel quale venne stabilito che la cosomministrazione di ALA e Creatina migliorasse il trasporto e il contenuto muscolare totale di quest’ultima.(61) Purtroppo, lo studio presenta delle limitazioni che ne impediscono una valutazione concreta e che vanno dalle caratteristiche dei soggetti utilizzati (non allenati prima dello studio) al tipo di carboidrato assunto. In definitiva, sembra che l’ALA velocizzi soltanto l’uptake cellulare di Creatina ma non il contenuto totale di questa.
Viene sconsigliata un assunzione giornaliera superiore a 1.8g onde evitare possibili casi di tossicità. Viene consigliata la contemporanea somministrazione di vitamine del gruppo B insieme all’ALA dal momento che quest’ultimo ne può provocare la perdita.(62)
Esistono diverse altre azioni potenziali legate all’uso dell’ALA e che sono state scientificamente documentate. Per ovvie ragioni, legate soprattutto all’argomento principale trattato in questa serie di articoli, ho omesso diversi studi di un certo interesse. Per chiunque volesse approfondire cliccare qui.
Per concludere l’analisi delle potenzialità dell’Acido Alfa Lipoico sul piano metabolico (e prettamente glucidico), non si può che esserne affascinati ed in parte delusi quando si soppesano i possibili effetti con la loro limitata applicabilità. A differenza della Berberina (vista nel dettaglio nella prima parte di questa serie di articoli), che ha mostrato una versatilità estrema accompagnata da una efficacia ben documentata, l’ALA ha mostrato invece di avere un impatto significativo (soprattutto come GDA) solo in contesti patologici o in condizioni che potremmo definire “induttive alla patologia” (vedi diete con elevato contenuto lipidico e insulino resistenza correlata). Se da un lato l’ALA sembri avere un vantaggio sullo stoccaggio del glicogeno epatico dall’altro mostra (a dosaggi >1-1.2g) sul lungo periodo la possibilità di causare danno epatico in soggetti sani. Questo rappresenta sicuramente una limitazione al suo utilizzo. L’impatto dell’ALA sulla soppressione dell’appetito, sull’aumento della beta-ossidazione e sui meccanismi legati alla Leptina, risultano sicuramente interessanti per i soggetti sottoposti a diete ipocaloriche e/o ipoglucidiche.
A questo punto la domanda che si ripresenta è “come si possono utilizzare queste informazioni per pianificare l’uso dell’ALA”?
- Vista la sua efficacia in soggetti patologici e/o in condizioni che in precedenza abbiamo classificato come “induttive alla patologia”, l’uso temporalmente ridotto di 1.2-1.8g (stand alone) o protratto di 600mg (in combinazione con altri GDA; vedi possibile azione additiva con la Berberina) di ALA al giorno può portare a dei vantaggi in quei soggetti con una insulino-resistenza di base genetica, cioè individui con una tolleranza glucidica limitata rispetto alla media, in condizioni nelle quali la percentuale dei macronutrienti pende in maniera marcata verso il consumo lipidico (vedi diete chetogeniche) o durante regimi ipercalorici (vedi peggioramento dell’insulino-resistenza durante regimi ipercalorici).
- Dosi contenute di ALA (400-600mg/die) assunte durante periodi ipocalorici possono aiutare il soggetto trattato a tollerare la riduzione calorica per via dell’effetto anoressizzante dato dall’uso di questo composto (legato al suo effetto leptino-mimetico non recettore-dipendente a livello ipotalamico).
- In combinazione con altri GDA durante e nel periodo successivo (periodo “protocollare” di 4 settimane) all’uso di Insulina esogena.
Gli effetti collaterali legati all’uso dell’ALA alle dosi e modalità di “sicurezza” sopra indicate sembrano essere rari e lievi, come rusch cutanei. I soggetti che decidono di assumerlo in concomitanza con l’uso di Insulina esogena devono prestare molta attenzione alla dose utilizzata del peptide in rapporto agli effetti indotti dalla dose di ALA utilizzata. È possibile, infatti, che possano aumentare i casi ipoglicemici (cosa possibile con tutti i GDA cosomministrati in tali circostanza). Un controllo regolare della glicemia ematica è una accortezza imprescindibile sia con l’uso di Insulina da sola che, in misura maggiore, cosomministrata con composti aventi effetti ipoglicemizzanti.
Quindi, cura del dosaggio e ponderatezza nell’utilizzo.
Fine 2° Parte…
Gabriel Bellizzi
Riferimenti:
- Lipoic Acid Biosynthesis: LipA Is an Iron−Sulfur Protein.
- Akiba S, et al. Assay of protein-bound lipoic acid in tissues by a new enzymatic method. Anal Biochem. (1998)
- Wollin SD, Jones PJ. Alpha-lipoic acid and cardiovascular disease. J Nutr. (2003)
- Moini H, Packer L, Saris NE. Antioxidant and prooxidant activities of alpha-lipoic acid and dihydrolipoic acid. Toxicol Appl Pharmacol. (2002)
- Merry BJ, Kirk AJ, Goyns MH. Dietary lipoic acid supplementation can mimic or block the effect of dietary restriction on life span. Mech Ageing Dev. (2008)
- Satoh S, et al. Selective and sensitive determination of lipoyllysine (protein-bound alpha-lipoic acid) in biological specimens by high-performance liquid chromatography with fluorescence detection. Anal Chim Acta. (2008)
- Backman-Gullers B, et al. Studies on lipoamidase: characterization of the enzyme in human serum and breast milk. Clin Chim Acta. (1990)
- Hiltunen JK, et al. Mitochondrial fatty acid synthesis type II: more than just fatty acids. J Biol Chem. (2009)
- Shay KP, et al. Alpha-lipoic acid as a dietary supplement: molecular mechanisms and therapeutic potential. Biochim Biophys Acta. (2009)
- Reed LJ. From lipoic acid to multi-enzyme complexes. Protein Sci. (1998)
- Park CH, et al. Improved efficacy of appetite suppression by lipoic acid particles prepared by nanocomminution. Drug Dev Ind Pharm. (2009)
- The Chemistry of 1,2-Dithiolane (Trimethylene Disulfide) As a Model for the Primary Quantum Conversion Act in Photosynthesis.
- Kinetics of the thiol-disulfide exchange. II. Oxygen-promoted free-radical exchange between aromatic thiols and disulfides.
- Saito G, Swanson JA, Lee KD. Drug delivery strategy utilizing conjugation via reversible disulfide linkages: role and site of cellular reducing activities. Adv Drug Deliv Rev. (2003)
- Interrelationships of Lipoic Acids.
- Jones W, et al. Uptake, recycling, and antioxidant actions of alpha-lipoic acid in endothelial cells. Free Radic Biol Med. (2002)
- Preparation and use of salts of the pure enantiomers of alpha-lipoic acid.
- Dosage forms containing thioctic acid or solid salts of thioctic acid with improved release and bioavailability.
- Takaishi N, et al. Transepithelial transport of alpha-lipoic acid across human intestinal Caco-2 cell monolayers. J Agric Food Chem. (2007)
- Prasad PD, et al. Cloning and functional expression of a cDNA encoding a mammalian sodium-dependent vitamin transporter mediating the uptake of pantothenate, biotin, and lipoate. J Biol Chem. (1998)
- Balamurugan K, Vaziri ND, Said HM. Biotin uptake by human proximal tubular epithelial cells: cellular and molecular aspects. Am J Physiol Renal Physiol. (2005)
- Teichert J, et al. Investigations on the pharmacokinetics of alpha-lipoic acid in healthy volunteers. Int J Clin Pharmacol Ther. (1998)
- Teichert J, et al. Plasma kinetics, metabolism, and urinary excretion of alpha-lipoic acid following oral administration in healthy volunteers. J Clin Pharmacol. (2003)
- Carlson DA, et al. The plasma pharmacokinetics of R-(+)-lipoic acid administered as sodium R-(+)-lipoate to healthy human subjects. Altern Med Rev. (2007)
- Breithaupt-Grögler K, et al. Dose-proportionality of oral thioctic acid–coincidence of assessments via pooled plasma and individual data. Eur J Pharm Sci. (1999)
- Harrison EH, McCormick DB. The metabolism of dl-(1,6-14C)lipoic acid in the rat. Arch Biochem Biophys. (1974)
- Panigrahi M, et al. alpha-Lipoic acid protects against reperfusion injury following cerebral ischemia in rats. Brain Res. (1996)
- Arivazhagan P, et al. Effect of DL-alpha-lipoic acid on the status of lipid peroxidation and antioxidant enzymes in various brain regions of aged rats. Exp Gerontol. (2002)
- Mignini F, et al. Single dose bioavailability and pharmacokinetic study of a innovative formulation of α-lipoic acid (ALA600) in healthy volunteers. Minerva Med. (2011)
- Schupke H, et al. New metabolic pathways of alpha-lipoic acid. Drug Metab Dispos. (2001)
- Zechner R, et al. Adipose triglyceride lipase and the lipolytic catabolism of cellular fat stores. J Lipid Res. (2009)
- Kuo YT, et al. Alpha-lipoic acid induces adipose triglyceride lipase expression and decreases intracellular lipid accumulation in HepG2 cells. Eur J Pharmacol. (2012)
- Butler JA, Hagen TM, Moreau R. Lipoic acid improves hypertriglyceridemia by stimulating triacylglycerol clearance and downregulating liver triacylglycerol secretion. Arch Biochem Biophys. (2009)
- El Midaoui A, et al. Impact of α-lipoic acid on liver peroxisome proliferator-activated receptor-α, vascular remodeling, and oxidative stress in insulin-resistant rats. Can J Physiol Pharmacol. (2011)
- Park KG, et al. Alpha-lipoic acid decreases hepatic lipogenesis through adenosine monophosphate-activated protein kinase (AMPK)-dependent and AMPK-independent pathways. Hepatology. (2008)
- Kuhla A, et al. Prophylactic and abundant intake of α-lipoic acid causes hepatic steatosis and should be reconsidered in usage as an anti-aging drug. Biofactors. (2016)
- Yi X, et al. Reversal of obesity-induced hypertriglyceridemia by (R)-α-lipoic acid in ZDF (fa/fa) rats. Biochem Biophys Res Commun. (2013)
- Alkhouri N, Dixon LJ, Feldstein AE. Lipotoxicity in nonalcoholic fatty liver disease: not all lipids are created equal. Expert Rev Gastroenterol Hepatol. (2009)
- Browning JD, Horton JD. Molecular mediators of hepatic steatosis and liver injury. J Clin Invest. (2004)
- Prieto-Hontoria PL, et al. Lipoic acid prevents body weight gain induced by a high fat diet in rats: effects on intestinal sugar transport. J Physiol Biochem. (2009)
- Fernández-Galilea M, et al. Effects of lipoic acid on apelin in 3T3-L1 adipocytes and in high-fat fed rats. J Physiol Biochem. (2011)
- Prieto-Hontoria PL, et al. Effects of lipoic acid on AMPK and adiponectin in adipose tissue of low- and high-fat-fed rats. Eur J Nutr. (2012)
- Cheng PY, et al. Reciprocal effects of α-lipoic acid on adenosine monophosphate-activated protein kinase activity in obesity induced by ovariectomy in rats. Menopause. (2011)
- Prieto-Hontoria PL, et al. Lipoic acid prevents body weight gain induced by a high fat diet in rats: effects on intestinal sugar transport. J Physiol Biochem. (2009)
- Timmers S, et al. Prevention of high-fat diet-induced muscular lipid accumulation in rats by alpha lipoic acid is not mediated by AMPK activation. J Lipid Res. (2010)
- Kim MS, et al. Anti-obesity effects of alpha-lipoic acid mediated by suppression of hypothalamic AMP-activated protein kinase. Nat Med. (2004)
- Wang Y, et al. alpha-Lipoic acid increases energy expenditure by enhancing adenosine monophosphate-activated protein kinase-peroxisome proliferator-activated receptor-gamma coactivator-1alpha signaling in the skeletal muscle of aged mice. Metabolism. (2010)
- Koh EH, et al. Effects of alpha-lipoic Acid on body weight in obese subjects. Am J Med. (2011)
- Park HS, et al. Hsp72 functions as a natural inhibitory protein of c-Jun N-terminal kinase. EMBO J. (2001)
- Park KJ, Gaynor RB, Kwak YT. Heat shock protein 27 association with the I kappa B kinase complex regulates tumor necrosis factor alpha-induced NF-kappa B activation. J Biol Chem. (2003)
- Gupte AA, et al. Lipoic acid increases heat shock protein expression and inhibits stress kinase activation to improve insulin signaling in skeletal muscle from high-fat-fed rats. J Appl Physiol. (2009)
- Antioxidants preserve redox balance and inhibit c-Jun-N-terminal kinase pathway while improving insulin signaling in fat-fed rats: evidence for the role of oxidative stress on IRS-1 serine phosphorylation and insulin resistance.
- Chen WL, et al. α-Lipoic acid regulates lipid metabolism through induction of sirtuin 1 (SIRT1) and activation of AMP-activated protein kinase. Diabetologia. (2012)
- Shen QW, et al. Ca2+/calmodulin-dependent protein kinase kinase is involved in AMP-activated protein kinase activation by alpha-lipoic acid in C2C12 myotubes. Am J Physiol Cell Physiol. (2007)
- Xiao C, Giacca A, Lewis GF. Short-term oral α-lipoic acid does not prevent lipid-induced dysregulation of glucose homeostasis in obese and overweight nondiabetic men. Am J Physiol Endocrinol Metab. (2011)
- Porasuphatana S, et al. Glycemic and oxidative status of patients with type 2 diabetes mellitus following oral administration of alpha-lipoic acid: a randomized double-blinded placebo-controlled study. Asia Pac J Clin Nutr. (2012)
- Ziegler D, et al. Efficacy and safety of antioxidant treatment with α-lipoic acid over 4 years in diabetic polyneuropathy: the NATHAN 1 trial. Diabetes Care. (2011)
- Jung TS, et al. α-lipoic acid prevents non-alcoholic fatty liver disease in OLETF rats. Liver Int. (2012)
- Kandeil MA, et al. Role of lipoic acid on insulin resistance and leptin in experimentally diabetic rats. J Diabetes Complications. (2011)
- Prieto-Hontoria PL, et al. Lipoic acid inhibits leptin secretion and Sp1 activity in adipocytes. Mol Nutr Food Res. (2011)
- Burke et al. Effect of alpha-lipoic acid combined with creatine monohydrate on human skeletal muscle creatine and phosphagen concentration. Int J Sport Nutr Exerc Metab. 2003 Sep;13(3):294-302.
- Ted A. Lennard, David G Vivian, Stevan DOW Walkowski, Aneesh K. Singla, Pain Procedures in Clinical Practice, Elsevier Health Sciences, 11 giugno 2011, pp. 1015–, ISBN 978-1-4377-3774-5. URL consultato il 29 settembre 2012.