Introduzione

Con il termine GDA (Glucose Disposal Agent) ci si riferisce ad una serie di composti (non farmaci) aventi la capacità di ottimizzare il metabolismo glucidico cellulare agendo sul miglioramento del insulino-resistenza. Questi integratori alimentari stanno avendo un largo consumo nel BodyBuilding e nel Fitness in generale data la, ormai, conosciuta importanza che la sensibilità all’insulina ha sulla composizione corporea e sulla salute generale. I GDA, quindi, agendo sul miglioramento della sensibilità all’Insulina contribuiscono ad una migliore ripartizione calorica che si traduce in un maggiore trasporto dei nutrienti verso il miocita (cellula muscolare) rispetto all’adipocita. Lo scopo di questa serie di articoli è, quindi, sostanzialmente quello di analizzare nel dettaglio i principali GDA valutandone il potenziale attraverso ciò che la letteratura scientifica ad oggi disponibile riporta analizzandone le possibili migliori applicazioni.
Principali GDA e loro caratteristiche
- Berberina: caratteristiche e possibili applicazioni.

La Berberina è un alcaloide, più precisamente un sale di ammonio quaternario appartenente al gruppo protoberberino degli alcaloidi benzilisochinolinici trovati in piante del genere Berberis (ad es. Berberis vulgaris – crespino, Berberis aristata – albero curcuma, Mahonia aquifolium – uva-Oregon, Hydrastis canadensis – goldenseal, Xanthorhiza simplicissima – yellowroot, Phellodendron amurense (1) – Albero di sughero Amur, Coptis chinensis – Goldthread cinese, Tinospora cordifolia, Argemone mexicana – papavero spinoso ed Eschscholzia californica – Papavero californiano). La Berberina si trova solitamente nelle radici, nei rizomi, nei gambi e nella corteccia delle piante precedentemente elencate.
Come accennato pocanzi, la Berberina è un alcaloide estratto da diverse piante utilizzate nella medicina tradizionale cinese.
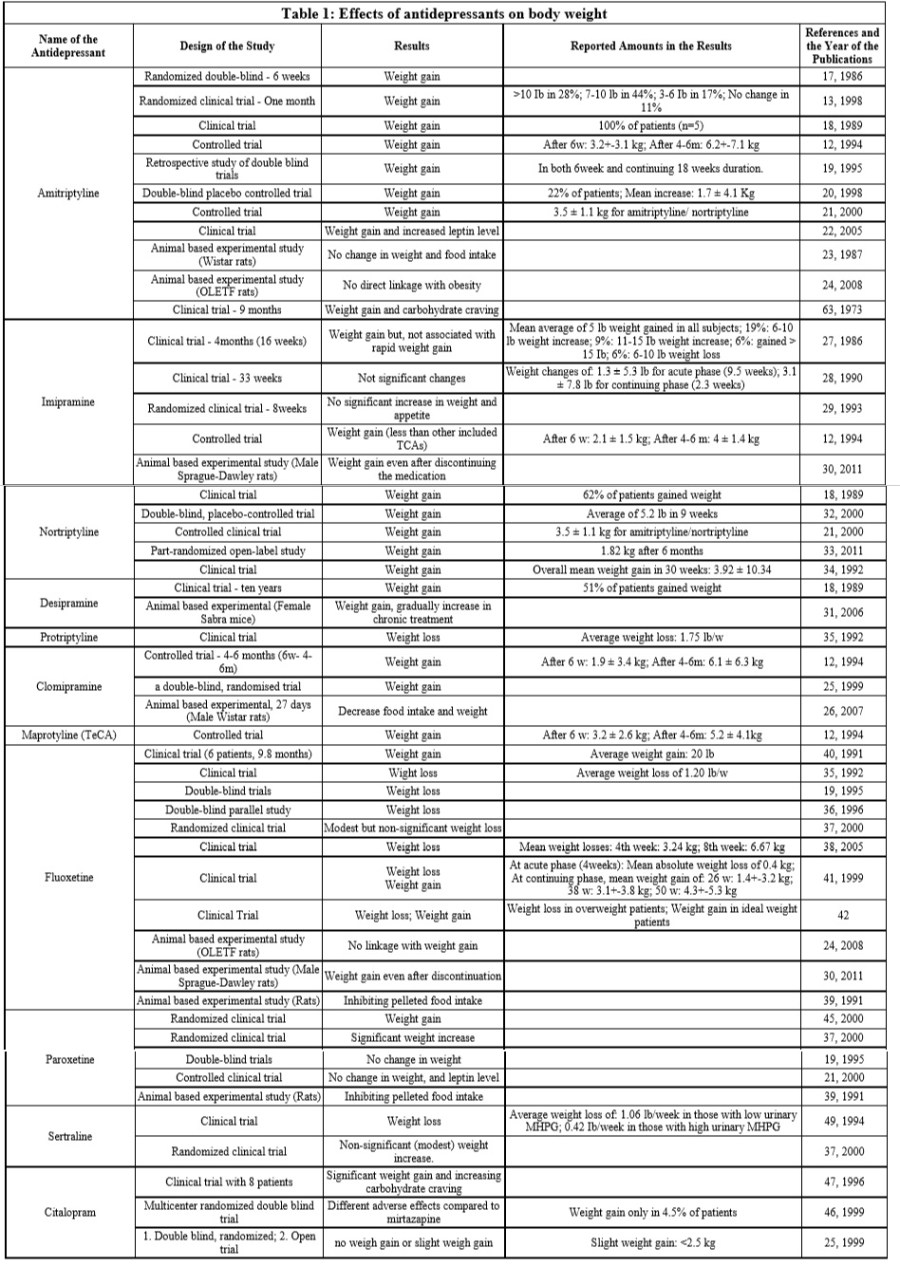
La Berberina è attualmente in fase di studio al fine di determinarne l’efficacia d’uso per il trattamento del aritmia, del diabete, (2) del iperlipidemia, (3) del infiammazione (4) e del cancro. La Berberina esplica azione antiaritmica di classe III.(5) Vi sono alcune prove che la Berberina possa avere proprietà Anti-Aging (gero-soppressive).(6)(7) Alcune ricerche sono state condotte su un possibile uso contro l’infezione da Staphylococcus aureus (MRSA) resistente alla meticillina.(8) La Berberina è considerata un antibiotico.(9)(10) Quando applicata in vitro e in combinazione con Methoxyhydnocarpina, un inibitore di pompe a resistenza multipla, la Berberina inibisce la crescita dello Staphylococcus aureus (11) e Microcystis aeruginosa (12), un cianobatterio tossico. La Berberina è utilizzata principalmente per i suoi effetti anti-infiammatori e anti-diabetici. Può anche migliorare la salute intestinale e abbassare il colesterolo. La Berberina è in grado di ridurre la gluconeogenesi epatica. La ricerca svolta su esseri umani e animali ha dimostrato che un dosaggio di Berberina pari a 1500mg/die, assunti in tre dosi eguali distribuite nell’arco della giornata, ha la medesima efficacia riscontrata con lo stesso dosaggio di Metformina o con 4mg di Glibenclamide, due farmaci per il trattamento del diabete di tipo II. L’efficacia è stata misurata attraverso l’impatto dei composti sulla riduzione dei biomarcatori del diabete di tipo II.
La Berberina sembra avere anche un effetto sinergico con i farmaci antidepressivi e coadiuvare la perdita del grasso corporeo. Entrambi questi benefici hanno bisogno di ulteriori prove a loro sostegno prima che la Berberina possa essere raccomandata per l’uso in tali circostanze.
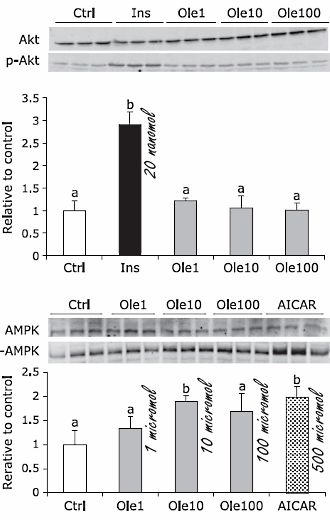
Il principale meccanismo responsabile degli effetti anti-infiammatori e anti-diabetici della Berberina è rappresentato dalla sua capacità di attivare un enzima chiamato proteina kinasi dipendente dall’adenosina monofosfato (Adenosine Monophospate-activated Protein Kinase o AMPK) inibendo al contempo la proteina-tirosina fosfatasi 1B (PTP1B).
Nelle cellule vive, la Berberina si localizza nei mitocondri. La sua localizzazione mitocondriale è coerente con l’inibizione del complesso I della catena respiratoria, la diminuzione della produzione di ATP e la successiva attivazione del AMPK, che porta alla soppressione della segnalazione dell’mTOR.(6) Una caratteristica quest’ultima non positiva, specie in soggetti “Natural”, ma con gravità d’effetto dose dipendente e non significativa, in base ai dati aneddotici, ai dosaggi medi utilizzati. La biodisponibilità della Berberina è bassa.(13)
La Berberina sembra sopprimere debolmente il consumo di glucosio in acuto, (14) con 72 ore di incubazione che sopprimono l’assorbimento del glucosio ad un grado statisticamente insignificante in vitro.(15)
L’enzima saccarasi è inibito in modo concentrazione-dipendente con un IC50 di 1,83 mg/L (potenza piuttosto bassa) (14) e di 0,28 mg/ml.(16) Il complesso dell’enzima saccarosio-isomaltasi (SI) sembra avere un mRNA aumentato nella condizione diabetica. Questo aumento di espressione dell’enzima viene ridotto (fino al 62% rispetto a quello dei ratti di controllo) con una dose di 100-200 mg/kg di Berberina per 35 giorni, effetto riscontrato anche nei ratti non diabetici.(17) In un altro studio nel quale è stata utilizzata una dose di Berberina pari a 125 mg/kg per 33 giorni è stato osservato che, in risposta ad un test di tolleranza al saccarosio assunto oralmente, il composto ha prodotto il 43% in meno nella AUC del glucosio serico (meno efficace del Acarbosio a 20mg/kg come controllo attivo) correlato con una minore attività del sucrasi in tutte le parti dell’intestino.(16) In un altro studio, una dose di 100mg/Kg di Berberina ha dimostrato di avere effetti analoghi. (18)
L’enzima maltasi sembra essere inibito ma non in modo dose-dipendente, (14) con uno studio che mostra le alterazioni dell’attività del maltasi nei ratti diabetici (aumento di 1,45-2,56 volte) normalizzate con 35 giorni di integrazione di Berberina (100-200 mg / kg) (17) con una normalizzazione significativa in tutte le aree dell’intestino dopo la somministrazione di 125mg /kg per 33 giorni. (16) Non sembra esserci alcuna inibizione diretta degli enzimi attivi del maltasi fino a 50μM di Berberina (sebbene contestato, un altro studio suggerisce un IC50 di 0,11 mg / ml (16)), ma 5 giorni di esposizione a questa concentrazione riducono l’attività del 48% in vitro.(17)
L’enzima lattasi (media la digestione del lattosio) è risultato essere aumentato nella condizione diabetica e attenuato, ma non normalizzato, in seguito all’ingestione di 125mg/kg di Berberina per 33 giorni nei ratti.(16)
Per quanto riguarda l’enzima alfa-amilasi (media la digestione dell’amido), la Berberina è stata testata in uno studio in vitro per l’inibizione della crescita dipendente dalla amilasi fungina con valori di Ki simili all’Acido Clorogenico e all’Acido Caffeico suggerendo una sua azione inibitoria non competitiva dell’enzima stesso. (19)
La sottoregolazione dell’attività enzimatica (complesso maltasi e SI) sembra essere in parte dipendente dalla PKA e l’inibizione della PKA con l’inibitore H89 attenua (ma non inibisce totalmente) questi effetti.(17)
L’effetto ipoglicemizzante della Berberina fu scoperto per la prima volta nel 1988 quando una condizione ipoglicemica venne osservata accidentalmente nei pazienti diabetici trattati con Berberina per i suoi effetti anti-diarroici.(20)
Una meta-analisi è stata condotta sulla Berberina al fine di valutarne le potenzialità nel trattamento del diabete di tipo II.(21) Questa meta-analisi ha rilevato 14 studi (tutti provenienti dalla Cina), che includevano l’osservazione di 1068 pazienti tra il 2007 ed il 2011, nei quali si è osservato che l’assunzione di Berberina ad un dosaggio di 0,5-1,5 g al giorno, abbinata ad un intervento correttivo dello stile di vita del paziente, per 12 settimane era associata a miglioramenti della glicemia a digiuno (0,87 mmol / Riduzione L, CI 0,54-1,20), postprandiale (riduzione di 1,72 mmol / L, CI 1,11-2,32) e del HbA1c (riduzione dello 0,72%; CI 0,47-0,97%) con miglioramenti del metabolismo lipidico e la riduzione dei livelli di Insulina a digiuno ( 0,5 mU / L; CI 0,03-0,96).(21)
Sette studi (su 448 pazienti) hanno utilizzato una valutazione comparativa con gli agenti ipoglicemizzanti orali e, sebbene non sia possibile eseguire una meta-analisi a causa dell’eterogeneità dei dati, non sembrano esserci differenze significative quando la Berberina è stata confrontata con Metformina, Glipizide, o Rosiglitazone. (21) In 4 studi su 6 che hanno usato la Berberina come trattamento adiuvante insieme ai farmaci ipoglicemizzanti orali, i benefici additivi sono risultati significativi per la glicemia a digiuno (riduzione di 0,59 mmoli / L, CI 0,35-0,83), postprandiale (riduzione di 1,05 mmoli / L, CI 0,48-1,62 ) e l’HbA1c (riduzione dello 0,53%, CI 0,11-0,95%) che sono stati osservati ridursi maggiormente nella terapia combinata rispetto all’uso dei soli farmaci ipoglicemizzanti orali.(21)
La metodologia degli studi inclusi è ritenuta scadente (punteggio Jadad minore di 3) ma non sembra esserci il rischio di bias come valutato mediante il grafico a imbuto (anche se in 10 studi utilizzati il grafico a imbuto non può essere stato accurato in modo desiderabile (22)).(21) Questa meta-analisi ha escluso tre studi (nessuno dei quali è indicizzato online) a causa delle differenze al basale o dell’incertezza nella randomizzazione.(21)
Un altro studio sulla Berberina ha mostrato che l’assunzione di 0,3g tre volte al giorno (900mg in totale) per 12 settimane su 37 soggetti con sindrome metabolica di nuova diagnosi causano una riduzioni significativa della glicemia (17%), del HbA1c (15%), dell’Insulina a digiuno (26%), e della sensibilità all’insulina valutata con l’indice HOMA-R (41%).(23) I soggetti con diabete di tipo II che avevano assunto 1g di Berberina per un mese hanno sperimentato una riduzione del 20% e del 26% rispettivamente del glucosio ematico a digiuno e post-prandiale insieme a una riduzione del 12% del HbA1c, ma solamente con una lieve tendenza al miglioramento della sensibilità all’insulina.(24) L’assunzione di 1g di Berberina per 2 mesi ha ridotto la glicemia a digiuno (25,9%), l’HbA1c (18,1%) e i Trigliceridi (17,6%).(25) Un altro studio sugli esseri umani con steatosi epatica non alcolica a cui sono stati applicati solo interventi sullo stile di vita o interventi sullo stile di vita più 15 mg di Pioglitazone al giorno o 0,5g di Berberina al giorno per 16 settimane non ha riscontrato differenze tra i 3 gruppi sul HbA1C, ma ha osservato un miglioramento nel punteggio del HOMA-IR nel gruppo che ha subito interventi sullo stile di vita insieme all’inserimento della Berberina rispetto agli interventi sullo stile di vita senza supplementazione, con nessuna differenza rispetto agli interventi sullo stile di vita in combinazione con la somministrazione di Pioglitazone.(26) L’area sotto la curva glicemica dopo un test di tolleranza al glucosio orale è stata ridotta anche nel gruppo trattato con Berberina rispetto ai soli interventi sullo stile di vita (con ancora nessuna differenza rispetto al Pioglitazone), principalmente a causa di una maggiore riduzione del glucosio a 120 e 180 minuti.(27) Miglioramenti simili sono stati riscontrati in soggetti con la sindrome metabolica, in cui 0,5g di Berberina tre volte al giorno per tre mesi hanno portato ad un miglioramento della sensibilità all’Insulina come misurato dagli indici insulinogenici e di Matsuda, dalla glicemia della AUC del glucosio e della AUC dell’Insulina rispetto al placebo.(27)

Studi comparativi sull’uso della Berberina hanno mostrato che l’assunzione di 1g al giorno dell’alcaloide presenta la medesima efficacia nel miglioramento dei parametri misurati (solitamente glicemia a digiuno, Insulina, HbA1c e Trigliceridi) riscontrata con la Metformina (28) (25) e il Rosiglitazone (25) quando utilizzati entro il range di dosaggio standard di 1,5g (Metformina) o 4mg (Rosiglitazone).

La Berberina ha mostrato di poter aumentare i livelli di Adiponectina, una adipochina (molecola di segnalazione derivata da cellule adipose) che svolge un ruolo positivo nella sensibilità all’Insulina (viene secreta e quindi agisce sul tessuto attraverso i suoi recettori per attivare l’AMPK (29)) e che si riduce nei diabetici, in particolare nella struttura ad alta attività. (30) L’Adiponectina si trova in tre forme strutturali: trimero, esamero e ad alto peso molecolare. Quest’ultima è maggiormente correlata alla sensibilità all’Insulina (31); la Berberina (2-4uM) agisce attraverso l’attivazione del AMPK, in particolare il sottoinsieme AMPKα1, per aumentare la percentuale di Adiponectina nella sua struttura ad alta attività; un processo noto come multimerizzazione della Adiponectina. (32) Questo è stato anche notato con l’uso del AICAR, un noto farmaco sperimentale utilizzato per attivare l’AMPK, suggerendo un effetto generale che non è unico per la Berberina; (32) questo intricato ciclo (Attivazione dell’Adiponectina tramite l’AMPK che promuove l’Adiponectina ad alta attività) è un meccanismo di autoregolazione dell’Adiponectina. (33)
Va notato che gli studi sull’uso della Berberina in adipociti predifferenziati hanno rilevato una minore secrezione di Adiponectina che era la conseguenza naturale della soppressione della differenziazione.(23) Questo è stato anche replicato nello studio sopra menzionato sull’aumento della funzione dell’Adiponectina, con entrambi i fenomeni che si verificano a concentrazioni simili. (32)
La Berberina ha dimostrato di stimolare l’uptake del glucosio nel muscolo scheletrico (34) in modo parzialmente mediato dal AMPK.(35)

L’attivazione del AMPK può aumentare la biogenesi mitocondriale nelle cellule del muscolo scheletrico, cosa che è stata dimostrata in seguito ad assunzione di Berberina; è stata stabilita l’inattività della Berberina nelle cellule prive del SIRT-1 (un intermedio richiesto).(36)

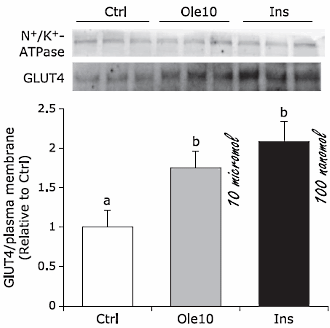
La Berberina è nota anche per migliorare l’uptake del glucosio nelle cellule adipose con una concentrazione di 25μm dimostratasi altrettanto potente di una concentrazione di 15uM di 2,4-thiazolidinedione (TZD, un farmaco antidiabetico, di 3,3 volte) e leggermente sovraperformato sia rispetto alla Arecolina (3,2 volte) che all’Acido Vanillico (2,9 volte), entrambi prodotti naturali. (37) Questo studio ha anche rilevato che Berberina ha agito sinergicamente sia con il TZD che con la Metformina. (37) La Berberina ha anche dimostrato di essere più efficace nell’aumentare l’assorbimento del glucosio rispetto ai polisaccaridi del Astragalus Membranaceus. (38)
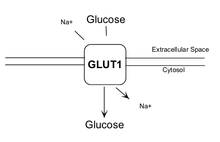
Sebbene l’aumento dell’attività del AMPK dato dalla Berberina sia noto per migliorare l’uptake del glucosio negli adipociti, (39) la Berberina sembra agire indipendentemente dal AMPK per aumentare l’assorbimento del glucosio di 5 volte nelle cellule dei fibroblasti L929 che esprimono solo trasportatori GLUT1; si è scoperto che la Berberina aumenta l’attività dei GLUT1 (un trasportatore del glucosio normalmente poco attivo) tramite un parziale pathway del MAPK e ERK p38.(40) Questo aumento dell’attività dei GLUT1 è stato osservato negli adipociti 3T3-L1, sebbene sia classificato come secondario all’attivazione del AMPK.(41)
La Berberina può anche inibire l’enzima PTP1B e promuovere l’assorbimento del glucosio negli adipociti (e nei miociti) preservando l’attività dell’Insulina. A concentrazioni di Berberina pari a 1,25-2,5uM, la fosforilazione del Recettore dell’Insulina è aumentata senza alterare il contenuto proteico.(39) L’IC50 della Berberina sul PTP1B sembra essere di 156,9 nM con un valore Ki di 91,3 nM, un valore significativo. (42)
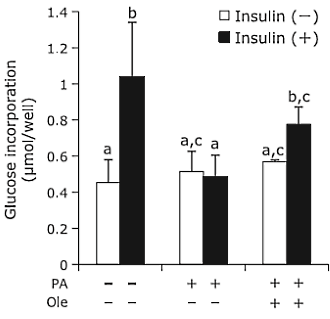
Si è scoperto che la Berberina normalizza parzialmente la diminuzione del consumo del glucosio indotto dal palmatato (un acido grasso), e ciò avviene attraverso gli effetti anti-infiammatori di inibizione dell’aumento dell’attività di IKKβ e NF-kB; che successivamente aumentano l’IRS-1 e riducono l’assorbimento del glucosio attraverso il Recettore dell’Insulina.(43) Questo effetto antinfiammatorio è stato notato anche quando la misurazione delle citochine (44), e della resistenza all’insulina indotta dagli acidi grassi è stata replicata in altre cellule in relazione al NF-kB.(45)
Lo studio svolto prendendo in esame persone con sindrome metabolica ha rilevato che l’assunzione di 300mg di Berberina tre volte al giorno (900 mg totali) per un totale di 12 settimane è associata ad una significativa riduzione del BMI da 31.5 +/- 3.6 a 27.4 +/- 2.4 (diminuzione media del 13%) con una diminuzione significativa della circonferenza vita del 5,5%; la massa magra e la massa grassa non sono state misurate. (23) Persone sane ma sovrappeso che assumono 500mg di Berberina per tre volte al giorno (1500 mg in totale) per 12 settimane senza aggiustamenti nell’esercizio fisico hanno notato una riduzione del peso corporeo di circa 2,26Kg (2,3% peso corporeo, 3,6% grasso corporeo); l’assunzione di cibo non è stata modificata nel complesso, ma due soggetti hanno riportato una diminuzione dell’appetito. (46)

Uno studio svolto su esseri umani con steatosi epatica non alcolica a cui sono stati applicati solo interventi sullo stile di vita o interventi sullo stile di vita più 15mg di Pioglitazone al giorno o 0,5g di Berberina al giorno per 16 settimane hanno riscontrato una riduzione significativa del BMI di 1,51 nel gruppo con aggiunta di Berberina rispetto alla riduzione di 0,72 in BMI riscontrata nel gruppo di solo interventi sullo stile di vita; il Pioglitazone ha causato una riduzione simile ai soli interventi sullo stile di vita.(47)

Per quanto riguarda la gluconeogensi epatica (la produzione di glucosio da fonti non glucidiche, la quale tende ad essere drasticamente aumentata nello stato di diabete contribuendo all’aumento del glucosio ematico a digiuno), la somministrazione di Berberina ad alte dosi (380mg/kg al giorno) per 5 settimane nei ratti diabetici è in grado di ridurre l’attività dei due enzimi implicati nella limitazione della velocità della gluconeogenesi epatica (PEPCK e G6Pase), senza che vi sia un aumento correlato dell’Insulina (normalmente soppressiva di questi due geni). (48) Questo sembra essere correlato alla normalizzazione dell’attività del FOXO1, che è stata aumentata nei ratti diabetici, (48) e alla riduzione del contenuto proteico e dell’mRNA (trascrizione genomica). (49)

Nelle cellule epatiche umane (studio in vitro), 10mcg/mL in 12 ore possono causare un aumento del contenuto di Recettori dell’Insulina negli epatociti; questo si estende anche ad altre linee cellulari testate (pancreas, colon, linfociti, fibroblasti) tra un aumento di 1,6 e 1,9 volte (25) e sembra funzionare sia in modo dose-dipendente che e dose-indipendente. (50) Anche la segnalazione dell’insulina è stata migliorata in modo secondario con la riduzione dello stress del reticolo endoplasmatico, (51) che è secondario al Recettore dell’Insulina.
Quando testato in cellule CEM, la coincubazione di 0,5nM di Insulina con 10mcg/mL di Berberina induce l’attivazione del Akt allo stesso grado dell’Insulina a 10nM. (25)
Uno studio sui ratti ha evidenziato che la Berberina è associata ad un aumento della secrezione di GLP-1 misurata sia nel siero che nell’intestino, in seguito all’aumento dell’mRNA del proglucagone nell’intestino; questi effetti si aggiungono alle qualità anti-diabetiche della Berberina. (52)
L’inibizione del PTP1B, che promuove la segnalazione del Recettore dell’Insulina con un IC50 di 156.9nM, (42) sembra anche avvenire nelle cellule muscolari. (39)
La Berberina sembra indurre l’assorbimento del glucosio nelle cellule muscolari di per sé indipendentemente dal fatto che la cellula sia in uno stato di aggravata insulino-resistenza (53) o di ottimale insulino-sensibile (54), e l’interazione sinergica tra Insulina e Berberina esiste solo quando la cellula muscolare è in una condizione di insulino-resistenza, mentre in presenza di cellule insulino-sensibili l’interazione è appena additiva (effetti additivi non statisticamente significativi, sembra esserci un crossover nei meccanismi). (53) (54)
La sovraregolazione del numero dei recettori insulinici (quantità di recettori insulinici espressi sulla superficie cellulare) sembra estendersi ai miociti diìel ratto L6 a 7,5 ÷ 2,5 volte quella del gruppo di controllo, con benefici significativi ma minori rilevati a 2,5uM.(50) Ciò era dovuto all’aumento della trascrizione del recettore a livello genomico, ed è dipendente dalla PKC, che la Berberina sembra attivare in modo dose-dipendente.
A causa delle interazioni con il CYP3A4 (inibizione attraverso cui può aumentare il Testosterone) e il CYP1A2 (Aromatasi), (55) in teoria la Berberina può aumentare i livelli circolanti di Testosterone; questo, però, non è ancora stato testato in sistemi viventi.
L’incubazione di Tamoxifene (1,5uM) e Berberina (16ug / mL) nelle cellule del cancro al seno MCF-7 estrogeno-sensibili è in grado di aumentarne sinergicamente l’apoptosi. (56) Questo sinergismo sembra essere correlato ai SERM in generale, sebbene il meccanismo(i) esercitato dalla Berberina non sia attualmente noto. (56)
L’intervento con Berberina su soggetti con sindrome metabolica di nuova diagnosi ad un dosaggio di 300mg assunti tre volte al giorno (900 mg totali) per 12 settimane è stato in grado di ridurre i livelli circolanti di Leptina del 36% mentre aumentava significativamente l’Adiponectina, ma il rapporto Leptina/Adiponectina è migliorato passando da 0,76 a 0,58.(23)

Il GLP-1 (glucagon-like peptide-1) è un ormone peptidico noto per essere secreto dall’intestino con proprietà ipoglicemizzanti, esplicate in parte attraverso la stimolazione della secrezione dell’Insulina (57)(58) e può anche avere un ruolo nella proliferazione delle cellule β del pancreas. (59) È stato osservato che la Berberina, alla dose orale di 120mg/kg per 5 settimane, aumenta le concentrazioni di GLP-1 e di Insulina nei ratti con diabete indotto da streptozotocina (misurazioni eseguite dopo somministrazione postprandiale). (60) Questo studio ha anche rilevato un aumento della popolazione delle cellule β (460% nel controllo diabetico, ma ancora meno della metà nel controllo non diabetico) che è stato attribuito all’azione del GLP-1.(60)
Le azioni della Berberina scientificamente documentate sono svariate e non implicano soltanto le interazioni di questo composto con il metabolismo glucidico. Per motivi di praticità, e per motivi legati all’argomento principale del presente articolo, ho dovuto omettere alcuni studi di un certo interesse. Per chiunque volesse approfondire cliccate qui.
Adesso sappiamo che la Berberina può migliorare la sensibilità all’Insulina in modo parzialmente dipendente dall’attivazione del AMPK, con conseguente aumento del uptake del glucosio sia da parte del miocita che del adipocita (sebbene, in questo ultimo caso, la cosa non è negativa come sembra dal momento che un ottimizzazione del metabolismo glucidico adipocitario porta ad un miglioramento della secrezione di Leptina con i benefici ad essa correlati), e che può ridurre l’assorbimento glucidico intestinale e ridurre i tassi di gluconeogenesi epatica. Sappiamo anche che l’impatto della Berberina in sinergia con l’Insulina risulta non significativo in condizioni di un ottimale insulino-sensibilità. A questo punto la domanda è “come si possono utilizzare queste informazioni per pianificare l’uso della Berberina”? La risposta è, ovviamente, dipendente dal vantaggio che le suddette caratteristiche possono apportare in una data fase e su determinati soggetti.
Soggetti con una insulino-resistenza di base genetica, e cioè individui con una tolleranza glucidica limitata rispetto alla media, possono trarre vantaggi dall’uso della Berberina sia in contesti di alimentazione ipercalorica (con un aumento del carico glucidico) che ipocalorica, sfruttando, nel primo caso, l’effetto sull’insulino-sensibilità dato anche dalla sinergia Berberina/Insulina in presenza di cellule con una condizione di insulino-resistenza (condizione peggiorata già di per se da una dieta ipercalorica) e, nel secondo caso, mantenendo una insulino-sensibilità migliorata rispetto al basale con una parallela riduzione dell’assorbimento glucidico intestinale e della gluconeogenesi epatica che risultano di particolare vantaggio durante diete ipocaloriche “low carb” nonché in regimi alimentari chetogenici. L’impatto della Berberina sull’attività mitocondriale nel muscolo-scheletrico non è di certo da trascurare specie in tali contesti.
Soggetti con una buona affinità con il glucosio possono trarre vantaggi dall’uso della Berberina durante fasi ipercaloriche, mantenendo una discreta sensibilità all’Insulina con una, e già citata, sinergia additiva tra la Berberina e l’Insulina in situazioni di insulino-resistenza cellulare (indotta e/o peggiorata dalla dieta ipercalorica). L’alterazione dell’assorbimento glucidico potrebbe dare alcuni problemi se si sta cercando di aumentare la massa magra dal momento che questo meccanismo riduce l’apporto calorico. E’ vero anche, però, che il miglioramento della ripartizione calorica dato dall’uso della Berberina aumenta l’efficienza dei nutrienti assunti il che, di per se, compensa l’eventuale riduzione dell’assorbimento glucidico intestinale. Questo effetto, invece, risulta vantaggioso, parallelamente all’applicazione della Berberina in soggetti con insulino-resistenza genetica basale, durante fasi ipocaloriche. L’uso durante “refeed” dovrebbe essere evitato per le possibili “complicazioni” relative all’assorbimento glucidico (tranne nei casi di insulino-resistenza genetica basale).
L’uso della Berberina durante e dopo protocolli d’uso dell’Insulina esogena permette di utilizzare dosaggi del peptide inferiori con il mantenimento di una discreta insulino-sensibilità (durante) con una azione “rigenerativa” a livello pancreatico (dopo).
I dosaggi che hanno dimostrato un impatto statisticamente significativo, anche alla luce della ricerca scientifica svolta fino ad oggi, vanno dai 500mg a 1.5g al giorno assunti in 2-3 somministrazioni di uguale portata distribuite durante la giornata (preferibilmente prima dei pasti). L’emivita della Berberina è stata stimata essere di circa 5-6 ore.(61)
Ai dosaggi comunemente usati nella medicina tradizionale e nel limite dei 1.500mg/die la Berberina è ben tollerata e sicura; a dosaggi più alti può determinare: disturbi gastrointestinali, dispnea, diminuzione pressoria, sintomi simil-influenzali e danno cardiaco. (62)
Fine 1° Parte…
Gabriel Bellizzi
Rifermenti:
1- Zhang Q, Cai L, Zhong G, Luo W (2010). “Simultaneous determination of jatrorrhizine, palmatine, berberine, and obacunone in Phellodendri Amurensis Cortex by RP-HPLC”. Zhongguo Zhong yao za zhi = Zhongguo zhongyao zazhi = China journal of Chinese materia medica. 35 (16): 2061–4. doi:10.4268/cjcmm20101603. PMID 21046728.
2- Dong H, Wang N, Zhao L, Lu F (2012). “Berberine in the treatment of type 2 diabetes mellitus: a systemic review and meta-analysis”. Evid Based Complement Alternat Med. 2012: 591654. doi:10.1155/2012/591654. PMC 3478874 . PMID 23118793.
3- Dong H, Zhao Y, Zhao L, Lu F (2013). “The effects of berberine on blood lipids: a systemic review and meta-analysis of randomized controlled trials”. Planta Med. 79 (6): 437–46. doi:10.1055/s-0032-1328321. PMID 23512497.
4- Mohan MC, Abhimannue AP, B PK. Identification and Characterization of Berberine in Tinospora cordifolia by Liquid Chromatography Quadrupole Time of Flight Mass Spectrometry (LC MS/MS Q-tof) and Evaluation of its anti Inflammatory Potential. Pharmacognosy Journal. 2017;9(3):350–355.
5- Huang WW, Xu SZ, Xu YQ. A study of the antiarrhythmic mechanism of berberine on delayed activation potassium current by voltage clamp. Zhonghua Xin Xue Guan Bing Za Zhi, 20 (5): 310–2, 1992 | PMID 1306830
6- Zhao H, Halicka HD, Li J, Darzynkiewicz Z. Berberine suppresses gero-conversion from cell cycle arrest to senescence. Aging (Albany) 2013; 6: 623–636. PMID 23974852, doi:10.18632/aging.100593
7- Darzynkiewicz Z, Zhao H, Halicka HD, Li J, Lee Y-S, Hsieh T-C, Wu J. In search of anti-aging modalities: evaluation of mTOR- and ROS/DNA damage- signaling by cytometry. Cytometry A 2014;85A:386-99. PMID 24677687, doi:10.1002/cyto.a.22452
8- Yu HH, Kim KJ, Cha JD, Kim HK, Lee YE, Choi NY, You YO (2005). “Antimicrobial activity of berberine alone and in combination with ampicillin or oxacillin against methicillin-resistant Staphylococcus aureus”. Journal of Medicinal Food. 8 (4): 454–61. doi:10.1089/jmf.2005.8.454. PMID 16379555.
9- “Poster Presentations”. FEBS Journal. 277: 37–271. 2010. doi:10.1111/j.1742-4658.2010.07680.x.
10- Li Y., Zuo G.-Y. ‘Advances in studies on antimicrobial activities of alkaloids” Chinese Traditional and Herbal Drugs 2010 41:6 (1006–1014)
11- Stermitz FR, Lorenz P, Tawara JN, Zenewicz LA, Lewis K (February 2000). “Synergy in a medicinal plant: antimicrobial action of berberine potentiated by 5′-methoxyhydnocarpin, a multidrug pump inhibitor”. Proceedings of the National Academy of Sciences of the United States of America. 97 (4): 1433–7. Bibcode:2000PNAS…97.1433S. doi:10.1073/pnas.030540597. PMC 26451 . PMID 10677479.
12- Zhang S, Zhang B, Xing K, Zhang X, Tian X, Dai W (2010). “Inhibitory effects of golden thread (Coptis chinensis) and berberine on Microcystis aeruginosa”. Water Science & Technology. 61 (3): 763–9. doi:10.2166/wst.2010.857. PMID 20150713.
13- Liu CS, Zheng YR, Zhang YF, Long XY (2016). “Research progress on berberine with a special focus on its oral bioavailability”. Fitoterapia (Review). 109: 274–82. doi:10.1016/j.fitote.2016.02.001. PMID 26851175.
14- Pan GY, et al. Inhibitory action of berberine on glucose absorption. Yao Xue Xue Bao. (2003)
15- Pan GY, et al. The antihyperglycaemic activity of berberine arises from a decrease of glucose absorption. Planta Med. (2003)
16- Liu SZ, et al. Antihyperglycemic effect of the traditional Chinese scutellaria-coptis herb couple and its main components in streptozotocin-induced diabetic rats. J Ethnopharmacol. (2012)
17- Liu L, et al. Berberine suppresses intestinal disaccharidases with beneficial metabolic effects in diabetic states, evidences from in vivo and in vitro study. Naunyn Schmiedebergs Arch Pharmacol. (2010)
18- Liu L, et al. Berberine attenuates intestinal disaccharidases in streptozotocin-induced diabetic rats. Pharmazie. (2008)
19- Tintu I, et al. An isoquinoline alkaloid, berberine, can inhibit fungal alpha amylase: enzyme kinetic and molecular modeling studies. Chem Biol Drug Des. (2012)
20- Ni YX. Therapeutic effect of berberine on 60 patients with type II diabetes mellitus and experimental research. Zhong Xi Yi Jie He Za Zhi. (1988)
21- Dong H, et al. Berberine in the treatment of type 2 diabetes mellitus: a systemic review and meta-analysis. Evid Based Complement Alternat Med. (2012)
22- Sterne JA, Gavaghan D, Egger M. Publication and related bias in meta-analysis: power of statistical tests and prevalence in the literature. J Clin Epidemiol. (2000)
23- Yang J, et al. Berberine improves insulin sensitivity by inhibiting fat store and adjusting adipokines profile in human preadipocytes and metabolic syndrome patients. Evid Based Complement Alternat Med. (2012)
24- Zhang Y, et al. Treatment of type 2 diabetes and dyslipidemia with the natural plant alkaloid berberine. J Clin Endocrinol Metab. (2008)
25- Zhang H, et al. Berberine lowers blood glucose in type 2 diabetes mellitus patients through increasing insulin receptor expression. Metabolism. (2010)
26- Yan HM, et al. Efficacy of Berberine in Patients with Non-Alcoholic Fatty Liver Disease. PLoS One. (2015)
27- Pérez-Rubio KG, et al. Effect of berberine administration on metabolic syndrome, insulin sensitivity, and insulin secretion. Metab Syndr Relat Disord. (2013)
28- Efficacy of Berberine in Patients with Type 2 Diabetes.
29- Kadowaki T, Yamauchi T. Adiponectin and adiponectin receptors. Endocr Rev. (2005)
30- Basu R, et al. Selective downregulation of the high molecular weight form of adiponectin in hyperinsulinemia and in type 2 diabetes: differential regulation from nondiabetic subjects. Diabetes. (2007)
31- Wang Y, et al. Post-translational modifications of adiponectin: mechanisms and functional implications. Biochem J. (2008)
32- Li Y, et al. Activation of AMPK by berberine promotes adiponectin multimerization in 3T3-L1 adipocytes. FEBS Lett. (2011)
33- Lin H, Li Z. Adiponectin self-regulates its expression and multimerization in adipose tissue: an autocrine/paracrine mechanism. Med Hypotheses. (2012)
34- Berberine-stimulated glucose uptake in L6 myotubes involves both AMPK and p38 MAPK.
35- Ma X, et al. Berberine-induced activation of 5’-adenosine monophosphate-activated protein kinase and glucose transport in rat skeletal muscles. Metabolism. (2010)
36- Gomes AP, et al. Berberine protects against high fat diet-induced dysfunction in muscle mitochondria by inducing SIRT1-dependent mitochondrial biogenesis. Biochim Biophys Acta. (2012)
37- Prabhakar PK, Doble M. Effect of Natural Products on Commercial Oral Antidiabetic Drugs in Enhancing 2-Deoxyglucose Uptake by 3T3-L1 Adipocytes. Ther Adv Endocrinol Metab. (2011)
38- Wang SH, et al. Effect of Astragalus polysaccharides and berberine on carbohydrate metabolism and cell differentiation in 3T3-L1 adipocytes. Zhongguo Zhong Xi Yi Jie He Za Zhi. (2004)
39- Chen C, Zhang Y, Huang C. Berberine inhibits PTP1B activity and mimics insulin action. Biochem Biophys Res Commun. (2010)
40- Cok A, et al. Berberine acutely activates the glucose transport activity of GLUT1. Biochimie. (2011)
41- Kim SH, et al. Berberine activates GLUT1-mediated glucose uptake in 3T3-L1 adipocytes. Biol Pharm Bull. (2007)
42- Bustanji Y, et al. Berberine potently inhibits protein tyrosine phosphatase 1B: investigation by docking simulation and experimental validation. J Enzyme Inhib Med Chem. (2006)
43- Yi P, et al. Berberine reverses free-fatty-acid-induced insulin resistance in 3T3-L1 adipocytes through targeting IKKbeta. World J Gastroenterol. (2008)
44- Choi BH, et al. Berberine reduces the expression of adipogenic enzymes and inflammatory molecules of 3T3-L1 adipocyte. Exp Mol Med. (2006)
45- Yi P, Lu FE, Chen G. Molecular mechanism of berberine in improving insulin resistance induced by free fatty acid through inhibiting nuclear trascription factor-kappaB p65 in 3T3-L1 adipocytes. Zhongguo Zhong Xi Yi Jie He Za Zhi. (2007)
46- Hu Y, et al. Lipid-lowering effect of berberine in human subjects and rats. Phytomedicine. (2012)
47- Yan HM, et al. Efficacy of Berberine in Patients with Non-Alcoholic Fatty Liver Disease. PLoS One. (2015)
48- Li H, et al. Hepatocyte nuclear factor 1alpha plays a critical role in PCSK9 gene transcription and regulation by the natural hypocholesterolemic compound berberine. J Biol Chem. (2009)
49- Zhang M, et al. Sodium caprate augments the hypoglycemic effect of berberine via AMPK in inhibiting hepatic gluconeogenesis. Mol Cell Endocrinol. (2012)
50- Kong WJ, et al. Berberine reduces insulin resistance through protein kinase C-dependent up-regulation of insulin receptor expression. Metabolism. (2009)
51- Wang ZS, et al. Berberine reduces endoplasmic reticulum stress and improves insulin signal transduction in Hep G2 cells. Acta Pharmacol Sin. (2010)
52- Sack RB, Froehlich JL. Berberine inhibits intestinal secretory response of Vibrio cholerae and Escherichia coli enterotoxins. Infect Immun. (1982)
53- Liu LZ, et al. Berberine modulates insulin signaling transduction in insulin-resistant cells. Mol Cell Endocrinol. (2010)
54- Liu LZ, et al. The pivotal role of protein kinase C zeta (PKCzeta) in insulin- and AMP-activated protein kinase (AMPK)-mediated glucose uptake in muscle cells. Cell Signal. (2010)
55- Zhao Y, et al. The in vitro inhibition of human CYP1A2, CYP2D6 and CYP3A4 by tetrahydropalmatine, neferine and berberine. Phytother Res. (2012)
56- Liu J, et al. Coptis extracts enhance the anticancer effect of estrogen receptor antagonists on human breast cancer cells. Biochem Biophys Res Commun. (2009)
57- Doyle ME, Egan JM. Mechanisms of action of glucagon-like peptide 1 in the pancreas. Pharmacol Ther. (2007)
58- Meier JJ, Nauck MA. Glucagon-like peptide 1(GLP-1) in biology and pathology. Diabetes Metab Res Rev. (2005)
59- Holst JJ, Gromada J. Role of incretin hormones in the regulation of insulin secretion in diabetic and nondiabetic humans. Am J Physiol Endocrinol Metab. (2004)
60- Li J1, et al. Berberine represses DAXX gene transcription and induces cancer cell apoptosis. Lab Invest. (2013)
61- The 5-minute Herb and Dietary Supplement Consult – a cura di Adriane Fugh-Berman (pag. 158).