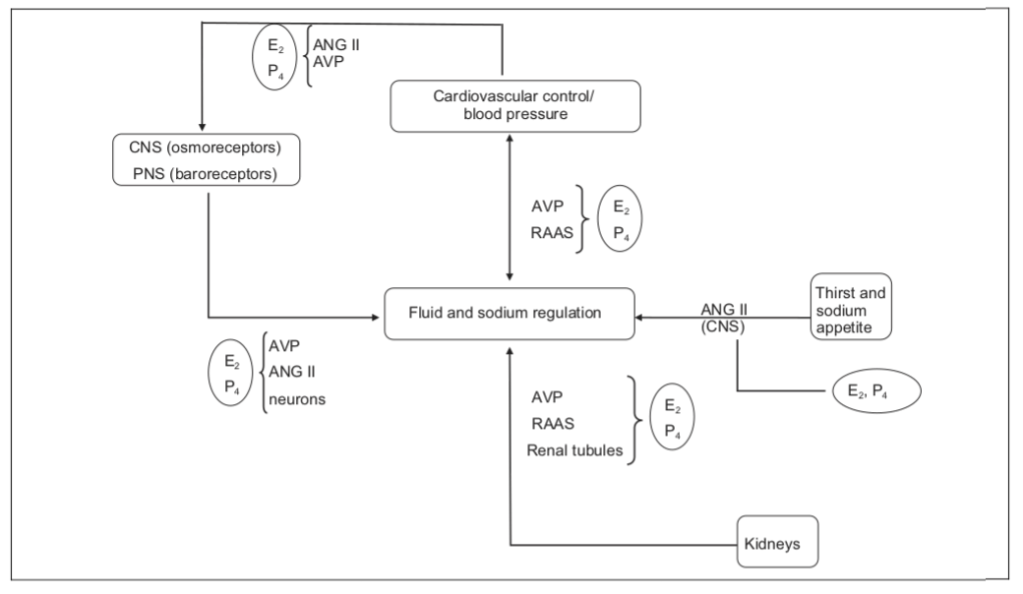
Introduzione:
Del cosa sono gli Esteri ne ho gia parlato in passato all’interno dell’articolo “Storia e chimica degli Steroidi Anabolizzanti Androgeni [AAS]“, come ho già parlato della emivita e vita attiva di un AAS esterificato e non. Dal momento, però, che la confusione in materia di farmacologia è al quanto diffusa, è utile approfondire nuovamente il discorso sugli esteri, loro influenza sul peso effettivo della molecola legata e sulla emivita e vita attiva degli AAS esterificati.
Repetita Iuvant… si spera…
Definizione di Estere:
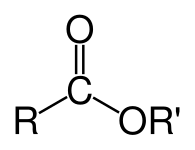
In chimica, un estere è un gruppo funzionale derivato da un acido (organico o inorganico) in cui l’atomo di idrogeno (H) di almeno un gruppo ossidrilico acido (-OH) di tale acido è sostituito da un gruppo organilico (R′). Anche gli analoghi derivati dall’ossigeno sostituito da altri calcogeni appartengono alla categoria degli esteri.[1] Secondo alcuni autori, anche i derivati organici degli idrogeni acidi di altri acidi sono esteri (ad esempio le ammidi), ma non secondo la IUPAC.[1]
Il termine estere fu coniato nel 1848 dal chimico tedesco Leopold Gmelin,[2] probabilmente come contrazione del tedesco Essigäther, “etere acetico”.

I gliceridi sono esteri di acidi grassi del glicerolo; sono importanti in biologia, essendo una delle principali classi di lipidi e costituendo la maggior parte dei grassi animali e degli oli vegetali. I lattoni sono esteri carbossilici ciclici; i lattoni presenti in natura sono principalmente lattoni con anello a 5 e 6 membri. I lattoni contribuiscono all’aroma di frutta, burro, formaggio, verdure come il sedano e altri alimenti.
Gli esteri possono formarsi da ossiacidi (ad esempio esteri dell’acido acetico, dell’acido carbonico, dell’acido solforico, dell’acido fosforico, dell’acido nitrico, dell’acido xantico), ma anche da acidi che non contengono ossigeno (ad esempio esteri dell’acido tiocianico e dell’acido trito-carbonico). Un esempio di formazione di un estere è la reazione di sostituzione tra un acido carbossilico (R-C(=O)-OH) e un alcol (R’-OH), che forma un estere (R-C(=O)-O-R’), dove R indica un gruppo qualsiasi (tipicamente idrogeno o organile) e R′ indica un gruppo organile.
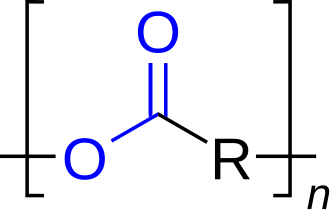
Gli esteri organici degli acidi carbossilici hanno tipicamente un odore gradevole; quelli a basso peso molecolare sono comunemente usati come fragranze e si trovano negli oli essenziali e nei feromoni. Sono utilizzati come solventi di alta qualità per un’ampia gamma di materie plastiche, plastificanti, resine e lacche,[3] e sono una delle più grandi classi di lubrificanti sintetici presenti sul mercato.[4] I poliesteri sono importanti materie plastiche, con monomeri legati da società estere. Gli esteri dell’acido fosforico costituiscono la spina dorsale delle molecole di DNA. Gli esteri dell’acido nitrico, come la nitroglicerina, sono noti per le loro proprietà esplosive.
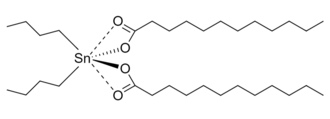
Esistono composti in cui l’idrogeno acido degli acidi citati in questo articolo non è sostituito da un organile, ma da qualche altro gruppo. Secondo alcuni autori, anche questi composti sono esteri, soprattutto quando il primo atomo di carbonio del gruppo organico che sostituisce l’idrogeno acido è sostituito da un altro atomo del gruppo 14 (Si, Ge, Sn, Pb); ad esempio, secondo loro, l’acetato di trimetilstannile (o acetato di trimetilstagno) CH3COOSn(CH3)3 è un estere di trimetilstannile dell’acido acetico, e il dibutilstagno dilaurato (CH3(CH2)10COO)2Sn((CH2)3CH3)2 è un estere dibutilstannilico dell’acido laurico, mentre il catalizzatore di Phillips CrO2(OSi(OCH3)3)2 è un estere trimetossilico dell’acido cromico (H2CrO4). [5][6]
Le basi su Esteri e AAS:
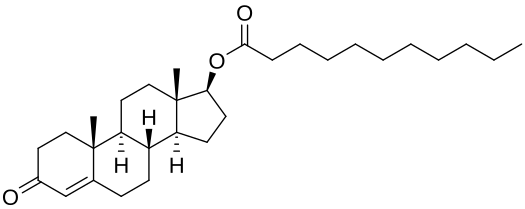
Un Estere di Androgeno o Steroide Anabolizzante/Androgeno (AAS) è un estere legato ad un AAS come il Testosterone, il Diidrotestosterone (DHT) o il Nandrolone (19-nortestosterone). L’esterificazione rende gli AAS dei pro-ormoni o pro-farmaci resistenti al metabolismo, migliorandone la biodisponibilità orale, aumentandone la lipofilia e prolungandone l’emivita di eliminazione (il che rende necessaria una somministrazione meno frequente). Inoltre, con l’iniezione intramuscolare, gli esteri di AAS vengono assorbiti più lentamente nell’organismo, migliorando ulteriormente l’emivita di eliminazione. A parte le differenze nella farmacocinetica (ad esempio, la durata di permanenza ed efficacia), questi esteri hanno essenzialmente gli stessi effetti dei farmaci progenitori.[7] Esempi di Esteri di Androgeni sono, ad esempio, gli Esteri legati al testosterone, come il Cypionato, l’Enantato, il Propionato e l’Undecanoato, e gli esteri legati al Nandrolone, come il Decanoato e il Fenilpropionato.
In pratica, se hai una molecola, come il Testosterone, puoi legare qualcosa a questa molecola madre per influenzarne le sue proprietà biofisiche. Nel caso dell’esterificazione di un AAS, si riduce al legame di un gruppo di acido carbossilico sul carbonio 17 dello scheletro carbossilico dello steroide come illustrato di seguito:

Il legame di questo gruppo influisce sulla polarità della molecola. E la polarità di una molecola si riferisce a come una carica è distribuita su di essa. Una carica su una molecola porta all’interazione con le molecole cariche circostanti. Ciò è di particolare rilevanza per quanto riguarda l’acqua. L’acqua è piuttosto polare e quindi le molecole che sono anche abbastanza polari si dissolvono facilmente in essa. Le molecole polari sono idrofile.
I lipidi, al contrario, sono apolari, o solo leggermente polari. Di conseguenza, hanno difficoltà a dissolversi in acqua. Ad esempio, se mettete dell’olio d’oliva in un bicchiere d’acqua, potete vedere come l’olio si attacca e forma uno strato sull’acqua. Non si sta dissolvendo. Questo è il risultato della mancanza di polarità dell’olio d’oliva. Gli oli sono quindi idrofobici.
E qui arriva il nocciolo della questione: le molecole non polari (o solo leggermente polari) si dissolvono facilmente nell’olio. Quando un estere è legato a una molecola steroidea, ne ridurrà la polarità e quindi lo renderà più facilmente solubile in olio e meno facilmente solubile in acqua. O in altre parole: diventa meno idrofilo (“amante dell’acqua”) e più lipofilo (“amante dell’olio”). Gli AAS esterificati sono quindi lipofili.
Da quanto detto è facile capire come l’esterificazione ha il potenziale per estendere notevolmente l’emivita di un AAS. Il Testosterone esterificato (o qualsiasi altro tipo di steroide) viene solubilizzato nell’olio. Questo olio viene quindi iniettato per via intramuscolare in cui si diffonderà per tutta la lunghezza dei fasci muscolari. Questo appare come segue nell’immagine (notare come l’olio si diffonde lungo la lunghezza dei fasci muscolari):
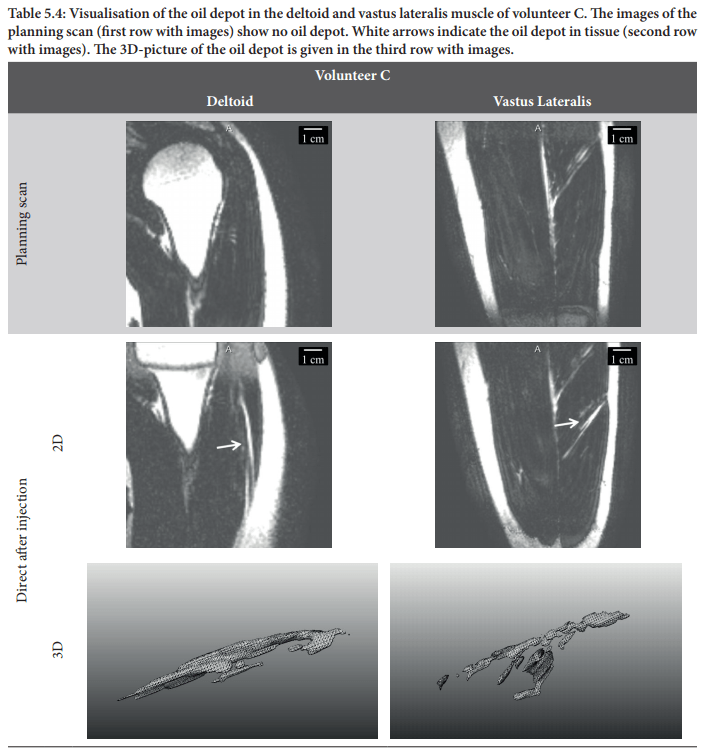
Il Testosterone esterificato quindi, in una certa misura, si diffonderà fuori dal deposito oleoso e si dissolverà nel tessuto circostante, che è costituito principalmente da acqua. La velocità con cui ciò accade è determinata dalla sua polarità. Se è molto apolare (e quindi lipofilo) si diffonderà molto molto lentamente dall’olio nel tessuto circostante. Dopotutto: le sostanze non polari sono lipofile e non idrofile. Quindi l’esterificazione determina l’emivita della molecola iniettata.
Una grande regola empirica è che, maggiore è la lunghezza della catena di carbonio dell’estere, maggiore sarà l’emivita del composto. Perché più lunga è la catena, più diminuirà la polarità della molecola. Oltre alla lunghezza dell’acido carbossilico, puoi anche cambiarne la struttura per influenzare la polarità. Ad esempio, questo è evidente con l’estere che vedete legato al Parabolan: Trenbolone Hexahydrobenzylcarbonate. Qui puoi trovare un gruppo cicloesano. Nell’immagine è stato evidenziato il gruppo cicloesano in blu:

Ad ogni modo, questo è anche il motivo per cui il Testosterone Enantato (6 atomi di carbonio) ha un’emivita significativamente più breve rispetto al Testosterone Undecanoato (11 atomi di carbonio) che ho menzionato precedentemente. Una volta che lo steroide esterificato raggiunge il flusso sanguigno, l’estere viene rapidamente idrolizzato dalle esterasi nel plasma, “liberando” la molecola madre che potrà svolgere la sua attività tissutale.[8]
Approfondimento sull’emivita di eliminazione:
Dal momento in cui un farmaco entra nel flusso sanguigno diventa soggetto alle tre funzioni metaboliche: 1) assorbimento – lavoro e funzionamento all’interno del corpo; 2) degradazione – degradazione della sua struttura chimica in preparazione per l’eliminazione; e 3) eliminazione – escrezione/ rimozione dal corpo.
Quando si parla di emivita di un farmaco si sta parlando di un momento in cui i tre processi metabolici sopra citati influenzano un dato farmaco nella misura in cui una metà (50%) di tale composto non è più presente nel corpo. Ancora una volta, poiché i farmaci hanno strutture chimiche variabili, questo periodo di tempo è soggetto a variazioni. A volte ci sono somiglianze particolari all’interno di classi di farmaci, ad es. gli AAS per via orale in genere possiedono ciò che riteniamo essere una emivita corta spesso collocata tra le 4 e le 16 ore. Tuttavia, questa è solo una generalizzazione per la maggior parte della classe in questione, in quanto alcuni altri tipi di AAS orali escono da questi parametri per ragioni diverse.
Questo tempo di dimezzamento vede una riduzione delle concentrazioni del farmaco del 50% ogni volta che viene sperimentato, vale a dire che dopo il primo tempo di dimezzamento si è al 50% delle concentrazioni del composto assunto, al secondo si calerà al 25% o alla metà del restante 50%, alla terza si scenderà al 12,5% , e così via fino a quando l’ultima emivita nota come “terminale” si verifica … generalmente accettata come l’8° (inferiore allo 0,05%). Anche se esistono ancora metaboliti in circolo, rendendo così possibile il rilevamento dell’uso della sostanza, le azioni del farmaco o la vita attiva è effettivamente cessata. Tuttavia, fintanto che si continua ad assumere il farmaco prima della realizzazione dell’emivita terminale, il suo potenziale verrà ristabilito a pieno riportando il coefficiente dell’emivita a un pieno 100%. L’importante qui è anche il fatto che più farmaco si assume e maggiore sarà la concentrazione di questo nel sangue, fino a quando non si raggiungerà una completa saturazione ematica. Alcune persone credono che la realizzazione della saturazione completa in qualche modo modifichi il principio dell’emivita, ma in realtà non è così. La saturazione ha a che fare con l’ottimizzazione degli effetti ricevuti da un farmaco nel corso del tempo, ma sottostà ancora al principio dell’emivita, perché anche se si può avere più di farmaco in circolo (in quantità), non si può superare il quoziente del 100%. Di conseguenza, ogni volta che si raggiunge la percentuale del 100% che sia la prima somministrazione del farmaco o dopo averlo assunto per diverse settimane, mesi o anni una volta terminata la prima emivita, la concentrazione del farmaco è necessariamente ridotto al 50% del totale assunto.
Esistono stati patologici e situazioni cliniche che possono variare l’emivita di una sostanza (e quindi rendere necessario un aggiustamento del dosaggio): shock cardiogeno, insufficienza renale, insufficienza cardiaca ed emorragia riducono il flusso plasmatico renale. La variazione di farmaco che si lega all’albumina, causato dall’utilizzo di un secondo farmaco, può variare il Vd (volume di distribuzione) del primo farmaco e perciò variarne l’emivita. La variazione della velocità di metabolizzazione, causata per esempio da stati patologici del fegato, può variare il tempo di dimezzamento del farmaco.
In poche parole, l’emivita si riferisce alla quantità di tempo necessario per ridurre le concentrazioni di un farmaco a una metà del suo dosaggio effettivo, in un processo che si verifica ripetutamente fino a quando il farmaco non è più efficace e subisce la totale eliminazione dal sistema.
Emivita media AAS esterificati
| Farmaco | Emivita |
| Nandrolone Decanoato (Deca-Durabolin) | 6-12 giorni |
| Nandrolone Fenilpropionato (NPP) | 2.5 giorni |
| Nandrolone Laurato (Laurabolin) | 6-12 giorni |
| Nandrolone Undecanoato (Dynabolan) | 20-30 giorni |
| Nandrolone Hexylphenylpropionato (Anadur) | 6-8 giorni |
| Boldenone Undecylenato (Equipoise) | 14 giorni |
| Trenbolone Acetato (Finaject) | 3 giorni |
| Trenbolone Hexahydrobenzylcarbonato (Parabolan) | 8-10 giorni |
| Trenbolone Enantato | 4-8 giorni |
| Trenbolone Cyclohexylmethylcarbonato | 14 giorni |
| Methenolone Acetato (Primobolan) | 2-3 giorni |
| Methenolone Enantato (Primobolan/Rimobolan) | 4-8 giorni |
| Testosterone Cypionato | 8-10 giorni |
| Testosterone Enantato | 4-8 giorni |
| Testosterone Propionato | 1-2 giorni |
| Testosterone Undecanoato (Nebido) | 20-30 giorni |
| Testosterone Fenilpropionato | 2-3 giorni |
| Testosterone Isobutyrato | 12-15 giorni |
| Testosterone Suspension | 1.5 giorni |
| Stanozololo (Winstrol) | 1.5 giorni |
| Metribolone | 1.5 giorni |
| Dihydroboldenone Cypionato | 8-12 giorni |
| Drostanolone Propionato | 1-2 giorni |
| Drostanolone Enantato | 7-10 giorni |
| Stenbolone Acetato (Anatrofin) | 3 giorni |
| Metandriolo Dipropionato | 3 giorni |
E il peso molecolare privo dell’Estere?
Un altro aspetto poco compreso riguarda il peso molecolare dell’AAS privo dell’Estere. Questo dettaglio non è di poca importanza dal momento che ci indica quanto principio attivo effettivamente si trova in un dato dosaggio di un dato AAS esterificato.
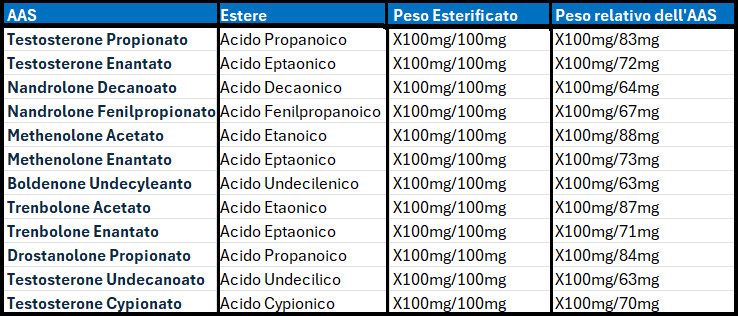
Conoscere il preciso contenuto della molecola attiva somministrata permette all’utilizzatore “Off-Label” o al paziente di calibrare correttamente il dosaggio.
Ricordiamoci che sono medie basate sul peso della molecola esterificata e su quello effettivo della molecola priva dell’Estere. Le variabili sono dipendenti dalla peso molecolare dell’Estere e da quello dell’AAS.
Bisogna, infatti, tenere in considerazione che ogni struttura carbossilica di un AAS possiede un differente “Peso Molare”. Per esempio, il Peso Molare del Testosterone Enantato [formula bruta o molecolare del Testosterone = C19H28O2] è 1.39 con “Peso Molare” della molecola priva dell’Estere pari a 0.72, mentre il “Peso Molare” del Trenbolone Enantato [formula bruta o molecolare del Trenbolone = C18H22O2] è 1.41 con “Peso Molare” della molecola priva dell’Estere pari a 0.71: stesso Estere ma piccola variabile sul “Peso Molare” della molecola priva dell’Estere.
Semplici conclusioni su un semplice “dilemma”:
Abbiamo visto nuovamente cos’è un Estere, le sue caratteristiche nel legame Androgeno/AAS, l’influenza sull’Emivita e l’impatto sul “Peso Molare” della molecola di AAS. Si presume che, ora, non ci dovrebbero essere più dubbi a riguardo.
Eh no, non si tratta di “mero nozionismo” dal momento che conoscere l’emivita, la vita attiva e il peso effettivo di una molecola privata dell’Estere per un dato quantitativo di pro-farmaco ci permette di calibrare i dosaggi e le tempistiche di somministrazione della/e molecola/e nel modo più preciso possibile, e ciò può essere applicato tanto dal paziente in TRT/HRT che dall’utilizzatore “Off-Label”.
Gabriel Bellizzi [CEO BioGenTech]
Riferimenti:
- IUPAC, Compendium of Chemical Terminology, 2nd ed. (the “Gold Book”) (1997). Online corrected version: (2006–) “esters“.
- Leopold Gmelin, Handbuch der Chemie, vol. 4: Handbuch der organischen Chemie (vol. 1) (Heidelberg, Baden (Germany): Karl Winter, 1848), page 182.
- Cameron Wright (1986). A worker’s guide to solvent hazards. The Group. p. 48. ISBN 9780969054542.
- E. Richard Booser (21 December 1993). CRC Handbook of Lubrication and Tribology, Volume III: Monitoring, Materials, Synthetic Lubricants, and Applications. CRC. p. 237. ISBN 978-1-4200-5045-5.
- “Acetoxytrimethyltin”.
- “Trimethyltin acetate | C5H12O2Sn | ChemSpider”.
- Richard Lawrence Miller (2002). The Encyclopedia of Addictive Drugs. Greenwood Publishing Group. pp. 416–. ISBN 978-0-313-31807-8.
- Van der Vies, J. “Implications of basic pharmacology in the therapy with esters of nandrolone.” European Journal of Endocrinology 110.3_Suppla (1985): S38-S44.