Nella prima parte di questa disamina sono state passate in rassegna diverse informazioni necessarie per comprendere cosa sono le Incretine e quali sono le loro principali azioni. Si è poi passati a descrivere la classe di farmaci degli Incretino-Mimetici discorrendo sulla loro sintesi, tipologia molecolare [in ordine cronologico in base alla data di commercializzazione] e caratteristiche di azione sia per quanto concerne le attività positive che quelle negative. In conclusione, si è accennato alla consistente diffusione dell’uso “cosmetico” di tali farmaci.
In questa seconda ed ultima parte vedremo come questa relativamente nuova classe di farmaci abbia trovato un certo spazio di diffusione nel Fitness e (sebbene in minor parte) nel BodyBuilding. Verranno discussi i punti di attrattiva e le limitazioni (e rischi) legati al loro uso.
Le “attrattive” degli Incretino-Mimetici:
L’obesità è una grave epidemia che affligge la società del così detto “occidente americanizzato”. I farmaci iniettabili sottocutanei inizialmente concepiti per la gestione del diabete di tipo II, come la Semaglutide e altri agonisti del recettore del GLP-1, stanno rapidamente guadagnando popolarità per i loro effetti sulla perdita di peso. Questi farmaci (Ozempic, Wegovy, Saxenda e Mounjaro) sono onnipresenti sui social media e sono promossi da celebrità di tutte le fasce demografiche. “Viso da Ozempic” e ‘sedere da Ozempic’ sono ormai concetti mainstream che evidenziano i possibili cambiamenti morfologici che si verificano con questi farmaci. Con la diffusione non controllata da personale qualificato dell’uso di questi farmaci, è aumentato anche l’elenco dei potenziali effetti avversi.
Nella prima parte di questa disamina si è constatato che gli Incretino-Mimetici hanno potenzialità che si esprimono su modifiche della composizione corporea e che riguardano principalmente:
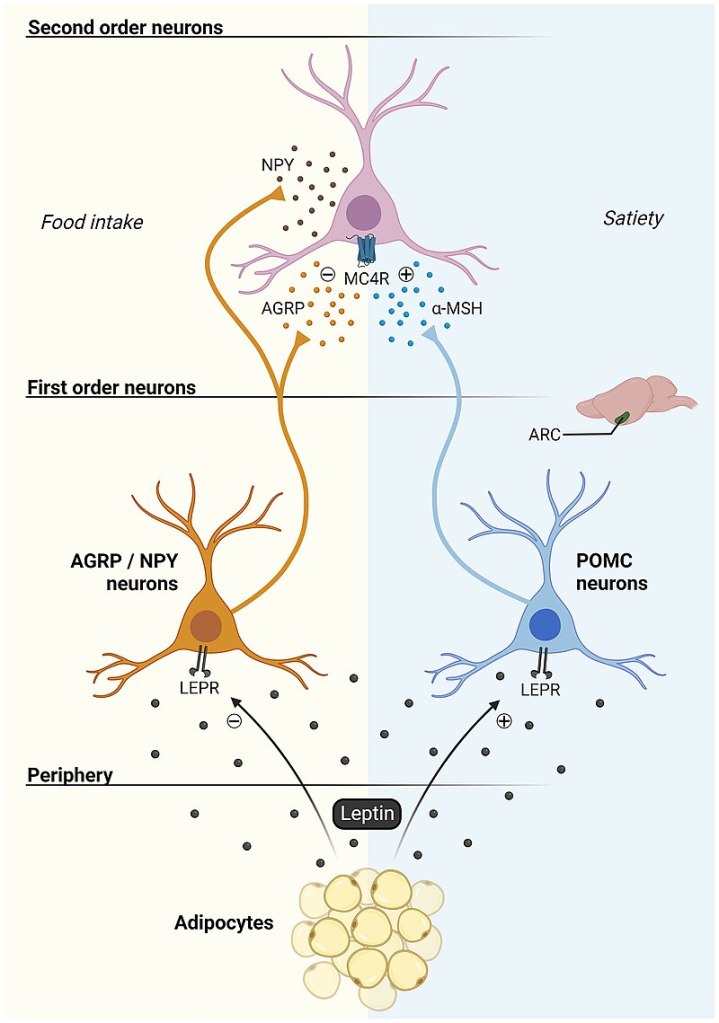
- Rallentamento dello svuotamento gastrico con riduzione del senso di fame derivante dal aumento del senso di sazietà;
- Gli effetti elettrofisiologici dell’attivazione del GLP-1R nelle aree cerebrali coinvolte nella modulazione del comportamento alimentare riducendo il senso di fame e il consumo di cibo;
- Indirettamente, per via della stimolazione insulinica, aumento del senso di sazietà dato dal picco insulinico a livello ipotalamico;
- Miglioramento del ripartizionamento Kcal attraverso il miglioramento della sensibilità all’insulina.
L'”attrattiva” che ha spinto (e che spinge) diverse persone di diverse classi sociali e di ambo i sessi a prendere in considerazione e concretizzare l’uso di questi farmaci è fondamentalmente ridotta alla riduzione della fame/appetito. Ma questo riguarda la persona “nella media”, la ragazza/donna alla ricerca di rapide soluzioni per l’imminente prova costume o per il servizio fotografico, sfilata ecc…
Nel Bodybuilding questa classe di farmaci ebbe una serie di attrattive comprendenti lo sfruttamento di tutti i punti sopra elencati. E, di conseguenza, si ipotizzarono fasi della preparazione nelle quali applicare tale categoria farmaceutica. Limitandone l’uso in “Cut” per ragioni legate al rischio (seppur limitato in monoterapia) di incorrere in eventi ipoglicemici, l'”attrattiva d’uso” riguardava il potenziale in fasi di “Recomp”; quindi non propriamente “ipocalorico” o, al massimo, leggermente ipocaloriche e non ipoglucidiche.
Ricomposizione corporea, Ripartizionamento calorico e Insulino-Sensibilità:
Ma chiariamo alcuni termini per schiarirci le idee…

- Ricomposizione corporea: si intende il raggiungimento di un obiettivo o un risultato desiderato di un regime alimentare e di allenamento (e di farmaci), come il “Cut” o il “Bulk”.
- “Cut”: si intende, propriamente, una diminuzione della massa grassa (FM) e il mantenimento della massa muscolare (LBM).
- “Bulk”: si intende un aumento della LBM con una concomitante attenuazione dell’aumento della FM.
- “Recomp” [comunemente intesa]: è definita come un aumento della LBM e la diminuzione della FM.
La suddivisione terminologica corretta è un concetto funzionale all’obiettivo di tutti gli interventi dietetici razionali.
Il rapporto p (rapporto di ripartizione) descrive le proteine depositate nei tessuti della LBM in relazione all’apporto energetico e, viceversa, le proteine perse dai tessuti della LBM in relazione al deficit energetico.
Il p-ratio comprende i fattori di:
- stato ormonale (cioè i livelli assoluti di ormoni chiave noti);
- sensibilità all’insulina;
- sensibilità alla Leptina.
Esiste un’interazione tra il punto 1 e 3.
La prima chiave è…
- Sensibilità all’Insulina: quando si è a dieta (cioè in uno stato di deficit energetico), la resistenza all’Insulina fisiologica è una condizione favorevole all’uso del grasso di deposito limitando l’uso del glucosio da parte del muscolo come substrato energetico, risparmiando il glucosio per il cervello e l’utilizzo degli Acidi Grassi intramuscolare. In condizioni di uscita da un regime ipocalorico, in uno stato di migliorata insulino-sensibilità, l’aumento calorico di una fase di “Bulk” vede, almeno inizialmente, un ripartizionamento delle Kcal al miocita a discapito del adipocita; tale condizione di inverte col protrarsi del regime ipercalorico.
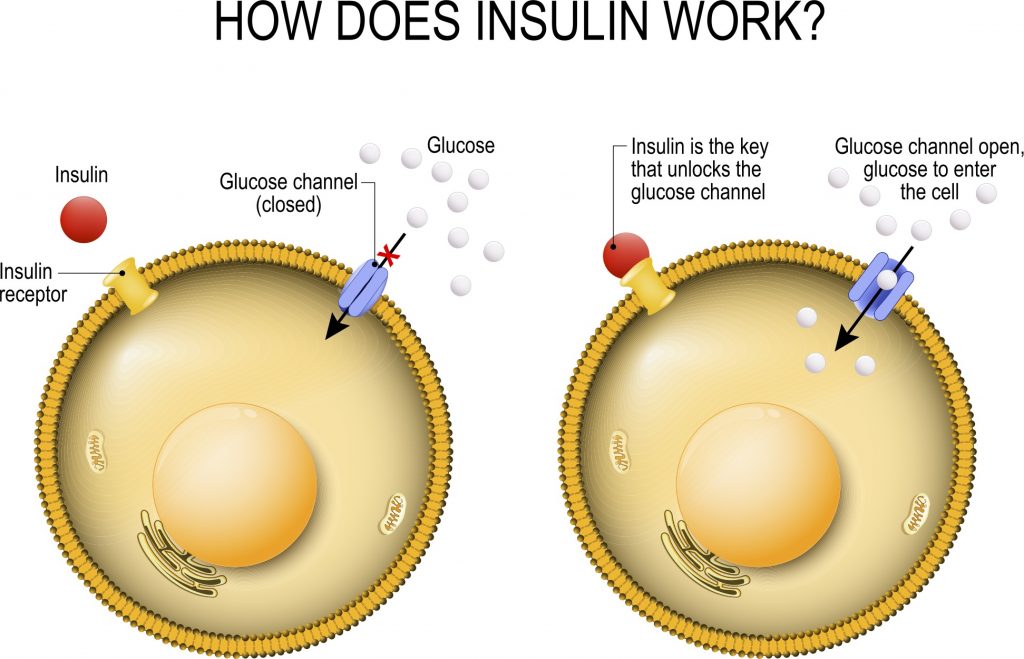
I fattori che influenzano la sensibilità all’insulina includono [1]:
- Livelli di grasso corporeo; B.F. % (predittore primario): ↑B.F. ⇒ ↑Acidi Grassi come substrato energetico (risparmiando glucosio e proteine [che possono essere utilizzate dal fegato nella gluconeogenesi]) e detta la segnalazione delle adipochine (cioè gli ormoni secernenti gli adipociti [leptina, TNF-α, IL-…, adiponectina, etc.]) ⇒ ↓ sensibilità all’insulina;
- Contrazione muscolare (cioè attività, come ad esempio locomozione, allenamento contro-resistenza) ⇒ ↑ assorbimento di glucosio nella cellula muscolare; traslocazione di GLUT-4 ⇒ ↑ sensibilità all’Insulina;
- Dieta: elevata quantità di carboidrati (in ipercalorica), grassi saturi e poche fibre ⇒ ↓ sensibilità all’Insulina;
- Stoccaggio del Glicogeno o Supercompensazione [successivo ad una deplezione] ⇒ ↑assorbimento di glucosio e glicogenesi ⇒↑sensibilità Insulinica;
- Deplezione di glicogeno (ad esempio, nel periodo successivo a un allenamento intenso, prima di un’alimentazione particolarmente ricca di carboidrati) ⇒ sottoregolazione (deplezione pressoché totale) della disponibilità di glucosio e promozione dell’ossidazione di Acidi Grassi dopo il depauperamento delle scorte di glicogeno muscolare (in media < 700 g negli adulti) ⇒ ↑ Acidi Grassi liberi nel sangue (circolanti) ⇒ ↓ sensibilità all’Insulina;
- Fattori genetici in parte modificabili dai farmaci, ad esempio, nei casi di ipogonadismo, l’applicazione TRT inverte chiaramente l’insulino-resistenza nei casi in cui l’eziologia dell’insulino-resistenza è riconducibile alla carenza di Testosterone.
La seconda chiave è…
La Leptina: come sappiamo bene, la Leptina è un ormone, più precisamente è una adipochina, secreta principalmente dagli adipociti, che si correla con la %B.F.;↑%B.F. ⇒ ↑Leptina. (i depositi viscerali e quelli sottocutanei hanno rapporti diversi con la Leptina). A una data percentuale di B.F., le donne producono ~2 – 3 volte più Leptina rispetto agli uomini. Le concentrazioni di Leptina cambiano con la restrizione energetica e la sovralimentazione. La Leptina è un segnalatore primario di regolazione dell’accumulo di energia che riflette:
- la percentuale di B.F.;
- l’assunzione di energia.
Esempio 1: all’inizio di una dieta ipocalorica, la Leptina può diminuire del 50% entro 1 settimana (o meno) – anche se ovviamente il soggetto a dieta non ha perso il 50% di B.F. – quindi, in un primo momento, i cambiamenti della concentrazione di Leptina non sono correlati alla B.F. (piuttosto segnalano l’assunzione di energia).
Dopo il calo iniziale, si assiste a un declino più graduale della Leptina in relazione alla perdita di %B.F. .
Esempio 2: in caso di sovralimentazione, la Leptina subisce un incremento in modo altrettanto rapido (cioè senza relazione con la %B.F., ma in relazione all’assunzione di energia).
A breve termine, la secrezione di Leptina è determinata principalmente dalla disponibilità di glucosio, per cui la riduzione della disponibilità di glucosio nella cellula adiposa (dieta ipocalorica) ⇒ ↓Leptina e viceversa.
Gli effetti specifici dell’ormone Leptina includono effetti sul pancreas e sul fegato, nel muscolo scheletrico ↑FA e ↓AA e l’uso del glucosio come substrato energetico (aumentando la perdita di grasso, promuovendo il risparmio di proteine)… [1]
In sostanza, il partizionamento (p-ratio) è un concetto che associa la Leptina e la sensibilità all’Insulina come fattori principali che determinano il modo in cui le variazioni dell’apporto calorico e del contenuto di macronutrienti influiscono sul metabolismo (influenzando profondamente la composizione corporea) e sullo stato ormonale. Possiamo modificarlo e migliorarlo, tenendo conto dei tessuti bersaglio e del nostro obiettivo (ad esempio, se Bulk o Cut).
Inoltre, non bisogna confondere il potenziamento dell’insulino-resistenza fisiologica sulla perdita di grasso con l’erronea valutazione che l’insulino-resistenza sia salutare. L’insulino-resistenza, soprattutto in una persona sedentaria, è associata alla sindrome metabolica, al diabete di tipo II, per non parlare del grasso viscerale, ecc.
L’insulino-resistenza è uno stato in cui i tessuti dell’organismo (ad esempio, fegato, pancreas, muscolo scheletrico) presentano una scarsa recettività con l’Insulina continuando, se si parla in particolare del fegato, a produrre glucosio in quantità inappropriate. Questo stato di iperglicemia è un effetto piuttosto che la causa dell’insulino-resistenza, anche se i livelli tossici di glucosio degradano la reattività delle isole pancreatiche all’Insulina rappresentando così una delle vie/meccanismi dell’insulino-resistenza, peggiorando la stessa condizione.
Ma tutto questo cosa centra con gli Incretino-Mimetici? Se non ci siete ancora arrivati, calma e capirete …
Agonisti del recettore GLP-1 e GIP:
La perdita di grasso si verifica con gli agonisti del GLP-1 e della GIP (Incretino-mimetici) – come la Semaglutide e la Tirzepatide – che sono veri e propri agenti sensibilizzanti dell’Insulina. Tuttavia, non è la sensibilità all’Insulina di per sé che è responsabile della perdita di grasso con questa classe di farmaci – ma piuttosto, come abbiamo già visto, la perdita di grasso avviene grazie agli altri effetti di questi farmaci, come l’alterazione potenziale delle preferenze alimentari, il ritardo dello svuotamento gastrico, il senso di sazietà, che promuovono il controllo dell’appetito e riducono l’assunzione di energia.

Sappiamo che gli agonisti del GLP-1 e del GIP migliorano direttamente la sensibilità all’insulina modulando la secrezione di Insulina – accoppiandola alla presenza di elevate concentrazioni di glucosio. Questa secrezione di Insulina si attenua quando le concentrazioni di glucosio nel sangue diminuiscono e si avvicinano all’euglicemia. Inoltre, anche se indirettamente, riducendo l’assunzione di cibo, questi farmaci determinano una riduzione della %B.F.. La riduzione della percentuale di B.F. dovuta alla riduzione dell’assunzione di cibo riduce le riserve di massa grassa (e quindi gli FFA circolanti), migliorando ulteriormente la sensibilità all’Insulina.
La stragrande maggioranza degli agenti per la perdita di grasso, in quanto agenti lipolitici, favoriscono l’insulino-resistenza. Ad esempio i β-agonisti, non selettivi come l’Efedrina o selettivi come il Clenbuterolo, oppure lo stimolante da banco per eccellenza la caffeina, agendo in modo analogo o aumentano l’azione delle catecolamine (epinefrina e noradrenalina, o adrenalina e noradrelanina) possono portare ad un peggioramento di questa condizione.
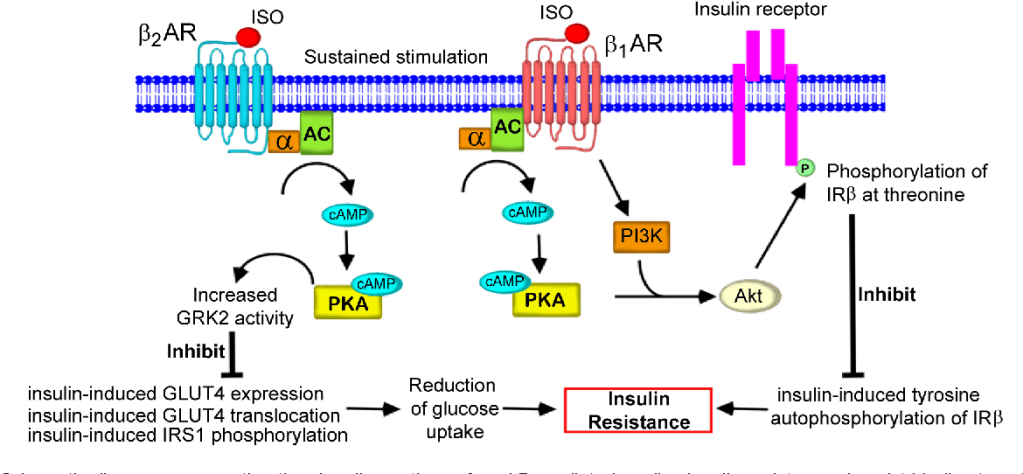
Quando tessuti come il fegato e le cellule adipose vedono ridotta l’interazione con l’Insulina, il glucosio non viene ottimamente assorbito dalle cellule. Con un marcato calo del glucosio, il fegato inizia a metabolizzare gli acidi grassi liberi (FFA), aumentando così i livelli di chetoni nel sangue e impedendo che vengano riesterificati nelle cellule adipose (in ipocalorica). Nel fegato e nelle cellule adipose, senza che l’Insulina interagisca ottimamente con questi tessuti, si verifica una soppressione della sintesi/lipogenesi dei grassi (negli adipociti) e della sintesi di lipoproteine a bassissima densità (VLDL) (nel fegato).
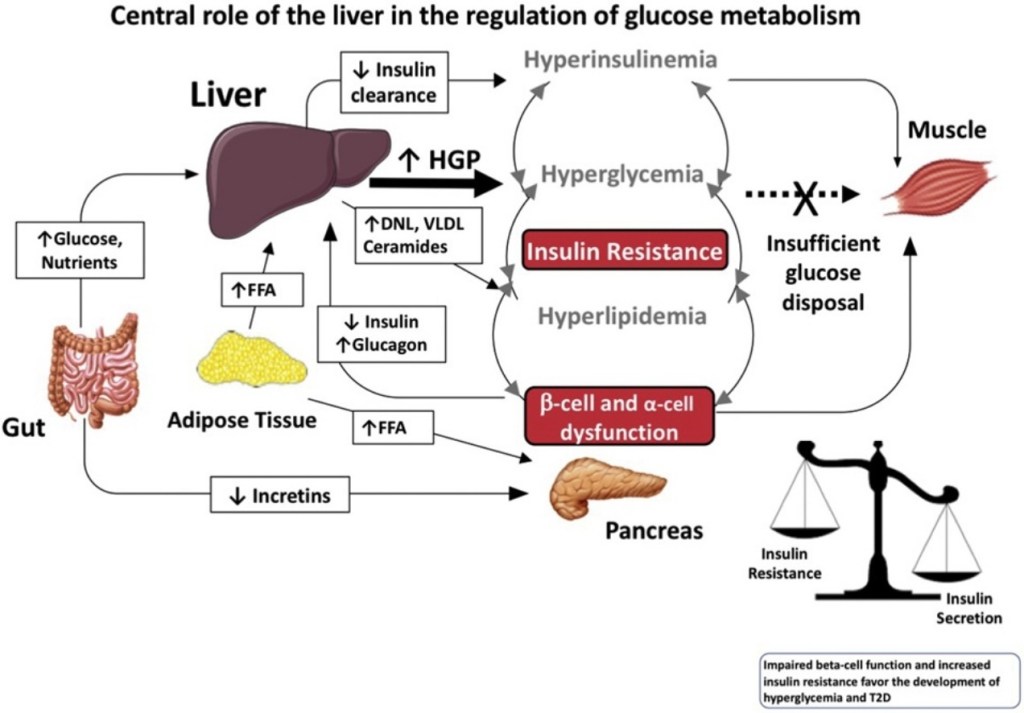
Incretino-mimetici, miglioramento della sensibilità all’Insulina e preservazione della massa muscolo-scheletrica:
La classificazione degli incretino-mimetici come agenti di ripartizione calorica:
Nel BodyBuilding, il fascino verso questa classe di farmaci si concentra anche sul funzionamento degli agonisti del GLP-1 e della GIP sull’insulino-resistenza, poiché quest’ultima durante la restrizione calorica nel muscolo scheletrico (>60% del peso corporeo, più nei bodybuilder) è un’immagine non proprio esaltante, con le riserve di glicogeno che vengono prima catabolizzate abbastanza rapidamente; poi i trigliceridi intramuscolari (che rappresentano solo l’1% del peso del muscolo idratato, fino al 2% del volume, dato che il grasso è meno denso del muscolo scheletrico, e ~1/3 dell’energia muscolare, dato che il grasso è energeticamente denso) e infine, se necessario, l’organismo utilizzerà gli AA (catabolizzando le proteine muscolari; proteolisi) per ottenere l’energia necessaria a svolgere le attività giornaliere. Questi agenti, quindi, nella misura in cui sono sensibilizzanti per l’Insulina, dovrebbero servire a promuovere il mantenimento della LBM durante il “Cut”.

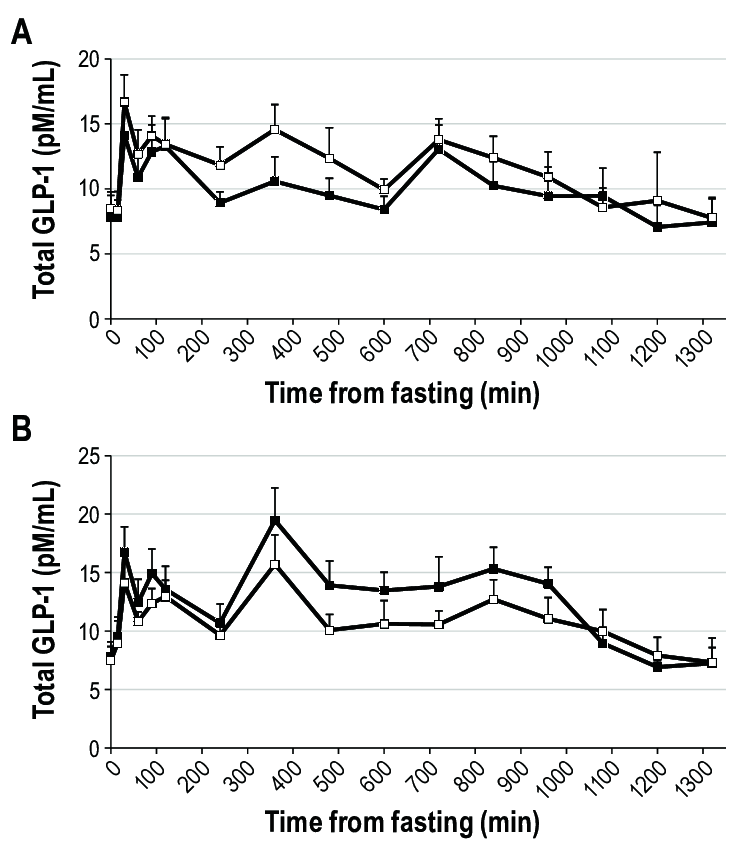
In effetti, come si evince dalla seguente immagine tratta da un articolo di ricerca di Volpe et. al del 2022 [2], la Semaglutide preserva in modo abbastanza efficace la LBM e riduce in modo preferenziale la FM, con riduzioni solo clinicamente insignificanti dell’indice di massa magra (FFMI, kg/m²) e dell’indice della muscolatura scheletrica durante il periodo iniziale di adattamento, che poi si attenua:
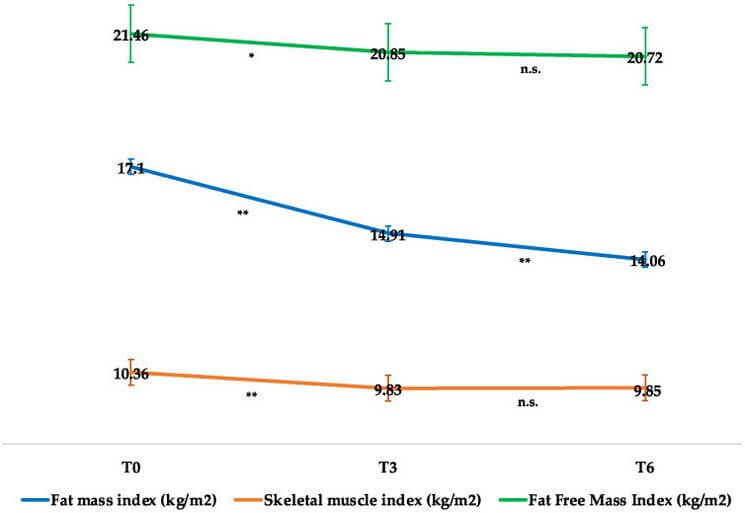
In un certo senso, quindi, migliorando il grado di sensibilità all’Insulina dell’equazione della p-ratio, gli incretino-mimetici possono essere classificati come agenti di ripartizione calorica, a grandi linee come il Clenbuterolo, ma invece di promuovere l’insulino-resistenza come i β-agonisti, la migliorano.
* Ovviamente, creare un ambiente significativamente insulino-sensibile in un contesto ipocalorico (soprattutto se ipoglucidico) può mettere l’utilizzatore a maggior rischio (sebbene limitato) di ipoglicemia o calo glicemico borderline con effetti simili allo stato di ipoglicemia (tremore, sudorazione copiosa ecc…).
Per coloro che hanno familiarità con questi concetti, derivanti dalle discussioni sul bodybuilding, può risultare molto confuso il fatto che l’iperglicemia (elevata quantità di glucosio nel sangue) è solo uno dei fattori associati all’insulino-resistenza, ma in realtà non è sinonimo di insulino-resistenza (iperglicemia ≠ insulino-resistenza). Sì, ridurre la glicemia a livelli normali è molto importante per migliorare la sensibilità all’insulina durante l’uso dell’ormone della crescita esogeno (rhGH), perché il glucosio è tossico per le cellule β pancreatiche. Questa glucotossicità a livello delle cellule pancreatiche si traduce in una diminuzione della risposta secretoria dell’insulina all’iperglicemia, alimentando così il fuoco dell’iperglicemia e della glucotossicità, contribuendo all’insulino-resistenza – ma non costituendone l’unica eziologia.
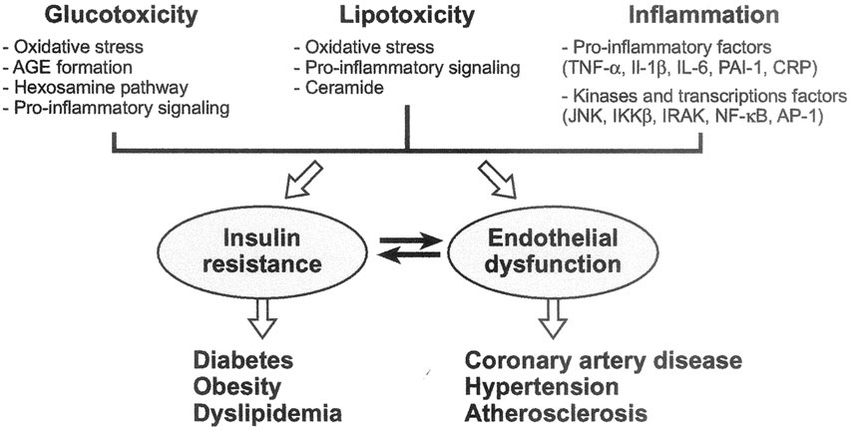
La sensibilità all’Insulina è multifattoriale e comprende componenti sistemiche (ad esempio, QUICKI) e periferiche (ad esempio, GLUT-4) ed è regolata a livello centrale da GLP-1 e GIP. L’iperglicemia è solo uno dei fattori (l’altro è l’Insulina) che funge da proxy dell’insulino-resistenza sistemica. Vi sono altri aspetti, tra cui la tolleranza ai carboidrati [vedi anche capacità di tolleranza del metabolismo glucidico], ecc.
In tema di insulino-resistenza, è utile ricordare che l’Insulina endogena viene secreta in modo pulsatile per regolare il metabolismo glucidico e lipidico, la crescita cellulare ecc…, a differenza del Testosterone che viene secreto in modo più stabile (rilascio graduale nel sangue, ma soggetto a variazioni diurne, ad esempio una maggiore secrezione al mattino rispetto a mezzogiorno/sera). Gli aumenti cronici di Insulina, ad esempio quelli relativi al profilo di rilascio di una bassa dose giornaliera di Insulina Glargine (Lantus), presentano un’area sotto la curva (AUC) relativamente ampia a causa del profilo di rilascio (concentrazioni elevate per lunghi periodi di tempo) rispetto ai normali profili di rilascio dell’Insulina endogena (paragonabili alla farmacocinetica dell’Insulina regolare, ad esempio Actrapid, Novolin o HumuLin -R). L’elevata AUC di Lantus e/o le dosi di Insulina regolare esogena moderatamente elevate e frequenti sono descritte come iperinsulinemia cronica.
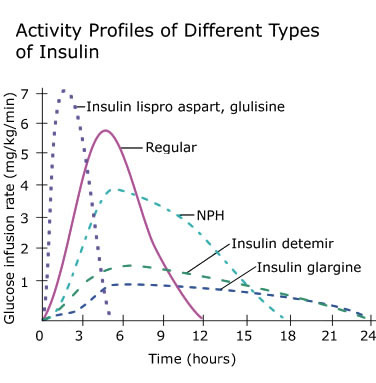
Questa resistenza non avviene per feedback negativo a livello delle cellule β.
Al contrario, l’iperinsulinemia cronica che causa l’insulino-resistenza è multifattoriale e comprende:
- L’aumento dell’HOMA-IR e la diminuzione del QUICKI (misure biochimiche dell’insulino-resistenza e della sensibilità all’Insulina, rispettivamente).
- L’alterata trasduzione del segnale insulinico dovuta alla disfunzione del recettore dell’Insulina (IR) e alla diminuzione dell’autofosforilazione dell’IR, che blocca la traslocazione del GLUT-4 sulla superficie cellulare nelle cellule muscolari e adipose, con conseguente aumento del glucosio nel sangue [3]:
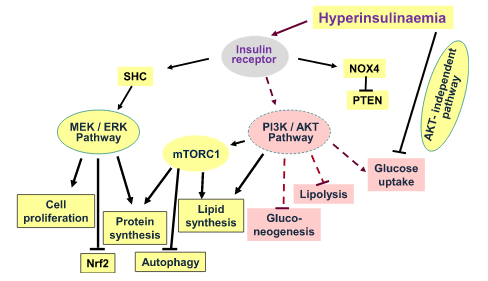
3. Aumento dei livelli e dell’attività di sn-1,2-diacilglicerolo (DAG) grazie alla sintesi de novo.
Le limitazioni degli Incretino-Mimetici dietro all’iniziale entusiasmo:
Se ci dovessimo basare su quanto esposto fino a questo punto, saremo tutti d’accordo nell’ammantare della nomea di “farmaci prodigiosi per la ricomposizione corporea” tanto la Semaglutide quanto il Tirzepatide e tutti gli altri membri di questa classe. Ma, dal momento che, la conoscenza per essere utile deve essere sufficientemente approfondita, occorre indagare meglio sulle caratteristiche di questi farmaci.
Sappiamo che la Semaglutide è effettivamente associata alla perdita di peso con una differenza media dell’11,85% rispetto al placebo emersa dalle ultime review. Il consolidamento degli studi ha mostrato che nausea, vomito, costipazione e diarrea sono gli eventi avversi più comuni. Nonostante questi effetti sembrano essere per lo più di gravità da lieve a moderata, la loro risoluzione totale era spesso connessa al termine del trattamento.
Dal momento che gli Incretino-mimetici causano una riduzione del senso di fame, in modo anche significativo (dose dipendente), rallentano lo svuotamento gastrico portando anche ad eventi diarroici preceduti da mal assorbimento dei nutrienti, senza sottovalutare il rischio di paresi gastrica, la facilità di perdere massa muscolare in un contesto ipocalorico è molto alta, specie se non supportata da agenti anabolizzanti; l’inserimento di questi ultimi, però, non “tampona” la possibile condizione di mal assorbimento e/o scarsa assunzione proteica/alimentare.
Inoltre, la paresi gastrica è una condizione che un bodybuilder sano di mente cerca di evitare a tutti i costi combattendoci già se sussiste abuso di Insulina e/o hGH.

Trattando la limitazione data da una potenziale eccessiva inappetenza, è giusto specificare un impatto singolare che le Incretine (e gli Incretino-Mimetici) hanno sulle preferenze alimentari. Sappiamo, infatti, che gli alimenti maggiormente palatabili sono tipicamente ricchi di grassi e/o zuccheri e tendono a essere preferiti a quelli a basso contenuto di grassi/zuccheri. L’entità di questa preferenza, tuttavia, può essere influenzata da peptidi intestinali quali la Grelina e il GLP-1. La Grelina e il GLP-1 sono influenzati in modo differenziato dal consumo di alimenti palatabili. Tralasciando la Grelina, le concentrazioni di GLP-1 a digiuno predicono negativamente l’assunzione di alimenti ricchi di zuccheri semplici in un paradigma di distributori automatici, che gli autori dello studio hanno interpretato come prova del fatto che il GLP-1 svolge un ruolo nelle vie di ricompensa che regolano l’assunzione di zuccheri semplici. Diversi studi riportano anche un’alterazione delle preferenze alimentari dopo l’intervento di bypass gastrico, con un allontanamento dalla preferenza per gli zuccheri/grassi elevati. L’assunzione di alimenti appetibili, in particolare di soluzioni zuccherate, è aumentata dalla Grelina, mentre il GLP-1 riduce preferenzialmente l’assunzione di alimenti ad alto contenuto di grassi e zuccheri, almeno dopo una somministrazione acuta. Inoltre, i lavori condotti sull’uomo rivelano che la preferenza per i grassi e gli zuccheri può essere alterata dalla chirurgia bariatrica e contribuire alla perdita di peso, ma non è ancora stato stabilito se questi effetti siano legati a un’alterazione del segnale della Grelina o del GLP-1. Infine, i livelli circolanti di Grelina e GLP-1 possono essere indicativi del consumo di cibo appetibile nell’uomo.[https://www.frontiersin.org/]
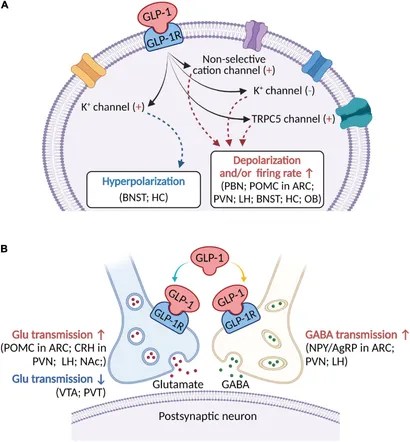
Di conseguenza, nonostante gli indizi di cui sopra, l’uso di Incretino-Mimetici potrebbe ridurre marcatamente il consumo di cibo indipendentemente dalla fonte anche se, come abbiamo visto, l’effetto anoressizzante del GLP-1 sembra essere a maggior carico della componente alimentare glucidico-lipidica.

Tornando invece sulla questione legata al catabolismo muscolo-scheletrico e l’uso concomitante di agenti anabolizzanti, per ovviare a questo problema nei pazienti trattati con Semaglutide, è stato avviato uno studio clinico di fase 2b, multicentrico, in doppio cieco, controllato con placebo, randomizzato, per la determinazione della dose e per valutare la sicurezza e l’efficacia di Ostarina 3mg, Ostarina 6mg o placebo come trattamento per preservare la massa muscolare e aumentare la perdita di grasso in circa 150 pazienti con obesità sarcopenica o pazienti anziani in sovrappeso (>60 anni di età) trattati con Semaglutide (Wegovy®). L’endpoint primario è la massa corporea magra totale e gli endpoint secondari chiave sono la massa grassa corporea totale e la funzione fisica misurata dal test di salita delle scale a 16 settimane.
Dopo aver completato la parte di determinazione della dose di efficacia dello studio clinico di Fase 2b, si prevede che i partecipanti continueranno in cieco in uno studio clinico di estensione di Fase 2b in cui tutti i pazienti smetteranno di ricevere un GLP-1 RA, ma continueranno ad assumere un placebo, Ostarina 3mg o Ostarina 6mg per ulteriori 12 settimane. Lo studio clinico di estensione di fase 2b valuterà se l’Ostarina è in grado di mantenere la massa muscolare e prevenire l’aumento di grasso e peso che si verifica dopo l’interruzione di un GLP-1 RA.
Lo studio clinico è condotto in 14 centri clinici negli Stati Uniti. È stato raggiunto l’arruolamento completo dei circa 150 pazienti nello studio di fase 2b QUALITY. L’azienda prevede ora che l’ultimo paziente a completare lo studio di fase 2b QUALITY sarà nel dicembre 2024, con i risultati clinici di prima linea per lo studio clinico di fase 2b QUALITY attesi nel gennaio 2025. Inoltre, i risultati principali per lo studio clinico di estensione di Fase 2b in cieco separato possono ora essere attesi nel secondo trimestre solare del 2025.
Ovviamente, queste limitazioni, incisive nel Culturismo, interessano tutti gli Incretino-Mimetici, compresa la Tirzepatide la quale sembrerebbe avere un maggior margine di efficacia e “sicurezza” per quanto riguarda il rischio (seppur limitato in monoterapia) di eventi ipoglicemici.
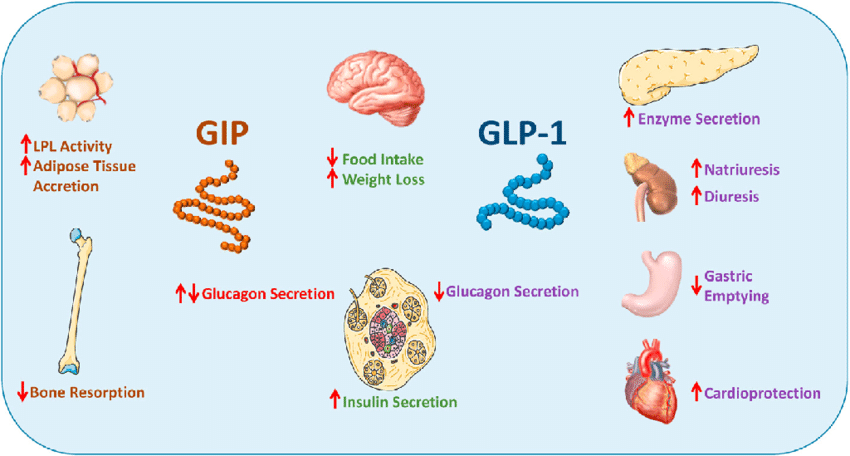
Il motivo di questa riduzione di rischio ipoglicemico è dovuta alla doppia affinità recettoriale della Tirzepatide la quale, come abbiamo visto, possiede una attività agonista per i recettori del GLP-1 e del GIP. Ed è proprio il legame e l’attivazione di quest’ultimo recettore (GIP) da parte della Tirzepatide a permettere ciò. Infatti, l’attivazione del recettore GIP stimola la secrezione di Glucagone in modo glucosio-dipendente nelle persone sane, con un’attività maggiore in presenza di glicemie più basse. Ciò significa che, raggiunta la soglia euglicemica i livelli di glucosio nel sangue verranno mantenuti più facilmente all’interno di questa soglia per via dell’attività del Glucagone secreto dalle cellule α delle isole di Langerhans.[https://pubmed.ncbi.nlm.nih.gov/]
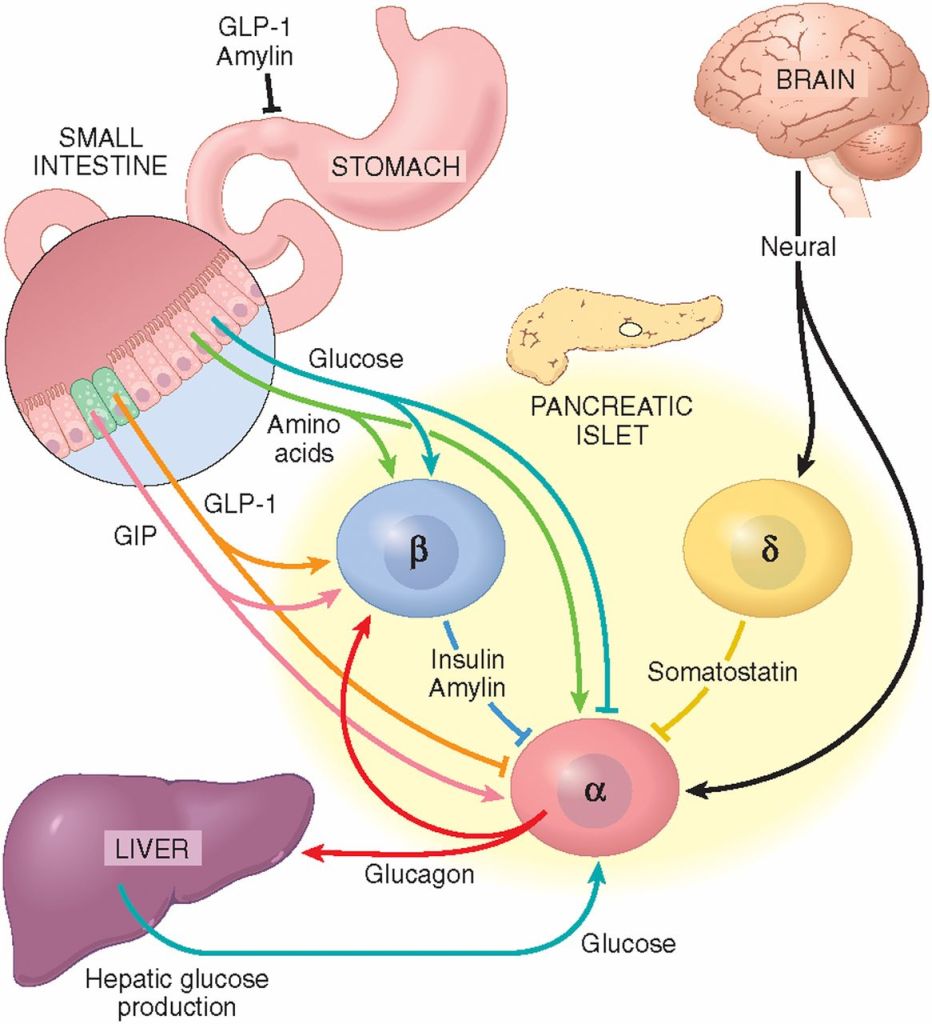
Sebbene i trials clinici suggeriscano che la Tirzepatide riduca la glucagonemia, un recente studio dimostra che la Tirzepatide è un potente stimolatore della secrezione di Glucagone nelle condizioni sopradette.
Quindi la Tirzepatide è superiore alla Semaglutide?
Alcuni studi recenti hanno messo a confronto la Semaglutide e la Tirzepatide per la perdita di peso. Studi di ricerca del 2021, del 2023 e del 2024 suggeriscono che la Tirzepatide può determinare una maggiore perdita di peso rispetto alla Semaglutide.
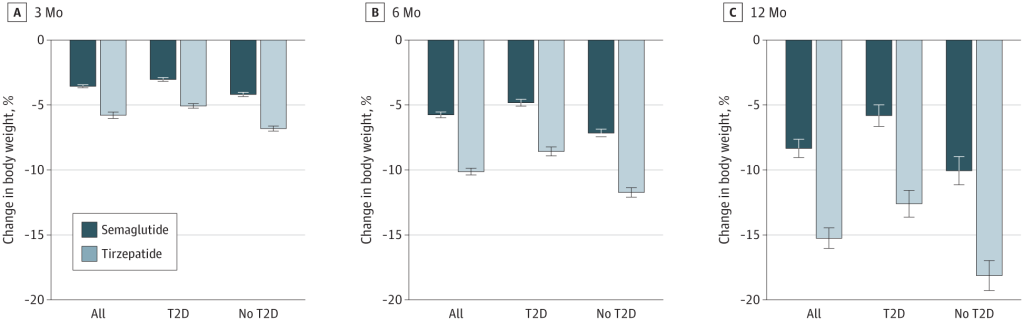
Ma questi studi presentano alcuni importanti limiti.
Le dosi di Semaglutide e Tirzepatide somministrate ai partecipanti non erano, per ovvie ragioni, uguali. La Semaglutide e Tirzepatide funzionano in modo leggermente diverso, come ormai sappiamo, e quindi i ricercatori hanno scelto livelli di dose comparabili. Tuttavia, la dose di Tirzepatide era più alta, il che potrebbe aver, anche di poco, influenzato i risultati.
Sappiamo altresì che la Tirzepatide ha una maggiore affinità con i recettori GIP rispetto ai recettori GLP-1. Di conseguenza, la ratio della dose di Tirzepatide con quella di Semaglutide risulta maggiormente a carico della prima.
La Tirzepatide è attualmente approvata dalla FDA per l’uso in persone in sovrappeso o con obesità, indipendentemente dal fatto che soffrano o meno di diabete di tipo II. Tuttavia, alcuni studi suggeriscono che la Tirzepatide sia un farmaco che non ha bisogno di essere somministrato in caso di mancanza della condizione diabetica.
Negli studi dove la Tirzepatide è stata somministrata a soggetti obesi, sono comunque stati osservati miglioramenti in tutte le misure cardiometaboliche. Gli eventi avversi più comuni con la Tirzepatide sono i medesimi riscontrati con la Semaglutide o altri membri della stessa famiglia. Essi sono stati di tipo gastrointestinale e la maggior parte di questi sono stati di gravità lieve o moderata e si sono verificati principalmente durante l’aumento della dose. Gli eventi avversi hanno causato l’interruzione del trattamento nel 4,3%, 7,1%, 6,2% e 2,6% dei partecipanti che hanno ricevuto dosi di Tirzepatide da 5, 10 e 15mg e placebo, rispettivamente.
In uno studio di 72 settimane su partecipanti con obesità, 5mg, 10mg o 15mg di Tirzepatide una volta alla settimana hanno fornito riduzioni sostanziali e durature del peso corporeo.
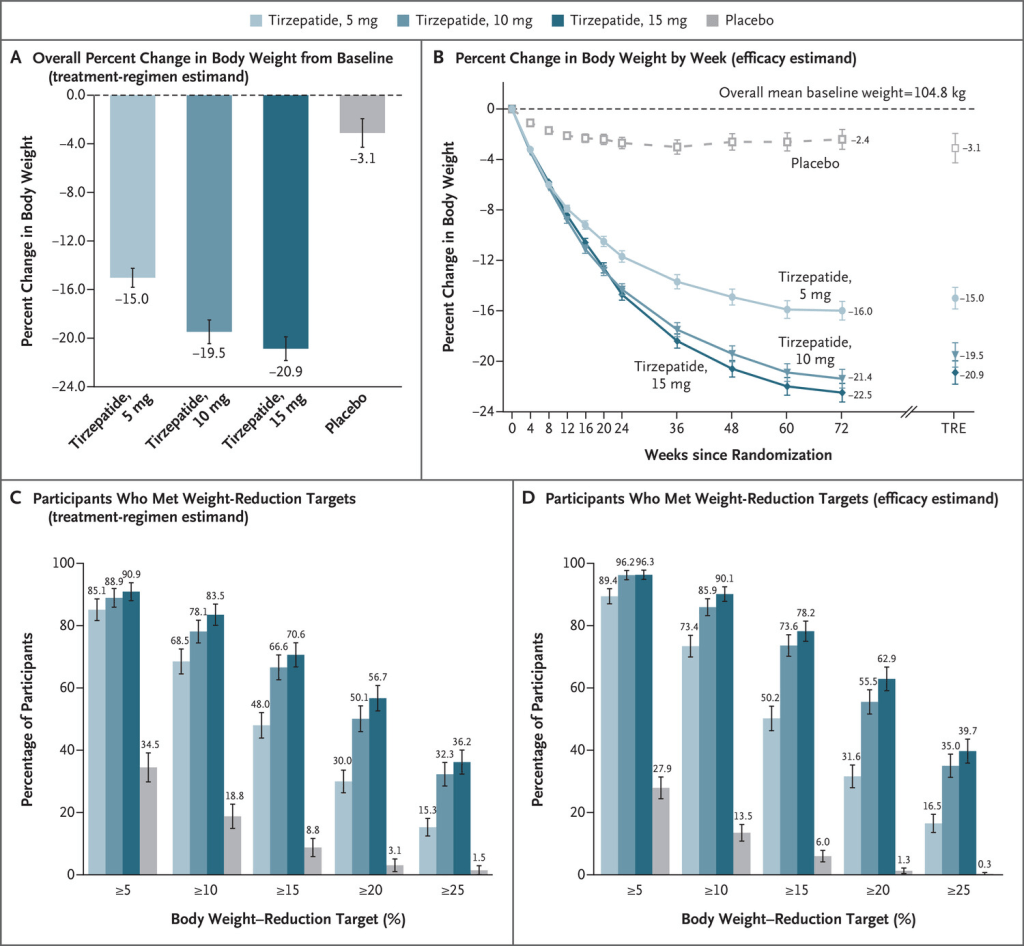
Le medie dei minimi quadrati sono presentate, se non diversamente specificato. Il pannello A mostra la variazione percentuale del peso corporeo dal basale alla settimana 72, derivata da un modello di analisi della covarianza per la stima del regime di trattamento (TRE). Il pannello B mostra la variazione percentuale del peso corporeo in base alle settimane dalla randomizzazione, derivata da un modello misto per misure ripetute (MMRM) per la stima dell’efficacia; sono riportate anche le stime alla settimana 72 per la stima del regime di trattamento. I riquadri C e D mostrano le percentuali di partecipanti che hanno avuto riduzioni di peso di almeno il 5%, 10%, 15%, 20% e 25% dal basale alla settimana 72. Per il riquadro C, la percentuale è stata calcolata in base al numero di settimane di randomizzazione. Per il pannello C, la percentuale è stata calcolata con l’uso delle regole di Rubin, combinando le percentuali dei partecipanti che hanno raggiunto l’obiettivo nei set di dati imputati. I valori mancanti alla settimana 72 sono stati imputati con MMRM se la mancanza era dovuta esclusivamente a Covid-19 e con imputazione multipla se la mancanza non era dovuta a Covid-19. Per il pannello D, la percentuale di partecipanti che hanno raggiunto gli obiettivi di riduzione del peso è stata ottenuta dividendo il numero di partecipanti che hanno raggiunto i rispettivi obiettivi alla settimana 72 per il numero di partecipanti con un valore al basale e almeno un valore post-base non mancante. I valori mancanti alla settimana 72 sono stati imputati dall’analisi MMRM. Le barre 𝙸 indicano gli intervalli di confidenza al 95%.
Nella pratica su bodybuilder, si sono osservati i minori sides comparati a ottimi risultati su insulino-resistenza e riduzione contenuta della fame con dosaggi settimanali di 2.5mg.
Alla luce di ciò, e in contesto aspecifico, la Tirzepatide mostra un moderato vantaggio gestionale rispetto alla Semaglutide.
- Si è parlato di un ipotetico “rebound” di Grelina con incremento della fame e del consumo calorico (con aumento di peso) dopo la cessazione d’uso di Semaglutide o Tirzepatide. Al momento non esistono dati certi che ci indichino un reale collegamento equazionale tra cessazione d’uso di GLP-1 agonisti > picco in cronico della Grelina > iperfagia > aumento ponderale di peso. Sappiamo, però, che le variazioni di Grelina e GLP-1 a 6 mesi dalla cessazione di una dieta ipocalorica non hanno predetto il recupero del peso da 6 a 18 mesi. Ciò significa che, in un soggetto sano, potrebbe si esserci una maggiore attività della Grelina nelle prime settimane dopo cessazione d’uso di un incretino-mimetico (calo soglia ematica del farmaco e stabilizzazione dei livelli endogeni di GLP-1), ma l’aumento del peso successivo potrebbe risultare con maggiore probabilità dalla modifica omeostatica multi-fattoriale la quale, per trovare un nuovo equilibrio, richiede per lo meno un arco di tempo direttamente proporzionale al tempo di trattamento. Si consideri, inoltre, che un anno dopo la sospensione della Semaglutide sottocutanea a 2,4mg una volta alla settimana e dell’intervento sullo stile di vita, i soggetti possono mostrare una riacquisizione di due terzi della perdita di peso precedente, con cambiamenti simili nelle variabili cardiometaboliche. Qualcosa di un possibile rebound grelinico…

Conclusioni:
Arrivati alla conclusione di questa disamina abbiamo tutti gli elementi per valutare l’eventuale senso di utilizzo degli Incretino-Mimetici in contesti al di fuori del trattamento del diabete di tipo II o di soggetti obesi.
Le limitazioni date dagli effetti collaterali più comuni, se contestualizzate in una preparazione di un bodybuilder, possono causare non poche problematiche specie nelle vicinanze di una gara; vedi, ad esempio, estrema riduzione dell’assunzione calorica e proteica, mal assorbimento e gonfiore addominale o paresi gastrica.
Sebbene la possibilità di eventi ipoglicemici sia contenuta, e ancor più rara con la Tirzepatide in monoterapia, il rischio, in concomitanza dell’effetto sulla insulino-sensibilità degli AAS o di altre molecole co-somministrate, di questo sides può aumentare in modo sensibile durante una dieta ipocalorica.
In tal sede non ho preso in considerazione i due più preoccupanti, e più rari, effetti collaterali legati all’uso di incretino-mimetici: Tumore Midollare della Tiroide [MTC] e Pancreatite. Quest’ultima può manifestarsi anche con l’uso di AAS, seppur raramente, specie in caso d’uso di molecole aromatizzabili; la presenza di un incretino-mimetico in tali circostanze potrebbe avere un incidenza maggiore nello sviluppo e manifestazione della Pancreatite.[https://jmedicalcasereports.biomedcentral.com/]
In definitiva, i vantaggi potenziali di una una insulino-sensibiltà maggiore iatrogeno-dipendente (visti in precedenza) con l’uso di Incretino-Mimetici è, con i dovuti distinguo complessivi, ottenibile con l’uso di Metformina la quale presenta un margine di sicurezza decisamente più ampio.

Gabriel Bellizzi [CEO BioGenTech]
Riferimenti:
- Semaglutide and Tirzepatide are More Than Just Weight Loss Drugs [di Type-IIx]
[1] McDonald, L. The Ultimate Diet 2.0: Advanced Cyclical Dieting for Achieving Super Leanness. (2003). Lyle McDonald Publishing.
[2] Volpe S, Lisco G, Racaniello D, Fanelli M, Colaianni V, Vozza A, Triggiani V, Sabbà C, Tortorella C, De Pergola G, Piazzolla G. Once-Weekly Semaglutide Induces an Early Improvement in Body Composition in Patients with Type 2 Diabetes: A 26-Week Prospective Real-Life Study. Nutrients. 2022 Jun 10;14(12):2414. doi: 10.3390/nu14122414.
[3] Kolb H, Kempf K, Röhling M, Martin S. Insulin: too much of a good thing is bad. BMC Med. 2020;18(1):224. Published 2020 Aug 21. doi:10.1186/s12916-020-01688-6
