Introduzione:
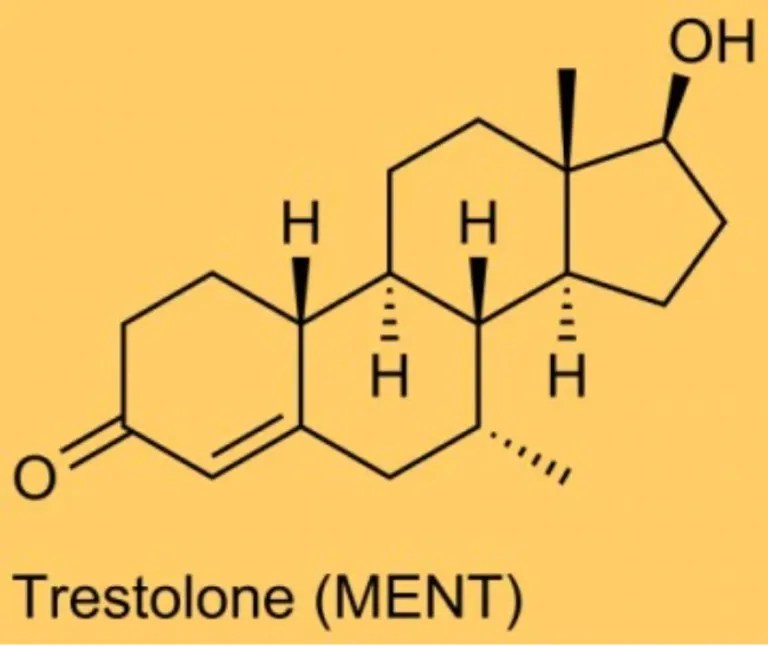
Del Trestolone [MENT; Methylnortestosterone; 7α-methyl-19-nortestosterone; 7α-CH₃-NorT) ho già parlato sia in un articolo che in un video della rubrica “The Lord Of The PEDs”. In entrambi i lavori sono stati esposti in generale pregi e difetti della molecola in questione. In questo articolo, invece, vorrei soffermarmi sulle caratteristiche uniche del Trestolone, le quali, e lo si vedrà, non gli conferiscono particolari e reali vantaggi d’uso nel Bodybuilding, a differenza, per esempio, del Trenbolone, dell’Oxandrolone o del Fluoxymesterone. Piuttosto, le sue peculiarità si combinano in modo sfavorevole per qualsiasi uso pratico nel bodybuilding, attraverso l’influenza sullo sviluppo della ginecomastia, dell’equilibrio dei liquidi e della pressione sanguigna.
Le caratteristiche uniche del Trestolone:
- Effetti estrogenici per aromatizzazione al prodotto aromatico più potente del 17β-estradiolo: il 7α-methylestradiolo (7α-ME);
- Effetti gestageni dovuti alla forte attivazione del recettore del Progesterone (PR):
- Che si combinano sinergicamente per produrre:
- 1. Effetti ginecomastici (crescita del tessuto mammario negli uomini)
- 2. Effetti edematosi (ritenzione di liquidi; “gonfiore”) e
- 3. Effetti ipertensivi (pressione sanguigna elevata, in particolare sistolica, cioè pressione da contrazione cardiaca).
Prima di discutere gli effetti edematosi del Trestolone (ritenzione di liquidi; “gonfiore”), dobbiamo innanzitutto esaminare i fattori che sono alla base della ritenzione di liquidi (effetti estrogenici e gestagenici/progestinici), prima di discutere il modo in cui questi stessi fattori sono alla base dei suoi particolari effetti ipertensivi (aumento della pressione arteriosa, in particolare della pressione sistolica; cioè, aumento della pressione da contrazione cardiaca).
Effetti estrogenici:
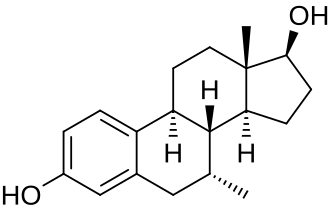
Il lettore nella media, ormai, dovrebbe essere al corrente sul fatto che il Trestolone aromatizza in 7α-methylestradiolo (7α-ME). [1].
Dalla Teoria delle Potenze Estrogeniche Dipendenti dai Composti (Per-AAS) e Individuali (Per-Utilizzatore) (Modello di Type-IIx), l’estrogenicità si riferisce agli effetti associati all’attivazione di ERα e β (quest’ultima generalmente opposta alla prima), e dipende da Fattori Dipendenti dai Composti (Per-AAS) e Individuali (Per-Utilizzatori) che determinano sia (A) i livelli ematici effettivi che (B) gli effetti a livello tissutale dei prodotti aromatici di un AAS.

Tuttavia, in letteratura, viene riportato che il Trestolone possiede solo una debole attività estrogenica data da un tasso di aromatizzazione che sembrerebbe essere insufficiente per scopi sostitutivi, come dimostrato dalla diminuzione della densità minerale ossea negli uomini trattati con questo farmaco per l’ipogonadismo. Dobbiamo, però, anche considerare il tasso di degradazione del 7α-methylestradiolo prodotto, nonché la potenza estrogenica dei metaboliti risultanti che vanno a sommarsi alla potenziale attività estrogenica di altri AAS aromatizzabili co-somministrati [vedi Oxymetholone e la sua attività estrogenica intrinseca e il Methandrostenolone con il suo metabolita estrogenico 17α-methylestradiolo] e l’attività gestatinica propria del Trestolone.
Effetti ginecomastici derivanti dall’estrogenicità

Il prodotto aromatico del Trestolone, il 7α-ME, ha una potenza più che quadrupla (“efficace”, una cosa negativa in questo caso) rispetto al 17β-estradiolo (E2) nelle cellule con presenza di ER.[1] L’efficacia si determina misurando l’effetto, ad esempio la crescita (in questo caso, nelle cellule di cancro al seno). La EC₅₀ (EC50) è determinata dalle concentrazioni alle quali il ligando innesca la crescita e può essere confermata da misurazioni della progressione del ciclo cellulare (cioè l’ingresso nella fase S durante il ciclo cellulare).
L’affinità di legame (IC₅₀) del prodotto aromatico del Trestolone, 7α-ME, è pari al 102% di quella dell’E2, che in letteratura viene tipicamente utilizzato come composto di riferimento per il legame con l’ER, data la sua notevole efficacia, potenza e affinità per il recettore ER-α. [1].
Confrontando il tasso di aromatizzazione tra Trestolone e Nandrolone, Attardi et al. hanno scoperto che, “[a] 180 min, circa il 23% del Trestolone è stato convertito in 7α-ME e circa il 13% del [Nandrolone] in E2”. Poiché il Nandrolone ha un tasso di aromatizzazione del 20% rispetto al Testosterone (T), e che presenta una maggior tendenza alla conversione in Estrone (E1), possiamo dedurre che il Trestolone aromatizza in 7α-ME circa il 35% rispetto al T [che aromatizza in E2], con una potenza quattro volte superiore a quella dell’E2, cioè per provocare la crescita delle cellule del cancro al seno. La semplice moltiplicazione del tasso di aromatizzazione (35%) × EC50(7α-methylestradiolo) × RBA(7α-methylestradiolo) ≈ Il potenziale di crescita del Trestolone nelle cellule con presenza di ER è superiore del 40% rispetto al T. [2]

La deduzione, quindi, supporta le segnalazioni degli utilizzatori secondo cui il Trestolone è potentemente estrogenico. Matematicamente, possiamo affermare che 50mg al giorno di Trestolone Enantato ≈ estrogenico quanto 500mg di Testosterone Enantato alla settimana.
Inoltre, come descritto nella sezione seguente, gli effetti gestageni del Trestolone potenziano notevolmente i suoi effetti ipertensivi ed edematosi (tendenza a trattenere liquidi).
Effetti gestagenici:
- Effetti ginecomastici derivanti dall’antiandrogenismo
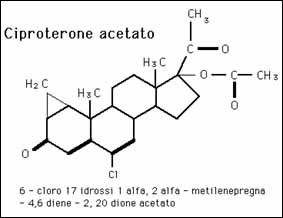
Il Trestolone è un androgeno potentemente progestinico (“ gestagenico”) che possiede il 27,5% della potenza di Androcur™ [Ciproterone Acetato] – un farmaco antiandrogeno e progestinico usato per trattare le patologie androgeno dipendenti, tra cui l’acne, l’irsutismo e il cancro alla prostata – per attivare il recettore del progesterone (PR). [11].
I progestinici contribuiscono alla soppressione dell’asse ipotalamo-ipofisi-gonadi (HPG) disregolando le gonadotropine ipotalamiche attraverso la segnalazione del dendro KNDy, interrompendo la pulsatilità del GnRH e inibendo la secrezione di LH ipofisario [e FSH], inibendo così la sintesi e la secrezione di Testosterone (endogeno). [12][13] I progestinici sintetici utilizzati in ambito contraccettivo traggono la loro efficacia da questa caratteristica. Bebb et al. hanno randomizzato uomini sani a ricevere Testosterone Enantato (100mg settimanali) o lo stesso dosaggio di Testosterone Enantato in combinazione con il progestinico Levonorgestrel, la cui aggiunta ha praticamente soppresso la secrezione di LH e FSH. [14] La diminuzione di LH e FSH può causare ipogonadismo secondario, con conseguente diminuzione del rapporto androgeni/estrogeni (A:E), causando ginecomastia. [15]
Gli effetti dei progestinici sono legati alle loro interazioni con i recettori: recettori degli androgeni (AR) (ad esempio, acne, effetti lipidici); recettori dei glucocorticoidi (GR) (ad esempio, ritenzione di sodio e acqua, gonfiore); o recettori dei mineralocorticoidi (MR) (ad esempio, diminuzione della ritenzione idrica e del peso). I progestinici antiandrogeni possono agire in diversi modi. Possono esercitare un’inibizione competitiva dell’AR, oppure legarsi all’enzima 5-α reduttasi e quindi interagire con la conversione del Testosterone in DHT (il suo metabolita fortemente androgeno)[16].
Il Progesterone e i suoi derivati e i “progestinici-mimici” (ad esempio, il Trestolone) si legano moderatamente all’AR in modo competitivo (cioè antagonista). [17]. I derivati del Progesterone alterano le risposte tissutali mediate da AR e PR, ma non da ER. [17]
Gli estrogeni regolano la sintesi di PR. [18] Inoltre, l’attivazione del PR è stata collegata a una ridotta espressione dell’AR, ostacolando così l’inibizione della crescita del tessuto mammario mediata dagli androgeni osservata in condizioni di normale omeostasi ormonale. [19].
Il Progesterone e i suoi derivati possono ulteriormente ma indirettamente causare ginecomastia potenziando l’effetto dell’E2 sui tessuti mammari. [20].
In sintesi, le caratteristiche discusse – effetti estrogenici e gestagenici del Trestolone – sono alla base dei suoi potenti effetti edematosi e ipertensivi.
Effetti edematosi:
L’edema, o ritenzione di liquidi, è il metro di paragone dell’eccessiva estrogenicità nei bodybuilder che fanno uso di AAS.
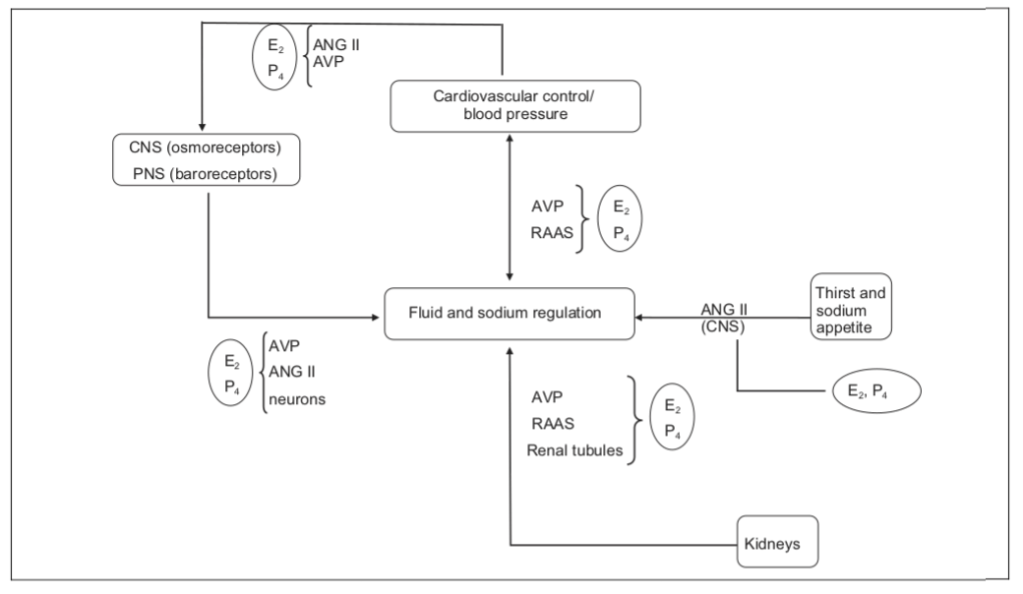
Il Trestolone si sostituisce a E₂ e P₄ per promuovere l’equilibrio dei fluidi attraverso molteplici meccanismi. [10]
Il diagramma qui sopra illustra come il Trestolone agisca in modo molteplice per promuovere la ritenzione di liquidi (edema) e l’ipertensione (aumento della pressione arteriosa sistolica; aumento della pressione da contrazione cardiaca). Il Trestolone è analogo all’E₂ (Estradiolo; E2) e al P₄ (Progesterone) nei confronti del 7α-ME e nella sua potenza del 29,2% nell’attivare la PR come il P₄. [11]
Il Trestolone, quindi, promuove la ritenzione di liquidi agendo su:
1. Il cervello e il sistema nervoso centrale (SNC) per aumentare la sete e il bisogno di assumere sodio attraverso la segnalazione dell’Angiotensina II, e
2. I reni agendo su:
1. gli ormoni antidiuretici, ad esempio l’Arginina Vasopressina (AVP), riducendo la minzione
2. il sistema renina-angiotensina-aldosterone (RAAS), aumentando il bilancio del sodio, e/o
3. i tubuli renali, favorendo la ritenzione di sodio e acqua. [10]
Effetti ipertensivi:
Nella Figura 1 è illustrato anche, in parte, come il Trestolone, al posto dell’E₂ (Estradiolo; E2) e del P₄ (Progesterone), favorisca l’aumento della pressione arteriosa. Lo fa aumentando lo squilibrio dei liquidi (cioè il “gonfiore”), come i suoi effetti edematosi, e agendo sugli osmorecettori del sistema nervoso centrale (SNC) e sui barorecettori del sistema nervoso periferico (SNP), nonché agendo sull’Angiotensina II, sull’AVP e sui neuroni di vari sistemi. [10]
– Aumento della pressione sistolica
Il Trestolone aumenta significativamente la pressione arteriosa sistolica (cioè la pressione da contrazione cardiaca) a una dose settimanale inferiore a 2mg. [21]
La pressione del polso (Pp) è la differenza (mmHg) tra pressione sistolica e diastolica. Una pressione sistolica normale è quindi di 40 mmHg (120 mmHg – 80 mmHg = 40 mmHg).
La pressione sistolica , o del polso (Pp), rappresenta la forza pressoria che il cuore genera ogni volta che si contrae, o la compliance arteriosa (C). Se la pressione del polso è normale a 40 mmHg, una Pp < 25% della pressione sistolica è bassa o ristretta, mentre una Pp > 100 mmHg è alta o estesa.
Una variazione della pressione sistolica (ΔPp) è proporzionale alla variazione del volume (V) (ΔV) ma inversamente proporzionale alla compliance arteriosa (C):
ΔPp = Δ V/C
Poiché la variazione di volume è dovuta al volume della gittata (SV) del sangue espulso dal ventricolo sinistro, possiamo approssimare la pressione del polso come:
Pp = SV/C
Un giovane adulto normale a riposo ha un volume di gittata (SV) di circa 80 mL. La compliance arteriosa (C) è di circa 2mL/mmHg, il che conferma che la pressione normale del polso è di circa 40 mmHg.
Il Trestolone, quindi, induce un aumento della pressione sistolica, aumentando il volume della gittata.
Effetti ematologici:
– Aumento del Ematocrito [HCT]
Il Trestolone, aumentando la ritenzione di sodio e di liquidi, e aumenta il volume plasmatico. Inoltre, aumenta rapidamente l’Emoglobina.
L’Emoglobina (Hb) è una proteina che si lega agli eritrociti (RBC) all’O₂ (Hb 13,5 – 17g/dL [uomini], 12 – 15,5g/dL [donne]).
L’Ematocrito (HCT) rappresenta la % del volume sanguigno occupato dagli eritrociti (RBC) [uomini 41-51%, donne 36-47%].
L’Ematocrito (HCT) è correlato all’Emoglobina (Hb) mediante la formula di base:
Hb (g/dL) × 3 ≈ HCT (%)
Esempio: Hb di 15g/dL ≈ HCT del 45%.
I livelli di emoglobina sono stati significativamente aumentati (149 ± 2,9 g/L → 154 ± 3,3; dimensione dell’effetto: 1,724; %Δ: +3,35%; intervallo di confidenza del 95%) con il Trestolone (~ 2 mg q.w.) a 12 settimane, e un andamento simile (da 0,44 a 0,46; dimensione dell’effetto: 2; %Δ: +4,5%; non significativo) è stato osservato nell’Ematocrito, che però non ha raggiunto la significatività statistica. [21] Nel gruppo Testosterone (~ 120mg q.w.), invece, è stato osservato un aumento progressivo più lento della concentrazione di Emoglobina, che è diventato significativo solo a 48 settimane. Nel gruppo Testosterone si è registrato anche un aumento complessivo significativo dell’Ematocrito, sebbene nessuno dei singoli punti di trattamento fosse significativamente diverso dal pre-trattamento (0,45 ± 0,01). [21]
Conclusioni:

Le caratteristiche di base del Trestolone – la sua potente estro- e gesta- genicità – pongono le basi per i suoi forti effetti edematosi e ipertensivi, in modo tale che i suoi effetti ginecomastici, gli effetti ginecomastici derivanti dall’estrogenicità e gli effetti ginecomastici derivanti dall’antiandrogenicità, non possono essere ignorati. Attraverso il suo metabolita aromatico 7α-ME, sopprime potentemente le gonadotropine (LH, FSH), diminuendo la A:E ratio, sinergizzando con le caratteristiche gestageniche con una potenza pari a quella degli antiandrogeni farmaceutici (ad esempio, Androcur™ [Ciproterone Acetato]), stimolando la crescita direttamente del tessuto mammario attraverso l’ER e indirettamente attraverso l’azione gestagenica e antiandrogena nella modalità del Progesterone (con una potenza di quasi ⅓ per mg). Il Trestolone favorisce in particolare il “gonfiore da ritenzione” attraverso la sua azione sui reni (influenzando negativamente la regolazione della ritenzione di liquidi e sodio) e sul cervello (aumentando la sete e l’ingestione di sodio) e favorisce in particolare l’ipertensione, soprattutto l’aumento della pressione sistolica, aumentando il volume di gittata attraverso l’aumento del volume plasmatico e dell’Ematocrito, cioè la viscosità o lo densità del sangue.
Questo articolo potrebbe prevedibilmente servire da deterrente all’uso di questo agente praticamente inutile (se paragonato alle altre molecole AAS) da parte dei bodybuilder dal momento che presenta alcuni aspetti unici e non accettabili nell’insieme di una corretta valutazione della molecola.
Se lo confrontiamo con il Trenbolone, non abbiamo alcun vantaggio nel suo inserimento sostitutivo: oltre al potenziale neurotossico e cardiotossico, come abbiamo visto, si aggiungono problematiche peculiari date dalla molecola che ne rendono un ipotetico uso nettamente difficile da gestire.
Gabriel Bellizzi [CEO BioGenTech]
Riferimenti:
- Articles by Type-IIx
[1] Attardi BJ, Pham TC, Radler LC, Burgenson J, Hild SA, Reel JR. Dimethandrolone (7alpha,11beta-dimethyl-19-nortestosterone) and 11beta-methyl-19-nortestosterone are not converted to aromatic A-ring products in the presence of recombinant human aromatase. J Steroid Biochem Mol Biol. 2008;110(3-5):214-222. doi:10.1016/j.jsbmb.2007.11.009
[2] Ryan, Kenneth J. “Biological aromatization of steroids.” Journal of Biological Chemistry 234.2. (1959): 268-272.
[3] Navarro, V. M., Gottsch, M. L., Chavkin, C., Okamura, H., Clifton, D. K., and Steiner, R. A. (2009). Regulation of Gonadotropin-Releasing Hormone Secretion by Kisspeptin/Dynorphin/Neurokinin B Neurons in the Arcuate Nucleus of the Mouse. Journal of Neuroscience, 29(38), 11859–11866. doi:10.1523/jneurosci.1569-09.2009
[4] Girmus, R. L., and Wise, M. E. (1992). Progesterone Directly Inhibits Pituitary Luteinizing Hormone Secretion in an Estradiol-dependent Manner1. Biology of Reproduction, 46(4), 710–714. doi:10.1095/biolreprod46.4.710
[5] Bebb, R. A., Anawalt, B. D., Christensen, R. B., Paulsen, C. A., Bremner, W. J., and Matsumoto, A. M. (1996). Combined administration of levonorgestrel and testosterone induces more rapid and effective suppression of spermatogenesis than testosterone alone: a promising male contraceptive approach. The Journal of Clinical Endocrinology and Metabolism, 81(2), 757–762. doi:10.1210/jcem.81.2.8636300
[6] Sitruk-Ware, R. (2004). Pharmacological profile of progestins. Maturitas, 47(4), 277–283. doi:1
0.1016/j.maturitas.2004.01.001
[7] Fang, H., Tong, W., Branham, W. S., Moland, C. L., Dial, S. L., Hong, H., … Sheehan, D. M. (2003). Study of 202 Natural, Synthetic, and Environmental Chemicals for Binding to the Androgen Receptor. Chemical Research in Toxicology, 16(10), 1338–1358. doi:10.1021/tx030011g
[8] Eyster, K. M. (Ed.). (2016). Estrogen Receptors. Methods in Molecular Biology. doi:10.1007/978-1-4939-3127-9
[9] Sansone, A., Romanelli, F., Sansone, M., Lenzi, A., and Di Luigi, L. (2016). Gynecomastia and hormones. Endocrine, 55(1), 37–44. doi:10.1007/s12020-016-0975-9
[10] Zhou, J., Ng, S., Adesanya-Famuiya, O., Anderson, K., and Bondy, C. A. (2000). Testosterone inhibits estrogen-induced mammary epithelial proliferation and suppresses estrogen receptor expression. The FASEB Journal, 14(12), 1725–1730. doi:10.1096/fj.99-0863com
[11] Houtman, C. J., Sterk, S. S., van de Heijning, M. P. M., Brouwer, A., Stephany, R. W., van der Burg, B., and Sonneveld, E. (2009). Detection of anabolic androgenic steroid abuse in doping control using mammalian reporter gene bioassays. Analytica Chimica Acta, 637(1-2), 247–258. doi:10.1016/j.aca.2008.09.037
[12] Navarro, V. M., Gottsch, M. L., Chavkin, C., Okamura, H., Clifton, D. K., and Steiner, R. A. (2009). Regulation of Gonadotropin-Releasing Hormone Secretion by Kisspeptin/Dynorphin/Neurokinin B Neurons in the Arcuate Nucleus of the Mouse. Journal of Neuroscience, 29(38), 11859–11866. doi:10.1523/jneurosci.1569-09.2009
[13] Girmus, R. L., and Wise, M. E. (1992). Progesterone Directly Inhibits Pituitary Luteinizing Hormone Secretion in an Estradiol-dependent Manner1. Biology of Reproduction, 46(4), 710–714. doi:10.1095/biolreprod46.4.710
[14] Bebb, R. A., Anawalt, B. D., Christensen, R. B., Paulsen, C. A., Bremner, W. J., and Matsumoto, A. M. (1996). Combined administration of levonorgestrel and testosterone induces more rapid and effective suppression of spermatogenesis than testosterone alone: a promising male contraceptive approach. The Journal of Clinical Endocrinology and Metabolism, 81(2), 757–762. doi:10.1210/jcem.81.2.8636300
[15] Narula HS, Carlson HE. Gynaecomastia–pathophysiology, diagnosis and treatment. Nat Rev Endocrinol. 2014;10(11):684-698. doi:10.1038/nrendo.2014.139
[16] Sitruk-Ware, R. (2004). Pharmacological profile of progestins. Maturitas, 47(4), 277–283. doi:10.1016/j.maturitas.2004.01.001
[17] Fang, H., Tong, W., Branham, W. S., Moland, C. L., Dial, S. L., Hong, H., … Sheehan, D. M. (2003). Study of 202 Natural, Synthetic, and Environmental Chemicals for Binding to the Androgen Receptor. Chemical Research in Toxicology, 16(10), 1338–1358. doi:10.1021/tx030011g
[18] Eyster, K. M. (Ed.). (2016). Estrogen Receptors. Methods in Molecular Biology. Doi:10.1007/978-1-4939-3127-9
[19] Sansone, A., Romanelli, F., Sansone, M., Lenzi, A., and Di Luigi, L. (2016). Gynecomastia and hormones. Endocrine, 55(1), 37–44. doi:10.1007/s12020-016-0975-9
[20] Zhou, J., Ng, S., Adesanya-Famuiya, O., Anderson, K., and Bondy, C. A. (2000). Testosterone inhibits estrogen-induced mammary epithelial proliferation and suppresses estrogen receptor expression. The FASEB Journal, 14(12), 1725–1730. doi:10.1096/fj.99-0863com
[21] Walton, M. J., Kumar, N., Baird, D. T., Ludlow, H., & Anderson, R. A. (2007). 7 -Methyl-19-Nortestosterone (MENT) vs Testosterone in Combination With Etonogestrel Implants for Spermatogenic Suppression in Healthy Men. Journal of Andrology, 28(5), 679–688. doi:10.2164/jandrol.107.002683
