L’acido arachidonico (AA) è un acido grasso poli-insaturo, ovvero che reca nella propria molecola più doppi legami carbonio-carbonio.
L’acido arachidonico è un omega 6 presente nell’organismo umano ed è introdotto con la dieta (ad esempio assumendo olio di arachidi, da cui prende il nome), ma lo si può far derivare anche dall’acido linoleico che… è un acido grasso essenziale omega 6 (presente ad esempio nell’olio di canapa o cannabis e nell’olio di semi di girasole). All’interno delle cellule è legato a fosfolipidi di membrana (fosfatidilinositolo, fosfatidilcolina, fosfatidiletanolamina).
L’acido arachidonico è liberato dalla molecola di fosfolipide dall’enzima fosfolipasi A2, restituendo così il monogliceride fosfato e una molecola di acido arachidonico. Una seconda via, minoritaria, di liberazione dell’acido arachidonico è quella che prevede la scissione del diacil glicerolo fosfato (DAG) precedentemente originatosi dalla scissione del fosfatidil inositolo difosfato PIP2 da parte della proteina Gq.
L’acido arachidonico è un precursore nella sintesi degli eicosanoidi:
• Attraverso l’azione dell’enzima cicloossigenasi e perossidasi dà origine alla Prostaglandina H2, che a sua volta viene trasformata in diverse sostanze tra cui le prostaglandine – coinvolte nei processi infiammatori e in molte funzioni fisiologiche tra cui la protezione della mucosa gastrica – in prostacicline, e trombossani.
• l’enzima 5-lipoossigenasi lo trasforma in 5-HPETE, che a sua volta è usato per la produzione dei leucotrieni.
• l’acido arachidonico è usato anche nella biosintesi dell’anandamide.
La produzione di questi derivati, e la loro azione nell’organismo, sono nel complesso conosciuti come la cascata dell’acido arachidonico.
L’acido arachidonico ovviamente non viene sintetizzato soltanto dall’acido linoleico, può essere introdotto anche tramite alimentazione, alcuni alimenti che lo contengono sono (l’olio di arachidi da cui prende il nome), noci, olio di pesce sardina, merluzzo e salmone, carne, uova, tuorlo.
Nel nostro organismo l’acido arachidonico è presente soltanto nei fosfolipidi di membrana.
Analizziamo lo schema della Fosfolipasi:
Esistono vari tipi di Fosfolipasi:
– 1: Fosfolipasi C (PLC)
– 2: Fosfolipasi A2 (PLA2)
– 3: Fosfolipasi D (PLD)
Di nostro interesse è la fosfolipasiA2 che è quella capace di liberare l’acido arachidonico dalla membrana dei fosfolipidi.
La Fosfolipasi A2, abbreviata in (PLA2), è un enzima che permette il rilascio di acidi grassi dal secondo gruppo carbonioso dei gliceroli.
Nello specifico, la PLA2 riconosce il legame sn-2 acil dei fosfolipidi e ne induce la catalisi idrolitica rilasciando acido arachidonico e lisofosfolipidi permettendo l’inizio della cascata dell’acido arachidonico.
La fosfolipasi è un enzima che può essere riscontrato, con le dovute differenze strutturali, nei mammiferi, negli insetti e nei veleni dei serpenti.
Il rilascio della PLA2 è fondamentale nel responso infiammatorio.
Il rilascio e l’attività di tale enzima è regolato dalla sua fosforilazione e dai livelli di calcio.
Quando la PLA2 è fosforilata dalla Mitogen-activated protein kinase a livello della serina-505 la PLA2 si trasforma nella forma attivata.
Quando poi la fosforilazione è accoppiata all’influsso di ioni calcio la PLA2 migra verso la membrana cellulare dove catalizza la liberazione di acido arachidonico.
Si distinguono tre classi appartenenti alla famiglia delle FosfolipasiA2:
– PLA2 secretorie (sPLA2),
– PLA2 citosoliche (cPLA2)
– PLA2 Ca+2 indipendenti.
Tutti i processi esaminati in precedenza fanno riferimento alla cPLA2, Le cPLA2 sono enzimi citoplasmatici ad alto peso molecolare, (80-110 Kda).
La liberazione intracellulare di acido arachidonico (AA) indotta dai recettori è mediata principalmente dalla cPLA2, perché questa forma idrolizza di preferenza fosfolipidi contenenti AA.
Come accennato in precedenza, l’AA è il precursore della sintesi degli eicosanoidi, una classe di mediatori molto incisiva che, come sappiamo, comprende prostaglandine, trombossano, leucotrieni e lipossine.
Gli eicosanoidi, sono un gruppo di autacoidi, ovvero di sostanze ormone-simili ad azione locale, che vengono fisiologicamente liberati dalla cellula attraverso una cascata enzimatica che parte da un acido grasso a 20 atomi che è appunto l’acido arachidonico. L’acido arachidonico, come detto pocanzi, viene liberato dai fosfolipidi per opera della fosfolipasi A2 (PLA2) o (cPLA2).
Una massiva liberazione di eicosanoidi è caratteristica dei processi infiammatori, in presenza di un danno tissutale.
Si distinguono due vie metaboliche principali che a partire dall’acido arachidonico arrivano alla formazione degli eicosanoidi.
Il metabolismo dell’AA può seguire due strade:
1- La via della ciclossigenasi (COX) e;
2- la via della lipossigenasi (LOX).
La via della ciclossigenasi porta alla formazione di prostaglandine (PGE2 pg ,PGD2, PGF2, PGI2) e trombossani (TXA2), per azione a sua volta di enzimi specifici.
Ciascuno di questi enzimi ha una ben precisa distribuzione tessutale.
Ad esempio, la “TXA sintetasi” è presente all’interno delle piastrine (TXA2 è un potentissimo aggregante piastrinico).
Al contrario, l’endotelio è provvisto dell’enzima atto alla produzione di prostaciclina (PGI2), potente antiaggregante piastrinico.
L’aspirina, ed i FANS (farmaci antiinfiammatori non steroidei) in genere, inibiscono la COX e quindi la produzione di tutte le prostaglandine ed i trombossani.
La ricerca ha mostrato che esistono due COX, dette COX1 e COX2. La COX1 è espressa nella mucosa gastrica. È per tale motivo che gli inibitori selettivi della COX2 hanno effetti lesivi della mucosa gastrica molto più attenuati.
La via della lipossigenasi vede l’azione del 5-LOX, che è l’enzima metabolizzante l’AA più importante dei neutrofili.
Il prodotto della 5-LOX è altamente instabile e viene successivamente convertito in leucotrieni (LTA4, LTB4, LTC4).
I leucotrieni, ed LTB4 in particolare, sono potenti agenti chemiotattici per i neutrofili.
LTC4 ed i suoi metaboliti (LTD4, LTE4) causano vasocostrizione, broncospasmo e
aumento della permeabilità vasale.
I farmaci anti-infiammatori steroidei (cortisone e derivati) inibiscono la fosfolipasi A2 e, quindi, la produzione di prostaglandine, trombossani e leucotrieni.
PAF deriva dai fosfolipidi di membrana dei neutrofili, delle piastrine, dei monociti, dei basofili, delle cellule endoteliali etc per azione della fosfolipasi A2.
PAF determina vasocostrizione, broncospasmo, vasodilatazione ed aumento della permeabilità vasale (100-10.00 volte più potente dell’istamina).
Inoltre, PAF facilita l’adesione dei leucociti attraverso modificazioni conformazionali delle integrine, ha azione chemiotattica, induce la
degranulazione leucocitaria e il burst ossidativo.
Il Fattore Attivante delle Piastrine (PAF) agisce sulle cellule bersaglio interagendo con recettori specifici e stimola la produzione di ulteriori mediatori (es. prostaglandine).
Lo schema riportato sopra che raffigura la cascata dell’AA è una semplificazione di quanto accade in natura.
In effetti la complessità delle reazioni coinvolte nella cascata dell’acido arachidonico è molto più ampia e interessa la formazione di molti composti di cui, alcuni, ancora non si conosce la funzione biologica e l’eventuale ruolo patologico durante i processi infiammatori.
Recentemente l’importanza nutrizionale dell’acido arachidonico è stata ampiamente rivalutata in campo sportivo, specie negli sport prevalentemente anaerobici, al punto che oggi viene commercializzato come integratore destinato a massimizzare la crescita muscolare. A permettere questo “cambio di rotta” sono state incisive le ricerche di William Llewellyn (autore di Anabolic) le quali lo condussero a formulare una teoria: che l’integrazione di acido arachidonico potrebbe aiutare gli atleti di forza a sviluppare la massa muscolare.
Successivamente William Llewellyn espose la sua teoria (1) lanciando sul mercato l’acido arachidonico sotto forma di integratore.
Fortunatamente esistono alcuni studi scientifici che mostrano l’azione del AA su forza e massa muscolare.
I ricercatori dell’Università di Tampa presentarono un poster in occasione della riunione annuale della National Strength and Conditioning Association in Las Vegas, che mostrava uno studio sugli effetti dell’acido arachidonico su 15 atleti di forza, dopo che avevano assunto 1500mg di acido arachidonico al giorno per un periodo di 8 settimane.
Lo studio venne svolto dividendo i partecipanti in 2 gruppi; uno a cui venne somministrato AA e un altro a cui venne somministrato un placebo.
L’età media dei soggetti era di 20 anni, tutti i soggetti eseguirono lo stesso programma di allenamento 3 volte a settimana.
I soggetti che avevano preso l’acido arachidonico guadagnarono 1,5 kg di massa magra durante l’esperimento, mentre negli atleti ai quali era stato somministrato un placebo non si verificò praticamente nessun cambiamento.
Le scansioni mostrarono che nel gruppo “acido arachidonico” i quadricipiti dei soggetti erano cresciuti di 0,47 centimetri in spessore, mentre per il gruppo “placebo” il risultato era circa la metà di 0,47.
I soggetti del gruppo “acido arachidonico” avevano migliorato il loro 1rm nella Bench press e nel leg press di quasi 110 kg in più, mentre per il gruppo “placebo” l’incremento era stato inferiore di 76 kg.
I ricercatori conclusero che questi risultati suggeriscono che l’acido arachidonico può aumentare positivamente gli adattamenti di forza e ipertrofia del muscolo scheletrico nei soggetti allenati, negli atleti e negli individui che tutti i giorni cercano di massimizzare la loro composizione corporea, la forza e la potenza. L’AA potrebbe essere usato come aiuto ergogenico.(2)
In un altro studio (3), trenta maschi sottoposti ad allenamento di resistenza (età: 20.4 ± 2.1 anni) sono stati divisi casualmente in due gruppi: uno al quale veniva somministrato Acido Arachidonico e un altro al quale veniva somministrato un placebo (cioè CTL). Successivamente, entrambi i gruppi sono stati sottoposti a seguire 3 allenamenti a settimana per 8 settimane, seguendo un protocollo di allenamento non periodizzato. Lo spessore del muscolo quadricipite, attraverso scansione della composizione del corpo intero (DEXA), la forza muscolare e la potenza sono stati valutati al basale e post-test. Nel modello dei roditore, ratti maschi Wistar (~ 250 g, ~ 8 settimane di vita) sono stati pre-alimentati sia con AA o con acqua (CTL) per 8 giorni e sono stati alimentati con la dose finale di AA prima di essere acutamente allenati per la forza tramite stimolazione elettrica su flessioni plantari unilaterali. Un campione di muscolo misto è stato rimosso dalla gamba allenata e non allenata 3 ore post-esercizio.
la massa magra corporea (2,9%, p <0,0005), la forza della parte superiore del corpo (8,7%, p <0,0001), e il picco della potenza (12,7%, p <0,0001) sono aumentati solo nel gruppo AA. Per la sperimentazione animale, GSK-β (ser9) fosforilazione (p <0.001) indipendente dall’esercizio e la fosforilazione del AMPK dopo l’esercizio (p-AMPK meno di ARA, p = 0.041) erano diverse tra i topi alimentati con AA e quelli alimentati con CTL.
I ricercatori conclusero che i risultati suggeriscono che la supplementazione con AA può aumentare positivamente il potenziamento muscolare e gli adattamenti indotti in maschi sottoposti ad allenamenti di resistenza. Tuttavia, gli studi cronici a livello molecolare sono necessari per chiarire ulteriormente come l’AA combinato con l’allenamento per la forza influisca sul adattamento muscolare.
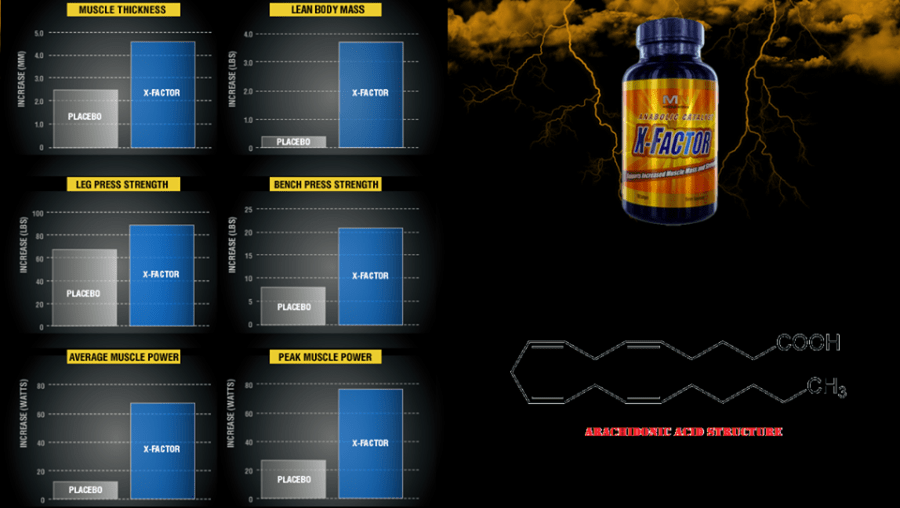
Nel 2005, il Laboratorio Exercise & Sport Nutrition presso la Baylor University ha condotto uno studio in doppio-cieco, placebo-controllato per determinare se 50 giorni di allenamento di resistenza combinati con la supplementazione di acido arachidonico (X-Factor ™) sarebbe stata capace di influenzare gli effetti dell’allenamento di 31 ragazzi con 1 anno di esperienza nell’allenamento di resistenza.
I risultati sono stati presentati alla conferenza dell’International Society of Sports Nutrition nel 15 Giugno 2006.
Tutti i soggetti avevano assunto un totale di quattro capsule ogni giorno (una capsula di 250 mg di AA) o placebo ogni quattro ore.
I soggetti che assumevano X-Factor avevano aumentato i loro carichi ad una media di 251lbs alla bench press in 50 giorni, che è stato un aumento del 45% superiore rispetto al gruppo placebo.
Il gruppo che assumeva acido arachidonico aveva “sovraperformato” il gruppo placebo nella:
– Potenza media (225 ° A>> placebo);
– Potenza Anaerobica (6000/0> placebo);
– Capacità del lavoro totale (250%> placebo).
Non sono stati segnalati effetti collaterali durante lo studio.
Come agente anabolico a breve termine, l’acido arachidonico andrebbe integrato con una dose variabile tra i 500 mg ed i 1.000 mg al giorno ( con capsule da 250 mg ).
Le dosi da 1.000 mg sono più comunemente usate nel Bodyweight.
l’AA viene comunemente “ciclato” similmente a come si fa usualmente con gli AAS, e viene assunto per un periodo di 7-8 settimane, seguito da un uguale periodo di tempo di non assunzione.
Come si è potuto leggere in precedenza, l’AA viene assunto in dosi variabili tra i 250mg 4 volte al giorno, ogni 4 ore fino ad arrivare ad un totale di 1000mg.
Tale metodo è sufficiente per notare guadagni in termini di massa muscolare, forza e potenza anaerobica.
A seconda delle diete individuali e fattori metabolici, questi guadagni possono essere accompagnati da una diminuzione del grasso corporeo.
L’acido arachidonico ha anche un effetto vasodilatatore, può infatti produrre un pompaggio maggiore con un allenamento intenso. Questo si verifica spesso entro due settimane dall’inizio della supplementazione.
L’acido arachidonico (X-Factor), spesso produce un aumento dei residui che si presentano post-allenamento, in pratica vengono prolungati i DOMS.
Per questo motivo i tempi di recuperi tra un allenamento e l’altro vengono leggermente prolungati, (forse è richiesto un ulteriore giorno di riposo) prima di dedicarsi all’allenamento successivo.
Ciò è dovuto ad una normale intensificazione della risposta fisiologica dopo l’allenamento, rappresenta un aumento della cascata anabolica (e del tasso di crescita muscolare).
Persone che presentano una minor massa muscolare possono provare più dolore a seguito della supplementazione, a causa di una maggior attività delle prostaglandine. (4)
Ricapitolando, l’AA è un acido grasso essenziale della famiglia degli omega 6, ed è una componente vitale delle membrane cellulari, rivestendo un ruolo importante nella risposta infiammatoria.
E’ particolarmente rilevante il suo apporto durante le fasi di crescita corporea, o di riparazione cellulare, ed è infatti una componente naturale e importante del latte materno.
Questa sostanza viene talvolta considerata qualcosa da evitare completamente per il semplice fatto che è “infiammatoria” ma, come sempre, questo punto di vista semplifica eccessivamente, e in modo drastico, ciò che si verifica effettivamente nel corpo. È infatti vero che l’AA gioca un ruolo nell’ambito dell’infiammazione, ma ciò va considerato un fatto positivo, se controllato.
L’AA permettere all’organismo di rispondere in modo appropriato ad un trauma fisico, e assicura anche che la risposta infiammatoria cessi quando non è più necessaria.
In alcuni studi epidemiologici i livelli più elevati nel plasma sia dell’AA che degli omega 3 sono stati associati con i più bassi livelli dei markers infiammatori (5).
Inoltre, studi clinici hanno rilevato che aggiungendo alla dieta fino a 1.200 mg di AA (il che corrisponde a un dosaggio 12 volte più elevato rispetto all’apporto medio giornaliero negli Stati Uniti) non provoca alcun effetto evidenziabile sulla produzione delle citochine infiammatorie (6), (7).
Infine è importante rilevare che la carne rossa contiene una concentrazione inferiore in AA rispetto a quella di altre carni, a causa del suo contenuto generalmente più basso in acidi grassi polinsaturi.
L’AA risulta essere un supplemento di grande efficacia anche nei protocolli OCT.
Gabriel Bellizzi
Riferimenti:
Wikipedia
1- http://www.google.com/patents/US20040102519
2- http://www.ncbi.nlm.nih.gov/
3- http://journals.plos.org/plosone/article?id=10.1371%2Fjournal.pone.0155153#sec022
4- Studio tratto dal libro di William Llewelyn, Anabolics 9° edition, pagina 440.
5- http://www.ncbi.nlm.nih.gov/pubmed/12821543
6- http://link.springer.com/article/10.1007/s11745-998-0317-4?no-access=true
7- http://link.springer.com/article/10.1007%2FBF02537187