Introduzione:
I capisaldi della gestione del peso sono gli interventi sullo stile di vita con il ruolo aggiuntivo di supporto dei farmaci anti-obesità e delle procedure bariatriche. Attualmente, i farmaci disponibili approvati per il trattamento dell’obesità agiscono sul bilancio energetico riducendo l’assunzione di cibo e il comportamento di ricompensa alimentare nel sistema nervoso centrale (ad esempio, sopprimendo l’appetito) o riducendo l’assorbimento dei grassi nell’intestino.[1,2,3] Finora non sono disponibili farmaci con un effetto diretto sull’aumento del dispendio energetico attraverso un’influenza sul tessuto adiposo [4,6].
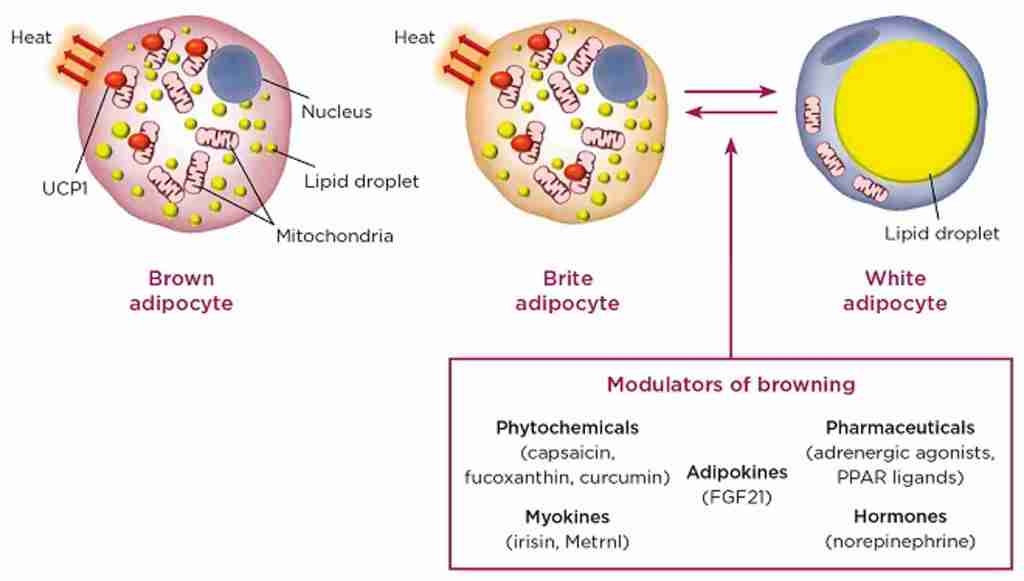
Nell’uomo esistono due tipi di tessuto adiposo con funzioni fisiologiche distinte: il tessuto adiposo bianco (WAT), specializzato nell’immagazzinamento di trigliceridi in eccesso quando l’assunzione di energia supera il dispendio energetico, e il tessuto adiposo bruno (BAT) – con i relativi adipociti “beige”/”bruni” (derivati dal WAT) – che svolge un ruolo centrale nel metabolizzare il glucosio, gli acidi grassi e altre sostanze chimiche per produrre calore attraverso l’attivazione della proteina di disaccoppiamento 1 (UCP1) specifica del tessuto termogenico [4,7].
Alcuni dati suggeriscono che il BAT possa essere funzionale nell’uomo adulto [1]. I recettori β3-adrenergici (AR) sono espressi non solo nella vescica urinaria, ma anche sulla superficie degli adipociti bruni e bianchi [1]. I tessuti adiposi bruni e “beige”, contenenti cellule grasse termogeniche, possono essere attivati da agonisti dei recettori β3-adrenergici (β3-AR) [8]. È stato riportato che il Mirabegron, un agonista β3-AR umano selettivo, può stimolare il BAT e il processo di imbrunimento degli adipociti derivati dal WAT [9,10]. Il fatto che l’attivazione del BAT e degli adipociti “beige” possa aumentare il dispendio energetico rende i tessuti adiposi bruni e “beige” nuovi e promettenti bersagli per il trattamento dell’obesità [4,11].
Il ruolo del tessuto adiposo nella termogenesi e nei processi metabolici associati all’obesità:
Nell’uomo esistono due tipi principali di tessuto adiposo, che svolgono funzioni diverse: il tessuto adiposo bianco e il tessuto adiposo bruno. Oltre al WAT e al BAT, sono state distinte anche cellule adipose “brune”, definite cellule adipose “beige”. Esse derivano dal WAT, ma la loro funzione metabolica è simile a quella del BAT [4,7].
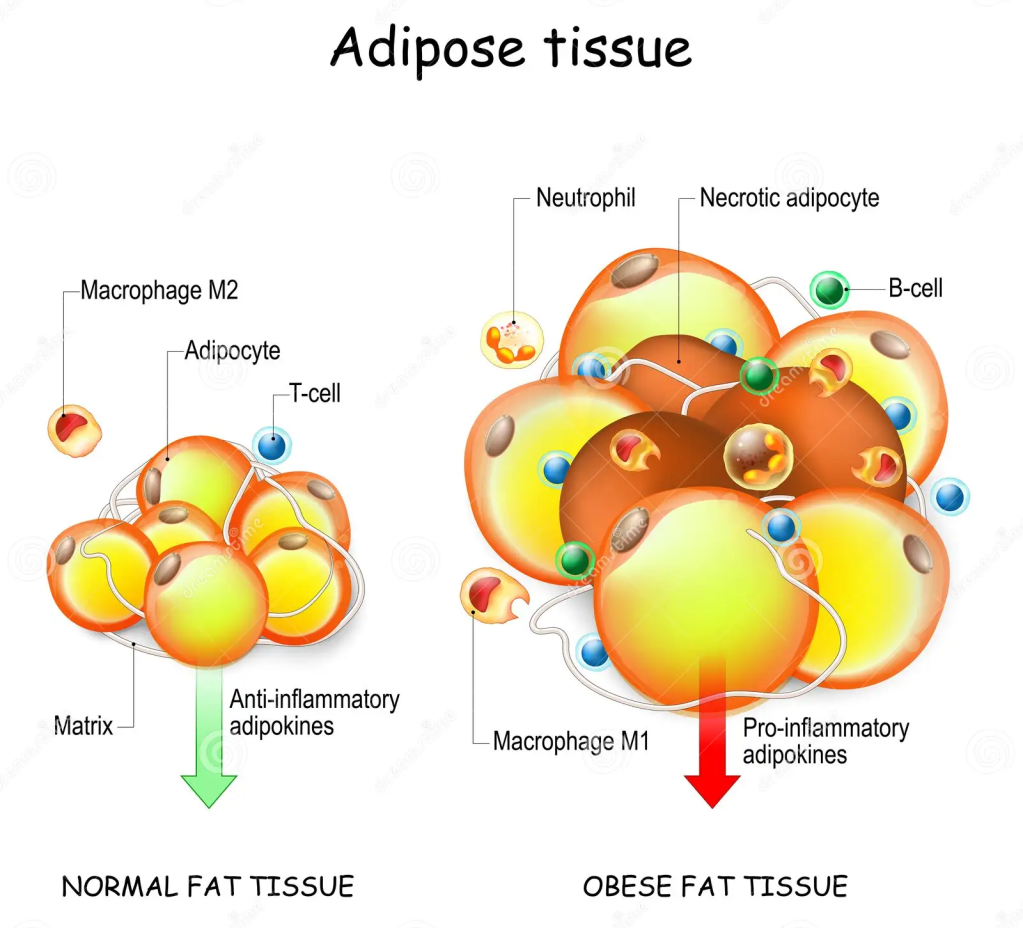
Il WAT è responsabile dell’immagazzinamento di energia sotto forma di trigliceridi, del rilascio di lipidi e della funzione di ghiandola endocrina, secernendo adipochine, come l’adiponectina e la leptina, per promuovere l’omeostasi metabolica [9,12]. Nell’obesità, gli adipociti bianchi si ipertrofizzano, seguiti da fibrosi, necrosi degli adipociti e infiltrazione di cellule immunitarie, che portano a infiammazione locale e sistemica, insulino-resistenza e disfunzione metabolica [9].
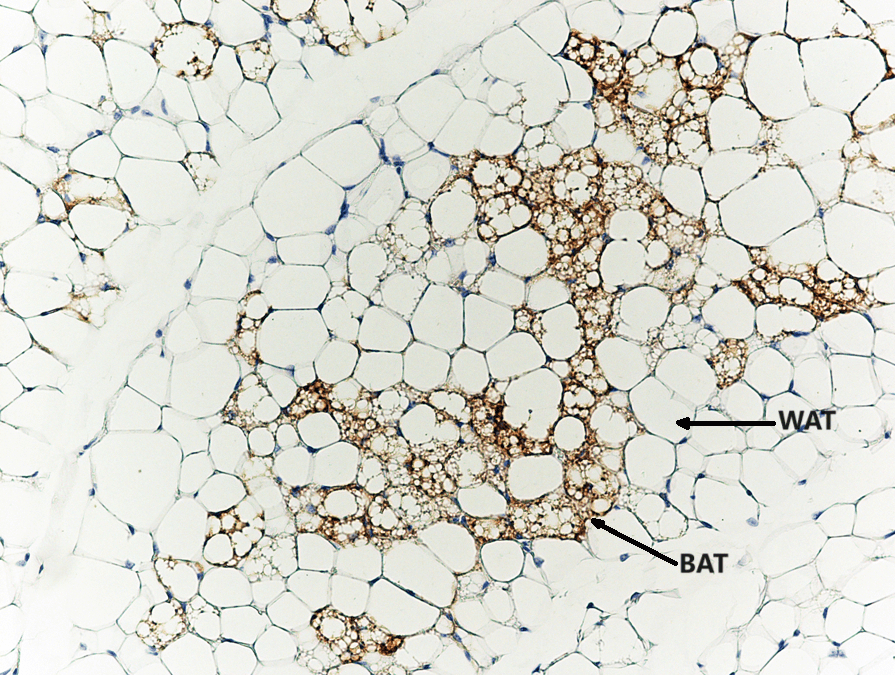
Il BAT è stato descritto per la prima volta nel 1981 in finlandesi che lavoravano all’aperto e che erano stati esposti a basse temperature ambientali [6]. Il BAT metabolicamente attivo è stato identificato negli adulti mediante imaging PET/CT focalizzato principalmente sulla fossa sopraclavicolare, sull’area succlavia e sull’ascella, seguito dalle aree mediastiniche, paraspinali, perinefriche e sopradrenali [10,12]. Sebbene il BAT sia presente nell’uomo, la sua prevalenza diminuisce con l’età e nelle persone in sovrappeso o obese rispetto ai soggetti magri [6,9,13,14]. Gli anelli mancanti nel trattamento dell’obesità sono i farmaci che possono aumentare la quantità o l’attività del BAT. È stato riportato che il volume del BAT può essere aumentato dopo la chirurgia bariatrica [12]. Il BAT è il principale organo termogenico dei mammiferi, con lo scopo di aumentare il dispendio energetico in risposta al freddo o ad altre stimolazioni nervose simpatiche, rilasciando noradrenalina dai terminali nervosi per attivare i recettori β3-adrenergici attraverso il processo definito termogenesi senza brividi [2,10,11,12,13]. La capacità termogenica del BAT è stata stimata in circa 500 W/kg [6]. Gli adipociti del BAT sono arricchiti di mitocondri (i loro livelli sono più alti di quelli del WAT), nei quali la proteina di disaccoppiamento 1 (UCP1) è altamente espressa. La UCP1 dissipa l’energia in eccesso sotto forma di calore in un processo noto come termogenesi [2,15]. L’attivazione adrenergica della lipolisi stimola l’attività termogenica della UCP1 [2,10]. L’attivazione dell’UCP1 sulla membrana mitocondriale interna disaccoppia la respirazione mitocondriale, separando il trasporto di elettroni dalla produzione di ATP per ossidare il substrato e generare calore [4,8,16]. Gli acidi grassi a catena lunga, generati dai pool lipidici intracellulari, sono trasportati ai mitocondri attraverso la carnitina palmitoiltransferasi 1 (CPT1) e utilizzati come fonte di carburante dagli adipociti bruni per produrre calore. Inoltre, è stato proposto che gli acidi grassi liberi agiscano come attivatori allosterici di UCP1. Oltre agli acidi grassi, anche il glucosio circolante può essere utilizzato dal BAT attivo per alimentare la termogenesi [2,10,17]. In sintesi, il BAT consuma glucosio e lipidi per generare calore attraverso la respirazione disaccoppiata mediata da UCP1, con conseguente miglioramento dell’omeostasi glucidica e lipidica [9,13,18].

Gli adipociti termogenici umani possono originare da due lignaggi distinti, non solo da adipociti bruni costitutivi ma anche da cellule “beige” reclutabili, definite adipociti “bruni” o “bruno-simili” [5]. Gli adipociti “beige” sono localizzati prevalentemente nei depositi di WAT [16]. Le cellule adipose del WAT possono essere convertite in adipociti “beige” termogenici in un processo chiamato “browning” o “beiging” [12]. Da un lato, è stato dimostrato un sostanziale “beiging” del WAT sottocutaneo umano in alcuni disturbi, come la cachessia da cancro, le ustioni e le condizioni con alti livelli di catecolamine, ad esempio il feocromocitoma [8,13,14]. I pazienti con tumori che secernono catecolamine hanno anche più tessuto adiposo bruno rispetto alla maggior parte delle persone [19]. D’altra parte, gli adipociti “bruni” possono essere attivati con l’induzione dell’espressione di UCP1 da parte di stimoli ambientali, come l’esposizione al freddo e agli agonisti β-adrenergici, mediata dalla via di segnalazione p38-MAPK [9,12,14,16]. La risposta “beiging” dei soggetti obesi al freddo è simile a quella dei soggetti magri [14]. Sebbene queste cellule differiscano dagli adipociti bruni convenzionali – in quanto si sviluppano da una cellula precursore di adipociti bianchi e non da una cellula precursore di adipociti bruni, simile agli adipociti bruni classici nel BAT – gli adipociti “beige” possiedono goccioline lipidiche multiloculari, un gran numero di mitocondri e marcatori unici di espressione genica del grasso bruno, come UCP1, aumentando la capacità del tessuto di ossidazione del carburante e il dispendio energetico [4,16,18]. Inoltre, è stato dimostrato che il “beiging” è associato a una riduzione della fibrosi del tessuto adiposo e della disfunzione adiposa. Questi risultati suggeriscono che l’induzione del tessuto adiposo “beige” può migliorare l’omeostasi metabolica aumentando la capacità del WAT sottocutaneo di funzionare come serbatoio metabolico per il glucosio e i lipidi o riducendo la disfunzione del WAT che si verifica con l’obesità [13]. Così, oltre alla termogenesi e al dispendio energetico, i tessuti adiposi bruni e “beige” sono associati a un miglioramento dell’omeostasi del glucosio e dei lipidi, nonché a una maggiore sensibilità all’insulina nell’uomo e nel topo [14].
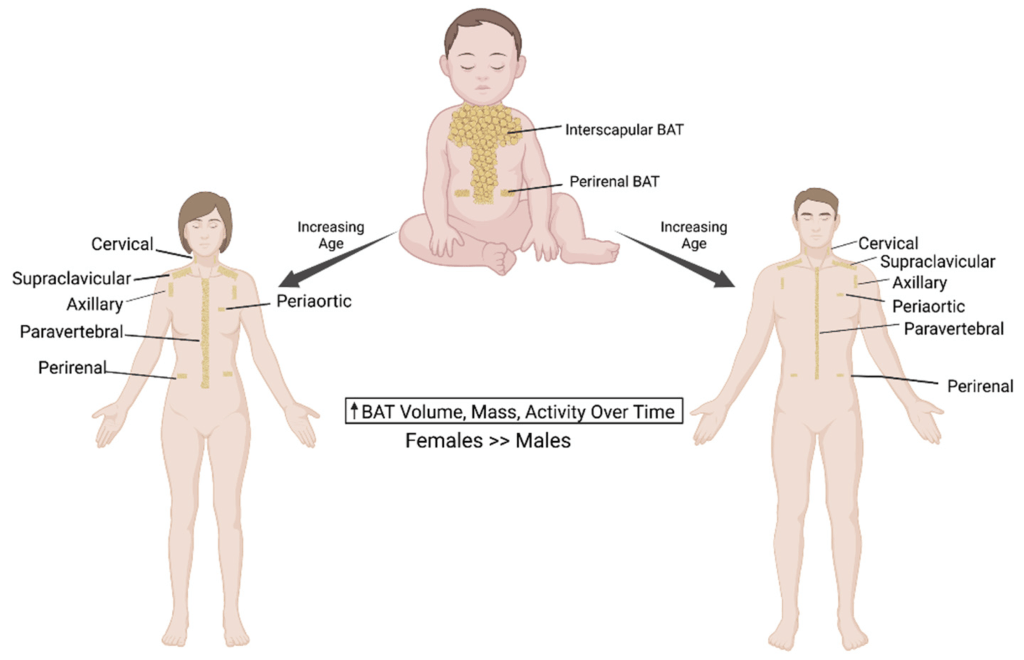
Considerando il fatto che nelle persone obese adulte c’è meno BAT rispetto ai soggetti magri, il WAT in eccesso, che può essere stimolante e in fase di “beigezzazione/imbrunimento”, può svolgere un ruolo aggiuntivo rispetto al BAT nei processi metabolici [13]. Pertanto, il tessuto adiposo bruno e il tessuto adiposo “beige” sono stati riconosciuti come regolatori critici del metabolismo e del dispendio energetico dell’intero corpo e sono considerati bersagli promettenti per la terapia anti-obesità [2,12,15].
L’Irisina è un ormone sintetizzato in grande quantità dal tessuto muscolare umano durante le attività sportive. La molecola è in grado di operare il meccanismo molecolare detto “browning” [“imbrunimento”], ovvero di conversione del WAT in BAT.
Il grasso bruno, il grasso “beige” e i β3-adrenocettori nel contesto dell’obesità:

La famiglia dei recettori β-adrenergici (AR) umani è composta dai recettori β1, β2 e β3, in cui il β1-AR è altamente espresso in tutto il sistema cardiovascolare, il β2-AR si trova nelle vie aeree polmonari, in tutta la vascolarizzazione e nel muscolo scheletrico e l’espressione del β3-AR è limitata soprattutto alla vescica urinaria e alla cistifellea, oltre che al BAT e al WAT [4,10]. Il β3-AR umano, identificato nel 1989, è un recettore a 7 membrane, con una coda N-terminale extracellulare e una coda C-terminale intracellulare, composta da 408 aminoacidi. Si accoppia principalmente a Gs per attivare l’adenilato ciclasi, con conseguente aumento dei livelli intracellulari di cAMP, sebbene sia stato riportato un accoppiamento promiscuo con altri effettori, come Gi [4,16].
La β3-AR svolge un ruolo critico nel tessuto adiposo, nella regolazione della termogenesi, della glicolisi e della lipolisi [16]. Studi sugli animali hanno dimostrato che la stimolazione cronica del BAT porta a un miglioramento della tolleranza al glucosio e della sensibilità all’insulina e a una riduzione dell’obesità, oltre che al rilascio di adipochine che regolano beneficamente il metabolismo [1,8,10,12,20]. Inoltre, l’attivazione β3-AR-mediata del WAT può aumentare la secrezione insulinica delle cellule β pancreatiche [5]. È stato anche riportato che una parte significativa della termogenesi non da brivido ha luogo nel tessuto adiposo bruno ed è mediata principalmente dal β3-adrenocettore [19]. Nei topi alimentati con dieta a base di chow e ad alto contenuto di grassi, il trapianto di BAT ha ridotto il peso corporeo, aumentato il metabolismo del glucosio e la sensibilità all’insulina e incrementato l’assorbimento di glucosio nel BAT e nel WAT [15].
Oltre alla funzione metabolica, la β3-AR svolge un ruolo nel cervello, essendo coinvolta nei processi di memoria, apprendimento e regolazione dell’appetito, nel tratto gastrointestinale, dove partecipa alla regolazione della motilità, e nel sistema genitourinario, dove svolge un ruolo nella regolazione della funzione vescicale [16].
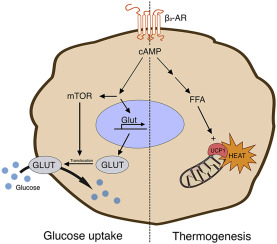
Durante la termogenesi, i β3-adrenocettori aumentano il dispendio energetico, che può portare alla perdita di grasso, in risposta alla stimolazione simpatica [19]. È dimostrato che la stimolazione cronica dell’attività nervosa simpatica e dei β3-AR può attivare il BAT [6]. È stato dimostrato che l’esposizione al freddo stimola il sistema nervoso simpatico a rilasciare noradrenalina dalle terminazioni nervose simpatiche per attivare i β-AR sulle membrane delle cellule del BAT, promuovendo la termogenesi. In questo modo, il BAT umano è in grado di avviare la termogenesi attraverso il consumo di acidi grassi e glucosio e, successivamente, di generare calore [1,3,8]. Inoltre, l’attivazione dei β3-ARs da parte dell’esposizione al freddo o di agenti farmacologici induce un programma di “beiging” nel WAT [18]. Un modo per aumentare la quantità effettiva di tessuto adiposo bruno può essere quello di somministrare l’agonista β3-adrenoccettore in modo cronico [19]. Una singola dose di agonista dei β3-adrenocettori può almeno raddoppiare il dispendio energetico in un modello murino a circa 21 °C [19].
Il ruolo dei β3-AR nel metabolismo energetico umano è supportato da studi clinici che riportano associazioni tra polimorfismi specifici nel gene umano ADRB3 (il gene che codifica i β3-AR) e tassi più elevati di obesità, insulino-resistenza e diabete [10]. Inoltre, le mutazioni nel gene ADRB3 sono state correlate all’insulino-resistenza, all’aumento del rischio di obesità e diabete e alla malattia del fegato grasso non alcolico negli individui obesi [10]. I dati indicano che il silenziamento di ADRB3 negli adipociti umani “marroni”/”beige” altera il macchinario termogenico cellulare e causa una riduzione dei livelli di espressione dei geni associati al metabolismo degli acidi grassi, alla massa mitocondriale e alla termogenesi, senza compromettere il fenotipo “marrone”/”beige” [10].
Attività agonista dei β3-AR del Mirabegron:
Mirabegron è una nuova generazione di agonisti dei β3-adrenocettori con una buona biodisponibilità [21]. Gli effetti dell’agonista selettivo dei β3-AR mirabegron sul rilassamento della vescica sono stati scoperti nel 2007. Per la prima volta, la selettività β3 del mirabegron (YM-178) nel contesto della funzione vescicale è stata descritta da Takasu et al. [22]. YM-178 ha aumentato l’accumulo di AMP ciclico in cellule ovariche di criceto cinese che esprimono il β3-adrenocettore umano. Mirabegron ha dimostrato valori di EC50 nanomolari contro il β3-AR umano in saggi biochimici, con una potente selettività rispetto ai β1- e β2-AR [22]. Studi in vivo hanno dimostrato che la somministrazione di mirabegron ha ridotto la pressione intravescicale e le contrazioni spontanee della vescica in modo dose-dipendente [23]. Mirabegron è stato approvato dalla Food and Drug Administration (FDA) statunitense nel 2012 come nuovo tipo di trattamento farmacologico per la vescica iperattiva (OAB) [6,21,24]. Cinquanta milligrammi di mirabegron è la dose raccomandata a tutti i pazienti con OAB [24]. Il farmaco è generalmente ben tollerato e gli effetti collaterali più comuni includono ipertensione, rinofaringite e infezione del tratto urinario [6].
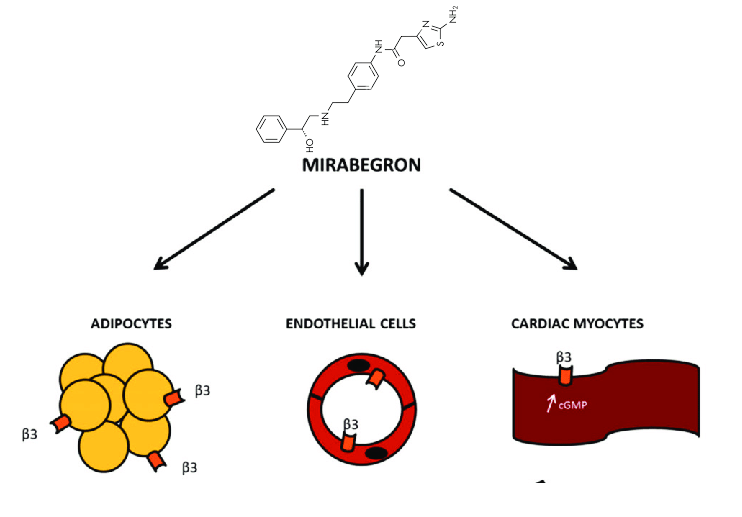
La selettività β3 di Mirabegron è stata confermata in molti studi con l’uso di linee cellulari che esprimono il β3-adrenocettore sia animale che umano [22,23,25]. Mirabegron ha mostrato una selettività per il β3-AR umano superiore di oltre 400 volte rispetto al β1-AR o al β2-AR umano [26]. Ad esempio, Brucker et al. [27] hanno utilizzato cellule di ovaio di criceto cinese (CHO)-K1, cellule di rene embrionale umano 293 esprimenti stabilmente recettori β1-, β2- o β3-adrenergici umani e recettori α1D- e α2B-adrenergici umani per valutare la selettività di mirabegron. A una concentrazione di 10 μM, l’attività β3-adrenergica rispetto all’isoproterenolo (agonista β-adrenergico completo) era dell’88% per mirabegron. A sua volta, l’attività β1- e β2-adrenergica di mirabegron era rispettivamente del 3% e del 15% [27]. In questo studio mirabegron non ha soddisfatto il criterio di significatività per l’inibizione dei recettori α1D- o α2B-adrenergici [27]. Tuttavia, alcuni studi hanno indicato che mirabegron potrebbe svolgere un ruolo come antagonista degli α1-adrenergici [28,29]. Alexandre et al. [28] hanno ipotizzato che mirabegron rilassasse la muscolatura liscia uretrale nei topi attraverso un duplice meccanismo che coinvolge l’attivazione dei β3-adrenocettori e il blocco degli α1-adrenocettori. In un altro studio, mirabegron ha indotto una vasorilassazione endotelio-indipendente nelle arterie del tessuto adiposo viscerale attraverso l’antagonismo degli α1-adrenocettori. Questa azione ha suggerito che mirabegron potrebbe migliorare efficacemente la perfusione del tessuto adiposo viscerale, favorendo così un sano rimodellamento del tessuto adiposo e prevenendo alcune delle conseguenze cardiometaboliche indesiderate dell’obesità e dell’invecchiamento [29]. Resta ancora difficile stabilire in che misura l’antagonismo degli α1-adrenocettori possa contribuire agli effetti clinici di mirabegron [28,29].
I cambiamenti metabolici benefici causati dal trattamento cronico con mirabegron potrebbero derivare dalla stimolazione della β3-AR nel BAT e nel WAT umani [5,12,18]. È stato suggerito che mirabegron potrebbe migliorare le malattie metaboliche legate all’obesità aumentando la termogenesi del BAT, la lipolisi del WAT e la stimolazione del processo di “brunimento” degli adipociti derivati dal WAT [4,5,9,10]. Il trattamento acuto con mirabegron ha aumentato il dispendio energetico [10,15]. Dopo il silenziamento dell’espressione dei β3-AR, il mirabegron non è stato in grado di stimolare la lipolisi e la termogenesi del BAT [10].
Molti studi hanno dimostrato che il trattamento con mirabegron ha aumentato l’assorbimento del glucosio negli adipociti bruni e “beige”, ha migliorato l’omeostasi del glucosio e ha aumentato la sensibilità all’insulina e la funzione delle cellule β [1,9]. Inoltre, è stato dimostrato che il trattamento cronico con agonisti β3-AR nell’uomo può rilasciare adipochine benefiche [1]. Il modo in cui mirabegron migliora il metabolismo del glucosio non è stato finora chiarito [5]. Tuttavia, sono stati ipotizzati alcuni meccanismi. In primo luogo, mirabegron stimola la secrezione di adiponectina, nota adipochina derivata dal WAT e associata a una maggiore sensibilità all’insulina nel muscolo scheletrico e nel fegato. In secondo luogo, mirabegron aumenta la concentrazione di polipeptide inibitore gastrico (GIP), l’incretina collegata alla secrezione di insulina. Infine, il meccanismo di mirabegron potrebbe coinvolgere le stesse cellule β [5].
L’agonista dei recettori β3-adrenergici è un ottimo candidato per il trattamento dell’obesità, poiché l’isoforma β3 è espressa esclusivamente negli adipociti e l’azione su altri tipi di cellule, come i cardiomiociti e le cellule muscolari lisce, attraverso le altre isoforme β – β1 e β2 – è minima e dose-dipendente [11]. Pertanto, come agonista β3-AR, Mirabegron attiverebbe la termogenesi nel tessuto adiposo, stimolando l’ossidazione dei lipidi e il consumo di glucosio per produrre calore, senza causare gravi effetti collaterali cardiovascolari [13].
Mirabegron come agente antiobesità negli studi sperimentali:
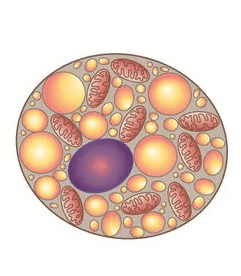
Il trattamento dei roditori con agonisti β3-AR ha attivato il BAT, con conseguente aumento del dispendio energetico, perdita di peso e miglioramento del metabolismo del glucosio e dei lipidi. Inoltre, ha ripristinato l’equilibrio NO/redox, migliorato la funzione endoteliale e, quindi, esercitato effetti protettivi vascolari [4,6,13,17]. L’aumento dell’attività del BAT ha impedito lo sviluppo e la gravità dell’obesità e del diabete di tipo 2, mentre i topi privi di BAT erano inclini all’obesità [16]. È stato riportato che una riduzione della massa del BAT nei topi indotta da un transgene produce obesità e che questi topi presentano un’ulteriore maggiore suscettibilità all’obesità a causa di diete obesitogene [8,30,31].

Come si è detto, il Mirabegron può essere efficace come attivatore del BAT, stimolatore delle cellule “beige” e controllore dell’omeostasi metabolica. L’influenza benefica di mirabegron sul metabolismo è stata confermata da studi in vitro e in vivo [2,4,15,18].
Nello studio condotto da Dehvari et al. [15], sono stati riportati gli effetti di mirabegron negli adipociti bruni, bianchi e “beige” in vitro e i suoi effetti sull’utilizzo del glucosio e sulla termogenesi in vivo. È stato dimostrato che mirabegron aumenta l’assorbimento di glucosio e la glicolisi negli adipociti bruni di topo in vitro e promuove l’assorbimento di glucosio nel BAT in vivo. Il mirabegron ha aumentato i livelli di cAMP e l’mRNA di UCP1, con conseguente aumento del consumo di ossigeno mediato da UCP1, nonché l’assorbimento di glucosio e la glicolisi cellulare negli adipociti bruni e “beige” (tale azione è mancata nelle colture cellulari primarie di adipociti bruni provenienti da topi knockout per il β3-adrenocettore), mentre questi effetti erano assenti o ridotti negli adipociti bianchi. In vivo, mirabegron ha aumentato il consumo di ossigeno nell’intero corpo e l’assorbimento di glucosio nel tessuto adiposo bruno e bianco inguinale e ha migliorato la tolleranza al glucosio. Nei topi knockout per il β3-adrenorecettore, mirabegron non è riuscito a indurre l’assorbimento di glucosio nel tessuto adiposo, né ad aumentare il consumo di ossigeno corporeo, il che dimostra che la segnalazione del β3-adrenorecettore è una via principale delle azioni metaboliche di mirabegron [15]. Analogamente a Dehvari et al. [15], Hao et al. [4] hanno studiato gli effetti anti-obesità di mirabegron utilizzando modelli in vitro e in vivo. In entrambe le linee cellulari – preadipociti bruni di topo e preadipociti bianchi 3T3-L1 – mirabegron ha stimolato l’espressione di UCP1. I topi trattati con mirabegron, alimentati con una dieta ad alto contenuto di grassi, presentavano una riduzione del peso corporeo e dell’adiposità, nonché un miglioramento della tolleranza al glucosio e della sensibilità all’insulina. Le goccioline lipidiche nel BAT dei topi trattati con mirabegron erano meno numerose e di dimensioni inferiori rispetto ai controlli. La colorazione H&E e l’immunoistochimica hanno indicato che mirabegron ha aumentato l’abbondanza di cellule “beige” nel WAT [4]. Si è concluso che mirabegron ha aumentato l’espressione di UCP1 e ha promosso la “brunitura” del WAT, che è stata accompagnata da un miglioramento della tolleranza al glucosio, della sensibilità all’insulina e della prevenzione dell’obesità indotta da una dieta ad alto contenuto di grassi [4]. In un altro studio su animali, Valgas da Silva et al. [18] hanno riferito che un trattamento di 2 settimane con mirabegron ha ridotto l’infiammazione, migliorato il metabolismo, impedito l’accumulo di grasso ectopico nel BAT e nel fegato e diminuito l’insulino-resistenza nei topi obesi (riduzione dell’indice HOMA e dei livelli di insulina). Mirabegron ha aumentato l’espressione di UCP1 nel BAT e il dispendio energetico, oltre a ridurre l’adiposità nei topi obesi. Inoltre, mirabegron ha ridotto i livelli circolanti di acidi grassi liberi, glicerolo e TNF-α. È noto che l’aumento dei livelli di FFA circolanti causa insulino-resistenza negli organi bersaglio dell’insulina ed è emerso come uno dei principali collegamenti tra l’obesità e lo sviluppo della sindrome metabolica. È noto anche che il TNF-α ha un effetto lipolitico, che determina un aumento dei livelli di FFA e glicerolo in circolo, contribuendo all’insulino-resistenza. Tuttavia, a differenza dello studio condotto da Dehvari et al. non sono stati riscontrati cambiamenti nel WAT inguinale: il mirabegron non ha indotto il “beiging” del WAT inguinale dei topi obesi. Inoltre, l’obesità indotta dalla dieta ha aumentato significativamente i depositi lipidici nel fegato e nel BAT, ma mirabegron ha parzialmente invertito questi cambiamenti, il che potrebbe indicare un ruolo protettivo di mirabegron nello sviluppo della steatosi epatica e dell’insulino-resistenza [18].
La conferma che mirabegron può essere utile come agente anti-obesità è stata trovata anche nello studio di Hao et al. [4]. È stato dimostrato che mirabegron provoca un aumento di 14 volte dell’espressione genica di UCP1 e può determinare una perdita di peso del 12% e una riduzione dell’adiposità nei topi obesi rispetto all’attività fisica.

La terapia combinata, composta da Mirabegron e Metformina, è stata verificata nel modello murino di prevenzione e nel modello murino di trattamento dell’obesità [2]. La metformina, un derivato della biguanide, è uno dei farmaci più comunemente utilizzati per il trattamento del diabete di tipo 2. Inibisce il complesso mitocondriale I, vitale per il trattamento dell’obesità. Inibisce il complesso mitocondriale I, vitale per il trasporto di elettroni, che porta all’attivazione dell’AMPK (proteina chinasi attivata dall’adenosina 5′-monofosfato). Di conseguenza, la produzione di ATP (adenosina trifosfato) diminuisce e la concentrazione intracellulare di ADP (adenosina difosfato) aumenta. Di conseguenza, i livelli cellulari di AMP (adenosina monofosfato) aumentano, attivando infine l’AMPK. L’AMPK è un regolatore chiave di numerose vie metaboliche, tra cui il metabolismo del glucosio e dei lipidi e l’omeostasi energetica. La metformina svolge anche un ruolo importante inibendo la segnalazione dei recettori dell’insulina e dell’IGF, con conseguenti cambiamenti nell’omeostasi metabolica [32]. Zhao et al. [2] hanno indicato che questa terapia complessa potrebbe essere un approccio promettente per la prevenzione e il trattamento dell’obesità, agendo contemporaneamente sull’assunzione e sul dispendio energetico, senza effetti collaterali sulla funzione cardiovascolare. Nel modello di prevenzione, metformina e mirabegron hanno provocato un’ulteriore riduzione del 12% e del 14% dell’aumento di peso corporeo indotto da una dieta ad alto contenuto di grassi, rispetto a metformina o mirabegron da soli, rispettivamente. Nel modello di trattamento, metformina e mirabegron hanno promosso in modo additivo una perdita di peso corporeo del 17% nei topi obesi indotti dalla dieta, superiore del 13% e del 6% rispetto a metformina e mirabegron da soli, rispettivamente. La terapia combinata ha avuto un effetto additivo sulla perdita di peso nei topi, associato a una significativa perdita di grasso, soprattutto nel WAT sottocutaneo [2]. I ricercatori hanno suggerito che l’effetto additivo di metformina e mirabegron sull’aumento del dispendio energetico abbia contribuito in modo determinante alla riduzione del peso corporeo e della massa grassa nei topi [2]. La terapia con metformina e mirabegron ha avuto un effetto additivo sulla termogenesi del BAT e sulla doratura del WAT sottocutaneo. La terapia combinata ha aumentato significativamente l’espressione di UCP1 nel BAT e nel WAT sottocutaneo [2]. Inoltre, metformina e mirabegron hanno migliorato la tolleranza al glucosio e la sensibilità all’insulina, e l’effetto era indipendente dall’assunzione di cibo. Tuttavia, la co-somministrazione di metformina e mirabegron non ha migliorato l’omeostasi del glucosio nei topi in misura maggiore rispetto alla metformina o al mirabegron da soli [2].

E’ interessante notare che la p-Sinefrina, una agonista selettivo dei β3-Adrenocettoiri di origine naturale, ha mostrato in studi su animali effetti positivi sull’imbrunimento del WAT, sopprimendo così l’obesità e la steatosi epatica.
Mirabegron come farmaco antiobesità: i dati degli studi sull’uomo:
Oltre agli studi sperimentali, esistono numerosi studi clinici in cui è stata dimostrata l’influenza di mirabegron sull’attività del BAT e sulla massa corporea. Gli autori hanno riferito che mirabegron ha portato a un aumento dell’attività del BAT e del dispendio energetico a riposo [1,3,5,10,17,21]. Prove preliminari suggeriscono che gli effetti del mirabegron sul metabolismo del glucosio, sul colesterolo HDL e sugli acidi biliari assomigliano a quelli ottenuti con un lieve esercizio fisico [1,5].
Nel primo gruppo di studi sono state testate soprattutto dosi elevate di mirabegron (100 mg, 150 mg o 200 mg) [1,3,5,17,21].
Cypess et al. [1] hanno usato, per la prima volta, Mirabegron per studiare il BAT umano e hanno confrontato la sua azione in un grado che corrispondeva alle risposte all’esposizione al freddo. La somministrazione di 200mg al giorno di Mirabegron orale per 12 settimane a 12 uomini sani è stata associata a una maggiore attività del BAT (misurata tramite tomografia a emissione di positroni 18F-fluorodesossiglucosio combinata con tomografia computerizzata) e all’aumento del tasso metabolico a riposo di 203 ± 40 kcal/die, rispetto agli individui che hanno ricevuto il placebo. È stato ipotizzato che la perdita di peso calcolata, associata al dispendio energetico, dovrebbe raggiungere i 5 kg nel primo anno e i 10 kg entro la fine dei 3 anni [1]. In questo studio, il dosaggio di 200 mg di mirabegron, una dose molto più alta di quelle attualmente approvate per ridurre i sintomi della vescica iperattiva, è stato generalmente ben tollerato, anche dopo 12 settimane di somministrazione orale giornaliera [1]. L’effetto collaterale più comune era la tachicardia [1].
L’alta dose di Mirabegron [100mg al giorno] è stata testata da O’Mara et al. durante un programma di terapia di 4 settimane su 14 donne sane di varie etnie [5]. Nell’endpoint primario, i ricercatori hanno riferito che la terapia cronica con Mirabegron ha aumentato il volume del BAT e l’attività metabolica, misurati tramite PET/CT con 18F-fluorodesossiglucosio [5]. Inoltre, le donne che avevano avuto principalmente meno BAT hanno finalmente raggiunto un aumento maggiore del volume e dell’attività del BAT dopo il trattamento [5]. Gli endpoint secondari hanno rivelato che la spesa energetica a riposo dell’intero corpo era più alta dopo il trattamento con mirabegron; tuttavia, non sono state riscontrate modifiche nel peso corporeo o nella composizione. Questi risultati dovrebbero essere associati a un intervallo di BMI ristretto e alla partecipazione di donne non obese. Inoltre, è stato riscontrato che la terapia con Mirabegron aumenta i biomarcatori delle lipoproteine come HDL e apolipoproteina A1, apolipoproteina E e peptide inibitorio gastrico (GIP), nonché i livelli di adiponectina, adipochina antidiabetica e antinfiammatoria. Dopo il trattamento con mirabegron, è stata osservata una riduzione del rapporto ApoB100/ApoA1, un biomarcatore del rischio cardiovascolare. Infine, dopo il trattamento cronico con mirabegron, un test di tolleranza al glucosio per via endovenosa ha rivelato una maggiore sensibilità all’insulina, efficacia del glucosio e secrezione di insulina [5]. Tuttavia, il cambiamento nella valutazione del modello omeostatico della resistenza all’insulina (HOMA-IR), una misura della resistenza all’insulina, non è stato significativo dopo il trattamento cronico con mirabegron. Gli autori hanno suggerito che la ragione principale dovrebbe essere il livello HOMA-IR quasi normale all’inizio dello studio [5]. Come è una preoccupazione comune nel trattamento cronico con agonisti adrenergici, 100mg di Mirabegron hanno portato a una variazione diurna della frequenza cardiaca tale che Mirabegron l’ha aumentata di più durante la notte rispetto a quando i soggetti erano svegli e in movimento. D’altra parte, il trattamento con Mirabegron non ha avuto alcun effetto sulla tolleranza all’esercizio [5].
Loh et al. [21] hanno riportato l’efficacia di varie dosi singole di mirabegron (50, 100, 150 e 200 mg) in un gruppo di 17 individui sani (11 uomini, 6 donne) che hanno assunto il farmaco in quattro giorni separati, con 3-14 giorni di wash-out tra ogni dose. Hanno riferito che la spesa energetica (misurata tramite calorimetria indiretta) è aumentata significativamente dopo le dosi da 100 mg e 200 mg e ha mostrato una tendenza all’aumento dopo le dosi da 150 mg, ma non era significativamente diversa dal basale in risposta a 50 mg di mirabegron. La temperatura cutanea sopraclaveare (come indicatore surrogato dell’attività BAT), è aumentata dopo le dosi di mirabegron da 50 mg, 100 mg e 150 mg, ma non era significativamente diversa dal basale in risposta a 200 mg. Considerando gli effetti collaterali, il cambiamento nella pressione sanguigna sistolica è stato significativo dopo le dosi da 150 mg e 200 mg rispetto alla dose da 50 mg e alla dose da 100 mg. Tuttavia, non c’era alcuna differenza nella pressione sanguigna diastolica tra le dosi da 50 mg, 100 mg, 150 mg e 200 mg. Il cambiamento nella frequenza cardiaca è stato maggiore dopo 200 mg rispetto alle dosi rimanenti. Hanno concluso che una dose da 100 mg di mirabegron può essere efficace per aumentare il dispendio energetico e la temperatura cutanea sopraclaveare in modo specifico per il recettore β3-adrenergico, senza gli aumenti significativi della pressione sanguigna o della frequenza cardiaca osservati a dosi più elevate [21].
Baskin et al. [17] hanno studiato le implicazioni cliniche del mirabegron in 12 uomini sani e magri a cui è stata somministrata la dose approvata di 50 mg e una dose elevata di 200 mg. Si è verificato un aumento più che proporzionale alla dose nell’attività metabolica del BAT (misurata tramite PET/CT). Rispetto al placebo, 50 mg di mirabegron hanno aumentato l’attività del BAT nella maggior parte dei soggetti. Tuttavia, l’attivazione del BAT con 50 mg è stata significativamente inferiore rispetto a quella con 200 mg. Solo la dose da 200 mg ha aumentato la spesa energetica a riposo (5,8%). La stimolazione cardiovascolare è stata coerente con studi precedenti, poiché 200 mg di mirabegron hanno aumentato sia la frequenza cardiaca che la pressione sanguigna.
Uno studio randomizzato, in doppio cieco, cross-over costituito da tre interventi (esposizione al freddo a breve termine (~2 h), mirabegron (dose singola da 200 mg) e placebo) in un gruppo di 10 uomini magri olandesi sud asiatici e 10 uomini magri europei, condotto da Nahon et al. [3], ha rivelato che l’esposizione al freddo e il mirabegron hanno indotto effetti metabolici benefici, tra cui un aumento della spesa energetica a riposo (misurata mediante calorimetria indiretta), livelli di acidi grassi liberi nel siero e ossidazione dei lipidi. Il mirabegron ha aumentato la frequenza cardiaca sia nei sud asiatici (+10 battiti/min) che nei caucasici bianchi (+7 battiti/min), mentre la pressione sanguigna sistolica e diastolica non sono cambiate in modo significativo [3]. È stato osservato che una singola dose di mirabegron ha aumentato i livelli di insulina nel siero senza influenzare i livelli di glucosio. Il mirabegron può stimolare il rilascio di insulina direttamente agendo sul β3-AR del pancreas o indirettamente attraverso un aumento degli FFA che possono stimolare il pancreas a rilasciare insulina [3].
L’azione dose-dipendente del mirabegron sul tessuto adiposo, inclusa l’influenza sull’attività BAT e sul dispendio energetico, può essere analoga all’effetto del mirabegron sulla vescica urinaria. L’attivazione dei recettori β3-adrenergici con mirabegron ha determinato risposte dei recettori β3-adrenergici dipendenti dalla concentrazione [27]. Per quanto riguarda la funzione della vescica, negli studi in vivo, la somministrazione di mirabegron ha ridotto la pressione intravescicolare e le contrazioni vescicali spontanee in modo dose-dipendente [23].
È stato riportato che dosi elevate di mirabegron (in particolare 200 mg al giorno), molto più elevate di quelle approvate dalla FDA per l’iperattività della vescica (50 mg al giorno), possono essere associate a effetti collaterali cardiovascolari come mal di testa, tachicardia e pressione sanguigna elevata (per lo più solo pressione sanguigna sistolica) [1,3,5,17,21]. L’aumento della pressione sanguigna sistolica può raggiungere ~10 mm Hg alla dose di 200 mg al giorno [21]. Questo è il risultato della perdita di selettività per il β3-adrenocettore a questa dose, tale che mirabegron attiva indirettamente i β1-adrenocettori che sono ampiamente espressi in vari organi, in particolare il sistema cardiovascolare. Questo meccanismo coinvolge l’assorbimento del trasportatore di noradrenalina del mirabegron nei terminali nervosi simpatici cardiaci, causando successivamente un rilascio di noradrenalina, che attiva i β1-adrenocettori [21]. Tuttavia, il trattamento con mirabegron non ha avuto effetti sulla tolleranza all’esercizio [5]. L’attivazione dei β1-adrenocettori può essere attenuata dalla co-somministrazione di propranololo o bisoprololo [16]. D’altro canto, gli studi clinici hanno rivelato che dosi di mirabegron fino a 100 mg al giorno per almeno 12 mesi hanno mostrato un buon profilo di sicurezza e non hanno determinato un aumento dell’incidenza di tachicardia, pressione sanguigna, alterazioni dell’ECG o eventi cardiovascolari [21]. Dosi terapeutiche inferiori (50 mg) nei pazienti con OAB hanno determinato piccole variazioni della frequenza cardiaca (1 battito al minuto) e della pressione sanguigna (1 mm Hg o meno). Considerando gli effetti collaterali cardiovascolari, il mirabegron non è raccomandato nei pazienti con grave ipertensione incontrollata (pressione sanguigna sistolica ≥ 180 mm Hg e/o pressione sanguigna diastolica ≥ 110 mm Hg) [16].
Nel secondo gruppo di studi, condotto da Finlin et al. [9,13,14], è stata testata una bassa dose di mirabegron, una che è stata approvata per il trattamento dell’OAB. In un gruppo di 13 pazienti obesi di mezza età, 50 mg di mirabegron al giorno durante una terapia di 12 settimane hanno indotto il “beiging” del tessuto adiposo bianco sottocutaneo, nonché un miglioramento della funzione delle cellule β. Mirabegron ha aumentato l’espressione proteica dei marcatori adiposi “beige” UCP1 (2,4 volte), della proteina transmembrana 26 (TMEM26) (4,2 volte) e dell’effettore A simile al DFFA che induce la morte cellulare (CIDEA) (2,4 volte) [13]. Il “beiging” del tessuto adiposo bianco sottocutaneo da parte di mirabegron può ridurre la disfunzione del tessuto adiposo, il che può migliorare la capacità ossidativa muscolare e può migliorare la funzione delle cellule β [13]. Prendendo in considerazione l’omeostasi del glucosio, il trattamento con mirabegron ha migliorato la tolleranza orale al glucosio, portando a convertire il prediabete in una normale concentrazione di glucosio, ha ridotto i livelli di emoglobina A1c e ha migliorato la sensibilità all’insulina e la funzione delle cellule β, senza influenzare la glicemia a digiuno o i livelli di insulina a digiuno e HOMA-IR. Tuttavia, i risultati delle pinze euglicemiche, che sono il gold standard per misurare la sensibilità all’insulina, hanno rivelato che il trattamento con mirabegron ha aumentato in modo coerente e significativo la velocità di infusione del glucosio di circa il 12% [13]. I livelli di lipidi plasmatici sono cambiati in modo significativo, ma, dopo il trattamento con mirabegron, è stata riscontrata una tendenza verso una riduzione del colesterolo totale [13]. Sfortunatamente, una terapia di 12 settimane non ha determinato un aumento significativo della quantità di BAT e del dispendio energetico a riposo, della perdita di peso o dei cambiamenti nella composizione corporea in tali pazienti [13].
L’effetto benefico del mirabegron, simile all’effetto dell’esposizione al freddo, sull’induzione del tessuto adiposo “beige” nel tessuto adiposo sottocutaneo umano è stato riportato anche in un altro studio condotto da Finlin et al. [14]. Hanno esposto al freddo i partecipanti alla ricerca magri e obesi o li hanno trattati con mirabegron. Il trattamento cronico con mirabegron (10 settimane; 50 mg/giorno) ha indotto UCP1 (3 volte) e TMEM26 (8,7 volte) nei soggetti obesi. Inoltre, l’espressione di UCP1 e dei marcatori degli adipociti “beige” è aumentata più che dopo 10 giorni di ripetuta esposizione al freddo [14].
Nello studio successivo, composto da 12 partecipanti obesi insulino-resistenti, Finlin et al. [9] hanno valutato la capacità del trattamento con pioglitazone (30 mg/giorno) o del trattamento con mirabegron (50 mg/giorno) in monoterapia, così come una combinazione di trattamento con pioglitazone (30 mg/giorno) e mirabegron (50 mg/giorno), di aumentare il grasso “beige” o migliorare ulteriormente il metabolismo del glucosio durante 12 settimane di terapia. Il pioglitazone è un attivatore PPARγ che può stimolare il BAT o “grasso beige”. Il trattamento con pioglitazone o la combinazione di pioglitazone e mirabegron hanno aumentato l’espressione del marcatore proteico del tessuto adiposo “beige” e migliorato la sensibilità all’insulina (misurata tramite clamp euglicemico, più efficace nella terapia combinata) e l’omeostasi del glucosio (inclusi test di tolleranza al glucosio migliorati, più efficaci nella terapia combinata), ma nessuno dei due trattamenti ha indotto il BAT o influenzato la spesa energetica nei soggetti obesi. Inoltre, non si è verificato alcun cambiamento significativo nel peso corporeo dopo il trattamento. Nonostante il fatto che mirabegron e pioglitazone somministrati separatamente abbiano indotto il “beiging” del tessuto adiposo, l’aggiunta di pioglitazone a mirabegron non ha migliorato il “beiging”, poiché il trattamento combinato ha prodotto un “beiging” inferiore rispetto a entrambi i farmaci somministrati singolarmente [9].
Sebbene i risultati preliminari degli studi sugli animali abbiano mostrato i benefici della co-somministrazione di mirabegron e metformina nella prevenzione e nel trattamento dell’obesità [2], a nostra conoscenza, l’influenza di tale terapia combinata non è stata verificata in relazione all’attività BAT, al dispendio energetico e alla perdita di peso negli esseri umani. È noto solo che non ci sono interazioni clinicamente significative tra metformina e mirabegron. Nello studio con 32 soggetti maschi sani (BMI: 18–30 kg/m2), mirabegron (160 mg somministrati una volta al giorno) non ha mostrato alcun effetto sulla farmacocinetica di metformina (500 mg somministrati due volte al giorno). La co-somministrazione di mirabegron con metformina ha determinato piccole modifiche nell’esposizione a mirabegron (AUC e Cmax diminuite del 21%). Le modifiche farmacocinetiche osservate non sono state considerate clinicamente rilevanti. Pertanto, non è necessario alcun aggiustamento del dosaggio di mirabegron quando viene co-somministrato con metformina [33].
Sebbene i dati confermino che una bassa dose di mirabegron può indurre il “beiging” del WAT sottocutaneo, è stato riportato che 50 mg di mirabegron durante il trattamento a breve termine (circa 12 settimane di terapia) non hanno alcun effetto sulla quantità di BAT, sul dispendio energetico a riposo e sulla perdita di peso. Pertanto, sono necessari studi clinici di lunga durata, con partecipanti obesi con una dose inferiore di mirabegron, per valutare se il “beiging” del tessuto adiposo si tradurrebbe in un miglioramento del dispendio energetico a riposo e in una significativa perdita di peso.
Conclusioni:

Il BAT metabolicamente attivo è stato correlato positivamente al miglioramento dell’energia, del glucosio e del metabolismo dell’intero corpo [34]. L’attivazione del BAT e l’induzione del processo di “browning” nel WAT sembrano essere un’interessante strategia terapeutica per aumentare la spesa energetica e migliorare il metabolismo. Il mirabegron, come agonista del recettore β3-adrenergico, si è rivelato efficace come attivatore del BAT, stimolatore delle cellule “beige” e regolatore dell’omeostasi metabolica sia negli studi sugli animali che negli esseri umani. Sebbene negli studi sugli animali la somministrazione di mirabegron abbia portato a un miglioramento dell’obesità, non è stata ancora dimostrata una significativa perdita di peso nei pazienti obesi dopo dosi elevate o basse del farmaco. Ciò può essere spiegato dalla durata troppo breve degli studi e dal numero esiguo di partecipanti agli studi. Inoltre, negli esseri umani, il trattamento più efficace per la stimolazione del BAT e del WAT è stato quello con dosi elevate di mirabegron; tuttavia, gli effetti collaterali cardiovascolari possono limitare l’uso di dosi superiori a quelle approvate dalla FDA per il trattamento della vescica iperattiva. Da un lato, considerando l’uso di dosi elevate di mirabegron, deve essere valutata la sicurezza a lungo termine in relazione al sistema cardiovascolare. In caso di attivazione aggravata dei recettori β1 miocardici, la somministrazione concomitante di 100-200 mg di mirabegron con un bloccante β1-AR può essere una strategia terapeutica utile per evitare effetti collaterali cardiovascolari. D’altro canto, dovrebbe essere valutato se dosi più piccole di mirabegron, ad esempio quelle approvate per la vescica iperattiva (50 mg al giorno), assunte per un periodo di tempo più lungo, saranno sufficienti a stimolare la crescita del BAT, l’imbrunimento del WAT e la termogenesi che può portare alla perdita di peso. Negli studi clinici riguardanti l’efficacia e la sicurezza del mirabegron nei pazienti con vescica iperattiva, l’influenza del mirabegron sul peso corporeo non è stata verificata. A nostra conoscenza, l’efficacia del mirabegron in relazione ai disturbi metabolici, inclusa l’obesità, nei soggetti trattati per vescica iperattiva, non è stata finora valutata.
Si potrebbe quindi ipotizzare che, il potenziale ruolo del Mirabegron nel trattamento o nella prevenzione dell’obesità dipenderebbe dai risultati della sua efficacia determinati da studi clinici a lungo termine. In caso di mancanza o insoddisfacente effetto dimagrante (rispetto ai farmaci attualmente disponibili approvati per il trattamento dell’obesità), il mirabegron potrebbe essere utilizzato per migliorare il profilo metabolico nei pazienti obesi. Se l’effetto dimagrante del mirabegron venisse confermato, il farmaco diventerebbe un’opzione alternativa agli attuali agenti anti-obesità, specialmente nei pazienti con controindicazioni o intolleranza ad altri farmaci. Inoltre, un aspetto interessante da valutare negli studi clinici sarebbe se la co-somministrazione di mirabegron e altri farmaci, come metformina, pioglitazone o altri farmaci anti-obesità attualmente utilizzati, potrebbe essere una strategia più efficace rispetto alla somministrazione di tali farmaci da soli per migliorare i profili metabolici o per trattare l’obesità. I benefici della co-somministrazione di mirabegron e metformina nella prevenzione e nel trattamento dell’obesità, dimostrati in studi sugli animali, devono essere confermati in ulteriori studi clinici. Sebbene i risultati preliminari della co-somministrazione di mirabegron e pioglitazone in partecipanti obesi non abbiano indicato alcuna influenza di tale terapia sul peso corporeo, devono essere eseguiti ulteriori studi per confermare questi risultati. Pertanto, l’introduzione di agonisti del recettore β3-adrenergico nel trattamento dell’obesità in futuro richiederà studi a lungo termine con un numero maggiore di soggetti per valutarne l’efficacia, la tollerabilità e la sicurezza.
I tessuti adiposi bruni e “beige” rimangono un bersaglio attraente per combattere le malattie metaboliche. Sono necessari ulteriori studi per confermare se la combinazione di agenti attivatori di BAT e “beige”, esercizi fisici e una dieta ipocalorica sana sarebbe una strategia di successo per ottenere la perdita di peso nei pazienti con obesità.

E per l’uso off-label nella ricomposizione corporea? I test in tal senso sono ancora scarsi e dal design spesso pessimo. Vi sono stati riscontri positivi, almeno preliminarmente parlando, con protocolli di 8-12 settimane a dosaggi di 75-100mg/die. Il dosaggio era stato settato partendo da 25mg/die per poi mantenere e osservare le risposte al dosaggio per qualche giorno [pressione, battito cardiaco ecc…]. L’uso del Mirabegron in ambito sportivo è tanto pionieristico come lo è quello dei tireomimetici. Ci vorranno ancora diversi studi per poter essere maggiormente certi di concreti vantaggi applicativi di questa molecola come PEDs.
Gabriel Bellizzi [CEO BioGenTech]
Riferimenti:
- Cypess, A.M.; Weiner, L.S.; Roberts-Toler, C.; Elia, E.F.; Kessler, S.H.; Kahn, P.A.; English, J.; Chatman, K.; Trauger, S.A.; Doria, A.; et al. Activation of human brown adipose tissue by a β3-adrenergic receptor agonist. Cell. Metab. 2015, 21, 33–38. [Google Scholar] [CrossRef]
- Zhao, X.Y.; Liu, Y.; Zhang, X.; Zhao, B.C.; Burley, G.; Yang, Z.C.; Luo, Y.; Li, A.Q.; Zhang, R.X.; Liu, Z.Y.; et al. The combined effect of metformin and mirabegron on diet-induced obesity. Med. Comm. 2023, 4, e207. [Google Scholar] [CrossRef]
- Nahon, K.J.; Janssen, L.G.M.; Sardjoe Mishre, A.S.D.; Bilsen, M.P.; van der Eijk, J.A.; Botani, K.; Overduin, L.A.; Ruiz, J.R.; Burakiewicz, J.; Dzyubachyk, O.; et al. The effect of mirabegron on energy expenditure and brown adipose tissue in healthy lean South Asian and Europid men. Diabetes Obes. Metab. 2020, 22, 2032–2044. [Google Scholar] [CrossRef]
- Hao, L.; Scott, S.; Abbasi, M.; Zu, Y.; Khan, M.S.H.; Yang, Y.; Wu, D.; Zhao, L.; Wang, S. Beneficial Metabolic Effects of Mirabegron In Vitro and in High-Fat Diet-Induced Obese Mice. J. Pharmacol. Exp. Ther. 2019, 369, 419–427. [Google Scholar] [CrossRef]
- O’Mara, A.E.; Johnson, J.W.; Linderman, J.D.; Brychta, R.J.; McGehee, S.; Fletcher, L.A.; Fink, Y.A.; Kapuria, D.; Cassimatis, T.M.; Kelsey, N.; et al. Chronic mirabegron treatment increases humaan brown fat, HDL-cholesterol and insulin sensitivity. J. Clin. Investig. 2020, 130, 2209–2219. [Google Scholar] [CrossRef]
- Hainer, V. Beta3-adrenoreceptor agonist mirabegron—A potential antiobesity drug? Expert Opin. Pharmacother. 2016, 17, 2125–2127. [Google Scholar] [CrossRef]
- Roberts-Toler, C.; O’Neill, B.T.; Cypess, A.M. Diet-Induced Obesity Causes Insulin Resistance in Mouse Brown Adipose Tissue. Obesity 2015, 23, 1765–1770. [Google Scholar] [CrossRef]
- Flier, J.S. Might β3-adrenergic receptor agonists be useful in disorders of glucose homeostasis? J. Clin. Investig. 2020, 130, 2180–2182. [Google Scholar] [CrossRef]
- Finlin, B.S.; Memetimin, H.; Zhu, B.; Confides, A.L.; Vekaria, H.J.; El Khouli, R.H.; Johnson, Z.R.; Westgate, P.M.; Chen, J.; Morris, A.J.; et al. Pioglitazone does not synergize with mirabegron to increase beige fat or further improve glucose metabolism. JCI Insight 2021, 6, e143650. [Google Scholar] [CrossRef]
- Cero, C.; Lea, H.J.; Zhu, K.Y.; Shamsi, F.; Tseng, Y.H.; Cypess, A.M. β3-Adrenergic receptors regulate human brown/beige adipocyte lipolysis and thermogenesis. JCI Insight 2021, 6, e139160. [Google Scholar] [CrossRef]
- Waki, H.; Yamauchi, T. Body-weight-independent glucose-lowering effect of the b3-adrenergic receptor agonist mirabegron in humans. J. Diabetes Investig. 2021, 12, 689–690. [Google Scholar] [CrossRef]
- Harb, E.; Kheder, O.; Poopalasingam, G.; Rashid, R.; Srinivasan, A.; Izzi-Engbeaya, C. Brown adipose tissue and regulation of human body weight. Diabetes Metab. Ress. Rev. 2023, 39, e3594. [Google Scholar] [CrossRef]
- Finlin, B.S.; Memetimin, H.; Zhu, B.; Confides, A.L.; Vekaria, H.J.; El Khouli, R.H.; Johnson, Z.R.; Westgate, P.M.; Chen, J.; Morris, A.J.; et al. The β3-adrenergic receptor agonist mirabegron improves glucose homeostatsis in obese humans. J. Clin. Investig. 2020, 130, 2319–2331. [Google Scholar] [CrossRef]
- Finlin, B.S.; Memetimin, H.; Confides, A.L.; Kasza, I.; Zhu, B.; Vekaria, H.J.; Harfmann, B.; Jones, K.A.; Johnson, Z.R.; Westgate, P.M.; et al. Human adipose beiging in response to cold and mirabegron. JCI Insight 2018, 3, e121510. [Google Scholar] [CrossRef]
- Dehvari, N.; Sato, M.; Bokhari, M.H.; Kalinovich, A.; Ham, S.; Gao, J.; Nguyen, H.T.M.; Whiting, L.; Mukaida, S.; Merlin, J.; et al. The metabolic effects of mirabegron are mediated primarily by β3-adrenoceptors. Pharmacol. Res. Perspect. 2020, 8, e00643. [Google Scholar] [CrossRef]
- Dehvari, N.; da Silva Junior, E.D.; Bengtsson, T.; Hutchinson, D.S. Mirabegron: Potential off target effects and uses beyond the bladder. Br. J. Pharmacol. 2018, 175, 4072–4082. [Google Scholar] [CrossRef]
- Baskin, A.S.; Linderman, J.D.; Brycha, R.J.; McGehee, S.; Anflick-Chames, E.; Cero, C.; Johnson, J.W.; O’Mara, A.E.; Fletcher, L.A.; Leitner, B.P.; et al. Regulation of Human Adipose Tissue Activation, Gallbladder Size, and Bile Acid Metabolism by a b3-Adrenergic Receptor Agonis. Diabetes 2018, 67, 2113–2125. [Google Scholar] [CrossRef]
- Pereas Valgas da Silva, C.; Calmasini, F.; Alexandre, E.C.; Raposo, H.F.; Delbin, M.A.; Monica, F.Z.; Zanesco, A. The effects of mirabegron on obesity-induced inflammation and insulin resistance are associated with brown adipose tissue activation but not beiging in the subcutaneous white adipose tissue. Clin. Exp. Pharmacol. Physiol. 2021, 48, 1477–1487. [Google Scholar] [CrossRef]
- Arch, J.R.S. Challenges in β3-adrenoceptor agonist drug development. Ther. Adv. Endocrinol. Metab. 2011, 2, 59–64. [Google Scholar] [CrossRef]
- Liu, X.; Pérusse, F.; Bukowiecki, L.J. Mechanisms of the antidiabetic effects of the beta 3-adrenergic agonist CL-316243 in obese Zucker-ZDF rats. Am. J. Physiol. 1998, 274, R1212–R1219. [Google Scholar]
- Loh, R.K.C.; Formosa, M.F.; Gerche, A.L.; Reutens, A.T.; Kingwell, B.A.; Carey, A.L. Acute metabolic and cardiovascular effects of mirabegron in healthy individuals. Diabetes Obes. Metab. 2019, 21, 276–284. [Google Scholar] [CrossRef] [PubMed]
- Takasu, T.; Ukai, M.; Sato, S.; Matsui, T.; Nagase, I.; Maruyama, T.; Sasamata, M.; Miyata, K.; Uchida, H.; Yamaguchi, O. Effect of (R)-2-(2-aminothiazol-4-yl)-4′-{2-[(2-hydroxy-2-phenylethyl)amino]ethyl} acetanilide (YM178), a novel selective beta3-adrenoceptor agonist, on bladder function. J. Pharmacol. Exp. Ther. 2007, 321, 642–647. [Google Scholar] [CrossRef]
- Igawa, Y.; Michel, M.C. Pharmacological profile of β3-adrenoceptor agonists in clinical development for the treatment of overactive bladder syndrome. Naunyn. Schmiedebergs. Arch. Pharmacol. 2013, 386, 177–183. [Google Scholar] [CrossRef] [PubMed]
- Krhut, J.; Martan, A.; Zachoval, R.; Hanus, T.; Svabik, K.; Zvara, P. Impact of body mass index on treatment efficacy of mirabegron for overactive bladder in females. Eur. J. Obstet. Gynecol. Reprod. Biol. 2016, 196, 64–68. [Google Scholar] [CrossRef] [PubMed]
- Hatanaka, T.; Ukai, M.; Watanabe, M.; Someya, A.; Ohtake, A.; Suzuki, M.; Ueshima, K.; Sato, S.; Sasamata, M. In vitro and in vivo pharmacological profile of the selective β3-adrenoceptor agonist mirabegron in rats. Naunyn. Schmiedebergs. Arch. Pharmacol. 2013, 386, 247–253. [Google Scholar] [CrossRef]
- Nagiri, C.; Kobayashi, K.; Tomita, A.; Kato, M.; Kobayashi, K.; Yamashita, K.; Nishizawa, T.; Inoue, A.; Shihoya, W.; Nureki, O. Cryo-EM structure of the β3-adrenergic receptor reveals the molecular basis of subtype selectivity. Mol. Cell. 2021, 81, 3205–3215. [Google Scholar] [CrossRef] [PubMed]
- Brucker, B.M.; King, J.; Mudd, P.N., Jr.; McHale, K. Selectivity and Maximum Response of Vibegron and Mirabegron for β3-Adrenergic Receptors. Curr. Ther. Res. Clin. Exp. 2022, 96, 100674. [Google Scholar] [CrossRef]
- Alexandre, E.C.; Kiguti, L.R.; Calmasini, F.B.; Silva, F.H.; da Silva, K.P.; Ferreira, R.; Ribeiro, C.A.; Mónica, F.Z.; Pupo, A.S.; Antunes, E. Mirabegron relaxes urethral smooth muscle by a dual mechanism involving β3 -adrenoceptor activation and α1 -adrenoceptor blockade. Br. J. Pharmacol. 2016, 173, 415–428. [Google Scholar] [CrossRef]
- De Stefano, A.; Schinzari, F.; Di Daniele, N.; Sica, G.; Gentileschi, P.; Vizioli, G.; Cardillo, C.; Tesauro, M. Mirabegron relaxes arteries from human visceral adipose tissue through antagonism of α1-adrenergic receptors. Vascul. Pharmacol. 2022, 146, 107094. [Google Scholar] [CrossRef]
- Lowell, B.B.; S-Susulic, V.; Hamann, A.; Lawitts, J.A.; Himms-Hagen, J.; Boyer, B.B.; Kozak, L.P.; Flier, J.S. Development of obesity in transgenic mice after genetic ablation of brown adipose tissue. Nature 1993, 366, 740–742. [Google Scholar] [CrossRef]
- Hamann, A.; Flier, J.S.; Lowell, B.B. Decreased brown fat markedly enhances susceptibility to diet-induced obesity, diabetes, and hyperlipidemia. Endocrinology 1996, 137, 21–29. [Google Scholar] [CrossRef] [PubMed]
- Lv, Z.; Guo, Y. Metformin and its benefits for various diseases. Front. Endocrinol. 2020, 11, 191. [Google Scholar] [CrossRef] [PubMed]
- Groen-Wijnberg, M.; van Dijk, J.; Krauwinkel, W.; Kerbusch, V.; Meijer, J.; Tretter, R.; Zhang, W.; van Gelderen, M. Pharmacokinetic Interactions Between Mirabegron and Metformin, Warfarin, Digoxin or Combined Oral Contraceptives. Eur. J. Drug Metab. Pharmacokinet. 2017, 42, 417–429. [Google Scholar] [CrossRef] [PubMed]
- Bel, J.C.; Tai, T.C.; Khaper, N.; Lees, S.J. Mirabegron: The most promising adipose tissue beiging agent. Physiol. Rep. 2021, 9, e14779. [Google Scholar] [CrossRef]
