Introduzione:
Il collagene (o collageno) è la principale proteina fibrosa del tessuto connettivo negli animali. È la proteina più abbondante nei mammiferi (circa il 25% della massa proteica totale), rappresentando nell’uomo circa il 6% del peso corporeo.
Il collagene, quindi, è il componente strutturale primario di tutti i tessuti connettivi (principalmente collagene di tipo I per ossa, tendini e legamenti; e principalmente collagene di tipo II per la cartilagine). L’attività del collagene di tipo III riflette la crescita e il turnover dei tessuti molli; è ampiamente distribuito nelle fibrille interstiziali dei tessuti molli, compresi tendini e legamenti, fascia, nonché nella matrice extracellulare (ECM) e nei suoi strati (ad esempio, l’endomisio) che avvolgono le parti costitutive dei gruppi muscolari e che contengono vari fattori di crescita coinvolti nella funzione e nella crescita del muscolo scheletrico.
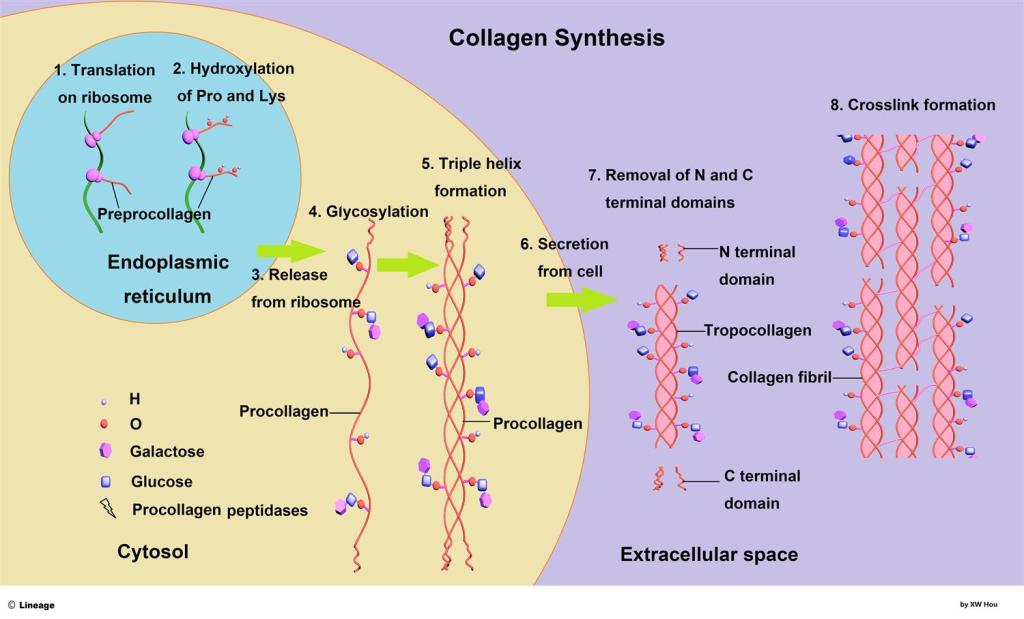
Il metabolismo del collagene comprende i processi biochimici che regolano la sintesi, la degradazione e il ricambio dei tessuti molli che sono costituiti principalmente da collagene. I tessuti connettivi del nostro corpo sono in uno stato costante di equilibrio e flusso. Il metabolismo del collagene mantiene l’integrità strutturale e la funzione di articolazioni, ossa, tendini e legamenti del corpo. Gli enzimi e le vie di segnalazione regolano questi processi di sintesi, scomposizione e ricambio.
Il procollagene, la proteina madre del collagene, è sintetizzata e secreta dai fibroblasti. Le molecole di procollagene sono costituite da 3 filamenti proteici disposti a tripla elica. Il procollagene lascia la cellula con estensioni protettive alle estremità per prevenire la formazione prematura di collagene. La scissione dei prolungamenti tramite enzimi porta alla formazione di collagene attivo che si allinea con altre molecole di collagene.
Punto chiave: La misurazione di questi enzimi (cioè dei marcatori) fornisce un’indicazione del metabolismo del collagene. Un aumento o una diminuzione dei livelli di alcuni enzimi indica la sintesi netta di collagene (ad esempio, di tipo I), mentre una diminuzione o un aumento dei livelli di alcuni enzimi indica la degradazione netta di collagene (ad esempio, di tipo I).
Una microfibrilla è un’unità di filamenti di collagene disposti in parallelo. Sono le subunità delle fibre di collagene. Le fibre sono disposte in fasci. I legami incrociati tra le molecole di collagene adiacenti nei fasci di collagene sono legami chimici forti che garantiscono l’integrità e un robusto reticolo di tessuti connettivi che supportano lo scheletro nella locomozione.
Il collagene di tipo I è particolarmente importante per le modifiche del contenuto minerale osseo e della densità minerale ossea (BMC/BMD).
Il collagene di tipo III è particolarmente importante per i cambiamenti nella ECM, nei tendini, nei legamenti e nei tessuti connettivi:
- Trasmissione della forza dal sarcomero all’osso (aumento della forza)
- Recupero da lesioni muscoloscheletriche, in particolare quelle che coinvolgono la matrice di collagene.
- Prevenzione di lesioni muscoloscheletriche da uso eccessivo o acute (aumentando il rapporto forza-fatica).

In generale gli AAS influenzano il metabolismo del collagene. AAS sovrafisiologici:
- ↑ PIIINP sierica [in maniera dose-dipendente]
- ↑ urina HP:LP
– Dosi elevate di AAS aumentano il metabolismo del collagene dei tessuti molli, senza variazioni nel riassorbimento osseo. [1].
Cessazione (“cycling-off”) d’uso degli AAS:
- ↓ ICTP sierico [in funzione del tempo]. [1].
Marker del metabolismo del collagene:
- Tendine ( marker metabolici del collagene)
Il propeptide N-terminale del procollagene di tipo III (PIIINP) è un marker della biosintesi delle fibrille interstiziali nei tessuti molli. Il PIIINP è stimolato dall’allenamento pliometrico nei tendini e dagli AAS in generale, dove la rigidità va a vantaggio della velocità, ma l’aumento della forza muscolare deve compensare l’aumento del rischio di strappi muscolari dovuto all’eccessiva rigidità dei tendini.
-Aumenta in modo dose-dipendente con gli AAS a concentrazione sovrafisiologica.
- Ossa e tendini (“marker metabolici del collagene”)
Procollagene di tipo I C-terminale propeptide (PICP): rilasciato in circolo dagli osteoblasti proliferanti durante la biosintesi del collagene, è quindi in gran parte un biomarcatore della formazione di collagene osseo, sebbene vi sia anche un certo contributo da parte del collagene di tipo I nei tessuti molli. [2].
Telopeptide reticolato del collagene di tipo I (ICTP): rilasciato in circolo durante la fase osteoclastica della modellazione e del rimodellamento osseo (disgregazione dell’osso/collagene). [2].
-Diminuisce con la sospensione di AAS sovrafisiologici (“cycling-off”) in modo dipendente dal tempo.
Dpyr: marcatore urinario della degradazione del collagene di tipo I. [2].
Sia l’ICTP che il Dpyr costituiscono legami incrociati piridinolinici formati nel collagene maturo di tipo I e le loro concentrazioni nel siero e nelle urine riflettono il riassorbimento osseo. [2].
- Ossa (“marker metabolici del collagene”)
Fosfatasi alcalina ossea (ALP): proteina presente nelle cellule ossee della placca di crescita epifisaria e negli osteoblasti maturi. È irrilevante per le dimensioni o la forza muscolare. [2].
HP (PYD): idrossilisilpiridinolina; riflette il turnover dei collageni di tipo I (osso), II, III e IX; presente in tendini, cartilagini, ossa, pareti dei vasi e dentina. [2].
LP (DPD): lisilpiridinolina; riflette il turnover del collagene di tipo I (osso); presente nell’osso e nella dentina.
Esiste un declino associato all’età di HP (↓), LP (↓) e del rapporto HP/LP (↓).
HP:LP (urina) esclude il metabolismo cutaneo (utile). [2].
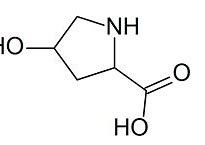
L’HP e l’LP urinari sono marcatori potenzialmente più utili del catabolismo delle fibre di collagene dei tessuti scheletrici rispetto all’idrossiprolina urinaria. Quest’ultima ha un profilo di specificità inferiore poiché si trova in tutti i tipi di collagene di tutti i tessuti connettivi (compresa la pelle). Inoltre, può anche essere rilasciata dalle molecole di collagene prima della loro incorporazione nelle fibrille e una grande percentuale di idrossiprolina viene metabolizzata nel fegato, eludendo così l’analisi quantitativa del riassorbimento del collagene maturo mediante misurazioni urinarie. [3].
Un rapporto HP:LP più basso può riflettere una maggiore proporzione relativa di riassorbimento osseo rispetto al turnover del collagene e della cartilagine, poiché il collagene osseo è la fonte primaria di LP, mentre l’HP riflette i tessuti molli in generale (eccetto la pelle)… suggerisce che anche il riassorbimento del collagene di tipo III (più HP rispetto al tipo I) diminuisce con l’età. [3].
-Aumenta con gli AAS sovrafisiologici.
Il picco di massa ossea e di HP:LP si verifica all’età di 27 anni. [3].
Ossa:
- Cellule ossee
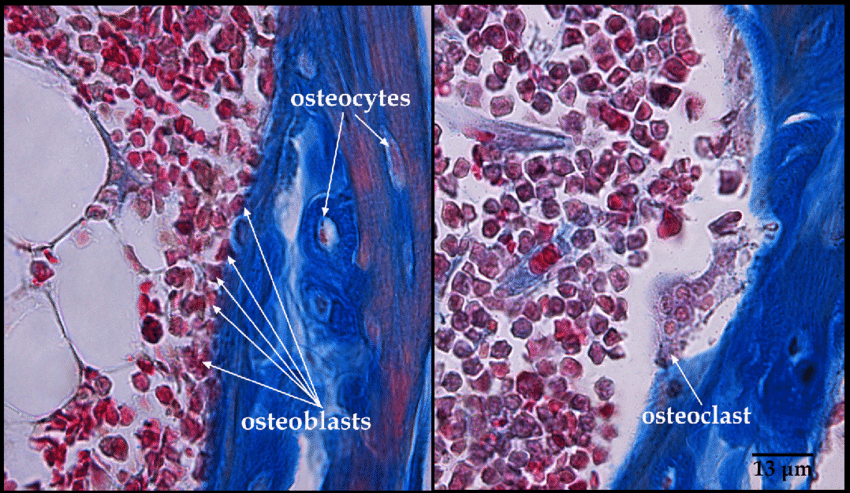
Osteoprogenitori: Cellule osteogeniche che si sviluppano in osteoblasti.
Osteoblasti: Formano l’osso; producono ECM ossea e mineralizzano l’osso (mononucleati).
Osteociti: Cellule ossee mature; secernono enzimi per mantenere l’osso.
Osteoclasti: Degradano l’osso (distruzione dell’osso invecchiato).
- Metabolismo osseo
La formazione ossea osteoblastica è associata alla deposizione di collagene di tipo I, seguita dalla mineralizzazione e dalla maturazione, durante le quali si formano legami incrociati stabili tra le fibrille di collagene. [4].
Osteocalcina (siero): Riflette la formazione ossea (così come il procollagene di tipo I [siero]).
Deossipiridinolina (urina): Riflette il riassorbimento osseo. [4].
Tendini e legamenti:
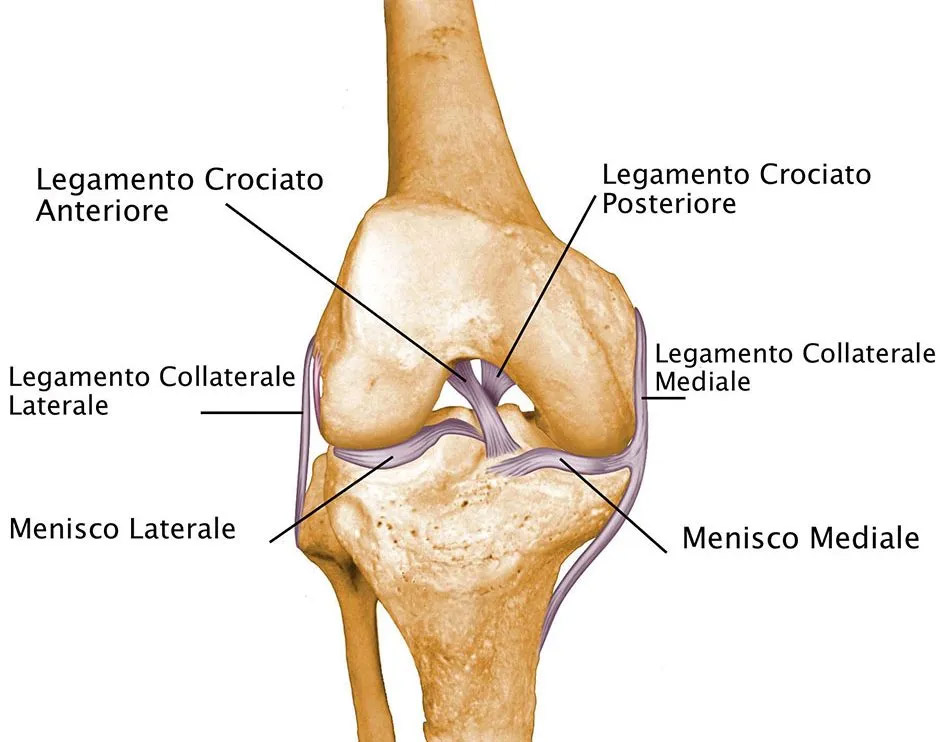
Il tendine è un tessuto connettivo che collega l’osso al muscolo, mentre il legamento è un tessuto connettivo che collega l’osso all’osso. In entrambi, circa ¾ del peso secco è costituito da collagene: la maggior parte è di tipo I: 60% (tendine) e fino all’85% (legamento).
La struttura relativamente (quasi totalmente) avascolare e collagena di legamenti e tendini limita il loro potenziale rigenerativo, con conseguenti complicazioni mediche sostanziali, che spesso rendono necessario un intervento chirurgico dopo una lesione traumatica.
I tendini e i legamenti maturi contengono relativamente poche cellule. Il numero ridotto di cellule metabolicamente attive comporta un fabbisogno di ↓O₂ e di nutrienti. I legamenti contengono fibre di elastina e collagene.
Le proprietà meccaniche di tendini e legamenti sono funzione di:
- Densità delle fibre di collagene
- Diametro
- Orientamento e
- Reticolazione
-Legami incrociati enzimatici, formati dall’ossido di lisile (LOX)
-Legami incrociati non enzimatici attraverso gli AGE (advanced glycation end-products), formati da una reazione di Maillard senza enzimi specifici tra uno zucchero e un amminoacido.
-Entrambi i legami incrociati aumentano la rigidità di tendini e legamenti. [5].
- Adattamenti dell’allenamento
Il metabolismo del tendine è molto più lento di quello del muscolo a causa della sua ridotta vascolarizzazione e circolazione, e l’aumento del flusso sanguigno al muscolo scheletrico attraverso l’esercizio fisico non è parallelo alla stessa perfusione del flusso nel tendine. [6].
L’ipertrofia muscolare è correlata a un aumento del numero e delle dimensioni dei fibroblasti, con conseguente aumento dell’apporto totale di collagene. L’attivazione dei fibroblasti e la successiva crescita del tessuto connettivo sono i prerequisiti dell’ipertrofia [7], in modo che il contenuto di collagene sia mantenuto in proporzione alla massa muscolare.
La rigidità del tendine si riferisce alla trasmissione della forza per unità di sforzo, o allungamento del tendine. L’aumento della rigidità del legamento è una buona cosa (✓), poiché la rigidità è utile per mantenere la stabilità dell’articolazione e il rischio di lesioni. Al contrario, poiché il tendine collega l’osso rigido al muscolo cedevole, un tendine più rigido non è sempre vantaggioso:
- In termini di prestazioni: ↑La rigidità (tendine) trasmette più velocemente le forze muscolari all’osso, con conseguente ↑ prestazione; tuttavia,
questo interesse deve essere bilanciato dal potenziale di concentrazione delle deformazioni all’interno del muscolo: - La maggiore deformazione (“stiramento”) prodotta in un determinato movimento si concentra nel muscolo collegato a un tendine rigido ⇒ contrazione isometrica piuttosto che nel tendine che si allunga in modo flessibile mentre il muscolo si contrae.
Un tendine rigido non si allunga; piuttosto, è costretto ad allungarsi durante la contrazione (eccentrica), pertanto un muscolo collegato a un tendine rigido subisce un carico eccentrico maggiore per un determinato movimento e presenta un rischio maggiore di lesioni. [5].
Effetti degli androgeni sul tendine:
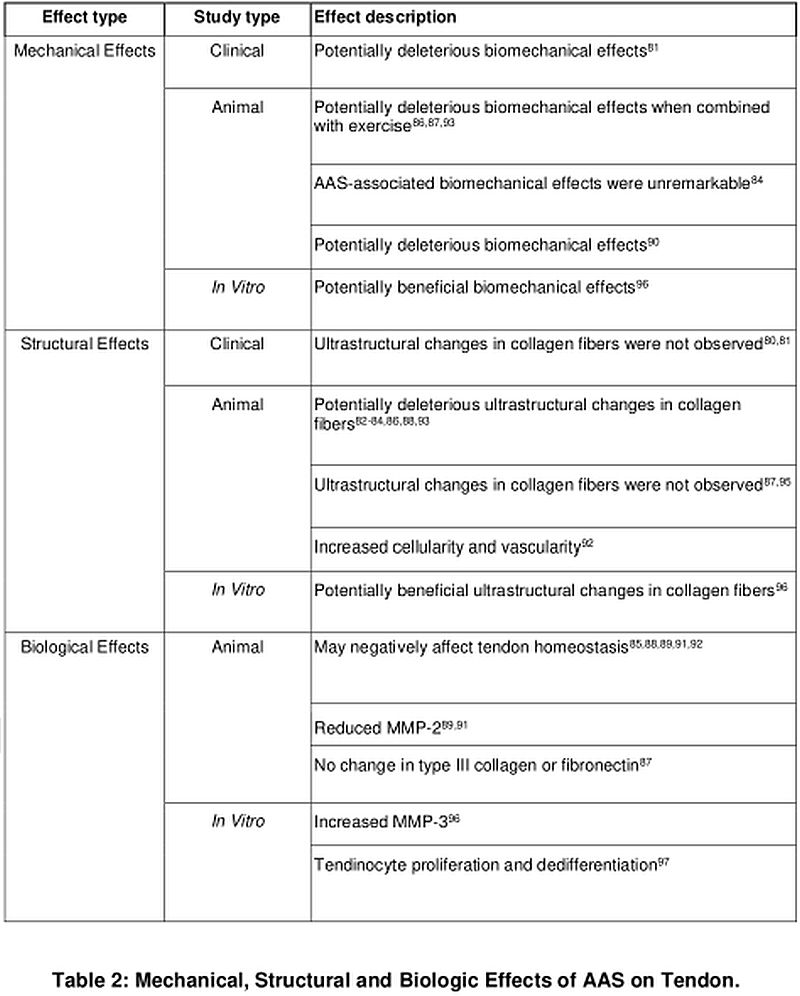
Tabella che descrive le prove degli effetti meccanici, strutturali e biologici degli AAS sul tendine. [9].
Il risultato di questa tabella mostra che gli effetti degli AAS sul tendine, e soprattutto sull’unità muscolo-tendinea, non si prestano a una descrizione univoca o a una conclusione univoca, ma presentano sfumature dovute all’eterogeneità dei dati. Gli AAS migliorano e ostacolano diversi elementi della struttura e della funzione del tendine.
In sintesi, le conclusioni pratiche che si possono trarre dalla letteratura sugli effetti degli AAS sul tendine sono le seguenti:
- Gli effetti biomeccanici potenzialmente deleteri degli AAS possono essere transitori.
- Gli AAS somministrati per via sistemica e locale possono avere effetti simili sui tendini.
- Esistono notevoli lacune nelle conoscenze relative a:
-Lesioni/patologia del tendine
-Risposta alla dose
-Risposta al farmaco (la maggior parte degli studi utilizza il nandrolone; alcuni il metandienone)
-Cosomministrazione
-Tempistica e
-Popolazione di risposta (differenze legate al sesso e all’età). - Effetti specifici sui tessuti:
-È probabile che gli AAS influenzino in modo diverso il metabolismo dei tendini, dei muscoli e della fibrocartilagine (sintesi/degradazione netta), ma finora non sono stati condotti studi per caratterizzare queste differenze. [9].
Articolazioni:
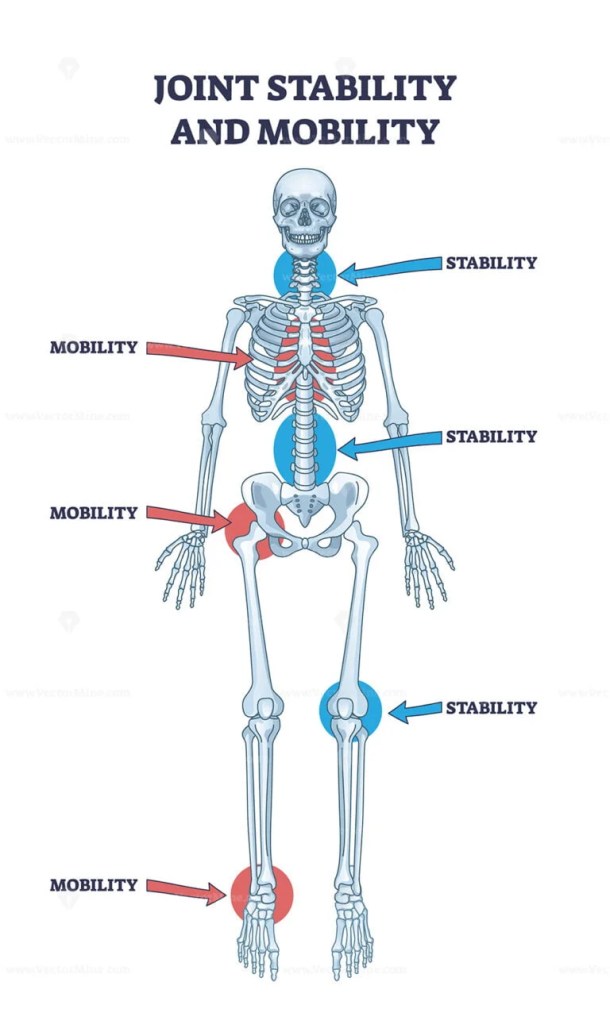
Le articolazioni del corpo sono i punti in cui le ossa si incontrano (articolazione) e che consentono la locomozione umana (i muscoli tirano le ossa sulle articolazioni per muovere il corpo). Le articolazioni sono costituite da ossa, tendini (che collegano le ossa ai muscoli) e legamenti (che collegano le ossa alle ossa). È possibile classificare le articolazioni secondo vari schemi (ad esempio, funzionale, strutturale). Questo articolo si concentrerà sulle articolazioni sinoviali dell’organismo, che comprendono l’anca, il ginocchio, la spalla e il gomito. Oltre a essere composte da ossa, tendini e legamenti, queste articolazioni contengono cellule sinoviali, un tipo di cellula che contiene una membrana di rivestimento che produce il liquido sinoviale. Il liquido sinoviale lubrifica e nutre l’articolazione, riduce l’attrito e fornisce ammortizzazione tra le superfici articolari. È importante notare che questa lubrificazione e questo nutrimento dipendono dalla produzione di proteine e fattori di crescita.
Gli effetti degli AAS sulle articolazioni non sono descritti in modo esaustivo, ma esistono studi sui singoli composti che verranno esaminati in seguito per approfondire i particolari AAS e i loro effetti sulle articolazioni. I potenziali meccanismi con cui gli AAS influenzano le articolazioni riguardano in generale gli effetti sul metabolismo, sul ricambio, sulla scomposizione e sulla sintesi del collagene, gli effetti sul C1-INH e la funzione delle articolazioni sinoviali.
C1-INH:
- Inibitore della C1-esterasi; SERPING1
Il C1-INH è un inibitore della proteasi multi-serina che controlla diverse vie catalitiche, tra cui l’attivazione dei componenti classici.
Gli androgeni attenuati – AAS che possiedono una potenza androgena relativamente ridotta – qui discussi, l’Oxandrolone e lo Stanozololo, entrambi 17AA, inducono la produzione intrinseca di C1-INH e il ↑catabolismo (cioè la scomposizione) della bradichinina.
La bradichinina, attraverso la sua azione sul B₂R, media la vasodilatazione e aumenta la permeabilità con conseguente angioedema. L’angioedema ereditario (HAE), per estensione, deriva da ↓C1-INH. L’HAE è una condizione che può essere trattata con androgeni attenuati.
Quando il C1-INH è ridotto, si verifica una permeabilità vascolare (sottocutanea e sottomucosa) (“angioedema”) dovuta alla ↑bradichinina (che il C1-INH attenua) [a causa degli effetti sul sistema di contatto classico e sull’attivazione del complemento che esulano dallo scopo di questo articolo]. [10].
Gli androgeni regolano l’espressione genica della C1-INH e l’aminopeptidasi P plasmatica (che catabolizza le chinine) (55, 56). [10].
Gli androgeni attenuati (17AA) aumentano in modo più potente la produzione epatica di C1-INH [23] per azione diretta a livello epatico piuttosto che per azione dell’AR di per sé ⇒ ↑C1-INH e C4 (a causa dell’inversione dei livelli secondariamente depressi di C4). [11].
I complessi C1/C1-INH si formano quando C1-INH si combina e rimuove C1r e C1s dal C1 attivato e questi complessi – rappresentativi dell’attivazione della via del complemento classica – sono associati a condizioni artritiche e reumatologiche. [12]. Ciò può contribuire alla reputazione di Stanozolol, in particolare, di causare dolori articolari.
Punto chiave: L'”angioedema acquisito senza focolai” può essere causato da farmaci, di cui gli ACE-inibitori (nello 0,1-2,2% dei consumatori, più numerosi negli africani) sono i responsabili più comuni. L’ACE è necessario per la degradazione della bradichinina e la sua inibizione può provocare un accumulo di bradichinina che causa l’angioedema. Gli androgeni possono in qualche misura sopprimere l’angioedema grazie ai loro effetti sulla C1-INH. In un articolo di prossima pubblicazione di questo autore si discutono i rischi della diffusione di farmaci antipertensivi, soprattutto ACE inibitori e ARB, per i bodybuilder sani che fanno uso di AAS in assenza di ipertensione cronica, e si affronta la questione particolare (e apparentemente controversa) della diminuzione (blunting) dell’ipertrofia indotta dagli ACE inibitori.
Molecole:
- Nandrolone

Meccanismi putativi che migliorano i sintomi del dolore articolare:
- Aumento della sintesi e del deposito di collagene nei tendini e nei legamenti.
- Ritenzione del liquido sinoviale articolare.
Entrambi i meccanismi (aumento della produzione di collagene, ad esempio nei tendini flessori) e la ritenzione di liquido articolare sinoviale possono essere influenzati positivamente dal sistema renina-angiotensina (RAS). Il RAS regola l’equilibrio idrico ed elettrolitico, la crescita delle cellule del tessuto connettivo e il metabolismo del tessuto connettivo lasso e denso e dei siti di riparazione dei tessuti. [13]. Dal punto di vista patologico, l’attivazione del RAS aumenta la vascocostrizione, l’ipertrofia cardiaca e la fibrosi (con conseguente infarto del miocardio e fibrosi del fegato). [13]. Pertanto, è importante considerare la dualità del potenziale aumento dell’articolazione (cioè del tendine estensore del ginocchio) con l’uso di nandrolone: si può avere un beneficio transitorio nel rimodellamento del tendine (cioè del tendine estensore), ma attraverso questo stesso meccanismo, si possono accumulare disadattamenti fibrotici o cardiaci.
Quindi, per quanto riguarda i potenziali benefici transitori: L’enzima di conversione dell’angiotensina I (ACE) è un marcatore positivamente correlato all’attività dell’mRNA del collagene di tipo I e può riflettere il rimodellamento della matrice extracellulare (ECM) in cui la sintesi di collagene supera la degradazione.
Il Nandrolone aumenta l’attività ACE e incrementa la deposizione di collagene di tipo I nella matrice. In un modello di allenamento (ad esempio, pliometrico), Nandrolone + allenamento per i salti >> allenamento per i salti > sedentario per quanto riguarda l’attività ACE nel tendine (ad esempio, estensore del bicipite femorale), suggerendo una potenziale sinergia tra allenamento e Nandrolone a questo proposito. Si consideri, tuttavia, che questa stessa via è implicata nel rimodellamento del tessuto cardiaco e nell’azione patologica. Inoltre, l’aumento della rigidità tendinea rappresenta un rischio se non si aumenta la forza per ridurre la probabilità di lesioni gravi dovute a uno sforzo concentrato. Pertanto, le considerazioni sull’allenamento devono essere pianificate in modo rigoroso, soprattutto se si pratica l’allenamento pliometrico. [13].
- Oxandrolone
L’aumento significativamente maggiore della velocità di crescita in altezza ottenuto con il trattamento con GH più oxandrolone rispetto al solo GH si è riflesso in differenze simili nella risposta precoce dell’ALP ossea e del PICP, entrambi associati alla formazione dell’osso, ma non nel PIIINP, un marcatore del turnover dei tessuti molli, o nell’ICTP, un marcatore della degradazione del collagene osseo. Ciò suggerisce che l’oxandrolone può, direttamente o indirettamente, influenzare la proliferazione degli osteoblasti e la proliferazione e maturazione dei condrociti, con un effetto additivo rispetto a quello del solo GH. [2].
La reputazione del nandrolone di migliorare la funzione articolare durante le fasi di allenamento con carichi pesanti è rafforzata da questi risultati, secondo cui, aumentando l’attività dell’ACE e influenzando il RAS, serve ad aumentare la sintesi netta di collagene e l’equilibrio dei fluidi nelle articolazioni.
I risultati di Crofton et al. suggeriscono che GH+oxandrolone > GH+test > GH > placebo nel ΔPIINP, ma le differenze significative tra i gruppi potrebbero non essere misurabili a causa delle ridotte dimensioni del campione (un potenziale errore di tipo 2). [2].
La somministrazione di oxandrolone fino a 24 mesi a pazienti pediatrici gravemente ustionati ha migliorato significativamente il contenuto minerale osseo dell’intero corpo (WB BMC), il contenuto minerale osseo della colonna lombare (LS BMC), la densità minerale ossea della colonna lombare (LS BMD) e la velocità in altezza. [14].
Una grave ustione induce una risposta ipermetabolica e ipercatabolica caratterizzata da un aumento del lavoro cardiaco, del dispendio energetico a riposo e della degradazione delle proteine muscolari (1-6). Questa risposta compensatoria è accompagnata da un’elevata produzione epatica di glucosio e da insulino-resistenza (4, 5, 7-10). I pazienti in genere subiscono una perdita di massa magra e nei bambini la crescita è ostacolata. Nel tempo si verifica una significativa riduzione del contenuto minerale osseo (BMC), della densità minerale ossea (BMD) e del tessuto adiposo. [14].
Gli effetti sulla BMC/BMD sono diventati significativi in questi pazienti solo dopo più di un anno di trattamento continuo. [14]. Nei pazienti pediatrici è stata riscontrata una sinergia in questo effetto modulato dalla fase di maturazione della crescita, che potrebbe avere ramificazioni per l’uso in età adulta di rhGH e androgeni aromatizzanti, associati all’impennata puberale. L’ipotesi che si potrebbe trarre è che l’uso a lungo termine di androgeni aromatizzanti (ad esempio, T, nandrolone) in combinazione con dosi elevate di rhGH possa imitare alcuni aspetti della fase di maturazione della crescita nei bambini, potenzialmente aumentando la BMC e la BMD in modo sinergico in combinazione con l’oxandrolone se usato per lunghi periodi.
I particolari effetti dell’oxandrolone sul contenuto e sulla densità minerale ossea nei bambini in crescita suggeriscono che sia particolarmente utile nella fase iniziale (cioè i primi sei mesi) dell’uso continuo di RhGH, quando il turnover osseo è aumentato.
- Stanozololo

Lo Stanozololo, popolarmente associato al dolore articolare (“articolazioni doloranti e secche”), agisce sui fibroblasti sinoviali, precursori delle cellule che compongono le articolazioni sinoviali (ad esempio, anca, ginocchia, spalle), inibendo la sintesi del DNA. [10]. Mentre lo Stanozololo è considerato particolarmente potente nello stimolare l’attività della procollagenasi nel cuoio capelluto, un effetto che è associato all’aumento della secrezione di TGF-β1 [15] – stimolando così l’attività procollagene, ma inducendo perversamente, con questo stesso meccanismo, l’alopecia androgenica nel cuoio capelluto – l’effetto sulla cellula sinoviale è qualitativamente diverso.
L’inibizione della sintesi del DNA da parte dello Stanozololo nella cellula sinoviale, insieme ai suoi effetti sul C1-INH, fornisce diverse modalità esplicative per il fatto che provoca dolore nelle articolazioni sinoviali.
Alla fine del 1980 ricercatori britannici hanno scoperto che le cellule della pelle producono più collagene quando viene usato lo Stanozololo, ma che le cellule delle articolazioni non lo fanno [https://www.ncbi.nlm.nih.gov/pubmed/2556901].
- Testosterone
Il testosterone (250 mg a settimana) ha causato modesti aumenti dei biomarcatori del metabolismo del collagene, aumentando il PINP del 28%, l’ICTP del 22% e il PIINP del 70%. [16]. Il testosterone ha aumentato il tipo I (osso; PINP, ICTP) e il tipo III (tendini e legamenti, tessuti molli; PIINP) e ha potenziato in particolare l’effetto dell’rhGH sui marcatori di tipo III (PIINP), suggerendo un forte effetto modulante del testosterone sul collagene di tipo III che comprende tendini, legamenti e probabilmente fasce in risposta al GH. [16].
- rhGH
La somministrazione di rhGH nel tendine o nel legamento determina un marcato aumento del metabolismo del collagene con conseguente deposito netto. [17]. L’RhGH aumenta l’attività dell’osteocalcina e del procollagene di tipo I nel siero, riflettendo un aumento della BMD/BMC. Nel muscolo scheletrico e nel tendine la matrice extracellulare (ECM) conferisce importanti proprietà di trazione ed è di fondamentale importanza per la rigenerazione dei tessuti dopo una lesione. [10]. La somministrazione di rhGH promuove la sintesi di collagene ECM nel tessuto muscolo-tendineo di giovani adulti sani.
L’RhGH ha aumentato l’mRNA del collagene I (osso) di 2,3 volte e del collagene III (ECM, tendini, legamenti) di 2,5 volte. [10]. È stata osservata una tendenza ad un aumento di 5,8 volte della sintesi proteica del collagene muscolare. [10]. Il dosaggio utilizzato è stato di 33,3 µg * kg-¹ * giorno-¹ nei primi sette giorni e di 50 µg * kg-¹ * giorno-¹ in giovani uomini sani. [10]. Ciò equivale a una dose giornaliera di 3 – 4,5 UI di rhGH per un uomo di 90 kg.
Nella popolazione GHD si osserva una variazione bifasica (a due punte) della BMD in risposta alla somministrazione di rhGH, con una diminuzione iniziale a circa sei mesi dall’inizio della terapia, seguita da un successivo aumento dopo almeno un anno di trattamento. [18]. L’ipotesi prevalente è che il GH stimoli sia la formazione che il riassorbimento osseo, con conseguente aumento del turnover osseo. [18]. Questo effetto è evidente almeno nei primi sei mesi di somministrazione di rhGH, con conseguente diminuzione della BMD e del contenuto minerale osseo. [18]. Non è stata stabilita una relazione dose-risposta a causa dell’ampia variazione dei dosaggi utilizzati. [18]. Sembra che l’osso trabecolare (colonna vertebrale lombare) abbia una diversa sensibilità al GH rispetto all’osso corticale (collo del femore). [18].
L’RhGH si combina almeno in alcuni aspetti con gli androgeni (ad esempio, oxandrolone, testosterone) e in altri in modo sinergico per quanto riguarda il metabolismo dei tessuti molli. L’RhGH e il testosterone, se usati in combinazione, stimolano particolarmente la PIINP, suggerendo un effetto sinergico su tendini, legamenti e probabilmente fasce.
Conclusioni
Gli AAS hanno effetti di classe e specifici sulle articolazioni e sui tessuti connettivi che le compongono. In generale, gli AAS migliorano il metabolismo dei tessuti molli senza alcun effetto sul riassorbimento osseo, ma è importante considerare i vari effetti positivi e negativi degli AAS nei confronti dei tendini.
Gli androgeni aromatizzanti, come il testosterone, hanno effetti sinergici (più che additivi) in combinazione con il GH su alcuni aspetti del metabolismo del collagene, in particolare per quanto riguarda gli aspetti legati al metabolismo dei tessuti molli (ad esempio, la fascia), ed effetti additivi per altri aspetti.
I 17AA non aromatizzabili Oxandrolone (un 5α-androstan-3-one) e Stanozololo (un AAS il cui anello A ha una giunzione anulare pirazolica) condividono alcuni effetti di classe, ad esempio la stimolazione della produzione intrinseca di C1-INH che è associata a condizioni reumatologiche e artritiche, ma lo Stanozololo si distingue per la sua dimostrabile inibizione dose-dipendente della sintesi di DNA nelle cellule sinoviali che comprendono le principali articolazioni del corpo, modulando la disgregazione del tessuto connettivo. È stato dimostrato che l’Oxandrolone aumenta in modo additivo la densità minerale ossea (BMD/BMC) e può essere particolarmente utile nei primi sei mesi di inizio di un ciclo di androgeni aromatizzanti e rhGH per migliorare la conservazione della massa ossea.
Punto chiave: Un approccio sfumato al processo decisionale sul carico dell’allenamento (ad esempio, progressione, intensità, modalità) e sugli effetti dei farmaci (ad esempio, AAS, rhGH) in relazione alle articolazioni, ai tendini, ai legamenti e alle ossa, è reso possibile da una lettura attenta di questo articolo. Per i professionisti, le aree particolari da leggere con attenzione riguardano la rigidità dei tendini e le implicazioni per coloro che si impegnano in allenamenti pliometrici o anche con carichi leggeri; i pro e i contro degli AAS sugli aspetti biologici, strutturali e meccanici dei tendini; e la scarsità di dati solidi relativi agli effetti sui tessuti molli da parte di diversi AAS.
Gabriel Bellizzi [CEO BioGenTech]
Riferimenti:
- Anabolic Steroids and Growth Hormone: Their Impact on Bones, Tendons, Ligaments, and Joints y Type-IIx
[1] Pärssinen, M., Karila, Kovanen, and Seppälä. (2000). The Effect of Supraphysiological Doses of Anabolic Androgenic Steroids on Collagen Metabolism. International Journal of Sports Medicine, 21(6), 406–411. doi:10.1055/s-2000-3834
[2] Crofton, P. M., Stirling, H. F., Schönau, E., and Kelnar, C. J. H. (1996). Bone alkaline phosphatase and collagen markers as early predictors of height velocity response to growth-promoting treatments in short normal children. Clinical Endocrinology, 44(4), 385–394. doi:10.1046/j.1365-2265.1996.706cn527.x
[3] Açil, Y., Brinckmann, J., Notbohm, H., Müller, P. K., and Bätge, B. (1996). Changes with age in the urinary excretion of hydroxylysylpyridinoline (HP) and lysylpyridinoline (LP). Scandinavian Journal of Clinical and Laboratory Investigation, 56(3), 275–283. doi:10.3109/00365519609088617
[4] Aerssens, J., Van Audekercke, R., Geusens, P., Schot, L. P. C., Osman, A. A.-H., and Dequeker, J. (1993). Mechanical properties, bone mineral content, and bone composition (collagen, osteocalcin, IGF-I) of the rat femur: Influence of ovariectomy and nandrolone decanoate (anabolic steroid) treatment. Calcified Tissue International, 53(4), 269–277. doi:10.1007/bf01320913
[5] Chidi-Ogbolu N, Baar K. Effect of Estrogen on Musculoskeletal Performance and Injury Risk. Front Physiol. 2019;9:1834. Published 2019 Jan 15. doi:10.3389/fphys.2018.01834
[6] Kjaer, M.J. (2008). Role of extracellular matrix in adaptation of tendon and skeletal muscle to mechanical loading. Physiol. Rev. 84:649-698.
[7] Joblecki, C.K., Heuser, J.E., Kaufman, S. (1973). Autoradiographic localization of new RNA synthesis in hypertrophying skeletal muscles. Journal of Cellular Biology. 57:743-759.
[8] Spadari, A., Romagnoli, N., Predieri, P. G., Borghetti, P., Cantoni, A. M., and Corradi, A. (2013). Effects of intraarticular treatment with stanozolol on synovial membrane and cartilage in an ovine model of osteoarthritis. Research in Veterinary Science, 94(3), 379–387. doi:10.1016/j.rvsc.2012.11.020
[9] Jones, I. A., Togashi, R., Rick Hatch, G. F., Weber, A. E., and Vangsness JR, C. T. (2018). Anabolic Steroids and Tendons: A Review of their Mechanical, Structural and Biologic Effects. Journal of Orthopaedic Research®. doi:10.1002/jor.24116
[10] Ellis AJ, Cawston TE, Mackie EJ. The differential effects of stanozolol on human skin and synovial fibroblasts in vitro: DNA synthesis and receptor binding. Agents Actions. 1994 Mar;41(1-2):37-43. doi: 10.1007/BF01986391. PMID: 8079819.
[11] Wright JK, Smith AJ, Cawston TE, Hazleman BL. The effect of the anabolic steroid, stanozolol, on the production of procollagenase by human synovial and skin fibroblasts in vitro. Agents Actions. 1989 Nov;28(3-4):279-82. doi: 10.1007/BF01967415. PMID: 2556901.
[12] Oleesky DA, Daniels RH, Williams BD, Amos N, Mor gan BP. Terminal complement complexes and C1/C1 inhibitor complexes in rheumatoid arthritis and other arthritic conditions. Clin Exp Immunol. 1991;84(2):250-255.
[13] Marqueti, R. de C., Hashimoto, N. Y., Durigan, J. L. Q., Batista e Silva, L. L., Almeida, J. A. de, Silva, M. da G. da, … Araújo, H. S. S. de. (2015). Nandrolone increases angiotensin-I converting enzyme activity in rats tendons. Revista Brasileira de Medicina Do Esporte, 21(3), 173–177. doi:10.1590/1517-869220152103143667
[14] Reeves, P. T., Herndon, D. N., Tanksley, J.D., Jennings, K., Klein, G. L., Mlcak, R. P., … Finnerty, C. C. (2016). FIVE-YEAR OUTCOMES AFTER LONG-TERM OXANDROLONE ADMINISTRATION IN SEVERELY BURNED CHILDREN. Shock, 45(4), 367–374. doi:10.1097/shk.0000000000000517
[15] Falanga, V., Greenberg, A. S., Zhou, L., Ochoa, S. M., Roberts, A. B., Falabella, A., and Yamaguchi, Y. (1998). Stimulation of Collagen Synthesis by the Anabolic Steroid Stanozolol. Journal of Investigative Dermatology, 111(6), 1193–1197. doi:10.1046/j.1523-1747.1998.00431.x
[16] Nelson, A. E., Meinhardt, U., Hansen, J. L., Walker, I. H., Stone, G., Howe, C. J., … Ho, K. K. (2008). Pharmacodynamics of Growth Hormone Abuse Biomarkers and the Influence of Gender and Testosterone: A Randomized Double-Blind Placebo-Controlled Study in Young Recreational Athletes. The Journal of Clinical Endocrinology and Metabolism, 93(6), 2213–2222.
[17] Vestergaard, P., Jørgensen, J. O. L., Olesen, J. L., Bosnjak, E., Holm, L., Frystyk, J., … Hansen, M. (2012). Local administration of growth hormone stimulates tendon collagen synthesis in elderly men. Journal of Applied Physiology, 113(9), 1432–1438. doi:10.1152/japplphysiol.00816.2012
[18] Barake, M., Klibanski, A., and Tritos, N. A. (2014). Effects of Recombinant Human Growth Hormone Therapy on Bone Mineral Density in Adults With Growth Hormone Deficiency: A Meta-Analysis. The Journal of Clinical Endocrinology and Metabolism, 99(3), 852–860. doi:10.1210/jc.2013-3921
