Introduzione:
I reni sono responsabili, tra l’altro, del filtraggio del sangue e della produzione di urina. Lo fanno creando un filtrato dalle grandi quantità di sangue che li attraversano. Di solito, più di un litro di sangue passa attraverso i reni ogni minuto. Se si sottrae la frazione non fluida, lasciando quindi il plasma sanguigno, questo si traduce in circa 625 ml di plasma sanguigno che passa attraverso i reni ogni minuto. Circa un quinto di questo fluido viene filtrato attraverso i capillari glomerulari (vedi figura sotto) in ogni singolo nefrone di cui sono composti i reni. Il nefrone è l’unità funzionale del rene. Ciascuno di essi è in grado di filtrare il sangue e di produrre l’urina. Un rene è composto all’incirca da 1 milione di nefroni, ma la percentuale varia notevolmente da una persona all’altra [1]. Il fluido che viene filtrato attraverso i capillari glomerulari viene catturato in un “sacco” chiamato capsula di Bowman. La velocità con cui questo fluido, o filtrato glomerulare, viene catturato collettivamente nella capsula di Bowman da tutti i nefroni al minuto è definita velocità di filtrazione glomerulare (eGFR). Negli adulti sani è di circa 125mL/min (il 20% dei 625mL/min di cui sopra).
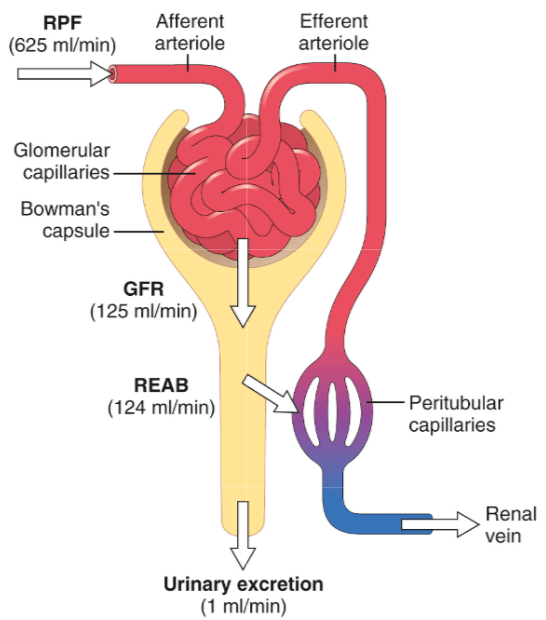
Stima della velocità di filtrazione glomerulare (eGFR)
La stima del eGFR viene utilizzata come indicatore della funzione renale. Il metodo migliore per farlo è utilizzare una sostanza che viene filtrata liberamente dal glomerulo e non viene né secreta, né riassorbita, né sintetizzata, né metabolizzata dal rene. Pertanto, qualsiasi quantità di sostanza venga filtrata dal glomerulo viene escreta anche nelle urine. Pertanto, l’eGFR può essere ricavato con precisione dalle misurazioni delle urine e dalla conoscenza della quantità somministrata. Il gold standard per misurarlo è l’utilizzo di una sostanza chiamata inulina. È poco utilizzata nella pratica perché è costosa, la maggior parte dei laboratori non è in grado di dosarla e per una valutazione più accurata è necessaria un’endovena con diversi campioni di sangue e la cateterizzazione della vescica. Tutto sommato, non è molto pratico.
Per questo motivo, l’eGFR viene spesso stimato in base alla concentrazione di creatinina nel siero. La creatinina non viene riassorbita o metabolizzata dai reni e viene filtrata liberamente a livello del glomerulo. Inoltre, l’apporto dal tessuto muscolare scheletrico è costante (essendo un prodotto di degradazione della creatina), per cui non è necessario somministrarla per via endovenosa, a differenza dell’inulina. Tuttavia, può verificarsi una significativa secrezione tubulare di creatinina [2]. Pertanto, pur non essendo assolutamente perfetta, queste proprietà della creatinina la rendono comunque utile per ricavare l’eGFR. Sono state stabilite diverse formule che possono fornire una stima del eGFR in base alla sua concentrazione. Tutte si basano sul presupposto che livelli di creatinina più elevati implicano una minore eliminazione di creatinina, ovvero una diminuzione del eGFR.
La formula attualmente raccomandata nella pratica clinica è l’equazione della Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) [3]. In precedenza, veniva comunemente utilizzata la Modification of Diet in Renal Disease (MDRD). L’equazione CKD-EPI tiene conto, oltre che della concentrazione di creatinina sierica, del sesso, dell’età e del gruppo etnico ed è corretta per un’area di superficie corporea di 1,73 m2. In questo modo si ottengono valori di eGFR con un’unità di misura di mL/min/1,73m2. Un eGFR normale o elevato è considerato superiore a 90 [3].
Problemi con l’eGFR basato sulla creatinina negli utilizzatori di AAS
La stima del eGFR basata sulla concentrazione di creatinina nel siero è notoriamente inaffidabile nei soggetti muscolosi. Poiché il muscolo è il principale sito di immagazzinamento della creatina nell’organismo, i soggetti muscolosi hanno una maggiore quantità di creatina nel corpo. Di conseguenza, anche il tasso di produzione di creatinina è più elevato. Di conseguenza, con tassi di clearance simili, anche i livelli di creatinina nel siero saranno più elevati. Di conseguenza, queste formule sottostimano il vero eGFR. Un altro problema che si presenta in questa popolazione è quello causato dall’integrazione di creatina. L’integrazione di creatina è una pratica comune tra i soggetti che si allenano contro-resistenza ed è efficace nell’aumentare le riserve corporee di creatina [4]. Di conseguenza, la produzione di creatinina è in assoluto più elevata. Inoltre, la creatina etil-estere in particolare può portare a un forte aumento dei livelli di creatinina nel siero [5, 6]. Il motivo più probabile è che la creatina etil-estere viene rapidamente degradata in creatinina nell’organismo dopo l’ingestione [7]. Anche l’ingestione di carne cotta può aumentare transitoriamente i livelli di creatinina nel siero per diverse ore [8]. Inoltre, ci sono prove che indicano che l’uso di steroidi anabolizzanti potrebbe aumentare la biosintesi della creatina. La creatina viene sintetizzata con un meccanismo a due fasi, come illustrato di seguito:

La reazione catalizzata dall’AGAT, che forma l’acido guanidinoacetico, è la fase limitante della sintesi della creatina [9]. È stato riscontrato che la somministrazione di uno steroide anabolizzante (17α-metil testosterone) aumenta l’espressione di AGAT [10]. Inoltre, ha aumentato l’escrezione di acido guanidinoacetico nelle urine del 70%. L’insieme di questi dati suggerisce fortemente che gli steroidi anabolizzanti, almeno quelli biodisponibili per via orale, stimolano la biosintesi della creatina. Di conseguenza, potrebbero aumentare l’accumulo di creatina e quindi influenzare anche il tasso assoluto di produzione di creatinina. Infine, la maggior parte dei consumatori di steroidi anabolizzanti consuma anche una dieta ad alto contenuto proteico. È stato riscontrato che una dieta ad alto contenuto proteico aumenta la eGFR [11]. Si noti che non si tratta di una sovrastima del eGFR, ma di un leggero aumento del eGFR reale.
Riassumendo, i seguenti fattori possono influenzare i livelli di creatinina sierica e quindi l’eGFR stimato senza influenzare effettivamente l’eGFR reale:
- Essere più muscolosi
- Integrazione di creatina (in particolare di creatina etil-estere)
- Aver mangiato carne cotta nelle ore precedenti la misurazione
- Assunzione di steroidi anabolizzanti (per via orale).
Detto questo, se si tiene conto del fatto che l’eGFR sarà alterato da questi fattori, si possono comunque osservare variazioni dell’eGFR nel tempo. Supponendo di mantenere tutto abbastanza costante, queste variazioni possono essere indicative di cambiamenti nella velocità di filtrazione glomerulare.
Gli AAS influenzano l’eGFR basato sulla creatinina
Pochi studi hanno misurato l’effetto degli steroidi anabolizzanti, in particolare del Testosterone Enantato, sui livelli di creatinina sierica. Bhasin et al. hanno riportato un lieve aumento da 1,0mg/dL a 1,1mg/dL in uomini normali che ricevevano 600mg di Testosterone Enantato settimanalmente in associazione a esercizi contro-resistenza [12]. Tuttavia, uno studio successivo dello stesso gruppo non ha rilevato cambiamenti significativi nei livelli di creatinina sierica in giovani uomini sani che ricevevano dosi graduate di Testosterone Enantato da 25 a 600mg settimanali per una durata di 20 settimane [13]. Lo stesso gruppo, sempre con un design di studio simile, ma in uomini più anziani, ha riscontrato un aumento da 1,03 a 1,17mg/dL negli uomini che ricevevano 600mg settimanali e da 1,12 a 1,19mg/dL nel gruppo che riceveva 125mg settimanali (che è limite di dosaggio della terapia sostitutiva del Testosterone [TRT]) [14]. Anche uno studio che ha fornito il proormone orale 1-androsterone al dosaggio di 330mg al giorno per 4 settimane ha rilevato un aumento da 1,1mg/dL a 1,3mg/dL dei livelli di creatinina sierica [15]. Gli autori hanno anche calcolato l’eGFR, che è sceso da 88,3 a 71,9ml/min/1,73m2. Non è chiaro se questi aumenti della creatinina sierica riflettano un’effettiva diminuzione del eGFR o se siano semplicemente artefatti derivanti dai problemi relativi all’eGFR basato sulla creatinina, come sottolineato in precedenza. In particolare, non sono note disfunzioni o malattie renali causate dagli steroidi anabolizzanti, ad eccezione di alcuni casi riportati.
Alternative all’eGFR basato sulla creatinina
Nei casi in cui vi siano chiare ragioni per sospettare che l’eGFR basato sui livelli di creatinina sierica sia impreciso, si possono utilizzare alcuni metodi alternativi. Uno di questi si basa sulla misurazione dei livelli di cistatina C nel siero. L’idea è più o meno simile a quella della misurazione della creatinina. La differenza principale è che la cistatina C è prodotta da tutte le cellule (nucleate) a un tasso relativamente costante. Tuttavia, una differenza importante è che una certa metabolizzazione della sostanza avviene nei tubuli. Inoltre, mentre inizialmente si pensava che non fosse influenzata dal sesso, dall’età o dalla massa muscolare, le prove che si stanno accumulando suggeriscono che in realtà lo sia. Diversi studi hanno rilevato che è influenzato da sesso, età, razza, peso, altezza, composizione corporea e stato di fumatore [16, 17, 18]. Tuttavia, uno studio ha concluso che la cistatina C potrebbe rappresentare un’alternativa più adeguata per valutare la funzione renale nei soggetti con massa muscolare più elevata quando si sospetta una lieve compromissione renale [19]. È probabile che l’eGFR basato sulla cistatina C possa fornire un’immagine più chiara del vero eGFR di quanto non faccia l’eGFR basato sulla creatinina nei soggetti allenati contro-resistenza che fanno o non fanno uso di steroidi anabolizzanti. Infine, i dati suggeriscono che la combinazione delle due misurazioni potrebbe addirittura fornire un quadro ancora più accurato di una delle due da sola nella malattia renale cronica [20]. Tuttavia, questi dati non sono stati verificati in modo specifico nei soggetti muscolosi/bodybuilder.
Negli studi di ricerca vengono utilizzati anche marcatori più affidabili come lo Iotalamato e lo Ioexolo. Entrambi possono essere utilizzati con una singola iniezione in bolo, ma richiedono misurazioni plasmatiche multiple. Tuttavia, sono entrambi poco costosi e forniscono stime migliori rispetto all’eGFR basato sulla creatinina/cistatina C. L’Iotalamato, per quanto ne so, è il meno utilizzato nella pratica clinica ed è radioattivo (lo Ioexolo non lo è). Lo Iohexolo comporta un piccolo rischio di nefrotossicità e di reazione allergica (soprattutto ad alte dosi). Lo menziono più per completezza che per altro, in quanto non è qualcosa che dovrebbe essere usato di routine.
Glomerulosclerosi focale segmentale (FSGS) e rilevamento del danno renale con la misurazione delle urine
In letteratura ci sono pochissime segnalazioni di steroidi anabolizzanti dannosi per i reni. Un articolo degno di nota che riporta disfunzioni renali nei consumatori di steroidi anabolizzanti è quello del 2010 di Herlitz et al. [21]. Descrive 10 pazienti provenienti dagli archivi del loro laboratorio di patologia renale in un periodo di 10 anni. I pazienti erano tutti culturisti con una lunga storia di uso di steroidi anabolizzanti. Sono state prelevate biopsie renali che hanno rivelato una glomerulosclerosi focale segmentaria (FSGS) in nove di loro, e quattro di loro presentavano anche glomerulomegalia. In uno dei pazienti non sono stati riscontrati segni di FSGS, ma solo di glomerulomegalia. Che cos’è la FSGS? È un termine un po’ generico per indicare un gruppo di malattie che portano a lesioni glomerulari, mediate da diversi insulti diretti o inerenti al podocita (le cellule che formano la superficie esterna dei capillari glomerulari) [22]. O forse, per meglio dire, è un reperto istologico che non indica necessariamente una malattia specifica. In ogni caso, nella FSGS i podociti iniziano a cambiare forma, diventando più o meno appiattiti (effacement). A un certo punto, il podocita muore e si stacca dalla membrana basale. Poiché i podociti sono cosiddetti “differenziati terminali”, non possono andare incontro a divisione cellulare (proliferare). Pertanto, queste cellule vengono sostituite da tessuto connettivo (sclerosi). Ovviamente il tessuto connettivo non funziona come i podociti e quindi la funzione di filtraggio del glomerulo è compromessa.
Questo può manifestarsi con la perdita di proteine nelle urine. Che non dovrebbero esserci (a parte alcune tracce). I bodybuilder di questo studio hanno perso grandi quantità di proteine nelle urine (in media circa 10 grammi al giorno). In prospettiva, di solito non dovrebbe trattarsi di più di qualche milligrammo. Uno dei bodybuilder era addirittura in grado di produrre il proprio frullato proteico, visto che ha fatto la pipì con ben 26 g di proteine al giorno. In particolare, anche la creatinina sierica era marcatamente elevata in questi soggetti. Mentre l’intervallo di normalità va da 0,9mg/dL a 1,3mg/dL, questi soggetti presentavano in media livelli di creatinina sierica pari a 3,0mg/dL, con uno che raggiungeva l’incredibile valore di 7,8mg/dL. Ovviamente, queste grandi deviazioni sono chiaramente causate da una diminuzione della funzione renale.
Ci sono alcune cose che vorrei sottolineare in questo articolo. Uno è che questi bodybuilder non erano bodybuilder medi. Il loro IMC medio era di 35 kg/m2. Erano dannatamente enormi. Quattro di loro hanno ammesso di aver fatto uso di steroidi anabolizzanti in combinazione con il GH e uno di loro con l’Insulina. Inoltre, sei avevano anche l’ipertensione. Di seguito è riportata la foto di uno di loro:

Sono riusciti a effettuare un follow-up di otto dei soggetti dopo la sospensione degli steroidi anabolizzanti (a tutti, tranne uno, erano stati prescritti anche dei farmaci, per lo più inibitori del sistema Renina-Angiotensina-Aldosterone [RAAS]). Al follow-up, sono stati osservati grandi miglioramenti nella proteinuria e miglioramenti variabili nei livelli di creatinina sierica. In particolare, un paziente è ricaduto nell’uso di steroidi anabolizzanti e ha visto aumentare di nuovo in modo considerevole l’escrezione di proteine nelle urine.
Sebbene sia difficile affermare che tutto questo possa essere il risultato dell’uso di steroidi anabolizzanti, sembra probabile che in alcuni rari casi l’uso cronico eccessivo di steroidi anabolizzanti possa portare a questo fenomeno. Anche perché non se ne parla molto in letteratura, nonostante i milioni e milioni di consumatori di steroidi anabolizzanti sparsi per il mondo. Tuttavia, potrebbe esserci una significativa sottostima, in quanto forme più lievi di danno renale potrebbero passare inosservate, anche con le misurazioni di routine dell’eGFR. La diagnosi precoce può essere ottenuta con il test delle proteine nelle urine, che raramente viene effettuato senza indicazione.
Per questo motivo, si potrebbe raccomandare di effettuare le misurazioni delle urine con una certa regolarità. Ad esempio, annualmente o semestralmente. Lievi aumenti di albumina nelle urine dovrebbero indurre a ripetere l’esame, poiché possono derivare, ad esempio, da un’infezione o dall’esercizio fisico, senza essere causati da un vero e proprio danno renale. In caso di elevazioni persistenti o elevate, è necessario avviare un ulteriore follow-up e, idealmente, interrompere l’uso di steroidi anabolizzanti.
Nota: la ricerca in atto ha ipotizzato che l’uso di AAS sia adittivo al possibile emergere di disfunzioni renali. I risultati di alcuni studi indicano infatti che un’elevata assunzione di proteine, l’uso di AAS, in particolare gli schemi, tra cui il Boldenone Undecylenato, e altri farmaci con un certo “carico renale”, aumentano l’ecogenicità corticale, lo spessore del parenchima renale e il volume renale nei bodybuilder.
Interazione di rInsulina e rhGH sulla funzionalità renale
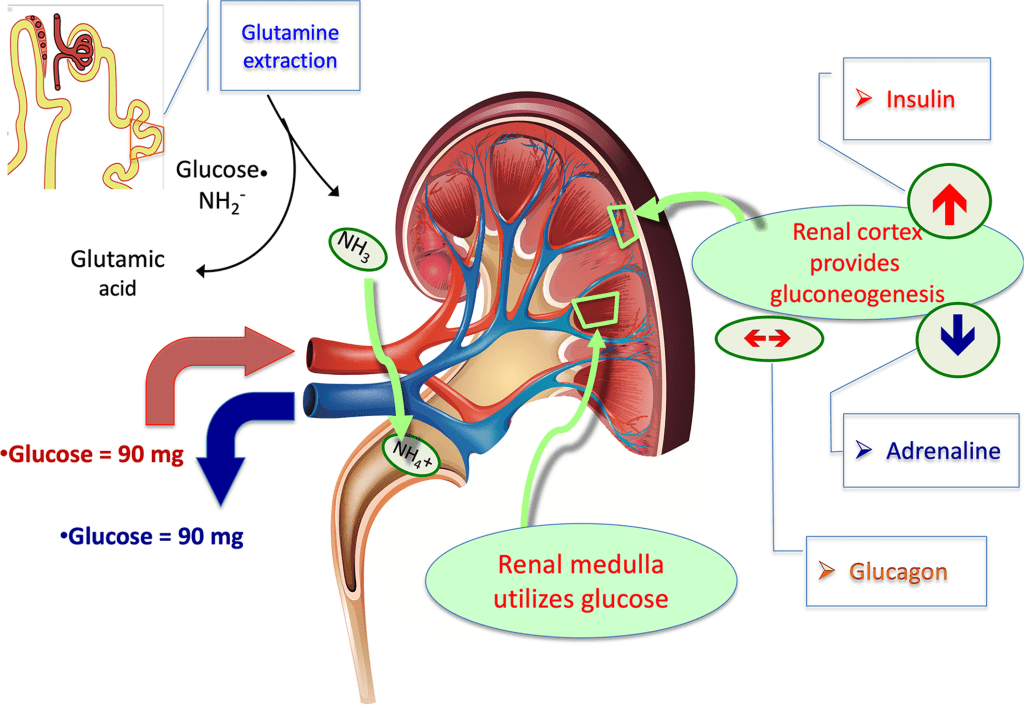
L’insulino-resistenza è una caratteristica comune nei bodybuilder che usano per lunghi periodi di tempo protocolli di hGH/Insulina. L’IR è comune nei pazienti con malattia renale cronica (CKD), anche in assenza di diabete (DeFronzo et al., 1981; Shinohara et al., 2002; Becker et al., 2005; Kobayashi et al., 2005; Landau et al., 2011), ed è un fattore di rischio per la progressione della CKD (Fox et al., 2004). La sua prevalenza nella CKD varia dal 30 al 50% e dipende principalmente dal metodo di misurazione adottato (Spoto et al., 2016). L’insulino-resistenza può essere rilevata nelle fasi iniziali, quando l’eGFR è ancora nel range di normalità, suggerendo un ruolo potenziale nell’innescare la CKD (Fliser et al., 1998). Un ampio studio basato sulla coorte Atherosclerosis Risk in Communities (ARICs) ha confermato che lo sviluppo della CKD aumenta in stretto parallelismo con il numero di criteri della sindrome metabolica misurati negli adulti non diabetici, e questa relazione rimane significativa anche dopo aver controllato lo sviluppo di diabete e ipertensione (Kurella et al., 2005). L’insulino-resistenza è stata anche associata a una prevalente CKD e a un rapido declino della funzione renale in individui asiatici anziani e non diabetici (Cheng et al., 2012) e alla microalbuminuria nella popolazione generale (Mykkänen et al, 1998) e in pazienti con T1DM (Yip et al., 1993; Ekstrand et al., 1998) e T2DM (Groop et al., 1993), indicando che questa relazione è indipendente dal diabete (Mykkänen et al., 1998; Chen et al., 2003, 2004). Il meccanismo proposto per cui l’IR contribuisce al danno renale prevede il peggioramento dell’emodinamica renale attraverso l’attivazione del sistema nervoso simpatico (Rowe et al., 1981), la ritenzione di sodio, la diminuzione dell’attività della Na+, K+-ATPasi e l’aumento del GFR (Gluba et al., 2013).
L’eziologia dell’IR nella CKD è multifattoriale e dipende da fattori di rischio classici e specifici della CKD, come l’inattività fisica, l’infiammazione e lo stress ossidativo, le alterazioni delle adipochine, la carenza di vitamina D, l’acidosi metabolica, l’anemia e le tossine microbiche (Spoto et al., 2016).
L’emodialisi a lungo termine ha un effetto positivo sull’IR (DeFronzo et al., 1978), ma ci sono pochi dati clinici sull’effetto della dialisi peritoneale.
Oltre a essere un fattore di rischio per l’insorgenza e la progressione della CKD, l’IR è anche coinvolta nell’aumento del rischio cardiovascolare (CV) in questa popolazione. L’IR può essere responsabile dell’ipertensione arteriosa attraverso la stimolazione diretta del RAAS (Nickenig et al., 1998), l’attivazione del sistema simpatico (Sowers et al., 2001) e la sottoregolazione del sistema dei peptidi natriuretici (Sarzani et al., 1999).
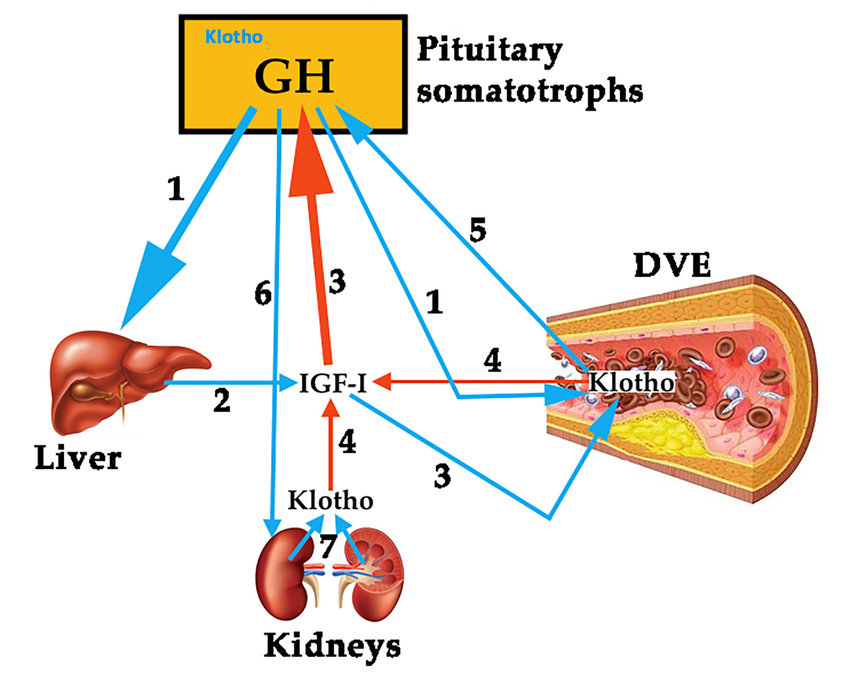
Similmente a quanto accade nei pazienti acromegalici, livelli cronicamente alti di rhGH possono essere associati a ipertrofia renale nell’uomo [Kamenický P et al. 2014]. In uno studio caso-controllo, la lunghezza del rene valutata mediante ecografia renale è risultata significativamente aumentata di circa 5cm (55%) e 2cm (20%) rispettivamente nei pazienti acromegalici attivi e controllati [Auriemma RS et al. 2010]. Le dimensioni del rene si normalizzano rapidamente entro 3-6 mesi nei pazienti acromegalici sottoposti a chirurgia transfenoidale [Zhang Z et al. 2018]. Mancano studi sistematici sull’istologia renale nei pazienti acromegalici. Rari casi, in cui i pazienti acromegalici sono stati sottoposti a biopsia renale a causa della sindrome nefrosica o della proteinuria persistente, hanno rivelato una glomerulosclerosi focale segmentaria [Takai M et al. 2001]. In un paziente acromegalico che presentava proteinuria di gamma nefrosica e glomerulosclerosi focale segmentaria alla biopsia renale, la proteinuria si è rapidamente normalizzata dopo l’asportazione del tumore, ma è ritornata 4 mesi dopo, rispondendo però al trattamento con Prednisolone [Wang R et al. 2021]. Nei pazienti acromegalici sottoposti a biopsia renale è stata notata solo un’ipertrofia moderata o non glomerulare.
I pazienti acromegalici presentano un’iperfiltrazione glomerulare caratterizzata da un aumento di circa il 15% del eGFR e del RPF rispetto ai soggetti sani, che è reversibile nella maggior parte dei pazienti, ma non in tutti, con la rimozione chirurgica degli adenomi ipofisari [Fujio S et al. 2016]. Si ritiene che l’iperfiltrazione glomerulare persistente contribuisca allo sviluppo di albuminuria nei pazienti acromegalici sottoposti a chirurgia tardiva [Grunenwald S et al. 2011]. Nello studio Baldelli, la microalbuminuria è stata riportata nel 55% dei pazienti acromegalici e associata a ipertensione, alterata tolleranza al glucosio e diabete [Baldelli R et al. 2008].
Similmente a quanto osservato con gli abusatori di rhGH, i pazienti acromegalici mostrano un aumento dell’acqua corporea totale e del sodio e possono presentare un edema evidente. Questi cambiamenti sono legati alle proprietà di ritenzione di sodio del GH e dell’IGF-1 attraverso l’ENaC nei tubuli distali renali e possono essere invertiti se i pazienti sono sottoposti a un trattamento efficace del tumore che produce GH [Kamenický P et al. 2020]. L’acqua corporea totale (56% contro 50% del peso corporeo) ed extracellulare (20% contro 15% del peso corporeo), così come il sodio scambiabile, sono risultati aumentati nei pazienti acromegalici rispetto ai soggetti sani, mentre non sono state rilevate differenze nel contenuto di acqua intracellulare [Ikkos D et al. 1954]. Anche il volume plasmatico è risultato aumentato in questi pazienti [Hirsch EZ et al. 1969]. Le conseguenze cliniche di queste alterazioni sono l’ipertensione arteriosa, l’ipertrofia ventricolare sinistra e l’insufficienza cardiaca congestizia, che contribuiscono all’aumento complessivo della mortalità nei pazienti non trattati. È importante notare che l’ipertensione arteriosa è associata a un esito inferiore in questi pazienti [Vila G et al. 2020]. Inoltre, i pazienti acromegalici diabetici presentano un’ipertrofia ventricolare sinistra più pronunciata rispetto ai pazienti non diabetici [Nemes A et al. 2020].
I pazienti acromegalici spesso presentano una lieve iperfosfatemia nonostante l’aumento del eGFR, a causa dell’aumento del TmP/eGFR, che può essere utilizzato come misura completa dello stato della malattia e può essere invertito con il trattamento [Xie T et al. 2020]. I meccanismi sottostanti includono l’up-regulation del cotrasportatore Na-Pi 2a nei tubuli prossimali renali indotta dall’IGF-1 e un maggiore assorbimento intestinale di fosfato, dovuto all’aumento della sintesi di calcitriolo indotto dal GH. I pazienti mostrano spesso concentrazioni sieriche verso l’intervallo superiore di normalità in associazione a ipercalciuria [Manroa P et al. 2014]. Questi risultati sono molto probabilmente correlati alla sintesi di calcitriolo indotta dal GH, con conseguente aumento dell’assorbimento intestinale di calcio, poiché i livelli di calcitriolo tendono a essere elevati in questi pazienti. Inoltre, nei pazienti acromegalici è stato dimostrato un maggiore assorbimento di calcio nei reni, molto probabilmente legato alla stimolazione indotta dal calcitriolo dell’espressione di TRPV5 nei tubuli renali distali [Suzuki Y et al. 2008]. Si ritiene che l’alterato metabolismo del calcio contribuisca all’aumento della fragilità scheletrica osservato nei pazienti acromegalici [Mazziotti G et al. 2013].
Conclusioni:
Sebbene non vi siano prove certe della correlazione tra patologie renali e AAS, questi ultimi hanno mostrato di poter causare peggioramenti della funzionalità renale anche solo in modo transitorio. La loro azione addittiva con altre molecole e loro alterazione del contesto metabolico (vedi abuso di rInsulina e rhGH con conseguente peggioramento dell’IR) può essere in parte la causa delle problematiche renali osservati in diversi bodybuilder Enhanced, specie di alto livello. Gli studi svolti su animali hanno mostrato possibili attività nefrotossiche in particolari AAS come, ad esempio, il Boldenone. La ricerca, seppur in piccolo, continua e un giorno potremmo avere le idee più chiare sulla reale correlazione tra AAS (e PEDs) e malattie renali.
Gabriel Bellizzi [CEO BioGenTech]
Riferimenti:
- Bertram, John F., et al. “Human nephron number: implications for health and disease.” Pediatric nephrology 26.9 (2011): 1529-1533.
- Shemesh, Ovadia, et al. “Limitations of creatinine as a filtration marker in glomerulopathic patients.” Kidney international 28.5 (1985): 830-838.
- Eknoyan, Garabed, et al. “KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease.” Kidney Int 3.1 (2013): 5-14.
- Harris, Roger C., Karin Söderlund, and Eric Hultman. “Elevation of creatine in resting and exercised muscle of normal subjects by creatine supplementation.” Clinical science 83.3 (1992): 367-374.
- Williamson, Lydia, and David New. “How the use of creatine supplements can elevate serum creatinine in the absence of underlying kidney pathology.” Case Reports 2014 (2014): bcr2014204754.
- Velema, M. S., and W. De Ronde. “Elevated plasma creatinine due to creatine ethyl ester use.” Neth J Med 69.2 (2011): 79-81.
- Gufford, Brandon T., et al. “pH-dependent stability of creatine ethyl ester: relevance to oral absorption.” Journal of dietary supplements 10.3 (2013): 241-251.
- Preiss, David J., et al. “The influence of a cooked-meat meal on estimated glomerular filtration rate.” Annals of clinical biochemistry 44.1 (2007): 35-42.
- Walker, James B. “Creatine: biosynthesis, regulation, and function.” Adv Enzymol Relat Areas Mol Biol 50.177 (1979): 2.
- Hoberman, Henry D., Ethan AH Sims, and William W. Engstrom. “The effect of methyltestosterone on the rate of synthesis of creatine.” Journal of Biological Chemistry 173.1 (1948): 111-116.
- Martin, William F., Lawrence E. Armstrong, and Nancy R. Rodriguez. “Dietary protein intake and renal function.” Nutrition & metabolism 2.1 (2005): 1-9.
- Bhasin, Shalender, et al. “The effects of supraphysiologic doses of testosterone on muscle size and strength in normal men.” New England Journal of Medicine 335.1 (1996): 1-7.
- Bhasin, Shalender, et al. “Testosterone dose-response relationships in healthy young men.” American Journal of Physiology-Endocrinology And Metabolism (2001).
- Bhasin, Shalender, et al. “Older men are as responsive as young men to the anabolic effects of graded doses of testosterone on the skeletal muscle.” The Journal of Clinical Endocrinology & Metabolism 90.2 (2005): 678-688.
- Granados, Jorge, et al. “Prohormone supplement 3β-hydroxy-5α-androst-1-en-17-one enhances resistance training gains but impairs user health.” Journal of applied physiology 116.5 (2014): 560-569.
- Knight, Eric L., et al. “Factors influencing serum cystatin C levels other than renal function and the impact on renal function measurement.” Kidney international 65.4 (2004): 1416-1421.
- Groesbeck, Darcy, et al. “Age, gender, and race effects on cystatin C levels in US adolescents.” Clinical Journal of the American Society of Nephrology 3.6 (2008): 1777-1785.
- Macdonald, Jamie, et al. “GFR estimation using cystatin C is not independent of body composition.” American journal of kidney diseases 48.5 (2006): 712-719.
- Baxmann, Alessandra Calábria, et al. “Influence of muscle mass and physical activity on serum and urinary creatinine and serum cystatin C.” Clinical Journal of the American Society of Nephrology 3.2 (2008): 348-354.
- Stevens, Lesley A., et al. “Estimating GFR using serum cystatin C alone and in combination with serum creatinine: a pooled analysis of 3,418 individuals with CKD.” American journal of kidney diseases 51.3 (2008): 395-406.
- Herlitz, Leal C., et al. “Development of focal segmental glomerulosclerosis after anabolic steroid abuse.” Journal of the American Society of Nephrology 21.1 (2010): 163-172.
- D’Agati, Vivette D., Frederick J. Kaskel, and Ronald J. Falk. “Focal segmental glomerulosclerosis.” New England Journal of Medicine 365.25 (2011): 2398-2411.
