Introduzione:
L’uso di AAS può portare a una condizione chiamata eritrocitosi. Si tratta di una condizione in cui il corpo ha troppi eritrociti (globuli rossi) nel sangue. Talvolta si parla anche di policitemia. La percentuale del volume sanguigno occupata dai globuli rossi è chiamata ematocrito. Per gli uomini l’intervallo di riferimento va dal 41 al 51% e per le donne dal 36 al 47%. (Esistono leggere deviazioni da laboratorio a laboratorio in questi intervalli di riferimento).
I globuli rossi sono responsabili del trasporto dei gas. In particolare, trasportano l’ossigeno dai polmoni al resto del corpo. Inoltre, trasportano anche parte dell’anidride carbonica generata dal corpo verso i polmoni. I globuli rossi possono trasportare l’ossigeno grazie a una speciale proteina che contengono in grandi quantità: l’emoglobina. I livelli di emoglobina possono essere misurati anche nel sangue e il loro intervallo di riferimento va da 13,5 a 17 g/dL negli uomini e da 12 g/dL a 15,5 g/dL nelle donne.
I livelli di ematocrito e di emoglobina possono essere facilmente derivati l’uno dall’altro, in quanto i due valori sono in genere strettamente correlati. La concentrazione di emoglobina in g/dL moltiplicata per tre dà il valore di ematocrito in %. Pertanto, una persona con un livello di emoglobina di 15 g/dL ha un valore di ematocrito di circa il 45%.
Quando l’ematocrito diventa troppo basso, l’organismo ha una minore capacità di soddisfare il fabbisogno di ossigeno delle sue cellule. In altre parole: anemia. Questo può far sentire stanchi, deboli e facilmente senza fiato. Questo fenomeno è più evidente durante l’esercizio fisico (faticoso) che richiede una grande quantità di ossigeno.
Quando l’ematocrito diventa troppo alto, il problema è un altro. Più è alto, più il sangue diventa “denso”: aumenta la viscosità del sangue. Questo comporta un aumento del rischio di trombosi (correlata anche ai fattori di coagulazione). Vediamo come gli AAS aumentano l’ematocrito e di quanto. Dopodiché, analizziamo il rischio di trombosi e cosa si può fare al riguardo.
In che modo gli AAS causano l’eritrocitosi?

Due fattori principali sembrano coinvolti nell’eritrocitosi indotta dagli steroidi anabolizzanti. Uno è l’aumento dell’eritropoietina (EPO). Un ormone che talvolta fa notizia, in quanto utilizzato come doping per migliorare le prestazioni negli sport di resistenza come il ciclismo.
L’EPO viene prodotta nei reni in risposta a una ridotta disponibilità di ossigeno. L’EPO indica al midollo osseo, dove vengono prodotti i globuli rossi in un processo chiamato eritropoiesi, di aumentare la produzione di eritrociti. L’aumento dei globuli rossi aumenta la disponibilità di ossigeno e di conseguenza abbassa nuovamente l’EPO. Si crea quindi uno stretto equilibrio tra ematocrito ed EPO.

L’altro fattore che sembra essere coinvolto è la soppressione di una proteina chiamata Epcidina. L’Epcidina è un regolatore chiave del metabolismo del ferro, in quanto regola la quantità di ferro assorbita dal tratto gastrointestinale [1]. Il ferro è una parte fondamentale dell’emoglobina: è responsabile del legame con l’ossigeno. La soppressione dell’Epcidina porta a un aumento dell’assorbimento di ferro, mentre un aumento dell’Epcidina ne diminuisce l’assorbimento. Se l’apporto di ferro è inadeguato, si sviluppa l’anemia. Al contrario, il sovraccarico di ferro (emocromatosi) sembra predisporre a un aumento dei livelli di emoglobina/ematocrito. In effetti, nell’emocromatosi (ereditaria) questi livelli possono essere elevati [2, 3].
Mentre la somministrazione di Testosterone per 20 settimane mostra un aumento dose-dipendente (fino a 600mg di Testosterone Enantato alla settimana) dell’emoglobina e dell’ematocrito, soprattutto negli uomini più anziani, non lo fa l’EPO [4]. Al contrario, la somministrazione di Testosterone ha portato alla soppressione dell’Epcidina sierica in uomini giovani e anziani [5]. Il dosaggio del Testosterone (fino a 600mg di Testosterone Enantato a settimana) era altamente correlato con l’ampiezza di questa soppressione. L’aumento dell’ematocrito in seguito alla somministrazione di Testosterone è più pronunciato negli uomini anziani. In particolare, questo studio ha rilevato che i maggiori aumenti dell’ematocrito negli uomini anziani durante la terapia con Testosterone erano correlati a una maggiore soppressione dell’Epcidina. Gli autori hanno inoltre misurato l’Epcidina in più momenti: al basale, alla prima settimana, alla seconda, quarta, ottava e ventesima settimana. In questo modo hanno potuto vedere come si è evoluta nel tempo. Nelle prime due settimane si è verificata una forte diminuzione, dopodiché i livelli di Epcidina sono risaliti verso i livelli di base, anche se ancora più bassi rispetto all’inizio.

Questo è uno dei problemi dello studio che non ha dimostrato alcun cambiamento nell’EPO dopo 20 settimane [4]. Forse l’EPO è aumentata inizialmente, ma è tornata ai valori di base al termine delle 20 settimane. In questo modo, si sarebbe perso un effetto iniziale. Inoltre, i livelli di EPO presentano un’ampia variabilità, il che rende difficile trovare cambiamenti statisticamente significativi, poiché è necessaria una dimensione del campione relativamente ampia.
Uno studio successivo ha misurato l’EPO e l’Epcidina in diversi momenti in uomini anziani con Testosterone basso che hanno ricevuto un placebo o il Testosterone per 6 mesi [6]. I valori sono stati misurati al basale, a 1 mese, 3 mesi, 6 mesi e 9 mesi (quindi 3 mesi dopo la sospensione del placebo o del Testosterone). I risultati hanno dimostrato un aumento iniziale dell’EPO in risposta al gel di Testosterone rispetto al placebo. In seguito, è sceso lentamente, non mostrando più alcuna differenza rispetto al placebo al termine dei 6 mesi:

Una variazione simile, ma inversa, è stata riscontrata per l’Epcidina:
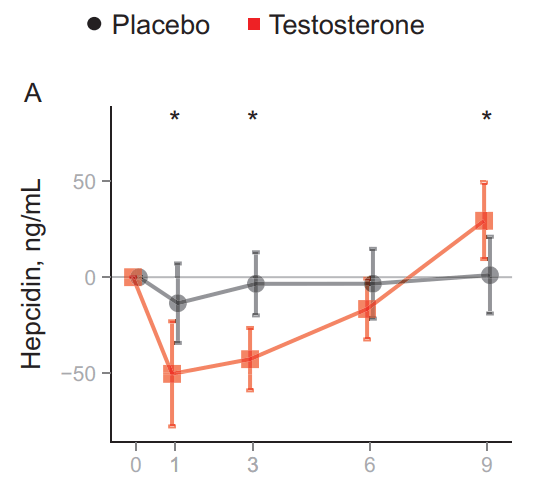
Ciò ha indotto gli autori a proporre che la somministrazione di Testosterone stabilisca un nuovo set point EPO/emoglobina. Normalmente, quando l’ematocrito aumenta, l’EPO diminuisce in risposta. In questa situazione, tuttavia, l’ematocrito aumenta, molto probabilmente come risultato dell’aumento dell’EPO e della diminuzione delle concentrazioni di Epcidina. Tuttavia, una volta stabilito l’aumento completo dell’ematocrito, i livelli di EPO rimangono simili a quelli precedenti, invece di diminuire. In altre parole, si stabilisce un nuovo setpoint. Ciò è illustrato dagli autori nella figura seguente:

In sintesi, gli androgeni aumentano l’ematocrito/emoglobina attraverso un aumento iniziale dei livelli di EPO e una contemporanea diminuzione dei livelli di Epcidina, che poi scendono gradualmente ai livelli di base di fronte all’aumento dell’ematocrito/emoglobina: un nuovo set point EPO/emoglobina. I meccanismi d’azione responsabili e il loro contributo relativo a questo fenomeno sono ancora da stabilire.
In che misura gli AAS aumentano l’ematocrito/emoglobina?
In uno studio dose-risposta, con dosaggi fino a 600mg di Testosterone Enantato alla settimana, l’emoglobina ha mostrato un aumento di 1,42g/dL nei giovani uomini dopo 20 settimane [7]. Ciò si traduce in un aumento dell’ematocrito di poco superiore al 4%. L’aumento è maggiore negli uomini più anziani, che mostrano un aumento di 2,94g/dL di emoglobina in risposta allo stesso dosaggio per lo stesso periodo di tempo [8].
E per quanto riguarda i dosaggi più elevati? Fortunatamente, sembra esserci un limite alla misura in cui gli AAS possono aumentare l’ematocrito. Vediamo lo studio HAARLEM. Lo studio HAARLEM, come ormai sappiamo bene, è uno studio prospettico condotto dall’ambulatorio per i consumatori di steroidi anabolizzanti nei Paesi Bassi [9]. In breve, 100 consumatori di steroidi anabolizzanti sono stati seguiti nel tempo mentre si autosomministravano AAS. Il dosaggio medio, basato sulle informazioni riportate sull’etichetta, era di 898mg a settimana, rendendo così il loro ciclo di AAS abbastanza rappresentativo dell’uso comune da parte dei bodybuilder. Le misurazioni sono state effettuate prima, durante, 3 mesi dopo la fine del ciclo e 1 anno dopo l’inizio del ciclo. I ricercatori hanno riscontrato un aumento del 3% dell’ematocrito dei soggetti dello studio al termine del ciclo. Questo dato è in linea con l’aumento del 4% osservato nello studio nei giovani uomini. L’autore principale ha fatto sapere che l’aumento dell’ematocrito sembra stabilizzarsi a un dosaggio di androgeni di circa 500mg a settimana. Infine, vorrei aggiungere che i soggetti dello studio non hanno effettuato donazioni di sangue, quindi questo non è stato un fattore confondente.
Naturalmente, questi risultati presentano alcune variazioni. Alcuni rispondono agli AAS con un aumento dell’ematocrito maggiore di altri. Tuttavia, livelli molto elevati di ematocrito sembrano essere rari, come si può vedere nei grafici a scatola e baffi dei partecipanti allo studio HAARLEM (T0 = subito prima del ciclo di AAS, T1 = alla fine, T2 = 3 mesi dopo la cessazione dell’uso, T3 = 1 anno dopo l’inizio del ciclo):

L’aumento dell’ematocrito è un fattore di rischio per la trombosi.

Come già detto, un ematocrito più alto rende il sangue più viscoso. Di conseguenza, aumenta il rischio di eventi trombotici, sebbene vadano presi in considerazione anche i fattori della coagulazione. Questo fenomeno è più evidente nei pazienti affetti da policitemia vera. Malattia in cui il midollo osseo produce in eccesso globuli rossi e, comunemente, anche globuli bianchi e piastrine (trombociti). La concentrazione mediana di emoglobina riscontrata in un’ampia coorte di pazienti con policitemia vera era del 57% (negli uomini) [10]. In rare occasioni, questi pazienti possono avere valori di ematocrito superiori al 70%. Il valore più alto registrato in questa coorte è stato di ben il 78%. Nel 18% di questi pazienti è stata riscontrata una complicanza trombotica arteriosa prima o al momento della diagnosi, e una trombosi venosa nel 5,4% (L’età media era di 59 anni). Si tratta di un dato piuttosto elevato, poiché il tasso di incidenza della trombosi venosa è di circa 1 per 1.000 anni-persona nel gruppo di età 55-59 [11]. Il rischio di trombosi venosa è semplicemente piuttosto basso all’inizio della vita, ma inizia ad aumentare sostanzialmente dopo i 50-60 anni, con un picco di incidenza di 7,9 per 1.000 anni-persona nella fascia di età 80-84 anni. Il rischio per tutta la vita è dell’8%.
Naturalmente, considerare i pazienti affetti da policitemia vera non è un paragone equo: anche loro, come già detto, producono comunemente globuli bianchi e trombociti.
Diamo un’occhiata allo studio norvegese di Tromsø [12]. Hanno seguito 26.108 soggetti nel tempo (follow-up mediano di 12,5 anni) per mettere in relazione gli eventi tromboembolici venosi con i livelli di ematocrito. Hanno corretto per età, indice di massa corporea e fumo. Ovviamente ci sono altri fattori che avrebbero potuto influenzare i risultati e che non sono stati corretti, ma almeno questo corregge alcuni importanti fattori confondenti. Lo studio ha dimostrato che per ogni aumento del 5% dell’ematocrito c’era un aumento del 33% della probabilità di un evento tromboembolico venoso (negli uomini).
Per mettere in prospettiva questo aumento del rischio: i ricercatori hanno riscontrato circa 1,6 eventi tromboembolici venosi ogni 1.000 anni-persona negli uomini con un ematocrito medio (43-46%). Quindi, se si ha un livello medio di ematocrito, ci sarebbe l’1,6% di probabilità di un evento tromboembolico nei 10 anni successivi. Se il vostro ematocrito fosse del 5% più alto, cioè 48-51%, il rischio aumenterebbe del 33%: 2.1%. Naturalmente questo dato non è lineare per sempre, ma credo che fornisca una buona indicazione dell’aumento del rischio di trombosi venosa dovuto all’aumento dell’ematocrito indotto dagli AAS.
Un altro studio danese ha riscontrato un rischio di tromboembolismo venoso superiore del 26% negli uomini con un ematocrito superiore al 48% rispetto a quelli con un ematocrito compreso tra 41,1 e 45% [13]. Tuttavia, questo dato non era statisticamente significativo. Gli autori riportano anche i rischi di trombosi arteriosa nel cervello e nel cuore. Si è registrato un aumento non statisticamente significativo del 27% nel primo caso e un aumento statisticamente significativo del 46% nel secondo, confrontando gli uomini con un ematocrito superiore al 48% con quelli con un ematocrito compreso tra 41,1 e 45%. I tassi di incidenza della trombosi arteriosa nel cervello e nel cuore sono paragonabili a quelli della tromboembolia venosa.
L’aspetto importante è che, pur essendoci un aumento sostanziale del rischio relativo, il rischio assoluto rimane basso. Questo vale soprattutto per le persone di giovane età (meno di 40 anni) e in assenza di altri fattori di rischio (ad esempio, un precedente evento trombotico o un disturbo della coagulazione come il fattore V Leiden). L’opportunità o meno di intervenire per contrastare l’aumento del rischio di trombosi dovuto all’aumento dell’ematocrito AAS-indotto sembra quindi dipendere in larga misura dalla presenza di altri fattori di rischio. Anche se si potrebbe sostenere che, in un certo senso, l’uso di steroidi anabolizzanti è di per sé un fattore di rischio. Dopo tutto, ha un impatto negativo su più di un semplice ematocrito.
Trattamento:
Forse il trattamento migliore consiste nel ridurre notevolmente il dosaggio (ben al di sotto dei 500mg settimanali) o nell’interrompere del tutto l’uso di AAS [tornando in fisiologia controllata]. In questo modo si abbasserà l’ematocrito, con un effetto completo dopo un paio di mesi, e si annullerà il rischio. Tuttavia, questo non è probabilmente il metodo più gradito per contrastare questo problema.
Una pratica che vedo comunemente eseguita è quella di assumere un basso dosaggio di CardioAspirina (Acido Acetilsalicilico con gastroprotettore). Sebbene non influisca sui livelli di ematocrito, è ampiamente utilizzata per la prevenzione delle malattie cardiovascolari [14]. Più precisamente, è utilizzata nella prevenzione secondaria delle malattie cardiovascolari. Previene la coagulazione del sangue inibendo un enzima chiamato ciclossigenasi (COX) nei trombociti. Se da un lato riduce il rischio di trombosi, dall’altro aumenta il rischio di emorragie. E, naturalmente, non solo il sanguinamento del dito tagliato mentre si taglia il pollo. Ma anche di emorragie interne, come l’ictus emorragico. I benefici devono quindi essere attentamente soppesati rispetto ai rischi del suo utilizzo. Attualmente, le linee guida europee sulla prevenzione delle malattie cardiovascolari nella pratica clinica ne sconsigliano l’uso nella prevenzione primaria (anche se questo potrebbe cambiare per alcune popolazioni, come i diabetici) [15].
Un dosaggio comune a questo scopo è di 81 o 100mg al giorno. È difficile fare una raccomandazione generale per il suo uso, anche se si può fare un’argomentazione per coloro che hanno un rischio maggiore (ma forse è saggio interrompere del tutto l’uso di AAS sovraffisiologici in questo caso).
Come nota finale, nelle settimane successive all’interruzione del farmaco vi è un aumento del rischio di eventi trombotici [16, 17]. Pertanto, anche l’assunzione e la sospensione frequente del farmaco sono sconsigliate.
Prima di un eventuale uso, è caldamente consigliato, oltre il parere medico, un controllo accurato dei fattori che regolano la coagulazione: tempo di tromboplastinaparziale attivata (aPTT), tempo di protrombina (PT) Fibrinogeno, D-Dimero, Antitrombina e Inibitore C1 Esterasi.
La Nattochinasi è un enzima digestivo (una proteasi alcalina) presente nel natto, un alimento tradizionale giapponese fermentato. La Nattochinasi ha mostrato effetti fibrolitici diretti sulla fibrina (1g di Nattō equivalente a circa 40CU di plasmina o 1600IU di urochinasi), sul substrato plasmina S-2251 (tasso di 68. 5nmol/min/mL), anche se è stato notato un fallimento della fibrinolisi con il substrato urochinasi S-2444 e il substrato elastasi S-2484. La Nattochinasi, in vitro e nei confronti della fibrina, sembra avere una maggiore attività trombolitica rispetto alla plasmina sierica.[https://www.ncbi.nlm.nih.gov/][https://www.ncbi.nlm.nih.gov/][https://www.ncbi.nlm.nih.gov/]
Il meccanismo d’azione attualmente ipotizzato è l’inattivazione dell’inibitore 1 dell’attivatore del plasminogeno (PAI-1) che determina un contemporaneo aumento del livello di attivatore del plasminogeno tissutale (tPA). [Questo è stato dimostrato nel siero in seguito all’ingestione orale di Nattochinasi, anche se con una certa variabilità interindividuale (con nattokinase orale a 1.300 mg tre volte al giorno), con un aumento del tPA di breve durata, solo 3 ore dopo la somministrazione orale. L’aumento del tPA, almeno in vitro, è stato osservato con nattokinase trattata termicamente che non ha alcuna attività fibrinolitica intrinseca ed è probabilmente dovuto a peptidi bioattivi.
È stata osservata una diminuzione del fibrinogeno sierico nei ratti alimentati con 2,6mg/g di Nattochinasi nella dieta (tale diminuzione non è stata riscontrata con la Nattochinasi trattata termicamente). L’ingestione orale di Nattochinasi per 2 mesi sembra ridurre il fibrinogeno sierico nell’uomo nell’ordine del 7-10%, con effetti di riduzione simili sul fattore VII (7-14%) e sul fattore VIII (17-19%). Non sono state riscontrate differenze apparenti nell’efficacia tra persone sane, con patologie cardiovascolari o in dialisi.
In vitro, la Nattochinasi mostra proprietà fibrinolitiche dirette che possono degradare la fibrina e ridurre il rischio di complicazioni cardiovascolari. Questo potrebbe però essere un depistaggio meccanicistico, in quanto questa attività diretta si perde con la distruzione dell’enzima (trattamento termico o digestione) e i peptidi della Nattochinasi sembrano aumentare i livelli di attivatore del plasminogeno, che ha anche un effetto fibrinolitico indiretto.
La Nattochinasi ha mostrato per la prima volta la sua efficacia in seguito alla somministrazione orale nei cani, dove il trombo è stato indotto sperimentalmente e gli effetti anti-clottici sono stati confermati tramite angiografia (il coagulo è stato eliminato entro 5 ore dall’ingestione orale). Un piccolo studio condotto su 12 persone a cui sono stati somministrati 12 g di nattō per 2 settimane (seguito da un periodo in cui sono stati ingeriti fagioli di soia bolliti per 2 settimane al posto del nattō) ha osservato che il consumo di nattō era associato a una maggiore attività fibrinolitica; ciò è stato successivamente replicato con un supplemento di Nattochinasi a 1.300mg assunto tre volte al giorno.
Un intervento sull’uomo che ha utilizzato un integratore combinato (Nattochinasi e Picnogenolo) in 186 soggetti ad alto rischio di trombosi venosa profonda prima di un volo di lunga durata (7-8 ore) ha osservato che, mentre cinque persone nel gruppo placebo hanno sperimentato una trombosi venosa profonda e due un trombo superficiale (7,6% del gruppo placebo), nel gruppo di intervento non è stato rilevato alcun trombo. Nel gruppo di intervento è stata rilevata una diminuzione dell’edema (15%), mentre nel gruppo placebo è stato rilevato un aumento (12%).
Non ci sono prove sufficienti sull’uomo che utilizzano la Nattochinasi isolatamente e che valutano la formazione di trombi per raccomandarne l’uso come farmaco anti-clottico, anche se sembra esserci qualche promessa. L’assunzione di nattō con la dieta potrebbe conferire un effetto protettivo simile, secondo uno studio preliminare sull’argomento.
Come per la CardioAspirina, la necessità di utilizzo andrebbe valutata per via esami dei fattori della coagulazione.

Nota: L’Acido Fitico, un estere diidrogenofosfato sestuplo dell’Inositolo (in particolare dell’isomero myo), chiamato anche Esacisfosfato di Inositolo (IP6) o polifosfato di inositolo, sembra avere effetti positivi sul controllo dell’ematocrito a dosaggi aneddotici di 1-2g/die. Ad oggi, non esiste sufficiente letteratura ad avvalorare l’effettiva efficacia terapeutica di questa molecola.
La flebotomia (salasso) è un modo per ridurre efficacemente l’ematocrito. Un modo per farlo è la donazione di sangue a una banca del sangue. Tuttavia, molti Paesi (e giustamente) limitano il numero di volte in cui è possibile farlo ogni anno. Vi sono paesi dove è limitato a cinque volte l’anno. Questo potrebbe non essere sufficiente a mantenere i valori nel range desiderato, dato che uno studio ha rilevato livelli di emoglobina persistentemente elevati in occasione di visite ripetute in un numero elevato di pazienti TRT che hanno donato il sangue [18]. Se la donazione di sangue non è sufficiente, si può sempre consultare un medico generico per eseguire una flebotomia terapeutica a intervalli più frequenti.

Tenete presente che ad ogni donazione di sangue si perde ferro. Di conseguenza, si corre il rischio di esaurire le proprie riserve di ferro e, consequenzialmente, anche l’emoglobina rimarrà molto bassa e si diventerà temporaneamente anemici. È possibile contrastare questo fenomeno integrando il ferro, ma questo riduce drasticamente il tempo necessario all’organismo per recuperare i livelli di emoglobina/ematocrito [19]. (nello studio è stato utilizzato un dosaggio di 37,5mg di ferro elementare al giorno). Pertanto, a intervalli più frequenti, è consigliabile un controllo con analisi del sangue.
Ricordiamoci, inoltre, che una flebotomia non monitorata nei tempi di prelievo può portare a rebound dell’ematocrito con peggioramento del quadro clinico ematico.
Conclusioni:
Abbiamo analizzato le cause del eritrocitosi AAS-indotta. Abbiamo visto come può essere gestita e risolta. Sappiamo che l’uso di anticoagulanti ha senso soprattutto se ci sono alterazioni dei fattori di coagulazione, e che il loro uso non è scevro da effetti avversi potenzialmente nefasti.

Non sarebbe nemmeno da dire, ma visto il livello del lettore medio nel capire i concetti è giusto sottolineare che l’uso di farmaci per ridurre l’eritropoiesi e, di conseguenza, l’ematocrito, come l’Hydroxyruea, l’Interferone alfa-2b, il Ruxolitinib e il Busulfano è caldamente sconsigliato per i possibili e gravi effetti collaterali che questi farmaci danno; e ovviamente perchè, come si è visto, non è necessario utilizzarli in caso di eritrocitosi AAS-indotta.
Gabriel Bellizzi [CEO BioGenTech]
Riferimenti:
- Rauf, Abdur, et al. “Hepcidin, an overview of biochemical and clinical properties.” Steroids 160 (2020): 108661.
- Barton, James C., Luigi F. Bertoli, and Barry E. Rothenberg. “Peripheral blood erythrocyte parameters in hemochromatosis: evidence for increased erythrocyte hemoglobin content.” Journal of Laboratory and Clinical Medicine 135.1 (2000): 96-104.
- Khan, Adnan Aman, et al. “Polycythemia and Anemia in Hereditary Hemochromatosis.” Cureus 12.4 (2020).
- Coviello, Andrea D., et al. “Effects of graded doses of testosterone on erythropoiesis in healthy young and older men.” The Journal of Clinical Endocrinology & Metabolism 93.3 (2008): 914-919.
- Bachman, Eric, et al. “Testosterone suppresses hepcidin in men: a potential mechanism for testosterone-induced erythrocytosis.” The Journal of Clinical Endocrinology & Metabolism 95.10 (2010): 4743-4747.
- Bachman, Eric, et al. “Testosterone induces erythrocytosis via increased erythropoietin and suppressed hepcidin: evidence for a new erythropoietin/hemoglobin set point.” Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences 69.6 (2014): 725-735.
- Bhasin, Shalender, et al. “Testosterone dose-response relationships in healthy young men.” American Journal of Physiology-Endocrinology And Metabolism (2001).
- Bhasin, Shalender, et al. “Older men are as responsive as young men to the anabolic effects of graded doses of testosterone on the skeletal muscle.” The Journal of Clinical Endocrinology & Metabolism 90.2 (2005): 678-688.
- Smit, Diederik L., et al. “Baseline characteristics of the HAARLEM study: 100 male amateur athletes using anabolic androgenic steroids.” Scandinavian journal of medicine & science in sports 30.3 (2020): 531-539.
- Tefferi, Ayalew, et al. “Survival and prognosis among 1545 patients with contemporary polycythemia vera: an international study.” Leukemia 27.9 (2013): 1874-1881.
- Bell, Elizabeth J., et al. “Lifetime risk of venous thromboembolism in two cohort studies.” The American journal of medicine 129.3 (2016): 339-e19.
- Brækkan, Sigrid K., et al. “Hematocrit and risk of venous thromboembolism in a general population. The Tromsø study.” haematologica 95.2 (2010): 270.
- Warny, Marie, et al. “Arterial and venous thrombosis by high platelet count and high hematocrit: 108 521 individuals from the Copenhagen General Population Study.” Journal of Thrombosis and Haemostasis 17.11 (2019): 1898-1911.
- Baigent, Colin, et al. “Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials.” Lancet 373.9678 (2009): 1849-1860.
- F. Hobbs, M. Piepoli, A. Hoes, S. Agewall, C. Albus, C. Brotons, A. Catapano, M. Cooney, U. Corra, B. Cosyns, et al. 2016 european guidelines on cardiovascular disease prevention in clinical practice. European Heart Journal, 37(29):2315–2381, 2016.
- M. Lordkipanidzé, J. G. Diodati, and C. Pharand. Possibility of a rebound phenomenon following antiplatelet therapy withdrawal: a look at the clinical and pharmacological evidence. Pharmacology & therapeutics, 123(2):178–186, 2009.
- L. A. G. Rodríguez, L. C. Soriano, C. Hill, and S. Johansson. Increased risk of stroke after discontinuation of acetylsalicylic acid a uk primary care study. Neurology, pages WNL–0b013e31820d62b5, 2011
- B. Chin-Yee, A. Lazo-Langner, T. Butler-Foster, C. Hsia, and I. Chin-Yee. Blood donation and testosterone replacement therapy. Transfusion, 57(3):578–581, 2017
- Kiss, Joseph E., et al. “Oral iron supplementation after blood donation: a randomized clinical trial.” Jama 313.6 (2015): 575-583.
