Nella seconda parte di questa serie di articoli dedicati alla alopecia androgenetica (e, quindi, anche AAS-correlata) ho discusso le modalità di trattamento più convenzionali per tale condizione , ovvero le versioni orali e topiche di Finasteride e Minoxidil con accenni alla Dutasteride. In questo articolo ne illustrerò alcune di più nuove o sperimentali, come gli Antagonisti topici del Recettore degli Androgeni, la terapia con plasma ricco di piastrine (PRP), i modulatori del segnale di Wnt e le Prostaglandine.
Antagonisti del Recettore degli Androgeni:
L’obbiettivo ottenuto con gli Antagonisti del Recettore degli Androgeni è simile a quello degli inibitori della 5α-reduttasi, come la Finasteride e la Futasteride: ridurre l’azione androgenica. Il meccanismo è tuttavia diverso. Gli inibitori della 5α-reduttasi bloccano la conversione del Testosterone nel più potente androgeno Diidrotestosterone (DHT). In questo modo, l’effetto androgeno del Testosterone non viene amplificato nel tessuto del cuoio capelluto. Gli Antagonisti del Recettore degli Androgeni bloccano l’azione androgena impedendo agli androgeni di legarsi al loro recettore. In questo modo, la loro azione viene bloccata a livello del Recettore degli Androgeni stesso, e quindi si rivolge praticamente a tutti gli androgeni piuttosto che a quello specifico, come nel caso degli inibitori della 5α-reduttasi. Il problema è che i suoi effetti devono rimanere localizzati al cuoio capelluto. Bloccare l’azione complessiva degli androgeni in altri tessuti, come quello muscolare, è decisamente indesiderato.
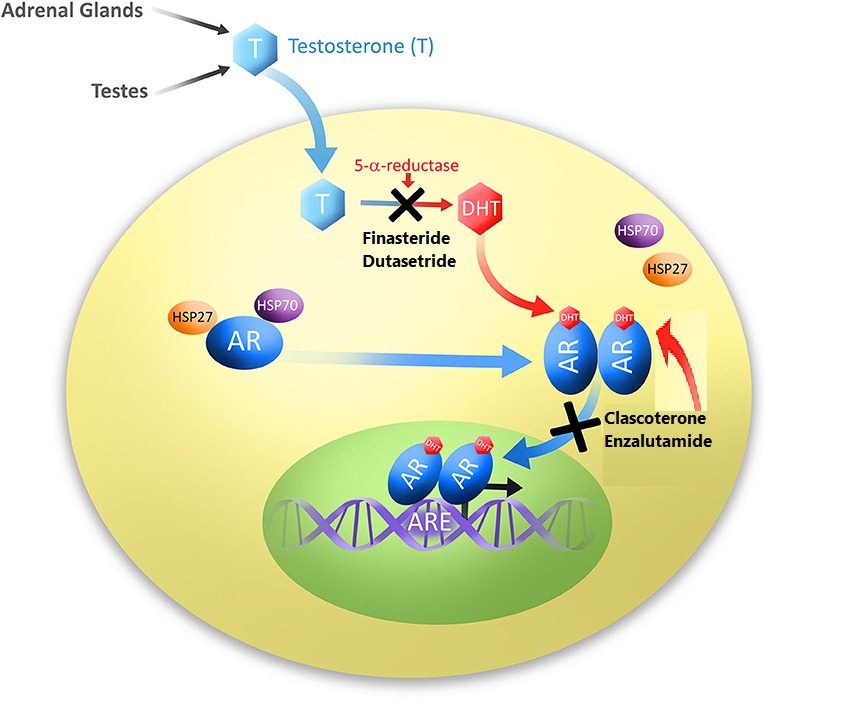
Uno di questi farmaci, attualmente in fase di sperimentazione clinica, è il Clascoterone (Breezula). La ricerca è condotta dall’azienda farmaceutica Cassiopea S.p.A. . Ricerche in vitro su cellule di papilla dermica umana hanno dimostrato che il composto è efficace nell’inibire l’azione degli androgeni [1]. Lo fa in misura maggiore rispetto all’Enzalutamide, un altro antagonista del recettore degli androgeni utilizzato nel trattamento del cancro alla prostata, e in misura paragonabile alla Finasteride. L’affinità per il AR è relativamente bassa, circa 100 volte inferiore all’affinità del DHT per il AR [2]. Questo non è un vero problema, si può rimediare semplicemente assicurandosi che le cellule del follicolo pilifero siano esposte a una concentrazione sufficientemente alta della molecola. Tuttavia, ci si chiede quale sia la sua affinità per altri recettori steroidei, come quello dei glucocorticoidi. Se non ha una specificità sufficientemente elevata per il Recettore degli Androgeni, si possono ottenere effetti fuori bersaglio legandosi a questi altri recettori. A sua volta, questo può portare a effetti collaterali. Anche questo non è necessariamente un problema se l’esposizione sistemica è minima o inesistente.
Nell’agosto 2020, la FDA ha approvato il Clascoterone crema 1 % (Winlevi) per il trattamento dell’acne vulgaris in pazienti di età pari o superiore a 12 anni [3]. È quindi in linea con le aspettative utili al fine di ottenere l’approvazione anche per l’alopecia androgenetica. Infatti, nel 2019 è stato completato uno studio di fase 2 su 404 uomini per il trattamento dell’alopecia androgenetica (EudraCT #2016-003733-23).
I soggetti sono stati trattati con una soluzione da 1mL di Clascoterone al 2,5, 5,0 o 7,5% da applicare due volte al giorno, oppure 0,0 (veicolo) e 7,5% una volta al giorno, o veicolo due volte al giorno, per un anno. Sebbene i risultati non siano stati pubblicati nella letteratura scientifica, possono essere consultati online nel registro degli studi clinici dell’UE. Il numero totale di peli nell’area è aumentato in modo significativo rispetto al gruppo con soluzione veicolante in tutti i gruppi di trattamento. (Soprattutto perché nel gruppo con soluzione veicolante si è verificata una diminuzione significativa del numero totale di capelli, che riflette la progressione dell’alopecia androgenetica). È interessante notare che le valutazioni della crescita dei capelli sono state simili tra tutti i gruppi, anche se un aumento è stato riportato con una frequenza leggermente maggiore nei gruppi di trattamento (dal 56,1 al 61,8% dei soggetti rispetto al 50,0% del gruppo con il solo veicolo). Gli eventi avversi sono stati simili tra i gruppi.
L’esposizione sistemica della crema all’1% utilizzata per il trattamento dell’acne è minima [4]. I dati relativi alla soluzione topica non sono purtroppo disponibili nella letteratura pubblicata. Gli effetti collaterali sessuali non sono stati monitorati nel loro studio, quindi è difficile ricavare una potenziale esposizione sistemica sulla base di questi risultati.
Come nota finale: è interessante vedere che nel 2016 è stato completato uno studio in cui una soluzione di clascoterone è stata confrontata con una soluzione di minoxidil al 5% o un placebo per il trattamento dell’alopecia androgenetica (NCT02279823). I risultati non sono mai stati pubblicati nella letteratura scientifica. Le ragioni possono essere molteplici, ma forse la più ovvia, dal punto di vista di un’azienda farmaceutica, è: risultati deludenti. Ho l’impressione che non abbia fatto molto bene rispetto al minoxidil.
Un altro antagonista del recettore degli androgeni che sta facendo il giro di internet è RU58841 (noto anche come PSK-3841 o HMR-3841). Nel 2004 era in fase di sperimentazione II, ma da allora lo sviluppo del farmaco è stato interrotto. All’epoca era oggetto di ricerca da parte di Proskelia, l’unità francese del gruppo ProStrakan. Proskelia è stata poi acquisita da Galapagos nel 2006. È importante notare che i risultati degli studi clinici non sono mai stati riportati in letteratura. Si dice che ciò sia dovuto a motivi finanziari. Questo sembra plausibile, Proskelia era un’azienda relativamente piccola (visto che è stata acquisita per 16,5 milioni di dollari nel 2006). I costi degli studi clinici di fase 3 sono molto elevati. Si parla di almeno qualche migliaio di dollari per soggetto (in media costano diverse decine di migliaia di dollari per soggetto). Se si moltiplica questa cifra per i 1000-2000 soggetti necessari per una sperimentazione di questo tipo, diventa subito evidente che molto probabilmente hanno dovuto fare affidamento sugli investitori per realizzarla. Ciononostante, se Galapagos fosse stata interessata a questo composto, avrebbe potuto facilmente finanziare uno studio di fase 3. Va ricordato che la ragione principale per cui i farmaci non entrano nella fase 3 è la mancanza di efficacia o di sicurezza.
Mostra un’elevata affinità per il recettore degli androgeni umani, leggermente inferiore a quella del testosterone (il che è notevole, dato che la maggior parte degli antagonisti ha un’affinità sostanzialmente inferiore) [5]. Sono stati pubblicati alcuni dati di studi su animali. Mostra un’efficacia simile a quella della finasteride nei macachi dalla coda monca [6]. In topi nudi femmina condizionati con testosterone, lo xenotrapianto di tessuto del cuoio capelluto di uomini calvi ha mostrato risultati più favorevoli rispetto ai controlli [7]. Onestamente, questi studi sono preclinici per un motivo: forniscono solo un’indicazione sul fatto che potrebbe essere interessante o meno proseguire con gli studi clinici. Non forniscono altre informazioni, quindi li cito solo per completezza. Senza dati di sperimentazione clinica non si può dire molto su questo composto.
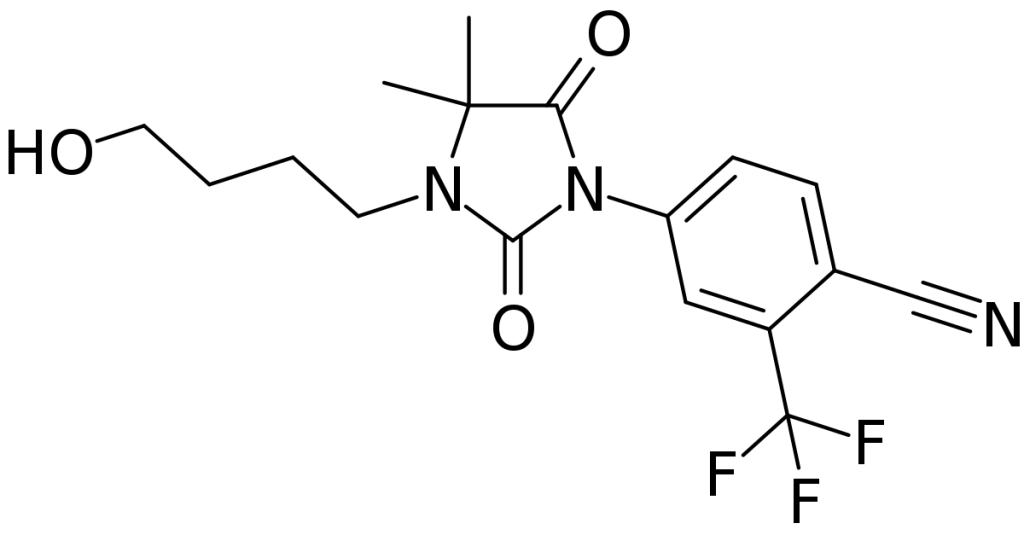
Un’ultima osservazione che vorrei fare è che è stato suggerito che RU58841 può influenzare il recettore degli androgeni in modo allosterico [8]. Ciò significa che influisce sulla sua funzione legandosi a un sito diverso da quello di legame con il ligando (dove si legherebbero gli androgeni). Questo ha un’implicazione pratica molto importante. Se c’è un legame competitivo, la sua efficacia dipende dalla concentrazione di altri ligandi (come il DHT). In caso di legame allosterico, ciò non avviene, per cui il suo effetto è indipendente dalle concentrazioni di ligandi, il che sarebbe ideale per i consumatori di steroidi anabolizzanti, in quanto le dosi sovrafisiologiche utilizzate non influirebbero sulla sua efficacia. Purtroppo non sono in grado di accedere allo studio originale che ipotizza questa caratteristica.
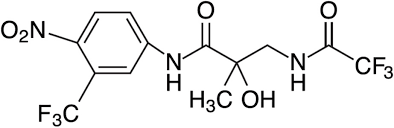
Un altro antagonista topico dei recettori degli androgeni è il Fluridil, noto anche come topilutamide e venduto con il nome commerciale di Eucapil. È approvato per uso cosmetico nella Repubblica Ceca. È stato pubblicato uno studio clinico su piccola scala, ma i risultati non sembrano promettenti [9]. 43 soggetti con alopecia androgenetica sono stati randomizzati a ricevere una soluzione topica di Fluridil al 2% o un placebo per 9 mesi. Il conteggio dei capelli in fase anagen o telogen è stato effettuato a 0, 3, 6 e 9 mesi. Mentre nel gruppo del Fluridil si è registrato un aumento maggiore dei peli in fase anagen e una diminuzione maggiore dei peli in fase telogen rispetto al placebo a 3 mesi, non c’è stata alcuna differenza significativa a 9 mesi. (È piuttosto deludente. Studi futuri (che a questo punto non mi aspetto) potrebbero chiarire se si tratta di una peculiarità dello studio o meno. Si potrebbe ipotizzare che sia necessaria una maggiore concentrazione di soluzione di fluridil perché sia efficace.
Terapia con Plasma Ricco di Piastrine (PRP):
Credo che una piccola introduzione sul Plasma Ricco di Piastrine (PRP) sia necessaria. Che cos’è in realtà? In sostanza, è un concentrato di sangue con un’alta presenza di piastrine e la rimozione dei globuli rossi. Viene prodotto mediante un processo chiamato centrifugazione differenziale [9]. Il PRP prodotto contiene una concentrazione di piastrine da 2 a 8 volte superiore a quella del sangue intero. La concentrazione ottenuta dipende dal dispositivo e dal metodo utilizzato. Di solito, per preparare il PRP si prelevano circa 30ml di sangue.
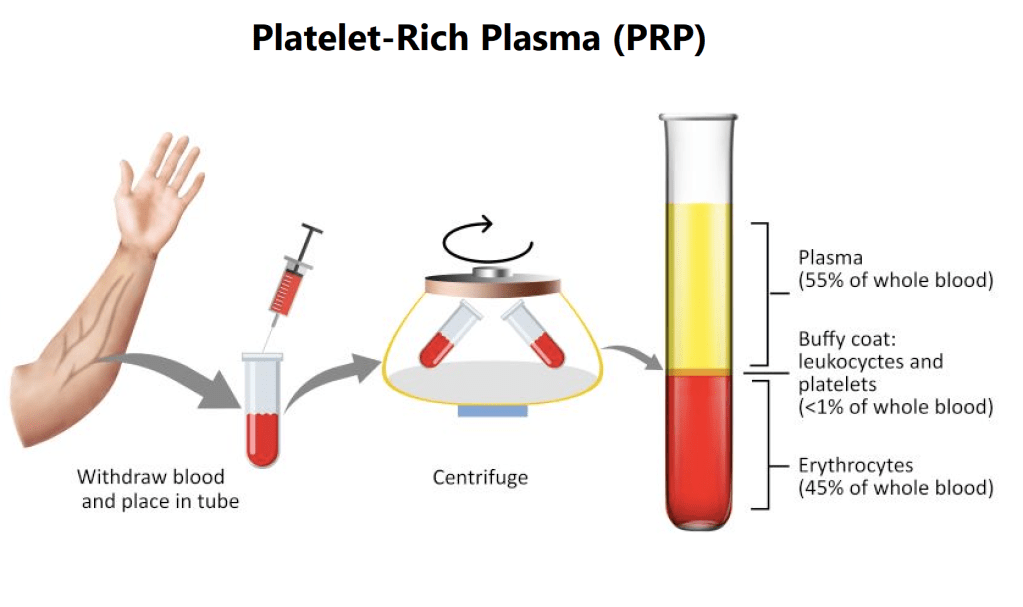
Le piastrine sono importanti per la coagulazione, ma contengono anche una serie di fattori di crescita e citochine [10]. Queste molecole di segnalazione sono il motivo per cui vengono impiegate in diversi campi medici, tra cui la dermatologia, ad esempio nel trattamento dell’alopecia androgenetica. Le piastrine rilasciano questi fattori di crescita e citochine al momento dell’attivazione, che può avvenire dopo l’iniezione nel cuoio capelluto da parte dell’organismo oppure aggiungendo sali di calcio o trombina alle piastrine prima dell’iniezione. Si ritiene che questi fattori di crescita agiscano sulle cellule del follicolo pilifero, esercitando così il loro effetto benefico nel trattamento dell’alopecia (androgenetica).
Poiché non esiste una procedura standardizzata per l’applicazione del PRP, gli studi possono dimostrare risultati diversi a seguito di procedure PRP differenti. Sebbene manchino prove valide, si ritiene che la pre-attivazione delle piastrine prima dell’iniezione e la preparazione del PRP mediante il cosiddetto protocollo a doppia centrifuga portino a risultati migliori.
Una meta-analisi del 2020 ha valutato gli effetti della terapia con PRP come trattamento dell’alopecia androgenetica [11]. Ha incluso 30 studi randomizzati e controllati per l’analisi qualitativa e 5 di questi hanno potuto essere utilizzati per l’analisi quantitativa. La terapia con PRP è risultata efficace nell’aumentare la densità e lo spessore dei capelli. Di fatto, è apparsa più efficace del Minoxidil e della Finasteride. Mentre una meta-analisi del 2017 ha rilevato che la Finasteride e il Minoxidil topico al 5% aumentano la densità dei capelli rispettivamente di 18 e 15 capelli per cm quadrato, la terapia con PRP ha portato a un aumento medio di 33 capelli per cm quadrato.
Gli eventi avversi sono stati riportati nella metà degli studi e si sono limitati a dolore, eritema (rossore) ed edema locale, sanguinamento puntuale, mal di testa transitorio, sonnolenza, ematomi e sensibilità del cuoio capelluto. Non sono stati segnalati eventi avversi gravi. Nel complesso, la terapia con PRP è molto promettente.
Modulatori della via Wnt/β-catenina:
La via Wnt/β-catenina è coinvolta in numerosi processi cellulari. E, come si è scoperto, la via è anche coinvolta nella crescita e nello sviluppo del follicolo pilifero [12, 13]. La via canonica prevede il legame di una proteina Wnt a Frizzled, il suo recettore sulla superficie cellulare, e al suo co-recettore Proteina legata al recettore LDL (LRP) [14]. In assenza di segnalazione Wnt, la β-catenina viene continuamente degradata, mentre con l’attivazione da parte di una proteina Wnt, la β-catenina inizia ad accumularsi nel citosol. La β-catenina trasloca poi nel nucleo dove stimolerà la trascrizione dei geni bersaglio di Wnt.
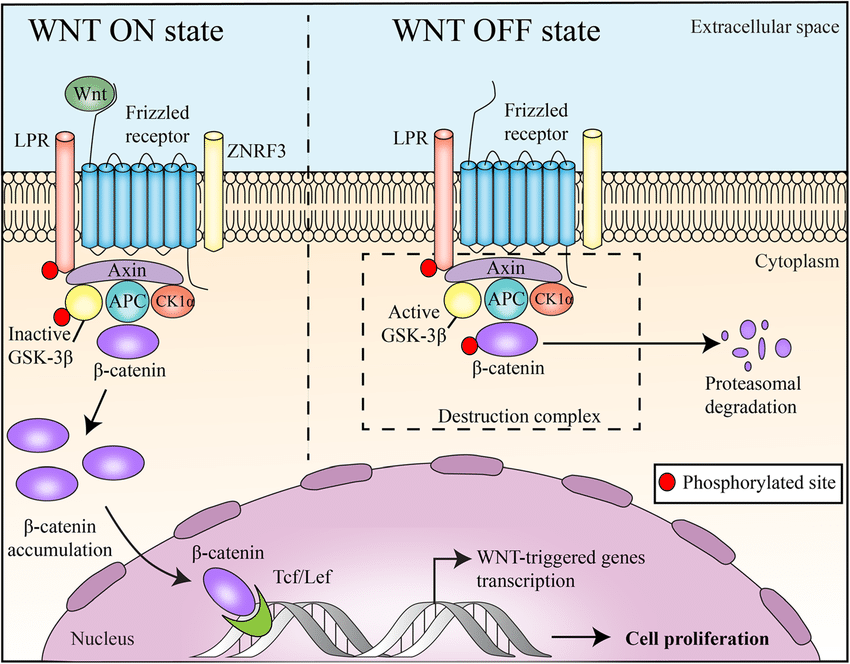
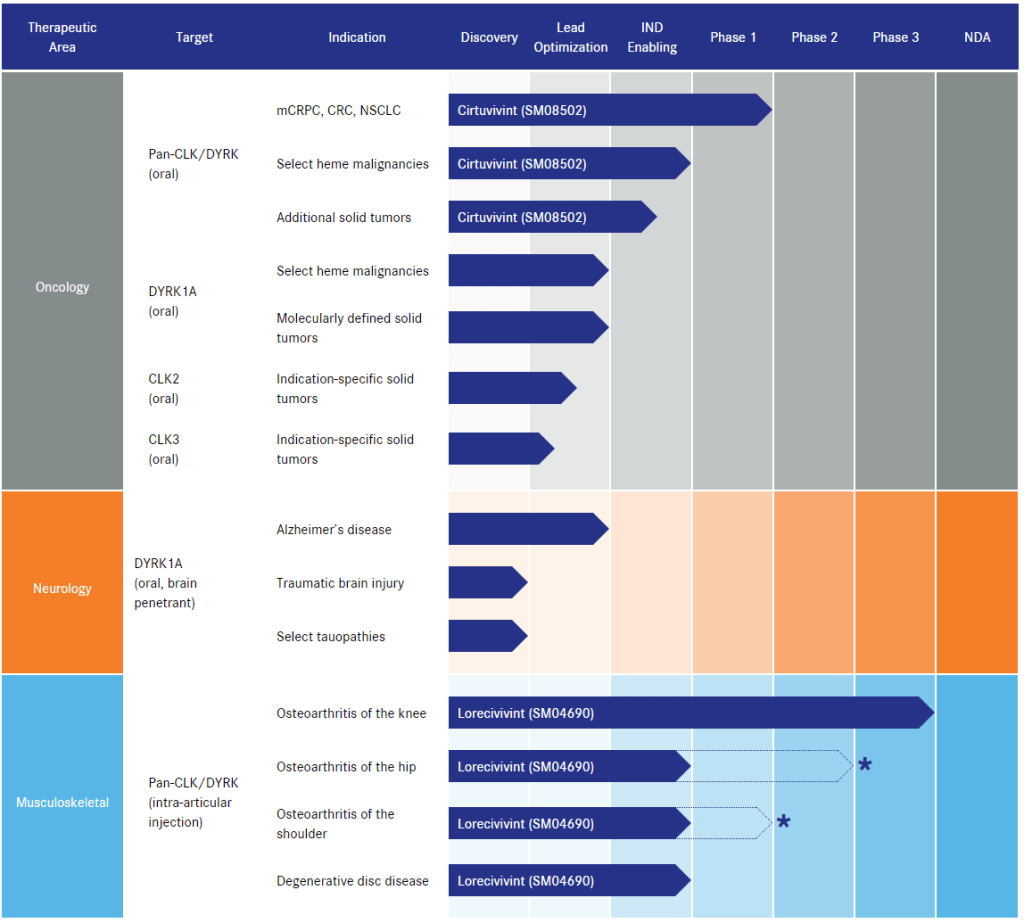
Un attivatore di Wnt attualmente in fase di studio per il trattamento dell’alopecia androgenetica è il SM04554 (noto anche come Dalosirvat). È stato sviluppato da Biosplice Therapeutics (precedentemente nota come Samumed) e sono stati registrati e completati 3 studi clinici: NCT02275351, NCT02503137, NCT03742518. Questi numeri NCT possono essere consultati sul sito www.clinicaltrials.gov per visualizzarne i dettagli. Lo studio registrato con il numero NCT03742518 è uno studio di fase II/III con 675 partecipanti che sono stati randomizzati in tre gruppi. Un gruppo ha utilizzato una soluzione di SM04554 allo 0,15% una volta al giorno, un altro ha utilizzato una soluzione allo 0,25% una volta al giorno e il terzo gruppo ha ricevuto una soluzione veicolo. Lo studio è durato 48 settimane e si è concluso il 31 dicembre 2020. Purtroppo non sono ancora stati pubblicati i risultati dello studio clinico nella letteratura scientifica. Tuttavia, facendo qualche ricerca su Google, è possibile trovare alcune diapositive utilizzate durante una presentazione al Congresso Internazionale di Dermatologia e Cosmetologia (INDERCOS) nel marzo 2019. In esse vengono presentati alcuni risultati di uno studio di fase II, tra cui questa diapositiva:

I partecipanti hanno ricevuto l’intervento per 90 giorni, dopodiché è stato effettuato un follow-up 45 giorni dopo. Ciò che mi colpisce è che la soluzione allo 0,25% ha fatto molto peggio della soluzione allo 0,15% e che la soluzione allo 0,15% ha iniziato a funzionare solo dopo aver terminato la somministrazione. (In ogni caso, i risultati non mi entusiasmano. E sospetto che anche la sperimentazione di fase III non sia andata molto bene. Se si utilizza la Wayback Machine per dare un’occhiata al sito web di Biosplice Therapeutics, si può vedere che SM04554 è ancora elencato nell’agosto 2021. Se si guarda oggi, il farmaco è scomparso e non è più presente nemmeno nella pagina della pipeline. Hanno rinunciato al farmaco?
Quindi, dov’è finito il SM04554?
Nel complesso, i modulatori della via di segnalazione Wnt sono promettenti, ma forse dovremo aspettare ancora un po’ prima di vedere il primo di questa classe di farmaci approvato dalla FDA.
Prostaglandine:
Le Prostaglandine sono emerse come importanti regolatori del ciclo del follicolo pilifero (poiché alcuni farmaci basati su di esse, di cui parlerò più avanti, si sono rivelati in grado di provocare una crescita localizzata dei capelli/ipertricosi). Sono sintetizzate dall’acido grasso arachidonico. In particolare, la Prostaglandina D2 (PGD2) è ritenuta responsabile dell’inibizione della crescita dei capelli nell’alopecia androgenetica [15]. La PGD2 è il prodotto di una reazione catalizzata dall’enzima Prostaglandina D2 Sintasi (PTGDS), il cui substrato è la Prostaglandina H2 (PGH2). La PGH2 è sintetizzata direttamente dall’Acido Arachidonico, una reazione catalizzata da un enzima ciclossigenasi (COX). Quindi, in poche parole:
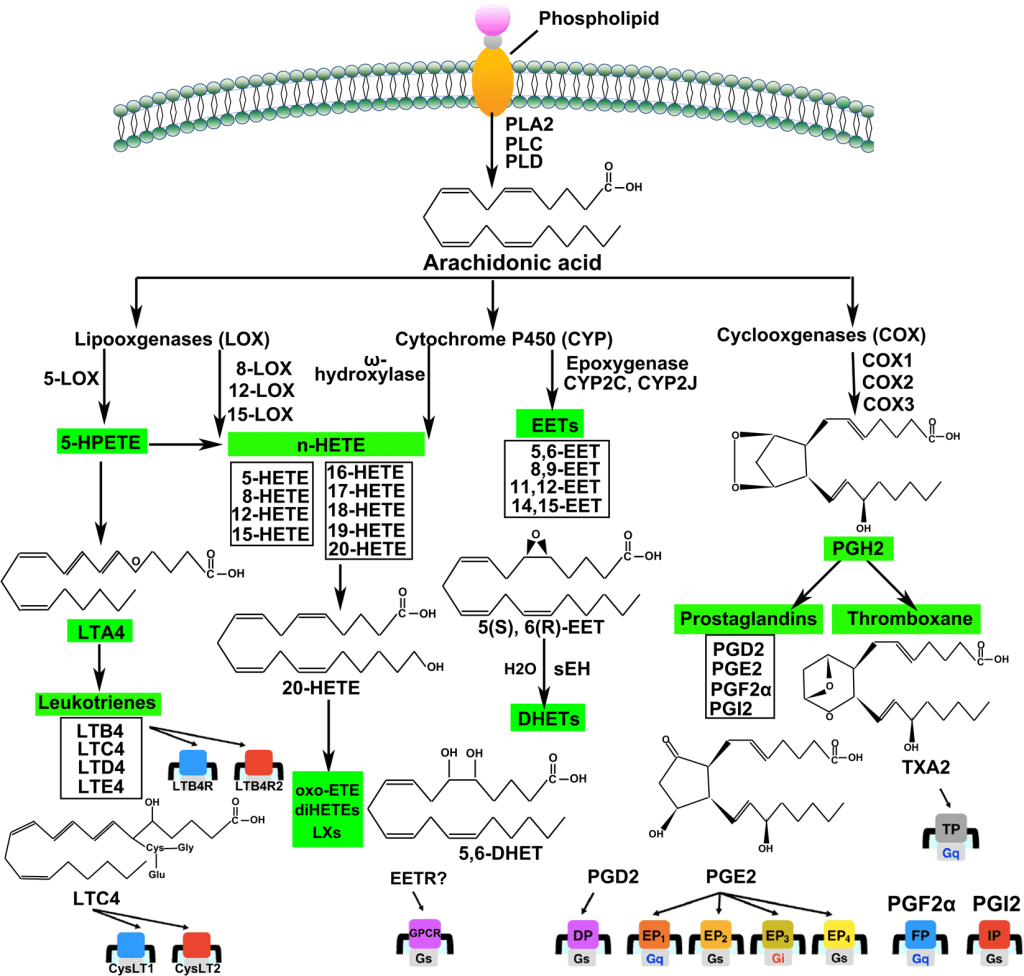
Acido Arachidonico (COX)-> PGH2 (PTGDS)-> PGD2
Al contrario, la Prostaglandina F2α (PGF2α) e la Prostaglandina E2 (PGE2) stimolano la crescita dei capelli [16]. Sia la PGF2α che la PGE2 derivano anche dalla PGH2. Il primo sintetizzato dalla PGF2α Sintasi e il secondo dalla PGE2 Sintasi.
Anche l’industria farmaceutica ha esplorato quest’area di ricerca per il trattamento dell’alopecia androgenetica. Alcuni farmaci che sono stati sviluppati sono una soluzione topica di Bimatoprost (un analogo della PGE2) e una soluzione topica di Latanoprost (un analogo della PGF2α). Entrambi i farmaci sono stati originariamente utilizzati per trattare l’ipertensione oculare o il glaucoma, in quanto abbassano la pressione oculare. Tuttavia, si è scoperto per caso che provocano la crescita dei peli delle ciglia (ipertricosi). Alcuni studi clinici su piccola scala hanno valutato i loro effetti e sembrano promettenti [17, 18].

Un altro farmaco è il Setipiprant, che agisce come Antagonista Selettivo del Recettore della Prostaglandina D2. Il farmaco è attualmente oggetto di studio da parte di Allergan Aesthetics e nell’ottobre 2021 sono stati pubblicati i risultati di uno studio di fase 2 [19]. I partecipanti hanno ricevuto il Setipiprant orale due volte al giorno (1g x 2 volte), 1mg di Finasteride una volta al giorno o un placebo, per 24 settimane. Sfortunatamente, però, non è stato possibile ottenere risultati migliori rispetto al placebo.
Penso che in futuro sentiremo ancora parlare di Prostaglandine (topiche), o di farmaci che potrebbero inibire la produzione di PGD2 inibendo l’enzima PTGDS (o di farmaci che stimolano la produzione di PGF2α o PGE2 stimolando i rispettivi enzimi che li sintetizzano).
Conclusione:
In questi tre articoli abbiamo imparato a conoscere una condizione (alopecia androgenetica) che interessa a diverso grado circa il 70% degli uomini ed il 40% delle donne. Abbiamo visto quali sono i farmaci approvati per il suo trattamento e quelli sperimentali più promettenti. Ora, sappiamo anche che con l’uso di dosi sovrafisiologiche di AAS riducono fortemente l’impatto apportato dagli inibitori della 5α-reduttasi i quali, comunque, interessano per lo più il Testosterone essendo il substrato principale per le 5α-reduttasi. Discorso diverso potrebbe essere fatto per ciò che concerne l’uso di soluzioni topiche contenenti Antagonisti del Recettore degli Androgeni. Ma, ad oggi, su questo punto non possiamo fare altro che analizzare la letteratura e ipotizzare.
Avrei sicuramente potuto parlare del potenziale effetto del TB-500 sulla sostanziale crescita di nuovi peli nella barba. La letteratura scientifica indica anche che la Timosina beta-4 attiva le cellule staminali nei follicoli (Questo è potenzialmente rilevante, poiché il TB-500 è, approssimativamente, un frammento della Timosina beta-4). È stato osservato che le applicazioni topiche giornaliere di TB-500 accelerano la crescita dei capelli. È stato osservato anche che i capelli risultanti sono più spessi, più scuri e più densi. Nel complesso, i risultati ottenuti su animali [topi e ratti] suggeriscono che, oltre ai suoi noti effetti angiogenici e di guarigione delle ferite, la Timosina β4 ( e potenzialmente il TB500) possa essere un modulatore naturale della crescita dei capelli che agisce stimolando la migrazione delle cellule staminali, la produzione di proteasi e la differenziazione. Attenzione però! Qui non si parla di una “resurrezione” del bulbo miniaturizzato e morto tipico della alopecia adrogenetica. Si parla di follicoli derivanti da sviluppo di cellule staminali, indi “nuovi”. Ma tutto questo rappresenta, ad oggi, poco più di una pura ipotesi nell’uomo.
L’unica soluzione, se la “rasata a 0” non è contemplata, è ovviamente il trapianto. Ma ciò non toglie che esso possa risultare migliorato da una combinazione di fattori iatrogeni, come quelli descritti in questo lavoro.
Gabriel Bellizzi [CEO BioGenTech]
Riferimenti:
- Rosette, Caridad, et al. “Cortexolone 17α-propionate (clascoterone) is an androgen receptor antagonist in dermal papilla cells in vitro.” Journal of drugs in dermatology: JDD 18.2 (2019): 197-201.
- Celasco, Giuseppe, et al. “Biological profile of cortexolone 17a-propionate (CB-03-01), a new topical and peripherally selective androgen antagonist.” Arzneimittelforschung 54.12 (2004): 881-886.
- Dhillon, Sohita. “Clascoterone: first approval.” Drugs (2020): 1-6.
- Mazzetti, Alessandro, et al. “Pharmacokinetic profile, safety, and tolerability of clascoterone (cortexolone 17-alpha propionate, CB-03-01) topical cream, 1% in subjects with acne vulgaris: an open-label phase 2a study.” Journal of drugs in dermatology: JDD 18.6 (2019): 563-563.
- Battmann, T., et al. “RU 58841, a new specific topical antiandrogen: a candidate of choice for the treatment of acne, androgenetic alopecia and hirsutism.” The Journal of Steroid Biochemistry and Molecular Biology 48.1 (1994): 55-60.
- Uno, H., et al. “Follicular regrowth with 5 α-reductase inhibitor (finasteride) or androgen receptor blocker (RU58841) in the bald scalp of the stumptailed macaque.” Journal of Investigative Dermatology 4.104 (1995): 658.
- De Brouwer, B., et al. “A controlled study of the effects of RU58841, a non‐steroidal antiandrogen, on human hair production by balding scalp grafts maintained on testosterone‐conditioned nude mice.” British Journal of Dermatology 137.5 (1997): 699-702.
- Poulos, Georgann A., and Paradi Mirmirani. “Investigational medications in the treatment of alopecia.” Expert opinion on investigational drugs 14.2 (2005): 177-184.
- Dhurat, Rachita, and M. S. Sukesh. “Principles and methods of preparation of platelet-rich plasma: a review and author’s perspective.” Journal of cutaneous and aesthetic surgery 7.4 (2014): 189.
- Alves, Rubina, and Ramon Grimalt. “A review of platelet-rich plasma: history, biology, mechanism of action, and classification.” Skin appendage disorders 4.1 (2018): 18-24.
- Evans, Adam G., et al. “Platelet-rich plasma as a therapy for androgenic alopecia: a systematic review and meta-analysis.” Journal of Dermatological Treatment (2020): 1-14.
- Beaudoin, Gerard MJ, et al. “Hairless triggers reactivation of hair growth by promoting Wnt signaling.” Proceedings of the National Academy of Sciences 102.41 (2005): 14653-14658.
- Lei, Ming-Xing, Cheng-Ming Chuong, and Randall B. Widelitz. “Tuning Wnt signals for more or fewer hairs.” Journal of Investigative Dermatology 133.1 (2013): 7-9.
- Clevers, Hans, and Roel Nusse. “Wnt/β-catenin signaling and disease.” Cell 149.6 (2012): 1192-1205.
- Garza, Luis A., et al. “Prostaglandin D2 inhibits hair growth and is elevated in bald scalp of men with androgenetic alopecia.” Science translational medicine 4.126 (2012): 126ra34-126ra34.
- Johnstone, Murray A., and Daniel M. Albert. “Prostaglandin-induced hair growth.” Survey of ophthalmology 47 (2002): S185-S202.
- Blume-Peytavi, Ulrike, et al. “A randomized double-blind placebo-controlled pilot study to assess the efficacy of a 24-week topical treatment by latanoprost 0.1% on hair growth and pigmentation in healthy volunteers with androgenetic alopecia.” Journal of the American Academy of Dermatology 66.5 (2012): 794-800.
- Barrón-Hernández, Yevher Lorena, and Antonella Tosti. “Bimatoprost for the treatment of eyelash, eyebrow and scalp alopecia.” Expert opinion on investigational drugs 26.4 (2017): 515-522.
- DuBois, Janet, et al. “Setipiprant for Androgenetic Alopecia in Males: Results from a Randomized, Double-Blind, Placebo-Controlled Phase 2a Trial.” Clinical, Cosmetic and Investigational Dermatology 14 (2021): 1507.
