Introduzione, meccanismi di sintesi e azione
Gli acidi biliari sono acidi steroidei che si trovano principalmente nella bile dei mammiferi e di altri vertebrati. Diverse forme molecolari di acidi biliari possono essere sintetizzate nel fegato da diverse specie.[1] Gli acidi biliari sono coniugati con Taurina o Glicina nel fegato e i sali di Sodio e di Potassio di questi acidi biliari coniugati sono chiamati sali biliari.[2][3][4]
Gli acidi biliari primari sono quelli sintetizzati dal fegato. Gli acidi biliari secondari derivano da azioni batteriche nel colon. Nell’uomo, l’Acido Taurocholico e l’Acido Glicocolico (derivati dell’Acido Colico) e l’Acido Taurochenodesossicolico e l’Acido Glicocchenodesossicolico (derivati dell’Acido Chenodesossicolico) sono i principali sali biliari nella bile e hanno approssimativamente la stessa concentrazione in essa.[5] Si trovano anche i sali coniugati dei loro derivati 7-alfa-deidrossilati, Acido Desossicolico e Acido Litocolico, con derivati degli acidi Colico, Chenodesossicolico e Desossicolico che rappresentano oltre il 90% degli acidi biliari umani.[5]

Gli acidi biliari rappresentano circa l’80% dei composti organici presenti nella bile (altri sono Fosfolipidi e Colesterolo).[5] Una maggiore secrezione di acidi biliari produce un aumento del flusso biliare. La funzione principale degli acidi biliari è quella di consentire la digestione di grassi e oli alimentari agendo come un tensioattivo che li emulsiona in micelle, [6] consentendo loro di essere sospesi colloidalmente nel chimo prima dell’ulteriore processazione. Hanno anche azioni ormonali sistemiche (in tutto il corpo), in particolare attraverso il Recettore X farnesoide e GPBAR1 (noto anche come TGR5).[7]
La sintesi degli acidi biliari si verifica nelle cellule epatiche che sintetizzano gli acidi biliari primari (Acido Colico e Acido Chenodesossicolico nell’uomo) mediante ossidazione del Colesterolo citocromo P450-mediata in un processo suddiviso in più fasi. Circa 600 mg di sali biliari vengono sintetizzati quotidianamente per sostituire gli acidi biliari persi nelle feci, anche se, come verrà descritto di seguito, ne vengono secreti quantitativi molto maggiori, riassorbiti nell’intestino e riciclati. La fase di limitazione della velocità in sintesi è costituita dall’aggiunta di un gruppo idrossilico in 7a posizione del nucleo steroideo da parte dell’enzima colesterolo 7 alfa-idrossilasi. Questo enzima è sotto-regolato dall’Acido Colico, sovra-regolato dal Colesterolo ed è inibito dall’azione dell’ormone Ileale FGF15/19.[2][3]

Prima di secernere uno qualsiasi degli acidi biliari (primario o secondario), le cellule epatiche li coniugano con uno dei due aminoacidi, Glicina o Taurina, per formare un totale di 8 possibili acidi biliari coniugati. Questi acidi biliari coniugati sono spesso indicati come sali biliari a causa delle loro proprietà acido-base fisiologicamente importanti. Il pKa degli acidi biliari non coniugati è compreso tra 5 e 6,5, [4] e il pH del duodeno varia tra 3 e 5, quindi quando gli acidi biliari non coniugati si trovano nel duodeno, sono quasi sempre protonati (forma HA), il che li rende relativamente insolubili in acqua. Gli acidi biliari coniugati con gli aminoacidi riducono la pKa del coniugato acido biliare/aminoacido tra 1 e 4. Pertanto gli acidi biliari coniugati sono quasi sempre nella loro forma deprotonata (A-) nel duodeno, il che li rende molto più idro-solubile e molto più in grado di adempiere alla loro funzione fisiologica di grassi emulsionanti.[8][9]
Quando questi sali biliari vengono secreti nel lume intestinale, la disidrossilazione parziale batterica e la rimozione dei gruppi Glicina e Taurina formano gli acidi biliari secondari, l’Acido Desossicolico e l’Acido Litocolico. L’Acido Colico viene convertito in Acido Desossicolico e l’Acido Chenodesossicolico in Acido Litocolico. Tutti e quattro questi acidi biliari possono essere riportati nel flusso sanguigno, tornare nel fegato ed essere nuovamente secreti in un processo noto come circolazione enteroepatica.[2][3]
Come molecole anfipatiche con regioni idrofobiche e idrofile, i sali biliari coniugati si trovano in una condizione lipidica/acquosa e, alla giusta concentrazione, formano micelle.[9] La solubilità aggiunta dei sali biliari coniugati aiuta nella loro funzione prevenendo il riassorbimento passivo nell’intestino tenue. Di conseguenza, la concentrazione di acidi/sali biliari nell’intestino tenue è abbastanza elevata da formare micelle e solubilizzare i lipidi. Con il termine “concentrazione micellare critica” ci si riferisce sia a una proprietà intrinseca dell’acido biliare stesso sia alla quantità di acido biliare necessaria per adempiere alla funzionalità nella formazione spontanea e dinamica delle micelle.[9] Le micelle contenenti l’acido biliare aiutano le lipasi a digerire i lipidi e li avvicinano alla membrana dell’orletto a spazzola nell’intestino, con conseguente assorbimento dei grassi.[6]
La sintesi degli acidi biliari è una delle principali vie del metabolismo del Colesterolo nella maggior parte delle specie diverse dall’uomo. Il corpo produce circa 800mg di Colesterolo al giorno (con variabili determinate anche dal tipo di alimentazione seguita dall’individuo) e circa la metà di questi viene utilizzata per la sintesi di 400-600mg di acidi biliari al giorno. Gli esseri umani adulti secernono nell’intestino tra i 12 ed i 18g di acidi biliari ogni giorno, principalmente dopo i pasti. La dimensione del pool di acidi biliari è compresa tra i 4 ed i 6g, il che significa che gli acidi biliari vengono riciclati più volte al giorno. Circa il 95% degli acidi biliari viene riassorbito dal trasporto attivo nell’Ileo e riciclato nel fegato per un’ulteriore secrezione nel sistema biliare e nella cistifellea. Questa circolazione enteroepatica degli acidi biliari consente un basso tasso di sintesi ma con grandi quantità che vengono secrete nell’intestino.[5]
Gli acidi biliari hanno altre funzioni, tra cui l’eliminazione del Colesterolo dal corpo, nel flusso biliare per eliminare alcuni cataboliti (compresa la bilirubina), come emulsionante per le vitamine liposolubili e consentirne il loro assorbimento, favorire la motilità e la riduzione della flora batterica presente nell’intestino tenue e il tratto biliare.[5]
Gli acidi biliari hanno azioni metaboliche nel corpo simili a quelle degli ormoni, agendo attraverso due recettori specifici, i prima citati Recettore X farnesoide e il Recettore degli Acidi Biliari accoppiato con Proteine G/TGR5.[7][10] Si legano in modo meno specifico ad alcuni altri recettori ed è stata osservata una loro azione nella regolazione dell’attività di alcuni enzimi [11], canali ionici [12] e la sintesi di diverse sostanze tra cui Etanolamidi di acidi grassi endogeni.
I sali biliari costituiscono una grande famiglia di molecole, ed esse sono formate da una struttura steroidea con quattro anelli, una catena laterale a cinque o otto atomi di Carbonio che termina in un Acido Carbossilico e diversi gruppi idrossilici, il cui numero e orientamento sono diversi tra gli specifici sali biliari.[1] I quattro anelli sono classificati con le lettere A, B, C e D, dal più lontano al più vicino alla catena laterale con il gruppo carbossilico. L’anello D è più piccolo di un carbonio rispetto agli altri tre. La struttura è comunemente rappresentata con A a sinistra e D a destra. I gruppi idrossilici possono essere in una delle due configurazioni: in alto (o fuori), definita beta (β; spesso disegnata per convenzione come linea continua) o in basso, definita alfa (α; visualizzata come linea tratteggiata). Tutti gli acidi biliari hanno un gruppo 3-idrossile, derivato dalla molecola madre, il Colesterolo, in cui il 3-idrossile è beta. [1]

Il primo passo nella via classica della sintesi epatica degli acidi biliari è l’aggiunta enzimatica di un gruppo idrossilico in posizione 7α da parte del Colesterolo 7α-idrossilasi (CYP7A1) che forma 7α-idrossicolesterolo. Questo viene quindi metabolizzato in 7α-idrossi-4-colesten-3-one. Ci sono più passaggi nella sintesi di un acido biliare che richiedono in tutto 14 enzimi.[3] Ciò comporta l’alterazione del legame tra i primi due anelli steroidei (A e B), che fa piegare la molecola; in questo processo, il 3-idrossile viene convertito nell’orientamento α. L’acido biliare a 24 atomi di Carbonio più semplice ha due gruppi idrossilici nelle posizioni 3α e 7α. Questo è l’Acido 3α, 7α-diidrossi-5β-colan-24-oico o, come più comunemente noto, Acido Chenodesossicolico. Questo acido biliare fu inizialmente isolato dall’oca domestica, dal cui nome deriva la porzione “cheno” del nome della molecola. Il 5β nel nome indica l’orientamento del legame tra gli anelli A e B del nucleo steroideo (in questo caso, sono piegati). Il termine “colan” indica una particolare struttura steroidea di 24 atomi di Carbonio e “acido 24-oico” indica che l’Acido Carbossilico si trova in posizione 24, alla fine della catena laterale. L’Acido Chenodesossicolico è sintetizzato da molte specie ed è il prototipo dell’acido biliare funzionale.[2][3]
Una via alternativa (acida) della sintesi dell’acido biliare è iniziata dalla sterolo mitocondriale 27-idrossilasi (CYP27A1), espresso nel fegato, nei macrofagi e in altri tessuti. Il CYP27A1 contribuisce in modo significativo alla sintesi totale dell’acido biliare catalizzando l’ossidazione della catena laterale dello sterolo, dopo di che la scissione di un’unità a tre atomi di Carbonio nei perossisomi porta alla formazione di un acido biliare C24. Anche le vie minori iniziate dalla 25-idrossilasi nel fegato e dalla 24-idrossilasi nel cervello possono contribuire alla sintesi dell’acido biliare. La 7α-idrossilasi (CYP7B1) genera ossisteroli, che possono essere ulteriormente convertiti nel fegato in CDCA.[2][3]

L’Acido Colico, 3α, 7α, 12α-triidrossi-5β-colan-24-oico, l’acido biliare più abbondante nell’uomo e in molte altre specie, è stato scoperto prima dell’Acido Chenodesossicolico. È un acido tri-idrossile-biliare con 3 gruppi idrossilici (3α, 7α e 12α). Nella sua sintesi epatica, l’idrossilazione 12α viene eseguita dall’azione aggiuntiva del CYP8B1. Come già descritto, la scoperta dell’Acido Chenodesossicolico (con 2 gruppi ossidrilici) ha reso la denominazione di questo nuovo acido biliare “Acido Desossicolico” in quanto aveva un gruppo idrossilico in meno rispetto all’Acido Colico.[2][3]

L’Acido Desossicolico è formato dall’Acido Colico mediante 7-deidrossilazione, risultando in 2 gruppi idrossilici (3α e 12α). Questo processo con Acido Chenodesossicolico da come risultato un acido biliare con solo un gruppo idrossilico 3α, chiamato Acido Litocolico (lito = pietra) che è stato isolato e classificato per la prima volta attraverso l’analisi di calcoli prelevati da un polpaccio. È scarsamente solubile in acqua e piuttosto tossico per le cellule.[2][3]
Diverse famiglie di vertebrati sono adatte ad utilizzare le modifiche della maggior parte delle posizioni sul nucleo steroideo e sulla catena laterale della struttura dell’acido biliare. Per evitare i problemi associati alla produzione di Acido Litocolico, la maggior parte delle specie è in grado di aggiunge un terzo gruppo ossidrilico all’Acido Chenodesossicolico. La successiva rimozione del gruppo idrossilico in posizione 7α da parte dei batteri intestinali si tradurrà quindi in un acido biliare diidrossile meno tossico ma ancora funzionale. Si ipotizza che nel corso del tempo, le locazioni per il posizionamento del terzo gruppo ossidrilico nei vertebrati si sia modificato. Sembrerebbe che, inizialmente, la posizione 16α fosse la principale, in particolare negli uccelli. Successivamente, questa posizione avrebbe lasciato il posto in un gran numero di specie alla posizione 12α. I primati (e gli esseri umani) utilizzano il 12α per la loro terza posizione del gruppo ossidrilico, producendo Acido Colico. Nei topi e in altri roditori, l’idrossilazione 6β forma acidi muricolici (α o β a seconda della posizione dell’idrossile 7). I suini hanno una idrossilazione 6α nell’Acido Ecolico (acido 3α, 6α, 7α-triidrossi-5β-cholanoico) e altre specie hanno un gruppo ossidrilico nella posizione 23 della catena laterale.
L’Acido Ursodesossicolico è stato inizialmente isolato dalla bile di orso, la quale è stata usata in medicina per secoli. La sua struttura ricorda l’Acido Chenodesossicolico ma con il gruppo 7-idrossile in posizione β.[1]
L’Acido Obeticolico, l’acido 6α-etil-chenodesossicolico, è un acido biliare semisintetico con maggiore attività come agonista del FXR che è oggetto di ricerche come agente farmacologico.

Gli acidi biliari fungono anche da ormoni steroidei, secreti dal fegato, assorbiti dall’intestino e con varie azioni metaboliche dirette nel corpo attraverso il recettore nucleare FXR, noto anche con il nome genico NR1H4. [14][15][16] Un altro recettore degli acidi biliari è il recettore della membrana cellulare noto come recettore 1 o TGR5 degli acidi biliari accoppiato con proteine G. Molte delle loro funzioni come molecole di segnalazione nel fegato e nell’intestino sono mediate attivando il FXR, mentre l’interazione con il TGR5 può avviare coinvolgimenti nelle funzioni metaboliche, endocrine e neurologiche.[7]
In quanto tensioattivi o detergenti, gli acidi biliari sono potenzialmente tossici per le cellule e quindi le loro concentrazioni sono strettamente regolate. L’attivazione del FXR nel fegato inibisce la sintesi di acidi biliari ed è un meccanismo di controllo a feedback quando i livelli di acidi biliari sono troppo alti. In secondo luogo, l’attivazione del FXR da parte degli acidi biliari durante l’assorbimento nell’intestino aumenta la trascrizione e la sintesi di FGF19, che quindi inibisce la sintesi epatica di acidi biliari.[17]

Prove emergenti associano l’attivazione del FXR con modifiche del metabolismo dei trigliceridi, del metabolismo del glucosio e della crescita del fegato.[7][18]
Gli acidi biliari si legano ad alcune altre proteine oltre ai loro prima citati recettori ormonali (FXR e TGR5) e ai loro trasportatori. Tra questi target proteici, l’enzima N-acil fosfatidiletanolammina specifica fosfolipasi D (NAPE-PLD) genera ammidi lipidici bioattivi (ad esempio l’Anandamide Cannabinoide Endogeno) che svolgono ruoli importanti in diversi percorsi fisiologici tra cui stress e risposte al dolore, appetito e durata della vita. La NAPE-PLD regola un dialogo di segnali incrociati diretti tra ammide lipidica e fisiologia degli acidi biliari.[13]

Poiché gli acidi biliari sono costituiti da Colesterolo endogeno, l’interruzione della circolazione enteroepatica degli acidi biliari abbasserà il Colesterolo. I sequestranti degli acidi biliari si legano a questi ultimi nell’intestino, prevenendone il riassorbimento. Così facendo, il Colesterolo endogeno viene deviato nella produzione di nuovi acidi biliari, riducendo così i livelli di Colesterolo. Gli acidi biliari sequestrati vengono quindi escreti nelle feci.[19]
I test per gli acidi biliari sono utili sia nella medicina umana che in quella veterinaria, poiché aiutano nella diagnosi di una serie di condizioni patologiche, tra cui vi sono i tipi di colestasi come la colestasi intraepatica della gravidanza, shunt portosistemico e displasia microvascolare epatica nei cani.[20] Anomalie strutturali o funzionali del sistema biliare provocano un aumento della bilirubina (ittero) e degli acidi biliari nel sangue. Gli acidi biliari sono correlati alla comparsa di prurito che è comune in condizioni colestatiche come nella Cirrosi Biliare Primaria (PBC), Colangite Sclerosante Primaria o Colestasi Intraepatica della Gravidanza.[21] Il trattamento con Acido Ursodesossicolico è stato usato per molti anni nel trattamento di questi disturbi colestatici.[22][23]
La relazione tra acidi biliari e saturazione del Colesterolo nelle precipitazioni di bile e Colesterolo nella formazione di calcoli biliari è stata ampiamente studiata. I calcoli biliari possono derivare da una maggiore saturazione di Colesterolo o bilirubina o da stasi biliare. Concentrazioni più basse di acidi biliari o fosfolipidi nella bile riducono la solubilità del Colesterolo e portano alla formazione di microcristalli. La terapia orale con acido Chenodesossicolico e/o Acido Ursodesossicolico è stata utilizzata per dissolvere i calcoli biliari di Colesterolo.[24][25][26] I calcoli possono ripresentarsi quando il trattamento viene interrotto. La terapia con un acido biliare può essere utile per prevenire i calcoli in determinate circostanze, come in seguito alla chirurgia bariatrica.[27]
Concentrazioni eccessive di acidi biliari nel colon sono una causa di diarrea cronica. Si manifesta comunemente quando l’Ileo è anormale o è stato rimosso chirurgicamente, come nella malattia di Crohn, o causa una condizione che ricorda la sindrome dell’intestino irritabile predominante nella diarrea (IBS-D). Questa condizione di diarrea da acido biliare/malassorbimento di acido biliare può essere diagnosticata dal test SeHCAT e trattata con sequestranti di acido biliare.[28]
Gli acidi biliari possono avere una certa importanza nello sviluppo del cancro del colon-retto.[29] L’Acido Desossicolico (DCA) risulta aumentato nelle sue concentrazioni nel colon dell’uomo in risposta a una dieta ricca di grassi.[30] Nelle popolazioni con un’alta incidenza di carcinoma del colon-retto, le concentrazioni fecali di acidi biliari sono più elevate, [31] [32] e questa associazione suggerisce che una maggiore esposizione del colon agli acidi biliari potrebbe svolgere un ruolo nello sviluppo del cancro. In un confronto particolare, le concentrazioni fecali di DCA nei nativi africani del Sudafrica (che seguono una dieta povera di grassi) rispetto agli afroamericani (che seguono una dieta ricca di grassi) erano 7,30 contro 37,51 nmol/g di feci umide.[33] I nativi africani del Sud Africa hanno un basso tasso di incidenza di cancro al colon inferiore a 1: 100.000, [34] rispetto all’alto tasso di incidenza per i maschi afroamericani che è di 72: 100.000.[35]
Attraverso studi sperimentali sono stati ipotizzati meccanismi che potrebbero regolare le alte concentrazioni di acidi biliari al carcinoma del colon. L’esposizione delle cellule del colon ad alte concentrazioni di DCA aumenta la formazione di specie reattive dell’ossigeno, causando stress ossidativo e aumentando anche il danno nel DNA.[36] I topi nutriti con una dieta con aggiunta di DCA che mimava i livelli di DCA del colon negli esseri umani che seguono una dieta ricca di grassi hanno sviluppato neoplasie del colon, tra cui adenomi e adenocarcinomi (tumori), a differenza dei topi alimentati con una dieta di controllo che causa un decimo delle concentrazioni di DCA nel colon e non hanno sviluppato neoplasie del colon.[37][38]
Gli effetti dell’Acido Ursodesossicolico (UDCA) nella modifica del rischio di sviluppo del carcinoma del colon-retto sono stati esaminati in diversi studi, in particolare nella colangite sclerosante primitiva e nella malattia infiammatoria intestinale, con risultati variabili in parte correlati al dosaggio.[39][40] La variazione genetica dell’enzima chiave di sintesi dell’acido biliare, CYP7A1, ha influenzato l’efficacia dell’UDCA nella prevenzione dell’adenoma colorettale in un ampio studio.[41]
Gli acidi biliari possono essere utilizzati in soluzione iniettabile da somministrare sottocute per il trattamento delle adiposità localizzate (vedi Mesoterapia). L’Acido Desossicolico in soluzione iniettabile ha ricevuto l’approvazione della FDA per il trattamento del grasso submentale.[42] Gli studi di fase III hanno mostrato risposte significative sebbene molti soggetti abbiano avuto lievi reazioni avverse come lividi, gonfiore, dolore, intorpidimento, eritema e rigidità intorno all’area trattata.[43][44] Della correlazione tra acidi biliari e tessuto adiposo, punto di particolare interesse in questo articolo, ne parlerò a breve.


Gli atleti che utilizzano PED conoscono ormai da tempo il potenziale “epatoprotettivo” dato dall’uso degli acidi biliari. L’Acido Tauroursodesossicolico (TUDCA) e l’Acido Ursodesossicolico (UDCA) sono generalmente utilizzati come parte integrante dei “mix” epatoprotettivi, in specie durante l’utilizzo di farmaci orali con una forte resistenza al metabolismo epatico (vedi, per esempio, AAS metilati in C17). Infatti, l’UDCA ha mostrato di:
- stimolare la secrezione di ATP da parte degli epatociti e di interagire quindi col sistema dei citocromi P450 riducendo la glicuronazione degli estrogeni sintetici (cosa che spiega in parte i suoi effetti benefici sulla colestasi epatica). Gli utilizzatori di AAS potrebbero non essere consapevoli del rischio aumentato di sviluppare calcoli biliari durante l’uso di molecole aromatizzabili e dell’aiuto nell’arginare il fenomeno correlato ad un aumento dei livelli estrogenici sul fattore in questione dato dal UDCA [45];
- attivare direttamente il recettore per i glucocorticoidi, il che contribuirebbe ad allargare i meccanismi della sua azione anticolestatica ed antinfiammatoria sul parenchima epatico;
- di fungere (come già accennato in precedenza) da agonista parziale del recettore FXRalpha coinvolto nell’espressione di proteine ed enzimi protettivi e/o regolatori del metabolismo intermedio riducendo la colestasi e l’intossicazione epatica stimolando dei meccanismi endogeni di difesa;
- stimolare la sintesi del Glutatione (GSH), potente antiossidante endogeno, attraverso l’intervento delle chinasi dipendenti dai Fosfoinositidi (PI-3K e PKB). Questo meccanismo potrebbe giustificarne l’impiego corrente nelle epatiti croniche;
- attivare un fattore di trascrizione particolare chiamato Nrf-2, presente allo stato di riposo nel citoplasma di tutte le cellule. Esso si attiva solo quando vi sono variazioni dello stato ossidoriduzione cellulare, ovvero la genesi di eccessive quantità di radicali liberi dell’ossigeno, o delle tossine esterne chiamate (xenobiotici). In risposta a questi stimoli, l’Nrf-2 entra nel nucleo cellulare ed induce una batteria di geni coinvolti nella protezione cellulare dallo stress ossidativo. Si pensa quindi che l’UDCA possa agire da ligando endogeno dell’Nrf-2, anche se non esistono ancora prove dirette o conclusive. Anche questo meccanismo ha azione protettiva sul tessuto epato-biliare.[46]
Come detto pocanzi, un altro uso degli acidi biliari conosciuto dai più in ambito sportivo e, soprattutto, culturistico, è quello, già accennato in precedenza, del trattamento mesoterapico. In particolare, Il Desossicolato di Sodio usato da solo o miscelato con Fosfatidilcolina, viene utilizzato nel trattamento delle adiposità localizzate (soprattutto nella zona submentale e periombellicale) in alternativa all’escissione chirurgica.[47]
Lo sviluppo della ricerca scientifica sugli acidi biliari e metabolismo/composizione corporea
Pratica di utilizzo degli acidi biliari meno conosciuta, ed ancora “embrionale” nella sua applicazione, è quella che vede la loro applicazione per il miglioramento della composizione corporea attraverso assunzione orale.
Già nel 2006 uno studio pubblicato sulla rivista Nature aveva rivelato che gli acidi biliari potevano aumentare il tasso metabolico e la perdita di peso nei topi, lasciando intravedere la possibilità che ciò si potesse verificare anche nell’uomo.[48] Mentre gli acidi biliari (AB) erano da tempo noti per essere essenziali nell’assorbimento dei lipidi nella dieta e nel catabolismo del Colesterolo, come abbiamo precedentemente visto, negli anni precedenti a questo studio era emerso un ruolo importante degli acidi biliari come molecole di segnalazione. Gli AB, come già detto, attivano le vie della protein chinasi attivate dal mitogeno, sono ligandi per il recettore TGR5 (GPCR) accoppiato alle proteine G e attivano i recettori dell’ormone nucleare come il recettore alfa X farnesoide (FXR-alfa; NR1H4). Il FXR-alfa regola il riciclo enteroepatico e la biosintesi degli AB controllando l’espressione di geni come il partner eterodimero breve (SHP; NR0B2) che inibisce l’attività di altri recettori nucleari. L’induzione SHP mediata da FXR-alfa è anche alla base della sottoregolazione della biosintesi di acidi grassi e dei Trigliceridi a livello epatico e della produzione di lipoproteine a bassissima densità mediata dalla proteina 1c legante gli elementi regolatori degli steroli. Ciò indicava che l’assunzione di AB avrebbe potuto essere in grado di funzionare al di là del semplice controllo dell’omeostasi degli stessi nelle vie metaboliche generali. Nello studio viene mostrato che la somministrazione di AB nei topi aumenta il dispendio energetico nel tessuto adiposo bruno, prevenendo l’obesità e il peggioramento della resistenza all’insulina. Questo nuovo effetto metabolico degli AB dipende in modo critico dall’induzione della sintesi dell’ormone tiroideo tri-iodotironina (T3) AMP-ciclico-dipendente attraverso l’attivazione l’enzima iodotironina deiodinasi di tipo 2 (D2). Il trattamento degli adipociti bruni e dei miociti muscolo-scheletrici umani con AB mostrò un aumento dell’attività del D2 e del consumo di ossigeno. Questi effetti sono indipendenti dall’FXR-alfa e sono invece mediati dall’aumentata produzione di cAMP che deriva dal legame degli AB con il recettore TGR5 accoppiato con proteine G. Sia nei roditori che nell’uomo, i tessuti più termogenicamente importanti sono specificamente presi di mira da questo meccanismo poiché coesprimono sia l’enzima D2 che il TGR5. Dallo studio emerse quindi che la via di segnalazione AB-TGR5-cAMP-D2 è un meccanismo cruciale per l’ottimizzazione dell’omeostasi energetica che può essere mirata a migliorare il controllo metabolico.
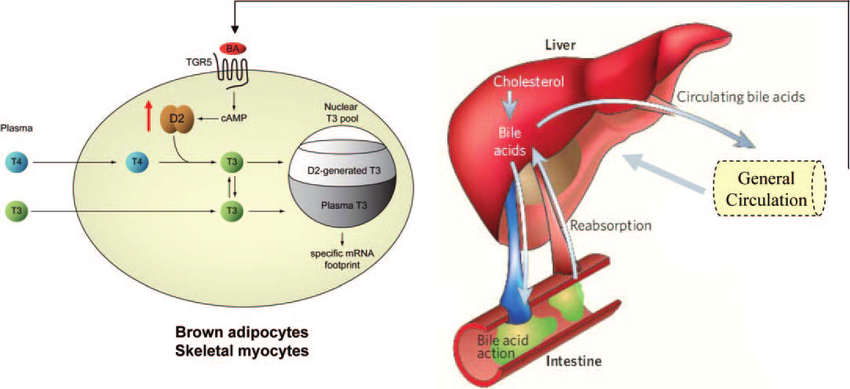
Dal 2006 ad oggi la ricerca sugli AB ed i loro effetti a livello metabolico-energetico sono proseguiti con ulteriori conferme sulla loro applicabilità per il trattamento dell’obesità negli esseri umani.
Uno studio del 2018 [49] ha evidenziato come il TGR5 sia un mediatore della conversione del tessuto adiposo bianco sottocutaneo (scWAT) in beige (metabolicamente simile al tessuto adiposo marrone) attraverso molteplici stimoli ambientali, tra cui l’esposizione al freddo e una alimentazione ricca di grassi. Inoltre, la somministrazione di mimetici degli acidi biliari TGR5-selettivi nei topi tenuti in ambiente termoneutrale porta alla comparsa di marker adipocitari beige e aumenta il contenuto mitocondriale nel tessuto scWAT dei topi Tgr5+/+ ma non nei loro simili Tgr5 -/- che si trovavano con loro e, quindi, esposti alle medesime condizioni ambientali. Questo fenotipo viene ricapitolato in vitro in adipociti differenziati, in cui l’attivazione del TGR5 aumenta la disponibilità di acidi grassi liberi attraverso la lipolisi, aumentando quindi la β-ossidazione e l’attività termogenica. La segnalazione del TGR5 induce anche la fissione mitocondriale attraverso il percorso ERK/DRP1, migliorando ulteriormente la respirazione mitocondriale. Nel loro insieme, questi dati identificano il TGR5 come un bersaglio farmacologico per promuovere la conversione del tessuto adiposo bianco in beige con potenziali applicazioni nella gestione dei disturbi metabolici.

Un altro studio, sempre del 2018, ha approfondito le dinamiche legate allo spiccato effetto metabolico e saziante, molto simile a quello ottenuto tramite bypass gastrico Roux-en-Y (RYGB), correlato alla diversione biliare verso l’Ileo (GB-IL) in modelli animali (roditori) obesi.[50] I ricercatori volevano appurare se i benefici metabolici di queste procedure (bypass gastrico) fossero mediate dall’aumento degli acidi biliari, dal momento che variazioni parallele del peso corporeo e altre variabili confondenti limitavano una possibile interpretazione oggettiva. Per fare ciò hanno utilizzato topi TGR5 -/- o FXRalfa -/- sottoposti ad una alimentazione ricca di grassi, confrontandoli con topi “selvaggi” con un antagonista del recettore per il polipeptide glucagone-simile 1 (Glp-1r) sottoposti ad una dieta chow (ricca in cereali e fibre). Il GB-IL ha indotto la perdita di peso e ha migliorato la tolleranza al glucosio assunto oralmente nei topi Tgr5 – / -, ma non nei topi FxrΔ -/- alimentati con una dieta ricca di grassi, suggerendo un ruolo dell’FXR intestinale. Il GB-IL in topi di tipo “selvaggio” alimentati con cibo convenzionale ha indotto miglioramenti della tolleranza al glucosio e al controllo della glicemia ematica indipendenti dal peso e secondari alla risposta aumentata dell’insulina. I miglioramenti erano concomitanti con un aumento dei livelli di GLP-1 linfatico nello stato a digiuno e un aumento dei livelli del batterio intestinale Akkermansia muciniphila. I miglioramenti nella glicemia a digiuno dopo il GB-IL sono stati mitigati con exendin-9, un antagonista del recettore del GLP-1 o Colestiramina, un sequestrante degli acidi biliari. Gli effetti glucoregolatori del GB-IL sono stati persi nei topi Glp-1r -/- a livello sistemico.

Per avere una panoramica dettagliata ed estremamente chiara sui potenziali effetti metabolici e, con sequenzialmente, sulla composizione corporea dati dall’uso di acidi biliari ci viene in aiuto una interessantissima review che vaglia tutti gli studi svolti fino al 2018 sulle possibili applicazioni farmacologiche degli acidi biliari e dei loro derivati nel trattamento della sindrome metabolica, pubblicata sulla rivista “Frontiers in Pharmacology” del 3 Dicembre 2018.[51] Anche in questo caso, glia autori sottolineano come, oltre alle classiche funzioni degli acidi biliari nella digestione e nella solubilizzazione dei nutrienti e dei farmaci lipofili nell’intestino tenue (Mikov e Fawcett, 2006; Mircioiu et al., 2012), ci sono prove emergenti che indicano il ruolo degli acidi biliari e il loro derivati come segnalatori, molecole endocrine che esercitano una varietà di effetti metabolici attraverso percorsi complessi e intrecciati, diventando così una classe di moecole molto interessanti per la ricerca volta al vaglio di nuovi trattamenti per la sindrome metabolica (Taoka et al., 2016; Chávez-Talavera et al., 2017; de Boer et al., 2018; Molinaro et al., 2018; Shapiro et al., 2018). Questa review fornisce una panoramica delle attuali conoscenze relative alle implicazioni degli acidi biliari nel metabolismo del glucosio, dei lipidi e delle vie energetiche, nonché la potenziale applicazione degli acidi biliari nel trattamento della sindrome metabolica con raccomandazioni per ulteriori studi.
Nella review è nuovamente riportato come il ricircolo enteroepatico degli acidi biliari amplifica il flusso transepatico degli acidi biliari che attivano il recettore X farnesoide (FXR), che ormai sappiamo essere il fattore di trascrizione più significativo coinvolto nella regolazione della biosintesi e del trasporto degli acidi biliari. Inoltre, il flusso transintestinale di acidi biliari riassorbiti attiva la FXR intestinale, regolando il ricircolo enteroepatico di queste molecole anfifiliche. Questi eventi epatici e intestinali prevengono il sovraccarico e l’accumulo di acidi biliari negli epatociti evitando così la possibilità che si creino concentrazioni tossiche prevenendo così potenziali lesioni epatocellulari, diminuendo la loro stessa sintesi e assorbimento, mantenendo allo stesso tempo quantità sufficienti di acidi biliari nell’albero biliare e nel lume intestinale per l’emulsificazione dei lipidi alimentari . Inoltre, l’assorbimento epatocellulare degli acidi biliari è incompleto e la gamma micromolare delle concentrazioni si riversa dal portale alla circolazione sistemica attraverso anastomosi venose. Queste concentrazioni sistemiche sono sufficienti per interagire con diversi recettori nucleari attualmente identificati; FXR, recettore X della gravidanza (PXR), recettore della vitamina D (VDR) e recettore costitutivo del androstano (CAR), nonché il già più volte citato TGR5 (o GPBAR) che esercita effetti di segnalazione sistemici oltre i tessuti enteroepatici (Gioiello et al., 2014; Comeglio et al., 2017).
E’ interessante notare come la transattivazione ligando-dipendente di geni bersaglio da parte degli acidi biliari è indotta dal legame dell’acido biliare come ligandi endogeni più potenti, con il CDCA come il più potente agonista, mentre l’UDCA, idrofilo, non attiva l’FXR (Kemper, 2011). La potenza degli acidi biliari naturali per il FXR è riassunta nella tabella seguente (secondo Gioiello et al., 2014). Nell’intestino, il FXR attiva la trascrizione del enterokine, fattore di crescita dei fibroblasti-19 (FGF-19 o ortologo FGF-15 roditore) attraverso SHP, governando gli acidi biliari post-prandiale e il metabolismo dei nutrienti (Mertens et al., 2017).

Inoltre, come endobiotici, gli acidi biliari possono attivare la PXR (NR1I2, cromosoma 3q13.33), che possiede la capacità di interagire con una vasta gamma di composti idrofobici strutturalmente diversi tra cui farmaci, integratori alimentari e inquinanti ambientali. La PXR-non attivata più comunemente crea complessi inibitori con il mediatore silenziante per il recettore dell’acido retinoico e il recettore dell’ormone tiroideo (SMRT), SHP e deacetylases dell’istone (Pavlovic et al., 2017). Dopo il legame con il ligando, il recettore subisce cambiamenti conformazionali e il rilascio di fattori corepressori induce l’acetilazione dell’istone o il reclutamento di proteine co-attivanti come il SRC–1 (steroid receptor coactivator–1) (Pavek, 2016; Buchman et al., 2018).
Acidi biliari e metabolismo glucidico
Nell’ultimo decennio, un numero crescente di prove ha fortemente indicato che gli acidi biliari regolano il metabolismo glucidico postprandiale mostrando anche capacità di segnalazione antidiabetica esplicata attraverso i recettori attivati dall’acido biliare, oltre che a migliorare il ripiegamento e la funzione delle proteine, e agli effetti antiapoptotico (Hylemon et al., 2009).

Vi sono, tuttavia, alcune discrepanze irrisolte in letteratura tra i risultati ottenuti relativi all’implicazione degli acidi biliari nel metabolismo glucidico. Gli studi iniziali che hanno identificato le implicazioni del FXR nel metabolismo del glucosio hanno dimostrato che gli acidi biliari o gli agonisti sintetici specifici del FXR hanno indotto l’espressione del tasso di controllo dell’enzima della gluconeogenesi, fosfoenolpiruvato carbossinasi (PEPCK), aumentando anche la produzione totale di glucosio nell’epatocita umano e di ratto come nei topi in vivo (Stayrook et al., 2005). Al contrario, Yamagata et al. (2004) hanno dimostrato che gli acidi biliari sopprimono l’espressione dei geni della gluconeogenesi PEPCK, glucosio-6-fosfatasi (G6Pase) e fruttosio 1,6-bis-fosfatasi (FBP1) attraverso l’interazione tra SHP con il fattore nucleare degli epatociti 4 (HNF-4) o fattore di trascrizione della fronte Foxo1, sia in vivo che in vitro. La riduzione dell’espressione del PEPCK sembra essere una possibilità interessante per il trattamento del diabete di tipo 2, dato che questa patologia è caratterizzato da un aumento della produzione di glucosio epatico e da iperglicemia (Cariou et al., 2005). Inoltre, l’attivazione epatica del FXR porta ad un aumento dell’attività della glicogeno sintasi mediante fosforilazione e inattivazione della glicogeno sintasi chinasi 3 (GSK3b) (Mencarelli e Fiorucci, 2010).

Nello studio del 2006 citato in precedenza (di Zhang et al.) è stato mostrato che la carenza del FXR nei topi è associata a intolleranza al glucosio e resistenza all’insulina manifestate da iperglicemia, ridotta tolleranza al glucosio e grave riduzione della sensibilità insulinica nel fegato, nei muscoli e nel tessuto adiposo. Di conseguenza, l’attivazione del FXR da parte dell’agonista sintetico non steroideo GW4064 nei topi (30mg/kg due volte al giorno) ha significativamente ridotto la produzione di glucosio epatico, abbassato i livelli di glucosio nel sangue, aumentato la glicogenesi, migliorato la sintesi e la secrezione di insulina, migliorato la sensibilità all’Insulina a livello centrale (epatico) e periferico negli animali (Zhang et al., 2006).
L’attivazione indotta del FXR nella trascrizione e nella secrezione di Insulina nelle cellule β del pancreas sono regolate da diversi meccanismi che coinvolgono effetti sia genomici che non genomici. Gli effetti genomici dell’attivazione del FXR si basano sull’induzione del KLF11, che si è dimostrato essere un fattore essenziale per la trascrizione del gene dell’Insulina. Gli effetti non genomici dell’attivazione del FXR nelle cellule βTC6 trasmettono sull’aumento della fosforilazione di Akt e nella traslocazione del trasportatore di glucosio di tipo 2 (GLUT2), un membro delle proteine di membrana che facilita il trasporto del glucosio lungo un gradiente di concentrazione alla membrana plasmatica, aumentando l’assorbimento di glucosio da parte delle cellule β del pancreas (Renga et al., 2010). Inoltre, l’attivazione del FXR induce l’espressione del trasportatore di glucosio GLUT4 nel fegato, la cui espressione risulta ridotta, sia nei soggetti diabetici di tipo 1 che 2 (Garvey et al., 1991, 1992). L’attivazione del FXR è stata in grado di sovraregolare l’espressione dei GLUT4 attraverso il FXRE nel promotore del gene GLUT4. Shen et al. (2008) hanno riferito che l’attivazione del FXR da parte del CDCA in concentrazione di 10 μM potrebbe indurre la trascrizione del GLUT4 nelle linee cellulari 3T3-L1 e HepG2 e aumentare l’espressione della proteina GLUT 4 nei topi C57BL / 6J trattati con CDCA (20 mg / kg / giorno ). Complessivamente, questi cambiamenti hanno comportato una riduzione del livello di glucosio plasmatico, una riduzione della gluconeogenesi epatica e un aumento della sintesi epatica di glicogeno (Mencarelli e Fiorucci, 2010).

Gli acidi biliari possono anche influenzare l’omeostasi del glucosio in modo indipendente dal FXR (Stanimirov et al., 2012). Oltre al ruolo nel dispendio energetico, è stato dimostrato che l’attivazione del recettore di membrana TGR5 da parte degli acidi biliari aumenta la secrezione intestinale di GLP-1 dalle cellule L endero-endocrine, sia in vitro che in vivo, stimolando la rilascio di Insulina dalle cellule β pancreatiche senza rilascio di Glucagone dalle cellule α e la riduzione della glicemia postprandiale (Katsuma et al., 2005; Kumar et al., 2012; Duboc et al., 2014). Inoltre, Maruyama et al. (2006) hanno mostrato che i topi TGR5-null hanno una riduzione del 25% nelle dimensioni del pool di acido biliare, mentre i topi TGR5-null femmine hanno mostrato un significativo accumulo di grasso con aumento di peso corporeo rispetto a quello dei topi wild-type quando nutriti con una dieta ricca di grassi. La figura seguente mostra chiaramente i percorsi intrecciati delle implicazioni degli acidi biliari nel metabolismo del glucosio mediato dalla segnalazione FXR e TGR5.
L’evidenza genetica in vitro e in vivo indica un forte legame causale tra la capacità funzionale del reticolo endoplasmatico e gli effetti dell’Insulina. Pertanto, la modulazione della funzione del reticolo endoplasmatico potrebbe fornire un nuovo approccio per il trattamento del diabete (Ozcan et al., 2006). Ozcan et al. (2006) hanno mostrato che il tauro-UDCA migliora la resistenza all’Insulina attenuando lo stress del reticolo endoplasmatico negli animali affetti da diabete di tipo 2 con conseguente normalizzazione dell’iperglicemia, miglioramento della sensibilità sistemica all’insulina e dell’azione dell’insulina in vari tessuti.
L’efficacia degli agonisti sintetici del FXR come potenziale terapia per il diabete mellito di tipo 2 è stata dimostrata in uno studio clinico di fase II già menzionato condotto da Mudaliar et al. (2013) nel quale è stato dimostrano che la somministrazione di OCA a pazienti con diabete mellito di tipo 2 e NAFLD per 6 settimane è stata ben tollerata, migliorando la sensibilità all’insulina e riducendo i marker del infiammazione e la fibrosi epatica.
Come già visto, recentemente, la ricerca dei meccanismi alla base dei rapidi miglioramenti glicemici a seguito di procedure chirurgiche bariatriche [bypass gastrico Roux-en-Y (RYGB) e gastrectomia a manica verticale] in pazienti con obesità patologica e diabete di tipo 2 ha confermato i significativi effetti fisiologici degli acidi biliari nella omeostasi del glucosio (Bradley et al., 2012; Pournaras et al., 2012). Queste procedure hanno causato un aumento degli acidi biliari liberi sia nel siero che nell’intestino inferiore (Madsbad et al., 2014; Raghow, 2015). L’aumentata concentrazione di acidi biliari liberi nel lume intestinale ha avuto un effetto diretto sulle Incretine attraverso l’asse TGR5 – GLP-1, migliorando la secrezione di Insulina, nonché attivando il FXR intestinale e il suo target diretto a valle FGF-15/19 – un ormone peptidico postprandiale che migliora la tolleranza al glucosio, una proteina la cui espressione è, altrimenti, ridotta nei pazienti diabetici (Jansen et al., 2011; Schaap, 2012; Madsbad and Holst, 2014). Gli effetti benefici mediati dai recettori degli acidi biliari FXR e TGR5 in seguito a chirurgia bariatrica sono stati ulteriormente confermati poiché in assenza di segnalazione FXR in topi null-FXR o segnalazione GLP-1 antagonizzata dal exendin- (9-39), gli effetti benefici della chirurgia bariatrica sul peso corporeo e il metabolismo del glucosio sono stati annullati (Salehi et al., 2011; Ryan et al., 2014). L’aumento delle concentrazioni di acido biliare libero nelle parti inferiori del tratto intestinale dopo RYGB crea un ambiente adatto per la crescita di batteri tolleranti la bile come il gruppo tassonomico Proteobacter phylum (Osto et al., 2013). La crescita eccessiva dei Proteobacter provoca una diminuzione delle specie secondarie, ceppi batterici che generano attraverso i loro processi metabolici acidi biliari più tossici, con conseguente aumento dei livelli di acido biliare primario (Acido Chenodeossicolico) nel plasma e un pronunciato effetto sulle Incretine (Vrieze et al., 2014).
Acidi biliari e microbiota intestinale
Il tratto intestinale umano è colonizzato da un insieme diversificata di microorganismi, con batteri come membri più numerosi. La composizione del microbiota intestinale è specifica per l’individuo ma rimane relativamente costante nel tempo (Stojančević et al., 2014). Alterazioni del microbioma intestinale umano possono avere un ruolo nello sviluppo di alcune patologie (DeGruttola et al., 2016). Il microbiota intestinale regola il metabolismo dell’ospite producendo numerosi metaboliti che segnalano attraverso i loro recettori affini, influenzando così il peso corporeo, il metabolismo degli acidi biliari, l’attività pro infiammatoria, la resistenza all’Insulina e la modulazione degli ormoni intestinali (Han e Lin, 2014; Wahlstrom et al., 2016). Un’importante classe di metaboliti prodotti dal microbiota sono appunto gli acidi biliari. L’idrolasi batterica dei Sali biliari (BSH), presente in tutte le principali specie batteriche nell’intestino umano, effettua la deconugazione del sale biliare aumentando così la resistenza alla tossicità biliare, mentre la 7α-deidrossilasi converte gli acidi biliari primari CA e CDCA nella bile negli acidi secondaria DCA e LCA, rispettivamente (Wahlstrom et al., 2016). Altre conversioni dei sali biliari eseguite dal microbiota intestinale sono l’ossidazione e l’epimerizzazione dei gruppi idrossilici, 7-disidrossilazione, esterificazione e desolfatazione, contribuendo così alla grande diversità chimica e al pool di acidi biliari più idrofobi (Ridlon et al., 2016). Inoltre, gli acidi biliari possono modulare la composizione del microbiota intestinale sia direttamente, distruggendo le strutture delle membrane batteriche, sia indirettamente, tramite l’attivazione del FXR promuovendo la trascrizione di agenti antimicrobici come iNOS e IL-18 nell’intestino tenue e inibendo così la crescita batterica (Inagaki et al., 2006; Wahlstrom et al., 2016).
Considerando la complessa relazione tra acidi biliari e microbiota intestinale, non sorprende che oltre ai cambiamenti nella composizione degli acidi biliari, i pazienti diabetici abbiano anche una diversa composizione e attività del microbiota intestinale rispetto agli individui sani (Quercia et al., 2014 ). Sia il diabete mellito di tipo 1 che quello di tipo 2 sono associati a una riduzione della diversità microbica complessiva, caratterizzata da riduzione di Firmicutes e batteri produttori di butirrato, nonché da una funzione alterata della barriera intestinale e da una maggiore permeabilità intestinale (DeGruttola et al., 2016; Knip e Siljander, 2016).
La supplementazione con batteri probiotici ha portato a una modulazione benefica del metabolismo dell’ospite in termini di secrezione di GLP-1 stimolata da specifici metaboliti batterici come gli acidi grassi a catena corta (SCFA) attraverso il meccanismo GPR41/43-dipendente (Everard e Cani, 2014). Inoltre, la somministrazione di batteri probiotici ha ridotto l’assunzione di cibo e protetto dall’aumento di peso corporeo e dal peggioramento dell’insulino resistenza nei modelli animali obesi e diabetici (Yadav et al., 2013). Gli studi condotti hanno dimostrato che un approccio multi-terapeutico che utilizza una combinazione di probiotici e acidi biliari come terapia aggiuntiva in un modello di ratto con diabete mellito di tipo 2 ha esercitato una regolazione glicemica ancora migliore e ha portato ad alleviare le complicanze rispetto a ciascun singolo trattamento (Al- Salami et al., 2008, 2012). Gli effetti sinergici degli acidi biliari, probiotici e terapia antidiabetica attuale sono esaminati in dettaglio da Mikov et al. (2017) indicando la potenziale applicazione di questa combinazione nei disturbi metabolici con particolare enfasi sul diabete mellito.
Pertanto, la manipolazione terapeutica del microbiota intestinale mediante integrazione probiotica con effetti secondari sulla composizione del pool di acidi biliari rappresenta una strategia promettente per il trattamento di tali condizioni. Sebbene ulteriori studi siano altamente raccomandati per svelare gli esatti meccanismi responsabili degli effetti benefici della co-somministrazione di acidi biliari-probiotici, l’attivazione di complesse vie di segnalazione FXR e TGR5 è proposta come una delle possibili spiegazioni.
A questo punto è utile precisare che nella composizione corporea il microbiota è un primo “ostacolo” alle calorie assunte. Più esso risulta in equilibrio e in salute e maggiore sembra essere la capacità batterica di esercitare un “blocco” nei confronti dell’eccesso calorico. Il microbiota in condizioni di salute agisce anche sul senso di sazietà, attraverso una segnalazione che parte dagli enterociti (le cellule dell’intestino) per giungere ai centri ipotalamici della fame. Questo avviene perché il microbiota converte le fibre alimentari in acidi grassi a corta catena, i quali sono il nutriente principale degli enterociti. In questo modo le cellule intestinali inviano al cervello il segnale di sazietà.
Acidi biliari e metabolismo lipidico
Come prodotto principale del catabolismo del Colesterolo, gli acidi biliari esercitano effetti profondi, non solo sul metabolismo del Colesterolo, ma anche sul metabolismo dei triacilgliceroli, regolando quindi il metabolismo di varie specie di lipoproteine. L’aumentata sintesi di acidi biliari aumenta l’utilizzo del colesterolo come substrato. Attivando il FXR gli acidi biliari inibiscono il CYP7A1, l’enzima che limita la velocità della sintesi degli acidi biliari e del catabolismo del Colesterolo negli epatociti. Di conseguenza, l’integrazione a lungo termine di 750mg o 375mg/die di CDCA nei pazienti con malattia dei calcoli biliari provoca un modesto aumento del livello di colesterolo lipoproteico a bassa densità (LDL) (Schoenfield e Lachin, 1981). L’aumento del LDL si è verificato nell’85,2% dei pazienti che ricevevano 750mg/die e, nell’82,8% dei pazienti che ricevevano 375mg/die, tuttavia, l’incremento del 67,0% è stato registrato in un gruppo di pazienti che assumevano placebo, probabilmente come conseguenza principale legata alla malattia. D’altra parte, studi in vitro dimostrano che l’agonista del FXR CDCA (250 μM) stabilizza l’mRNA del recettore LDL e aumenta l’attività del recettore LDL nella linea cellulare epatica umana in coltura aumentando così l’assorbimento e la clearance delle particelle di LDL (Nakahara et al., 2002). I cambiamenti nel livello di Colesterolo circolante attraverso l’attivazione del FXR in vivo sono distinti tra modelli animali (roditori) e umani. Vale a dire che, l’espressione del CYP7a1 nei roditori è opposta agli umani nei quali è regolata da due recettori nucleari, il recettore X del fegato-α (LXR-α) e il FXR, entrambi espressi abbondantemente nel fegato. Il LXR-α può essere attivato da derivati del Colesterolo tra cui il 24 (S), 25-epossicolesterolo e il 24 (S) -idrossicolcololo, e in seguito alla sua attivazione LXR interagisce con un elemento di risposta all’interno del promotore del CYP7a1, stimolando in tal modo l’espressione genica. La traduzione degli effetti osservati nei roditori è stata sconcertante poiché in queste specie il Colesterolo circolante è prevalentemente “impacchettato” sotto forma di lipoproteine HDL, contrariamente alle specie LDL dominanti nell’uomo. Nei topi chimerici i cui fegati contengono principalmente epatociti umani e un profilo lipoproteico “umanizzato”, il trattamento con un potente agonista FXR specifico, il derivato dell’acido biliare semisintetico OCA (10mg/kg/giorno), porta all’aumento della riduzione circolante di LDL e HDL , analogamente all’attivazione del FXR nell’uomo. L’aumento del LDL è correlato alla ridotta attività regolante della proteina 2 legante gli elementi sterolici (SREBP-2) e alla sua espressione genica bersaglio, inclusa una significativa sottoregolazione nell’espressione della proteina del recettore LDL (Papazyan et al., 2018). La somministrazione di OCA, 25 o 50mg/die per 2 settimane, durante gli studi clinici ha prodotto effetti simili (Mudaliar et al., 2013; Walters et al., 2015).
La riduzione del livello di HDL mediante attivazione del FXR [utilizzando chow integrato con Acido Taurocolico allo 0,5% p/p (TLCA) per un periodo di 6 giorni] può essere spiegata dalla repressione del gene dell’apolipoproteina A-I, nonché dall’etero-scambio di esteri del colesterolo e triacilgliceroli tra le HDL plasmatiche e le lipoproteine contenenti ApoB inducendo l’espressione della proteina di trasferimento dell’estere del colesterolo (colesteril estere)(Lambert et al., 2003; Gautier et al., 2013). D’altra parte, il targeting FXR può anche rafforzare il trasporto inverso del Colesterolo, un processo nel trasporto del Colesterolo dai tessuti e cellule periferici agli epatociti e al sistema biliare, al fine di eliminare il Colesterolo attraverso la via intestinale. L’analisi Northern blot su campioni di fegato di topi maschi C57BL/6, alimentati con una dieta integrata all’1% per un mese, ha rivelato che gli effetti sopra menzionati sono mediati tramite la proteina di trasferimento dei fosfolipidi, una proteina che media il rilascio di fosfolipidi e Colesterolo dalle lipoproteine LDL a HDL. Gli effetti osservati sono anche una conseguenza dei cambiamenti nell’espressione del recettore scavenger-B1 (SR-B1), che è coinvolto nel riconoscimento delle particelle di HDL e nel loro assorbimento da parte degli epatociti (Urizar et al., 2000). Inoltre, è stato dimostrato che l’attivazione diretta del target FXR, l’enterokina FGF15/19, stimola la consistente secrezione di Colesterolo nel lume intestinale attraverso l’eterodimero di sterolo adenosina trifosfato (ATP)-legante i membri della sottofamiglia G 5/8 (ABCG5 / G8) nei topi (de Boer et al., 2017). Questa scoperta ha potenziali implicazioni nello sviluppo di strategie volte alla riduzione del riassorbimento intestinale del Colesterolo. La somministrazione di 10 o 25mg di OCA al giorno in volontari sani ha indotto un aumento sostenuto della concentrazione sierica di LDL e una riduzione dell’HDL, con un leggero aumento del livello di Colesterolo totale indipendentemente dalla dose (Pencek et al., 2016). Cambiamenti simili sono stati osservati in pazienti con diabete mellito di tipo 2 e in pazienti con steatoepatite non alcolica confermata per biopsia (Mudaliar et al., 2013; Neuschwander-Tetri et al., 2015). Tuttavia, nei pazienti con colangite biliare primitiva trattati con 5-10mg di OCA al giorno per 1 anno, l’aumento di LDL e la riduzione del livello di HDL era minore in ampiezza e transitorio (Nevens et al., 2016). Gli effetti dell’attivazione del FXR mediante somministrazione ripetuta di 5, 10 o 25mg di OCA al giorno per 2 settimane o 20 giorni sono stati stimati nella sperimentazione clinica che recluta volontari sani (Pencek et al., 2016). I risultati osservati in questo studio hanno confermato i risultati di precedenti studi clinici in termini di lievi disturbi dello stato lipidico; vale a dire, il trattamento con OCA ha indotto una riduzione dose-indipendente di HDL, come risultato della riduzione della concentrazione di particelle HDL piccole e medie e un aumento del livello di colesterolo LDL (Pencek et al., 2016). Anche se l’attivazione del FXR da parte degli acidi biliari e dei derivati degli acidi biliari può indurre un fenotipo potenzialmente aterogenico in termini di spostamento delle frazioni di lipoproteine, sono altamente necessari ampi studi clinici multicentrici randomizzati per chiarire l’impatto clinico di tali effetti dislipidemici trattati con acidi biliari o derivati dell’acido biliare.
D’altra parte, è stato dimostrato che l’integrazione di acidi biliari con CA allo 0,5% (w/w) per 8 settimane modula il metabolismo dei triacilgliceroli attraverso diversi meccanismi distinti, principalmente attraverso l’attivazione del FXR. Attivando gli acidi biliari il FXR vanno a reprimere la sintesi di de novo triacilglicerolo attraverso il target downstream FXR, l’inibizione mediata dal SHP della trascrizione dell’elemento regolatore sterolo che lega la proteina-1c (SREBP-1c), un fattore chiave che controlla la trascrizione di diversi geni che regolano la sintesi di acidi grassi e triacilgliceroli, incluso un principale enzima lipogenico nel fegato, acido grasso sintasi (Watanabe et al., 2004). È stato anche dimostrato che l’attivazione del FXR induce l’espressione del recettore-α del perossisoma attivato dal proliferatore (PPAR-α) e dell’isoenzima-4 piruvato deidrogenasi chinasi che promuove l’ossidazione degli acidi grassi, mentre mediante l’inibizione SHP-mediata si verifica l’inibizione dell’espressione proteica microsomiale di trasferimento del triacilglicerolo per ridurre la sintesi di VLDL (Pan et al., 2010). Inoltre, il FXR promuove l’attività dell’enzima ancorato alla superficie luminale delle cellule endoteliali vascolari, una lipoproteina lipasi (LPL) che catalizza quindi l’idrolisi dei triacilgliceroli inducendo l’espressione di apoC-II attivanti LPL in topi C57BL/6J alimentati per 3 settimane con una dieta contenente lo 0,5% di Colato di Sodio. Inoltre, l’attivazione del FXR ha indotto l’espressione del recettore VLDL, facilitando la clearance delle particelle VLDL nelle cellule HepG2 incubate con 50μM di CDCA per 24 ore (Jiao et al., 2015). Oltre a ridurre i sintomi della diarrea da acido biliare nei pazienti, l’integrazione orale di 25mg di OCA al giorno per 2 settimane ha comportato un aumento del livello di FGF-19 e una diminuzione di triacilgliceroli, il che implica il ruolo potenziale dell’FGF-19 sul metabolismo dei triacilgliceroli (Walters et al., 2015).
L’ulteriore complessità della rete di segnalazione tra gli acidi biliari e la rete del triacilglicerolo nasce dalle interazioni con il microbiota intestinale, che è comunemente cambiato nelle persone alimentate con una dieta di tipo occidentale e nell’obesità. In effetti, anche la somministrazione a breve termine di antibiotici non assorbibili orali ha provocato disbiosi intestinale seguita dalla diminuzione delle quantità di acidi biliari secondari DCA e LCA le concentrazioni epatiche e ridotto livello sierico di triacilglicerolo, che non si è ripreso nemmeno dopo l’integrazione con acido biliare (Kuno et al., 2018). I risultati dello studio suggeriscono che gli acidi biliari secondari prodotti dalle specie batteriche intestinali esercitano un ruolo regolatorio significativo nel mantenimento dei livelli sierici di triacilgliceroli e del metabolismo nell’ospite.
Acidi grassi e fegato grasso non alcolico dipendente
Gli effetti positivi dati dall’attivazione del FXR e del TGR5 mediata dagli acidi biliari in una vasta gamma di processi metabolici, tra cui il metabolismo del glucosio e la segnalazione dell’Insulina, il metabolismo dei trigliceridi e del colesterolo, come abbiamo appena visto, nonché sull’infiammazione, focalizzano l’interesse della ricerca sugli acidi biliari per lo sviluppo di un’efficace terapia strategica per trattare la patologia del fegato grasso non alcolica.
Grazie alla sua caratterizzazione e valutazione preclinica, l’OCA è diventato uno dei ligandi più comunemente utilizzati per la decodifica della rete di segnalazione FXR sia in vivo che in vitro. Durante gli studi preclinici la somministrazione di OCA ha avuto effetti benefici significativi in numerosi disturbi del sistema enteroepatico, incluso il miglioramento della colestasi indotta dagli estrogeni, la fibrosi epatica, la NASH, la resistenza all’insulina, l’ipertensione portale, la riduzione dell’infiammazione intestinale e il miglioramento della funzione della barriera ileale durante la colestasi, il miglioramento della diarrea cronica indotta dell’acido biliare (Fiorucci et al., 2004, 2005; Adorini et al., 2012; Verbeke et al., 2014; Walters et al., 2015). È stato dimostrato che la somministrazione per via orale di 25mg di OCA per 72 settimane migliora le caratteristiche istologiche del fegato di pazienti con NASH durante la seconda fase della sperimentazione clinica FLINT (Neuschwander-Tetri et al., 2015). Gli effetti benefici dell’attivazione del FXR nei pazienti con NAFLD comprendono una migliore sensibilità insulinica epatica e di conseguenza un aumento della sintesi di glicogeno, una diminuzione della de novo lipogenesi nel fegato, una migliore sensibilità all’insulina adiposa (riduzione degli effetti lipotossici) e una migliore funzione del recettore attivato dal proliferatore del perossisoma -gamma (PPAR-γ) e PPAR-α, che regolano il metabolismo degli acidi grassi e del glucosio sia nel tessuto adiposo che nel fegato (Fiorucci et al., 2007). L’integrazione dietetica con OCA (10mg/kg/giorno) per il modello animale NASH sottoposto a regime alimentare dieta fast food, che imita la sindrome metabolica, presenta micro RNA-21 ablato (miR21) e PPAR-α attivato che ha portato a una significativa riduzione della steatosi, infiammazione e lipo -apoptosi, svelando il riassetto dell’asse miR21/PPAR-α nel fegato e nei tessuti muscolari mediante attivazione del FXR dato dal OCA (Rodrigues et al., 2017). L’attivazione da parte del OCA (10mg/kg/giorno, somministrato per via orale per 7 settimane) del FXR e del TGR5 mediante un intervento dietetico di 8 settimane contenente 30mg/kg/giorno di INT-777, ha portato ad un miglioramento della steatosi epatica e dell’insulina resistenza nel modello animale (roditori) con NAFLD e obeso (Thomas et al., 2009; Cipriani et al., 2010). La somministrazione di OCA (25, 50mg/die per os per 6 settimane) in pazienti con diabete mellito di tipo 2 e NAFLD ha ridotto significativamente il peso corporeo, ha migliorato la sensibilità all’insulina e ridotto il livello sierico di gamma-glutamiltransferasi, mentre l’aumento sierico dell’FGF-19 enterokine intestinale ha confermato l’attivazione del FXR nei pazienti (Mudaliar et al., 2013). Inoltre, l’OCA (10mg/kg) ha prevenuto l’infiammazione epatica prevenendo l’immunomodulazione e l’infiammazione mediate dal fattore nucleare dannoso κB. Inoltre, attraverso l’inibizione dell’attivazione delle cellule stellate epatiche, l’incubazione con 10μM di OCA ha impedito la progressione verso la fibrosi epatica e lo sviluppo della cirrosi (Goto et al., 2018). Il trattamento con questo agonista del FXR ha comportato un miglioramento delle caratteristiche biochimiche e istologiche del fegato nei pazienti con NASH. Queste funzioni indicano che il FXR è un bersaglio terapeutico interessante per le malattie del fegato (Massafra e van Mil, 2018). Ulteriori studi clinici randomizzati di grandi dimensioni sono altamente desiderabili per confermare gli effetti del “bussare alla porta del FXR” come un potenziale approccio terapeutico in cui il cambiamento nella dimensione e nella composizione del pool di acidi biliari può essere sfruttato per il trattamento dei disturbi metabolici.
Acidi biliari , obesità e patologie cardiometaboliche
È stato riscontrato che un aumento del livello di acidi biliari circolante negli individui obesi è correlato positivamente con l’indice di massa corporea (Prinz et al., 2015). Inoltre, l’insulino-resistenza è associata alla sottoregolazione mediata dal Foxo-1 del CYP8B1 con conseguente deplezione del pool di acido biliare 12α-idrossilato, che può essere spiegato dalla degradazione del Foxo indotta dall’iperglicemia e quindi dalla mancanza di attivazione del CYP8B1, mentre nel diabete di tipo 2 la concentrazione nei pazienti trattati con DCA è risultata elevata (Brufau et al., 2010; Haeusler et al., 2013). Pertanto, gli interventi che manipolano la composizione del pool di acidi biliari potrebbero rappresentare nuove strategie terapeutiche nel trattamento della resistenza all’insulina. I cambiamenti nella dimensione e nella composizione del pool di acidi biliari dopo la chirurgia bariatrica in soggetti obesi si riflettono nel miglioramento dell’omeostasi metabolica (Penney et al., 2015). È quindi ragionevole presumere che l’integrazione con acidi biliari o derivati dell’acido biliare, modificando la segnalazione dell’acido biliare, possa essere considerata come un potenziale intervento cardioprotettivo che migliora il metabolismo e diminuisce il livello infiammatorio. Infatti, l’attivazione del TGR5 nei macrofagi e nelle cellule endoteliali da parte di livelli micromolari di acidi biliari circolanti sia durante il digiuno che nello stato postprandiale quando gli acidi biliari circolanti bilaterali raggiungono il picco di concentrazione, esercitano effetti anti-aterogenici e inibiscono l’aterosclerosi e la malattia coronarica (Steiner et al ., 2011). Il recettore TGR5, espresso negli adipociti, regola il dispendio energetico e il peso corporeo (van Nierop et al., 2017). Il GLP1 indotto dagli acidi biliari esercita anche effetti benefici sulla funzione endoteliale, sulla pressione sanguigna, sul metabolismo miocardico, sulla frazione di eiezione ventricolare sinistra, sull’aterosclerosi e sulla risposta al danno ossidativo indotto dalla riperfusione ischemica (Kang e Jung, 2016). La procedura RYGBP nei pazienti obesi comporta un aumento del livello di GLP1 con effetti cardioprotettivi. Inoltre, un aumento del flusso intestinale di acidi biliari a seguito di RYGBP porta all’attivazione del FXR intestinale e del suo target a valle, Enterokine FGF15/19, che ha dimostrato di reprimere l’espressione genica apo(a) mediante la cascata mediata dalla fosforilazione ERK1/2, e la riduzione del livello circolante di lipoproteine altamente aterogeniche (a) (Chennamsetty et al., 2012). La somministrazione e sovraespressione di FGF19 o FGF19 ricombinante in topi diabetici con deficit di Leptina ha dimostrato di ridurre l’aumento di peso, invertire la condizione diabetica, aumentare il tasso di ossidazione dei lipidi diminuendo anche il contenuto epatico di trigliceridi (Fu et al., 2004). Le procedure di chirurgia bariatrica comportano anche un aumento dei livelli circolanti delle specie di acido biliare, sia in stato di digiuno che postprandiale, nonché cambiamenti qualitativi nella composizione del pool di acidi biliari, a causa di una maggiore sintesi e riassorbimento epatico e riduzione dell’eliminazione intestinale o da cambiamenti nella composizione del microbiota (De Giorgi et al., 2015; Dutia et al., 2016). Di conseguenza, l’aumento della concentrazione di acidi biliari sia nel lume intestinale che nella circolazione sistemica, come potenti ligandi per FXR e TGR5, media il miglioramento del tasso metabolico, del glucosio e del metabolismo lipidico, aumenta la termogenesi con conseguente riduzione del peso corporeo, migliora l’infiammazione sistemica e promuove persino la conversione del tessuto adiposo bianco nel metabolicamente più attivo tessuto adiposo beige, simile al tessuto adiposo marrone (Fang et al., 2015). Questi miglioramenti metabolici implicano che il cambiamento nella composizione e nelle dimensioni del pool degli acidi biliari mediante approccio farmacologico o chirurgia metabolica influisce sul metabolismo sistemico con esito favorevole, suggerendo un nuovo approccio terapeutico nel trattamento dell’obesità e dei componenti della sindrome metabolica. Tuttavia, dato che gli acidi biliari attivano recettori nucleari multipli e possibilmente più di un GPCR, un’accurata dissezione e una valutazione approfondita delle vie di segnalazione mediata dagli acidi biliari su modalità specifiche dei tessuti dovrebbero fornire informazioni utili nel futuro sviluppo di nuovi derivati specifici e selettivi degli acidi biliari come nuovi agenti terapeutici nel trattamento della sindrome metabolica.

Giunti a questo punto abbiamo appurato che le evidenze emergenti dell’ultimo decennio hanno indicato il ruolo degli acidi biliari come molecole di segnalazione endocrine che regolano il glucosio, i lipidi e il metabolismo energetico attraverso percorsi complessi e correlati che includono principalmente la cascata di segnalazione FXR e TGR5. Pertanto, la modulazione di questi percorsi di segnalazione utilizzando gli acidi biliari e i loro derivati e la co-somministrazione con batteri probiotici con effetti secondari sulla composizione del pool di acido biliare è diventata un’area di particolare interesse nella ricerca moderna che offre un nuovo approccio per il trattamento della sindrome metabolica. Tuttavia, molti dei risultati ottenuti derivano da studi condotti su modelli animali che dovrebbero essere presi in considerazione con una attenta interpretazione dei risultati a causa delle principali differenze nel metabolismo degli acidi biliari e nella composizione del microbiota intestinale tra animali e umani. Inoltre, le differenze interindividuali nella composizione del microbiota intestinale, vale a dire l’impronta batterica specifica in alcuni individui, contribuiscono anche a profili di acidi biliari altamente specifici nel singolo soggetto, che influenzano in modo differenziato la patogenesi della malattia e, presumibilmente, la risposta a interventi preventivi e terapeutici correlati agli acidi biliari, che richiedono ulteriori studi e chiarimenti. Da un punto di vista terapeutico, è altamente auspicabile un approfondimento degli effetti metabolici di ciascuna delle specie di acido biliare naturale e sintetico in vivo. I probiotici, come potenziale strategia per modulare la composizione del microbiota intestinale, dovrebbero essere ulteriormente studiati per aiutare il ripristino del metabolismo degli acidi biliari e potenzialmente aiutare nel trattamento dei disturbi metabolici. La ricerca futura dovrebbe basarsi su approcci metabolomici, proteomici e lipidomici in popolazioni sia sane che malate al fine di identificare biomarcatori correlati all’acido biliare che possano essere utili per la previsione della terapia correlata all’acido biliare di diversi disturbi metabolici.
Conclusioni pratiche “sperimentali” per l’uso degli acidi biliari nel miglioramento della composizione corporea
Ma all’atto pratico, l’atleta interessato al miglioramento della composizione corporea come può trarre qualcosa di applicabile in concreto da tutto quello che è stato fino ad ora riportato?
Ovviamente, come spesso è capitato e capita nell’ambiente del BodyBuilding, la “sperimentazione” di nuovi PED non è un comportamento inusuale. E l’applicazione d’uso “sperimentale” degli acidi biliari assunti oralmente al fine di migliorare la composizione corporea ha interessato diversi atleti fin dalle prime pubblicazioni scientifiche.

Alcune pratiche speculari vedono l’uso concomitante della Caffeina durante il periodo di assunzione degli acidi biliari al fine di aumentare l’attività del cAMP (Adenosina Monofosfato Ciclico) stimolato dall’attivazione del TGR5 indotta dall’acido bilare. Pertanto, l’efficacia degli acidi biliari potrebbe essere potenziata assumendo contemporaneamente una quantità ragionevole di Caffeina o altre Xantine. In tessuti come il grasso marrone, nei muscoli scheletrici e nel fegato, l’attivazione del TGR5 aumenta le concentrazioni dell’enzima Deiodinasi 2 (D2) nella cellula.[52] Come ben sappiamo, la D2 converte la forma dell’ormone tiroideo poco attiva T4, che ha per l’appunto un modesto effetto sul metabolismo, nella forma più attiva T3. Questo effetto si tradurrebbe in un vantaggio sia per l’atleta “Natural” in ipocalorica sia nell’atleta che utilizza T4 sintetico nella medesima circostanza. Pertanto, l’utilizzo di acidi biliari in concomitanza con l’uso di T4 porterebbe ad una maggiore conversione di questo in T3. In una fase preparatoria dove l’atleta usa il T4 insieme al GH, il quale ne aumenta già la conversione in T3, l’effetto potrebbe essere additivo. L’effetto in questione è stato osservato con l’uso di Acido Colico e Acido Chenodesossicolico, anche se è potenzialmente riproducibile con l’uso di Acido Ursodesossicolico o Tauroursodesossicolico.

Per chi fosse totalmente digiuno di biochimica, il cAMP è il mediatore intracellulare degli effetti dell’ormone. Mentre l’ormone è considerato il primo messaggero che agisce sulle cellule dotate di recettori per l’ormone stesso il cAMP è il secondo messaggero, uguale per tutte le cellule e per tutti gli ormoni che porta il messaggio all’interno della cellula.
Dai risultati di cui sopra, ci sono suggerimenti che indicano i fattori che possono migliorare o compromettere gli effetti sulla composizione corporea legati agli acidi biliari. Come accennato in precedenza, la Caffeina può aumentare l’effetto del segnale del TGR5 agendo sul cAMP nei tessuti. [53] Di conseguenza, per esempio, l’uso di beta-2 agonisti (es. Clenbuterolo) può accentuare ulteriormente l’effetto degli acidi biliari. [53][54] (15-17) Gli Estrogeni e i contraccettivi orali alterano la produzione di acidi biliari, diminuendo in particolare la produzione di Acido Chenodesossicolico; le Statine che abbassano il Colesterolo riducono la produzione totale di acidi biliari fino al 30%.[55][56] Il consumo di alcol riduce la produzione di acidi biliari e gli alcolisti cronici hanno una marcata riduzione della produzione di acidi biliari a causa in parte di un danno epatico avanzato. [57] Gli acidi biliari non raggiungono concentrazioni significative nei soggetti che seguono una dieta povera di grassi. Una dieta ricca di grassi e ricca di proteine induce un aumento del 50% nella produzione di acidi biliari e gli effetti metabolici potrebbero essere ancora maggiori se la fonte proteica è ricca di Taurina e Glicina. [58][59]
Coloro che seguono regimi alimentari ipocalorici “Low-Fat” con uno schema di digiuno intermittente potrebbero notare ulteriori benefici dalla supplementazione con acidi biliari. Questa ipotesi nasce dal fatto che, a digiuno, l’attività della D2 è bassa e le concentrazioni sieriche di acidi biliari sono al minimo, in particolare tra gli obesi. Sebbene non sia stato analizzato in una camera metabolica, è ragionevole ipotizzare che l’integrazione con un acido biliare, insieme a Caffeina o altra molecola con caratteristiche lipolitiche e termogeniche, possa aumentare la beta ossidazione e la termogenesi (dissipazione dell’energia sotto forma di calore), rispetto a un integrazione priva della componente AB durante il digiuno. Ma ciò potrebbe essere vero anche con regimi differenti al digiuno intermittente “Low-Fat”.
Gli acidi biliari hanno una migliore assimilazione se assunti durante un pasto composto da un moderato quantitativo di grassi ed enzimi che ne favoriscono la digestione. In questo modo si verificherà un aumento significativo post-prandiale degli acidi biliari nel flusso ematico. Gli acidi biliari possono anche essere assunti a digiuno e possono aumentare l’effetto beta ossidativo indotto dall’esercizio fisico svolto in tale contesto, sebbene non molto significativo di per se. Le dosi dovrebbero essere contenute , poiché anche i livelli prodotti endogenamente possono provocare ripercussioni negative a livello del colon, dove i batteri convertono gli acidi biliari in metaboliti più tossici. Alcuni acidi biliari sono usati in medicina alla dose di 10 mg/kg/die e sono considerati sicuri – 1g per una persona di 100Kg; gli effetti collaterali legati ad un sovradosaggio includono diarrea ed in cronico portano ad alterazioni degli enzimi epatici. Di conseguenza, la dose di 1g/die è considerabile come il “tetto massimo” di sicurezza. Inoltre, c’è da ricordarsi che l’eccesso delle concentrazioni di acidi biliari dato dalla supplementazione ridurrà marcatamente la loro sintesi endogena, limitandone il beneficio complessivo. In medio stat virtus!
E, ovviamente, evitate tassativamente di darvi al “fai da te” o di affidarvi alla guida di qualche “pitecus gimnicus”…
Gabriel Bellizzi
Riferimenti:
- Hofmann AF, Hagey LR, Krasowski MD (February 2010). “Bile salts of vertebrates: structural variation and possible evolutionary significance”. J. Lipid Res. 51 (2): 226–46. doi:1194/jlr.R000042. PMC2803226. PMID 19638645.
- Jump up to: a b c d e f g Russell DW (2003). “The enzymes, regulation, and genetics of bile acid synthesis”. Annu. Rev. Biochem. 72: 137–74. doi:1146/annurev.biochem.72.121801.161712. PMID12543708.
- Jump up to: a b c d e f g h Chiang JY (October 2009). “Bile acids: regulation of synthesis”. J. Lipid Res. 50 (10): 1955–66. doi:1194/jlr.R900010-JLR200. PMC2739756. PMID 19346330.
- Jump up to: a b Carey, MC.; Small, DM. (Oct 1972). “Micelle formation by bile salts. Physical-chemical and thermodynamic considerations”. Arch Intern Med. 130 (4): 506–27. doi:1001/archinte.1972.03650040040005. PMID4562149.
- Jump up to: a b c d e Hofmann AF (1999). “The continuing importance of bile acids in liver and intestinal disease”. Arch. Intern. Med. 159 (22): 2647–58. doi:1001/archinte.159.22.2647. PMID10597755.
- Jump up to: a b Hofmann AF, Borgström B (February 1964). “The intraluminal phase of fat digestion in man: the lipid content of the micellar and oil phases of intestinal content obtained during fat digestion and absorption”. J. Clin. Invest. 43 (2): 247–57. doi:1172/JCI104909. PMC289518. PMID 14162533.
- Jump up to: a b c d Fiorucci S, Mencarelli A, Palladino G, Cipriani S (November 2009). “Bile-acid-activated receptors: targeting TGR5 and farnesoid-X-receptor in lipid and glucose disorders”. Trends Pharmacol. Sci. 30 (11): 570–80. doi:1016/j.tips.2009.08.001. PMID19758712.
- ‘Essentials of Medical Biochemistry, Lieberman, Marks and Smith, eds, p432, 2007’
- Jump up to: a b c Hofmann AF (October 1963). “The function of bile salts in fat absorption. The solvent properties of dilute micellar solutions of conjugated bile salts”. Biochem. J. 89: 57–68. doi:1042/bj0890057. PMC1202272. PMID 14097367.
- Li T, Chiang JY (2014). “Bile acid signaling in metabolic disease and drug therapy”. Pharmacol. Rev. 66 (4): 948–83. doi:1124/pr.113.008201. PMC4180336. PMID 25073467.
- Nagahashi M, Takabe K, Liu R, Peng K, Wang X, Wang Y, Hait NC, Wang X, Allegood JC, Yamada A, Aoyagi T, Liang J, Pandak WM, Spiegel S, Hylemon PB, Zhou H (2015). “Conjugated bile acid-activated S1P receptor 2 is a key regulator of sphingosine kinase 2 and hepatic gene expression”. Hepatology. 61 (4): 1216–26. doi:1002/hep.27592. PMC4376566. PMID 25363242.
- Wiemuth D, Sahin H, Falkenburger BH, Lefevre CM, Wasmuth HE, Grunder S (2012). “BASIC–a bile acid-sensitive ion channel highly expressed in bile ducts”. FASEB J. 26 (10): 4122–30. doi:1096/fj.12-207043. PMID22735174.
- Jump up to: a b Magotti P, Bauer I, Igarashi M, Babagoli M, Marotta R, Piomelli D, Garau G (2015). “Structure of Human N-Acylphosphatidylethanolamine-Hydrolyzing Phospholipase D: Regulation of Fatty Acid Ethanolamide Biosynthesis by Bile Acids”. Structure. 23 (3): 598–604. doi:1016/j.str.2014.12.018. PMC4351732. PMID 25684574.
- Makishima M, Okamoto AY, Repa JJ, et al. (May 1999). “Identification of a nuclear receptor for bile acids”. Science. 284 (5418): 1362–5. doi:1126/science.284.5418.1362. PMID10334992.
- Parks DJ, Blanchard SG, Bledsoe RK, et al. (May 1999). “Bile acids: natural ligands for an orphan nuclear receptor”. Science. 284 (5418): 1365–8. doi:1126/science.284.5418.1365. PMID10334993.
- Wang H, Chen J, Hollister K, Sowers LC, Forman BM (May 1999). “Endogenous bile acids are ligands for the nuclear receptor FXR/BAR”. Mol. Cell. 3 (5): 543–53. doi:1016/s1097-2765(00)80348-2. PMID10360171.
- Kim, I; Ahn, SH; Inagaki, T; Choi, M; Ito, S; Guo, GL; Kliewer, SA; Gonzalez, FJ (2007). “Differential regulation of bile acid homeostasis by the farnesoid X receptor in liver and intestine”. Journal of Lipid Research. 48 (12): 2664–72. doi:1194/jlr.M700330-JLR200. PMID17720959.
- Shapiro, Hagit; Kolodziejczyk, Aleksandra A.; Halstuch, Daniel; Elinav, Eran (2018-01-16). “Bile acids in glucose metabolism in health and disease”. Journal of Experimental Medicine. 215 (2): 383–396. doi:1084/jem.20171965. ISSN0022-1007. PMC 5789421. PMID 29339445.
- Davidson MH (2011). “A systematic review of bile acid sequestrant therapy in children with familial hypercholesterolemia”. J Clin Lipidol. 5 (2): 76–81. doi:1016/j.jacl.2011.01.005. PMID21392720.
- Allen L, Stobie D, Mauldin GN, Baer KE (January 1999). “Clinicopathologic features of dogs with hepatic microvascular dysplasia with and without portosystemic shunts: 42 cases (1991-1996)”. J. Am. Vet. Med. Assoc. 214 (2): 218–20. PMID9926012.
- Pusl T, Beuers U (2007). “Intrahepatic cholestasis of pregnancy”. Orphanet J Rare Dis. 2: 26. doi:1186/1750-1172-2-26. PMC1891276. PMID 17535422.
- Poupon RE, Balkau B, Eschwège E, Poupon R (May 1991). “A multicenter, controlled trial of ursodiol for the treatment of primary biliary cirrhosis. UDCA-PBC Study Group”. N. Engl. J. Med. 324 (22): 1548–54. doi:1056/NEJM199105303242204. PMID1674105.
- Glantz A, Marschall HU, Lammert F, Mattsson LA (December 2005). “Intrahepatic cholestasis of pregnancy: a randomized controlled trial comparing dexamethasone and ursodeoxycholic acid”. Hepatology. 42 (6): 1399–405. doi:10.1002/hep.20952. PMID 16317669.
- Danzinger RG, Hofmann AF, Schoenfield LJ, Thistle JL (January 1972). “Dissolution of cholesterol gallstones by chenodeoxycholic acid”. N. Engl. J. Med. 286 (1): 1–8. doi:10.1056/NEJM197201062860101. PMID 5006919.
- Thistle JL, Hofmann AF (September 1973). “Efficacy and specificity of chenodeoxycholic acid therapy for dissolving gallstones”. N. Engl. J. Med. 289 (13): 655–9. doi:10.1056/NEJM197309272891303. PMID 4580472.
- Petroni ML, Jazrawi RP, Pazzi P, et al. (January 2001). “Ursodeoxycholic acid alone or with chenodeoxycholic acid for dissolution of cholesterol gallstones: a randomized multicentre trial. The British-Italian Gallstone Study group”. Aliment. Pharmacol. Ther. 15 (1): 123–8. doi:10.1046/j.1365-2036.2001.00853.x. PMID 11136285.
- Uy MC, Talingdan-Te MC, Espinosa WZ, Daez ML, Ong JP (December 2008). “Ursodeoxycholic acid in the prevention of gallstone formation after bariatric surgery: a meta-analysis”. Obes Surg. 18 (12): 1532–8. doi:10.1007/s11695-008-9587-7. PMID 18574646.
- Pattni, S; Walters, JR (2009). “Recent advances in the understanding of bile acid malabsorption”. British Medical Bulletin. 92: 79–93. doi:10.1093/bmb/ldp032. PMID 19900947.
- Degirolamo C, Modica S, Palasciano G, Moschetta A (2011). “Bile acids and colon cancer: Solving the puzzle with nuclear receptors”. Trends Mol Med. 17 (10): 564–72. doi:10.1016/j.molmed.2011.05.010. PMID 21724466.
- Reddy BS, Hanson D, Mangat S, et al. (September 1980). “Effect of high-fat, high-beef diet and of mode of cooking of beef in the diet on fecal bacterial enzymes and fecal bile acids and neutral sterols”. J. Nutr. 110 (9): 1880–7. doi:10.1093/jn/110.9.1880. PMID 7411244.
- Hill MJ (May 1990). “Bile flow and colon cancer”. Mutat. Res. 238 (3): 313–20. doi:10.1016/0165-1110(90)90023-5. PMID 2188127.
- Cheah PY (1990). “Hypotheses for the etiology of colorectal cancer–an overview”. Nutr Cancer. 14 (1): 5–13. doi:10.1080/01635589009514073. PMID 2195469.
- Ou J, DeLany JP, Zhang M, Sharma S, O’Keefe SJ (2012). “Association between low colonic short-chain fatty acids and high bile acids in high colon cancer risk populations”. Nutr Cancer. 64 (1): 34–40. doi:10.1080/01635581.2012.630164. PMID 22136517.
- O’Keefe SJ, Kidd M, Espitalier-Noel G, Owira P (May 1999). “Rarity of colon cancer in Africans is associated with low animal product consumption, not fiber”. Am. J. Gastroenterol. 94 (5): 1373–80. doi:10.1111/j.1572-0241.1999.01089.x. PMID 10235221.
- American Cancer Society. Cancer Facts and Figures 2009. http://www.cancer.org/Research/CancerFactsFigures/cancer-facts-figures-2009
- Bernstein H, Bernstein C, Payne CM, Dvorak K (July 2009). “Bile acids as endogenous etiologic agents in gastrointestinal cancer”. World J. Gastroenterol. 15 (27): 3329–40. doi:10.3748/wjg.15.3329. PMC 2712893. PMID 19610133.
- Bernstein C, Holubec H, Bhattacharyya AK, et al. (August 2011). “Carcinogenicity of deoxycholate, a secondary bile acid”. Arch. Toxicol. 85 (8): 863–71. doi:10.1007/s00204-011-0648-7. PMC 3149672. PMID 21267546.
- Prasad AR, Prasad S, Nguyen H, Facista A, Lewis C, Zaitlin B, Bernstein H, Bernstein C. Novel diet-related mouse model of colon cancer parallels human colon cancer. World J Gastrointest Oncol. 2014 Jul 15;6(7):225-43. doi: 10.4251/wjgo.v6.i7.225. PMID 25024814
- Singh S, Khanna S, Pardi DS, Loftus EV, Talwalkar JA (2013). “Effect of ursodeoxycholic acid use on the risk of colorectal neoplasia in patients with primary sclerosing cholangitis and inflammatory bowel disease: a systematic review and meta-analysis”. Inflamm. Bowel Dis. 19 (8): 1631–8. doi:10.1097/MIB.0b013e318286fa61. PMID 23665966.
- Eaton JE, Silveira MG, Pardi DS, Sinakos E, Kowdley KV, Luketic VA, Harrison ME, McCashland T, Befeler AS, Harnois D, Jorgensen R, Petz J, Lindor KD (2011). “High-dose ursodeoxycholic acid is associated with the development of colorectal neoplasia in patients with ulcerative colitis and primary sclerosing cholangitis”. Am. J. Gastroenterol. 106 (9): 1638–45. doi:10.1038/ajg.2011.156. PMC 3168684. PMID 21556038
- Wertheim BC, Smith JW, Fang C, Alberts DS, Lance P, Thompson PA (2012). “Risk modification of colorectal adenoma by CYP7A1 polymorphisms and the role of bile acid metabolism in carcinogenesis”. Cancer Prev Res (Phila). 5 (2): 197–204. doi:10.1158/1940-6207.CAPR-11-0320. PMC 3400261. PMID 22058145.
- “Deoxycholic acid injection”. Medline plus. Retrieved 26 August 2015. Cite web requires |website= (help)
- Ascher B, Hoffmann K, Walker P, Lippert S, Wollina U, Havlickova B (2014). “Efficacy, patient-reported outcomes and safety profile of ATX-101 (deoxycholic acid), an injectable drug for the reduction of unwanted submental fat: results from a phase III, randomized, placebo-controlled study”. J Eur Acad Dermatol Venereol. 28 (12): 1707–15. doi:10.1111/jdv.12377. PMC 4263247. PMID 24605812.
- Wollina U, Goldman A (2015). “ATX-101 for reduction of submental fat”. Expert Opin Pharmacother. 16 (5): 755–62. doi:10.1517/14656566.2015.1019465. PMID 25724831
- Henriksson P, Einarsson K, et al. Estrogen-induced gallstone formation in males. Relation to changes in serum and biliary lipids during hormonal treatment of prostatic carcinoma. J Clin Invest 1989;84:811-6.
- Sigma Aldrich; rev. del 12.07.2012
- Duncan D, Rotunda AM (2011). “Injectable therapies for localized fat loss: state of the art”. Clin Plast Surg. 38 (3): 489–501, vii. doi:10.1016/j.cps.2011.02.005.
- Watanabe M, Houten SM, et al. Bile acids induce energy expenditure by promoting intracellular thyroid hormone activation. Nature 2006;439:484-9.
- https://www.nature.com/articles/s41467-017-02068-0
- https://www.gastrojournal.org/article/S0016-5085(18)35259-4/fulltext
- https://www.frontiersin.org/articles/10.3389/fphar.2018.01382/full
- Teodoro JS, Zouhar P, et al. Enhancement of brown fat thermogenesis using chenodeoxycholic acid in mice. Int J Obes 2013 Dec 6. [E-pub, ahead of print]
- Dulloo AG, Seydoux J, et al. Potentiation of the thermogenic antiobesity effects of ephedrine by dietary methylxanthines: adenosine antagonism or phosphodiesterase inhibition? Metabolism 1992;41:1233-41.
- van der Lans AA, Hoeks J, et al. Cold acclimation recruits human brown fat and increases nonshivering thermogenesis. J Clin Invest 2013;123:3395-403.
- Everson GT, Fennessey P, et al. Contraceptive steroids alter the steady-state kinetics of bile acids. J Lipid Res 1988;29:68-76.
- Bertolotti M, Zambianchi L, et al. Influence of newly synthesized cholesterol on bile acid synthesis during chronic inhibition of bile acid absorption. Hepatology 2003;38:939-46.
- Monroe P, Vlahcevic ZR, et al. Effects of acute and chronic ethanol intake on bile acid metabolism. Alcohol Clin Exp Res 1981;5:92-100.
- Bortolotti M, Kreis R, et al. High protein intake reduces intrahepatocellular lipid deposition in humans. Am J Clin Nutr 2009;90:1002-10.
- Liaset B, Hao Q, et al. Nutritional regulation of bile acid metabolism is associated with improved pathological characteristics of the metabolic syndrome. J Biol
