Introduzione alla 6° ed ultima parte:
Nelle precedenti parti di questo lungo viaggio alla scoperta e comprensione degli aminoacidi [Parte 1°, 2°, 3°, 4° e 5°] abbiamo capito chiaramente cosa sono, quali sono le loro funzioni biologiche ed abbiamo analizzato quegli AA che sono maggiormente utilizzati in campo sportivo. In questa parte conclusiva il viaggio raggiungerà il culmine con una trattazione approfondita degli Aminoacidi Essenziali/EAA.
Introduzione agli EAA:
Gli aminoacidi “essenziali” (EAA) della dieta – istidina, isoleucina, leucina, lisina, metionina, fenilalanina, treonina, triptofano e valina – sono detti “essenziali” perché non possono essere prodotti endogenamente e quindi devono essere consumati per la sopravvivenza umana. Inoltre, l’arginina è considerata un aminoacido “condizionatamente” essenziale, il che significa che in alcune circostanze la produzione endogena di arginina non riesce a soddisfare le esigenze fisiologiche. La necessità di consumare tutti gli EAA è stata ben stabilita negli ultimi 100 anni [1], ed esiste un fabbisogno giornaliero accettato per ciascun EAA come parte del normale apporto dietetico [2]. Il fabbisogno giornaliero si basa sulla quantità minima di ciascun EAA che deve essere consumata per evitare sintomi clinici di carenza. Un consumo inadeguato di uno solo dei nove EAA provoca sintomi di carenza, tra cui un’alterata sintesi proteica [3]. I requisiti per il consumo giornaliero di ciascun EAA sono convenzionalmente soddisfatti come componenti dell’apporto proteico dietetico di routine. La quantità e il profilo degli EAA nelle singole proteine alimentari, insieme alla digeribilità degli EAA legati alle proteine, costituiscono la base per la valutazione quantitativa della qualità della proteina pura [4]. Le proteine che contengono una quantità abbondante di tutti gli EAA in un formato altamente digeribile sono considerate proteine di “alta qualità” [4].
Sono stati fatti vari tentativi per esprimere la “qualità” o il “valore” di vari tipi di proteine. Le misure includono il valore biologico, l’utilizzo netto delle proteine, il rapporto di efficienza proteica, il punteggio aminoacidico corretto per la digeribilità delle proteine e il concetto di proteine complete. Questi concetti sono importanti nell’industria zootecnica, perché la mancanza relativa di uno o più aminoacidi essenziali negli alimenti per animali avrebbe un effetto limitante sulla crescita e quindi sul rapporto di conversione degli alimenti. Pertanto, diversi mangimi possono essere somministrati in combinazione per aumentare l’utilizzo netto delle proteine, oppure si può aggiungere al mangime un supplemento di un singolo aminoacido (metionina, lisina, treonina o triptofano).
Mentre l’importanza di soddisfare il fabbisogno minimo di ciascun EAA attraverso il consumo di proteine alimentari di alta qualità è riconosciuta da molti decenni [5], i benefici ottenibili dal consumo di EAA in forma libera in quantità superiori al fabbisogno minimo sono stati pienamente apprezzati solo negli ultimi 25 anni. Sono disponibili prodotti a base di singoli aminoacidi liberi, come la leucina o la lisina, e composizioni di piccoli gruppi di EAA, in particolare gli aminoacidi a catena ramificata (leucina, valina e isoleucina; BCAA), ma molti studi hanno documentato che si ottengono maggiori benefici da composizioni contenenti tutti gli EAA. L’integrazione giornaliera con composizioni di tutti gli EAA in forma libera ha dimostrato di essere benefica in molti modi [6]. In particolare, le composizioni di EAA in forma libera stimolano la sintesi proteica e il ricambio proteico nell’organismo, compresa la sintesi di nuove proteine muscolari. La stimolazione della sintesi proteica muscolare (MPS) da parte degli EAA può produrre un aumento della massa e della qualità muscolare, che si traduce in un miglioramento delle prestazioni fisiche e dei risultati funzionali [7].
La valutazione dei benefici degli EAA si differenzia da quella di molti altri integratori alimentari valutati in quanto esistono requisiti ben accettati per il consumo giornaliero di EAA. Inoltre, piuttosto che integratori contenenti un solo composto, come la creatina, esistono combinazioni quasi illimitate dei nove EAA che possono essere realizzate a seconda della richiesta fisiologica.
Meccanismo d’azione degli EAA
- L’importanza del turnover delle proteine muscolari
Il continuo rinnovamento delle proteine muscolari degradate e danneggiate è importante per mantenere la massa e la funzione proteica del muscolo. Nello stato post-assorbitivo, la ripartizione netta delle proteine muscolari mantiene una fornitura costante di EAA plasmatici che forniscono precursori per la sintesi proteica in altri tessuti e organi. Gli EAA assunti con la dieta ripristinano la perdita netta di proteine muscolari stimolando la MPS. In condizioni normali, i tassi di MPS e di degradazione delle proteine muscolari sono uguali nel corso della giornata. Se la MPS supera il tasso di degradazione delle proteine muscolari, la massa muscolare aumenterà nel tempo, con un potenziale aumento della forza. L’accelerazione del turnover proteico muscolare (cioè la sintesi e la degradazione delle proteine aumentano in egual misura), senza un aumento della massa proteica muscolare netta, può anche giovare alla funzione muscolare, sostituendo le fibre muscolari più vecchie e danneggiate con nuove fibre altamente funzionanti [8]. Pertanto, la stimolazione del MPS/turnover è la principale base metabolica per l’aumento della forza e della funzione fisica. Sebbene anche i cambiamenti nella degradazione delle proteine giochino un ruolo nel controllo del metabolismo proteico muscolare, la stimolazione della MPS è la base principale degli effetti benefici degli integratori di EAA. Inoltre, le prime ricerche hanno dimostrato che l’effetto degli aminoacidi sul muscolo scheletrico si esplica principalmente attraverso la stimolazione della MPS, dato che la ripartizione delle proteine muscolari è rimasta invariata in uno studio acuto [9]. È importante notare che, poiché la misurazione della disgregazione delle proteine muscolari non è semplice e problematica in caso di assunzione esogena, la MPS rappresenta anche un indicatore surrogato del turnover proteico.
- Controllo della sintesi proteica muscolare
Il modo più definitivo per valutare l’effetto degli integratori di EAA sulle prestazioni fisiche è quello di misurare le risposte metaboliche e funzionali nel tempo quando vengono fornite quantità e profili diversi di EAA, a condizione che tutte le altre variabili siano mantenute costanti. Tuttavia, per ottenere risultati affidabili possono essere necessari mesi di trattamento, a causa del lento tasso di turnover delle proteine muscolari e della difficoltà di controllare tutte le altre variabili (dieta, assunzione totale di EAA, attività, ecc.). Di conseguenza, l’uso della metodologia dei traccianti isotopici stabili per quantificare la risposta acuta delle MPS a una singola dose di EAA in soggetti umani è diventato il surrogato accettato per prevedere la risposta anabolica nel muscolo. Aspetti della sintesi proteica, trascrizione e traduzione, possono essere potenzialmente influenzati dal consumo di EAA: in particolare l’iniziazione e l’allungamento traslazionale (vedi Figura 1a). La trascrizione dell’RNA messaggero (mRNA) dal DNA comporta l’attivazione dei relativi geni. I cambiamenti nell’attivazione dei geni si riflettono nel numero di mRNA specifici nella cellula. L’espressione dell’mRNA è importante perché l’assemblaggio fisico di nuove proteine avviene sull’mRNA. Il complesso processo di iniziazione consiste in diverse fasi collegate tra loro e mediate da fattori di iniziazione eucariotici (eIF). Il complesso mammalian target of rapamycin 1 (mTORC1) è un regolatore chiave dell’attivazione degli eIF a valle che sono mediatori dell’iniziazione delle MPS (vedi Figura 1b). Sia la trascrizione che la traslazione del processo di sintesi proteica possono essere stimolate dagli aminoacidi e dall’esercizio fisico [13-16]. Tuttavia, sia la trascrizione dell’mRNA [17] che lo stato di fosforilazione di mTORC1 [18] sono generalmente poco correlati con i tassi di MPS, il che significa che nessuno dei due processi è probabilmente limitante per la MPS nella maggior parte delle circostanze. Il controllo traslazionale della sintesi proteica da parte della disponibilità di EAA è stato riconosciuto fin dal 1958 [19]. La traduzione comporta il collegamento successivo degli aminoacidi nell’ordine dettato dal codice dell’mRNA. Gli aminoacidi intracellulari liberi sono legati ai corrispondenti RNA di trasferimento (tRNA), formando molecole di tRNA cariche. Le molecole di tRNA cariche a loro volta trasferiscono in sequenza gli amminoacidi legati ai siti dell’mRNA che corrispondono al codice del tRNA carico. L’allungamento traslazionale può procedere fino al completamento solo se sono disponibili quantità adeguate di tutti i precursori amminoacidici richiesti. Una carenza relativa di un qualsiasi EAA lo renderà limitante e l’allungamento traslazionale verrà interrotto prima del completamento del processo. Il controllo traslazionale della MPS richiede che siano disponibili quantità adeguate di tutti gli EAA per sostenere un aumento dei tassi di MPS. Oltre a fornire i precursori necessari per la sintesi proteica, gli EAA aumentano i geni associati al rilevamento, al trasporto e alla regolazione di mTORC1 degli aminoacidi [20].
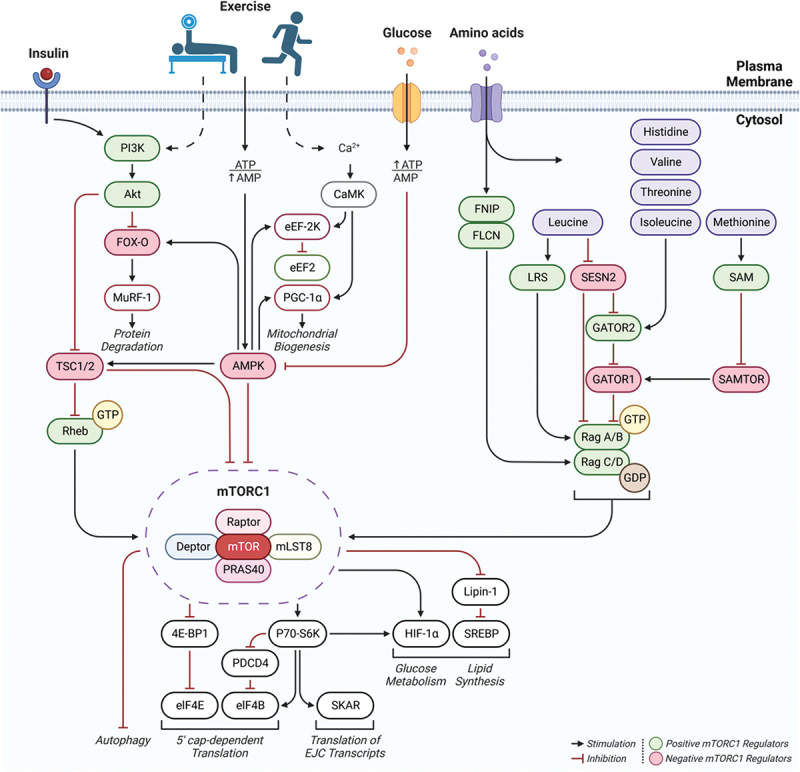
Abbreviazioni: Akt, proteina chinasi B; AMPK, proteina chinasi attivata dall’AMP; PI3K, fosfoinositide 3-chinasi; Ca2 +, ione calcio; CaMK, proteina chinasi calcio/calmodulina-dipendente; FNIP1, proteina folliculina-interagente 1; FLCN, folliculina (FLCN); mTORC1, complesso 1 del bersaglio mammifero della rapamicina; FOX-O, fattori di trascrizione forkhead box-O; PGC-1α, peroxisome proliferator-activated gamma coactivator-1 alpha; MuRF-1, muscle ring-finger protein-1; eEF-2K, eukaryotic elongation factor-2 kinase; eEF2, eukaryotic elongation factor-2; TSC1/2, Tuberous sclerosis proteins 1 (hamartin) +2 (tuberin); Rheb, Ras homolog enriched in brain; LRS, leucil-tRNA sintetasi; SESN2, Sestrin-2; GATOR1/2, GAP (GTPase-activating protein) activity toward Rags 1+2; SAM, s-adenosyl methionine; SAMTOR, s-adenosyl methionine sensor for mTORC1; 4E-BP1, eukaryotic translation initiation factor 4E-binding protein 1; P70-S6K, (S6K1) proteina ribosomiale S6 chinasi beta-1; SREBP, sterol regulatory element binding protein; HIF-1α, hypoxia-inducible factor-1 alpha; PDCD4, Programmed cell death protein 4; SKAR, S6K1 Aly/REF-like substrate; eIF4E/B, eukaryotic translation initiation factor 4E+B.
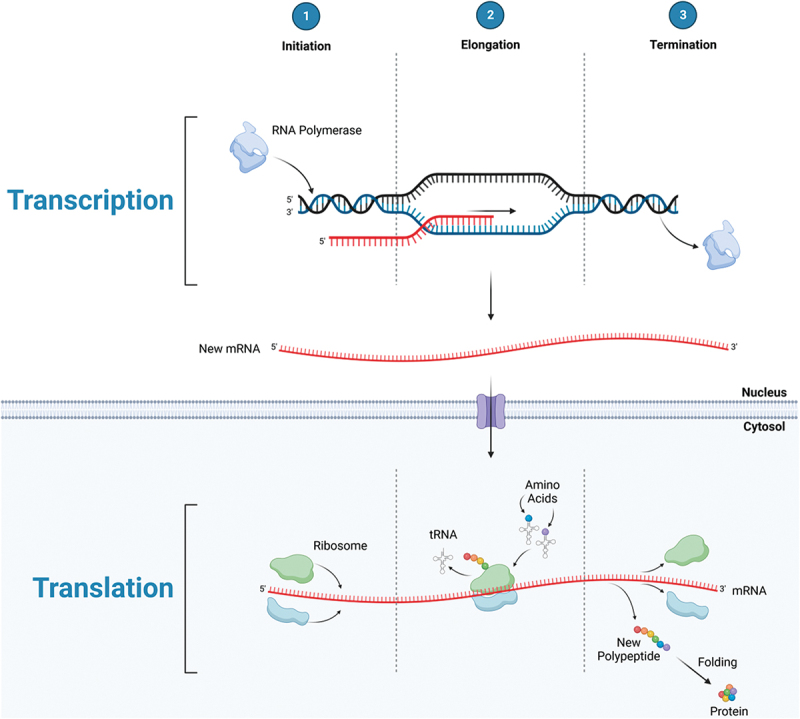
- Importanza del protocollo utilizzato per misurare la risposta delle MPS al consumo di aminoacidi
Il metodo più comunemente utilizzato per misurare la MPS nei soggetti umani consiste nel determinare il tasso di incorporazione di un aminoacido tracciante con isotopi stabili nelle proteine muscolari nel corso del tempo, diviso per l’arricchimento del precursore [21]. Questo approccio porta al calcolo del tasso di sintesi frazionale delle proteine muscolari (FSR). Poiché la massa muscolare è relativamente costante nell’arco di diversi giorni, le variazioni del FSR sono convenzionalmente considerate un riflesso diretto della MPS [21]. Un approccio alternativo alla misurazione della MPS si basa sulla differenza artero-venosa di traccianti aminoacidici non marcati e marcati e sull’arricchimento isotopico del pool libero intracellulare [22]. Questi due metodi danno risultati comparabili per la MPS in soggetti umani [23]. Infatti, è stato dimostrato che la stimolazione acuta della MPS da parte del consumo di EAA si riflette nel bilancio proteico delle 24 ore della gamba [24]. L’evidenza supporta la traduzione delle differenze nella risposta acuta della MPS al consumo di EAA in parametri di risultato misurati per settimane o mesi. Ad esempio, l’effetto del consumo giornaliero di una formula a base di EAA in soggetti sani giovani e normali è stato confrontato con un placebo per 28 giorni di riposo completo a letto [7]. Il consumo quotidiano della formula a base di EAA per tutti i 28 giorni di riposo a letto ha migliorato la perdita di massa muscolare osservata nei soggetti che consumavano il placebo di una quantità prevista dallo studio con tracciante prima del riposo a letto [7]. L’accuratezza predittiva del metodo del tracciante in acuto in questo paradigma è particolarmente significativa perché l’attività e l’assunzione di cibo sono state completamente controllate durante i 28 giorni di intervento [7].
Il periodo di tempo in cui viene determinata la MPS è importante per interpretare il significato fisiologico dei cambiamenti acuti in risposta all’assunzione di aminoacidi. Un aumento transitorio della MPS ha meno probabilità di predire un aumento a lungo termine della massa e della funzione muscolare rispetto a una risposta che rimane al di sopra del valore di base per tre ore o più. Ad esempio, il consumo di leucina da sola può suscitare una risposta transitoria (1-2 ore) nella MPS muscolare, ma questa risposta deve essere interpretata con cautela [25]. Il consumo di una quantità sufficiente di leucina da sola può attivare mTORC1 e le molecole associate coinvolte nell’avvio del processo di sintesi proteica e si riflette in un aumento transitorio delle proteine muscolari MPS. Tuttavia, la sintesi delle proteine muscolari richiede un’adeguata disponibilità di tutti gli aminoacidi componenti, compresi i nove EAA. In assenza di apporto dietetico, gli EAA necessari per produrre proteine muscolari complete devono provenire da fonti endogene. Inizialmente, gli EAA aggiuntivi necessari per la sintesi di proteine muscolari complete possono provenire da pool di EAA liberi nel fluido intracellulare ed extracellulare. Tuttavia, il conseguente esaurimento degli EAA liberi in questi pool limiterà la sintesi proteica muscolare a causa dell’inadeguata disponibilità di precursori (EAA disponibili nei pool di aminoacidi). L’unica altra fonte potenziale degli EAA necessari per mantenere la MPS in questa circostanza è la degradazione proteica accelerata, che limiterà qualsiasi guadagno netto di proteine muscolari che ci si potrebbe aspettare in base alle variazioni acute della MPS. Pertanto, la risposta anabolica (cioè MPS – MPB) delle proteine muscolari al consumo di un singolo EAA, come la leucina, o di piccoli gruppi di EAA (BCAA) sarà limitata dalla scarsa disponibilità degli altri EAA.
Il lavoro di Fuchs e collaboratori [26] fornisce prove sull’interpretazione dell’importanza dell’intervallo di campionamento sulla risposta della FSR muscolare all’assunzione di aminoacidi. In questo studio, la FSR muscolare è stata determinata in risposta al consumo di BCAA, proteine del latte o chetoacidi a catena ramificata, corrispondenti a leucina, valina e isoleucina. La FSR delle proteine muscolari è stata stimolata nelle prime due ore dopo il consumo di tutti e tre gli integratori alimentari. Tuttavia, 2-5 ore dopo l’ingestione di ciascun integratore, la FSR delle proteine muscolari è rimasta stimolata solo dopo il consumo di proteine del latte. In altre parole, l’ingestione dei BCAA o dei chetoacidi associati non è riuscita a stimolare la FSR delle proteine muscolari rispetto al valore di base dopo il consumo [26]. Il tasso di FSR delle proteine muscolari è stato limitato nelle ore 2-5 dopo il loro consumo da una diminuzione della disponibilità degli EAA non forniti dall’integratore alimentare, come risulta dalla diminuzione della concentrazione plasmatica di fenilalanina. La diminuzione degli EAA plasmatici è stata probabilmente attenuata in qualche misura da un aumento del tasso di degradazione delle proteine muscolari, limitando così l’effetto anabolico netto della stimolazione della FSR delle proteine muscolari. Al contrario, la disponibilità di fenilalanina (come riflesso degli EAA) era elevata 2-5 ore dopo il consumo di proteine del latte a causa della continua digestione e assorbimento di tutti gli EAA, nonché della disponibilità di aminoacidi non essenziali di supporto. Gli autori hanno concluso che “questi dati suggeriscono che, oltre all’aumento postprandiale delle concentrazioni plasmatiche di BCAA, è necessario fornire altri aminoacidi (essenziali) per consentire un aumento postprandiale più prolungato del tasso di sintesi proteica muscolare” [26]. È quindi ragionevole basarsi principalmente su dati provenienti da studi in cui la MPS è stata determinata in un intervallo di 3 ore o più dopo il consumo di EAA per aspettarsi una traduzione dei risultati in risultati funzionali.
Sicurezza
Il consumo di EAA non è stato segnalato come causa di reazioni avverse. I soggetti affetti da rare malattie genetiche che comportano un’alterazione della capacità di metabolizzare alcuni EAA, come la malattia delle urine a sciroppo d’acero (incapacità di metabolizzare i BCAA), potrebbero avere una risposta avversa agli integratori contenenti tutti gli EAA. Tuttavia, gli errori innati del metabolismo che influenzano il metabolismo di un EAA sono evidenti in età precoce e l’adattamento alla dieta è necessario per la salute ed eventualmente per la sopravvivenza. È quindi improbabile che un adulto con un errore innato del metabolismo che limita il consumo sicuro di EAA non sia consapevole di tale condizione. È anche possibile che un individuo con una malattia renale possa reagire male all’integrazione di EAA, poiché una dieta a basso contenuto proteico è spesso raccomandata nelle malattie renali a causa dell’accumulo di urea e ammoniaca nel sangue. Tuttavia, un’integrazione a base di EAA generalmente non contribuisce ad aumentare la produzione di urea o ammoniaca a causa del maggiore riutilizzo di aminoacidi non essenziali per la sintesi proteica. Tuttavia, non sono disponibili dati sufficienti su individui con funzionalità renale compromessa per determinare la sicurezza degli integratori alimentari a base di EAA.
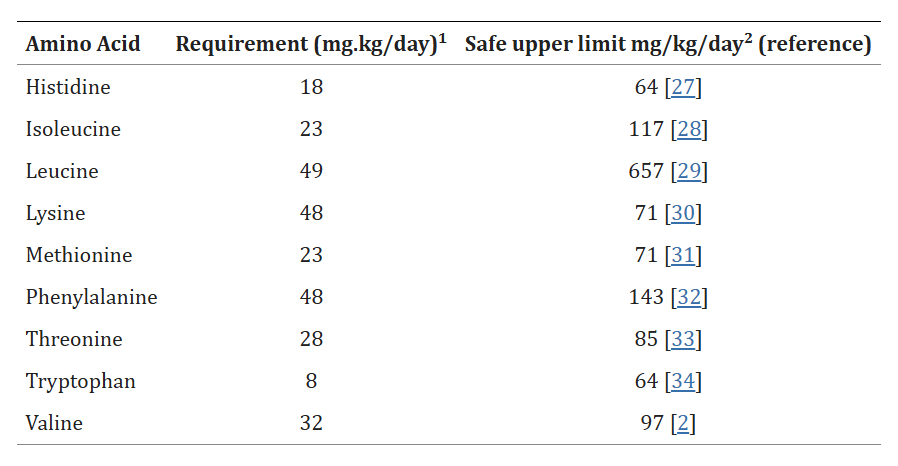
Sono disponibili pochi dati su cui basare il limite massimo di sicurezza del consumo dei singoli EAA. La Tabella 1 elenca i livelli di consumo di ciascun EAA che si sono dimostrati sicuri. I limiti massimi di sicurezza riportati nella Tabella 1 sono espressi come quantità di ciascun EAA consumata al di sopra dell’assunzione abituale. Pertanto, se si considerano le quantità sicure di ciascun EAA, questi dati indicano che più di 100 g di EAA supplementari possono essere consumati in modo sicuro al giorno in un adulto americano che già consuma l’apporto alimentare medio abituale di circa 40 grammi al giorno. Il dosaggio ragionevole di un integratore di EAA non supera i 15 g, il che significa che anche tre dosi massime al giorno sono in linea con il normale consumo giornaliero di EAA attraverso le fonti alimentari di proteine. I seguenti dati sugli effetti dell’integrazione di EAA sono stati ricavati in popolazioni con un’adeguata assunzione di proteine alimentari, a meno che non sia indicato diversamente.
Fabbisogno alimentare di aminoacidi essenziali e limite massimo di consumo sicuro per gli adulti:
Punti chiave:
- Il turnover proteico assicura il continuo rinnovo delle proteine muscolari degradate e danneggiate ed è importante per mantenere la massa e la funzione proteica muscolare.
- Il surrogato accettato per la misurazione del turnover proteico è la determinazione della sintesi proteica muscolare con la metodologia dei traccianti isotopici stabili. Sebbene la degradazione delle proteine sia importante in questo processo, la risposta acuta principale dell’assunzione di EAA sul muscolo scheletrico è la stimolazione della sintesi proteica.
- Il limite massimo di sicurezza dell’assunzione giornaliera di EAA consente un’integrazione sostanziale.
Consenso dei risultati della ricerca
- EAA e sintesi proteica muscolare a riposo
La MPS è stimolata dal consumo di composizioni di EAA [35] e inibita da una ridotta disponibilità di EAA nel plasma [36]. L’entità dell’aumento della MPS in seguito al consumo di EAA è funzione della quantità ingerita. A riposo, è stato riportato che una dose orale di EAA pari a 1,5 g stimola la MPS [37], mentre la dose massima efficace, dopo la quale non si ottiene un’ulteriore stimolazione della sintesi in una singola dose, è ritenuta pari a 15-18 grammi di EAA [38]. La stimolazione delle MPS attraverso il consumo di EAA non richiede il consumo simultaneo di aminoacidi non essenziali (NEAA) [35,38]. L’inclusione di NEAA in una miscela di 18 g di EAA nel profilo di proteine di manzo non ha avuto alcun effetto sulla stimolazione mediata dagli EAA della MPS [35]. Mentre il consumo di NEAA non ha alcun effetto sulla MPS quando si consumano meno di 18 g di EAA, è possibile che quando si consumano più di 18 g di EAA i NEAA siano limitati dai tassi massimi di produzione endogena; tuttavia, sono necessarie ulteriori ricerche per esplorare questa possibilità.
Gli integratori di EAA stimolano le MPS più di una pari quantità di proteine di alta qualità, sia come isolato [39] sia come componente di un pasto [40]. È stato riscontrato che una dose orale di 3 g di EAA stimola le MPS in misura simile a 20 g di proteine isolate del siero di latte, che contengono circa 10 g di EAA [41]. Inoltre, è stato dimostrato che l’aggiunta di EAA alle proteine del siero di latte aumenta significativamente la risposta delle MPS rispetto alle sole proteine del siero di latte [42]. L’effetto stimolante superiore degli EAA in forma libera (solo singoli EAA) è legato alla maggiore quantità di EAA/grammo rispetto a una fonte proteica alimentare [43]. A causa dell’elevato tasso di assorbimento intestinale degli EAA in forma libera [44], il rapido aumento delle concentrazioni plasmatiche di EAA in circolo favorisce il trasporto verso l’interno del muscolo [23,45], con conseguente raggiungimento più rapido del picco di concentrazione intramuscolare di EAA rispetto ad altre fonti proteiche alimentari.
L’importanza delle concentrazioni plasmatiche di EAA e della velocità di aumento fino al picco di concentrazione sulla risposta MPS non è chiara, ma alcuni studi hanno trovato una relazione tra le concentrazioni plasmatiche di EAA e la MPS [46] e l’analisi di dati consolidati mostra una correlazione tra la velocità di aumento fino al picco di concentrazione di EAA e la MPS [43]. D’altra parte, non è stata riscontrata alcuna differenza nella risposta alla MPS quando la stessa dose di EAA è stata somministrata in un unico bolo o in cinque dosi più piccole nel tempo [47]. Pertanto, si concorda sull’esistenza di una relazione tra la dose di EAA e la risposta alle MPS, ma non si concorda sui meccanismi di regolazione che collegano dose e MPS.
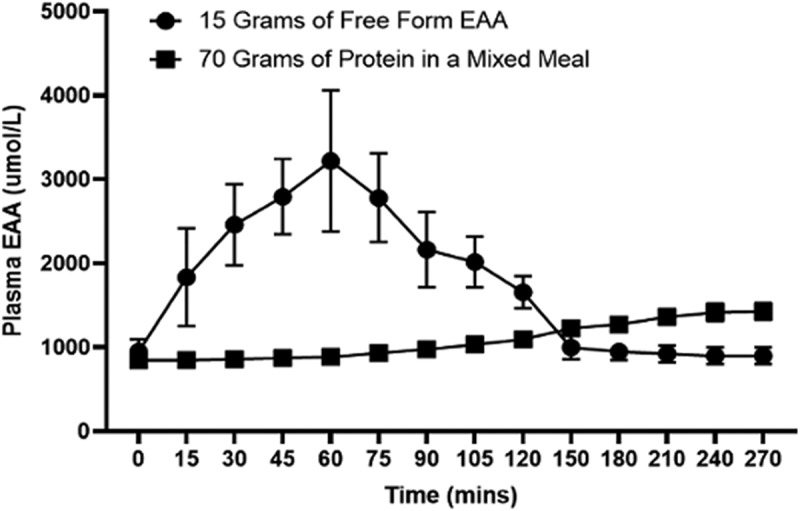
L’impatto complessivo di un integratore alimentare sulla MPS nell’arco delle 24 ore dipende non solo dalla risposta acuta al consumo della composizione, ma anche dalle risposte anaboliche ai pasti normali. È ormai assodato che la risposta anabolica a un pasto è ridotta in seguito a un pre-carico con un isolato proteico [48]. Al contrario, una dose di 15 g di EAA non ha avuto alcun impatto sulla risposta anabolica al pasto successivo [49]. Tuttavia, è importante notare che l’integrazione di EAA in forma libera determina un aumento delle concentrazioni ematiche di EAA molto maggiore rispetto a un pasto con una quantità maggiore di EAA, poiché non richiedono digestione e vengono assorbiti rapidamente. La Figura 2 mostra gli effetti di 15 g di EAA in forma libera [50] sulle concentrazioni plasmatiche rispetto a un pasto misto contenente 70 grammi di proteine di manzo [51]. A causa della lenta digestione e del rilascio degli EAA alimentari dopo il consumo di un pasto misto, i livelli ematici aumentano solo in minima parte, rispetto a un aumento rapido e robusto dopo l’ingestione di EAA cristallini/liberi. Inoltre, questo rapido aumento (3 volte o più) predice una maggiore risposta della MPS [43].
Lo stato fisiologico può influenzare la risposta delle MPS agli EAA. L’invecchiamento è lo stato non clinico più comunemente studiato in cui la risposta agli EAA può essere alterata, definita resistenza anabolica. Una minore reattività delle MPS al consumo è stata ben documentata [52,53], ma non osservata in modo coerente [54]. Le diverse risposte delle MPS degli individui anziani al consumo di EAA possono essere spiegate da differenze nel profilo EAA della composizione. Ad esempio, in un’occasione Katsanos et al. hanno fornito a soggetti anziani una miscela di 6,7 g di EAA con il profilo presente nelle proteine del siero di latte (27% di leucina) e in una seconda occasione hanno fornito la stessa quantità di una miscela di EAA con la leucina che comprendeva circa il 40% del totale degli EAA [55]. In questo studio, la composizione al 40% di leucina ha stimolato la sintesi proteica muscolare circa il 50% in più rispetto al profilo di leucina inferiore, nonostante contenesse la stessa quantità di EAA totali [55]. Questi risultati dimostrano la potenziale importanza del profilo EAA in una composizione. Tuttavia, le combinazioni dei nove EAA sono pressoché illimitate e ci sono pochi dati che confrontano direttamente l’efficacia di diversi profili di EAA nella stessa circostanza. A causa della mancanza di dati comparativi sufficienti, l’impatto dei diversi profili di EAA sulla MPS non sarà discusso in questo documento. A questo proposito sono necessarie ulteriori ricerche per determinare i profili ottimali per i vari requisiti fisiologici.
- EAA e bilancio proteico ed energetico dell’intero organismo
Un bilancio netto negativo delle proteine in tutto il corpo diverse da quelle muscolari (cioè nei tessuti e negli organi; riflesso dai tassi di sintesi e di degradazione delle proteine nell’intero organismo) influisce negativamente sulle proteine muscolari e quindi sulle prestazioni fisiche. Se l’assunzione di precursori di EAA con la dieta non è sufficiente a soddisfare il fabbisogno di tutto l’organismo, la scomposizione delle proteine muscolari e il rilascio di aminoacidi nel sangue forniranno gli EAA necessari. Un bilancio energetico negativo influirà indirettamente anche sulle proteine muscolari, poiché gli EAA ingeriti saranno almeno in parte destinati all’ossidazione per la produzione di energia, anziché essere incanalati verso la sintesi proteica muscolare [56]. Una discussione sugli effetti degli EAA sulla sintesi proteica muscolare deve quindi essere considerata nel contesto dello stato dell’equilibrio proteico ed energetico dell’intero organismo.
I periodi di deficit calorico sono comuni nelle categorie di peso e negli sport di resistenza come la maratona e il nuoto di distanza, dove i periodi di allenamento intenso e il desiderio di avere un peso corporeo ridotto possono limitare l’apporto calorico [57]. Il deficit calorico aumenta il fabbisogno di EAA dell’intero organismo [58]. Ad esempio, cinque giorni di deficit calorico del 30% hanno richiesto un aumento di 3 volte dell’assunzione di EAA per produrre un bilancio proteico corporeo positivo [58]. Se non si riesce a soddisfare l’aumento del fabbisogno di EAA dell’intero corpo, si verifica una scomposizione netta delle proteine muscolari per fornire gli EAA necessari e non si può invertire completamente la tendenza fino a quando non si soddisfa il fabbisogno dell’intero corpo.
Molti stati clinici inducono cambiamenti nel metabolismo proteico dell’intero corpo che influenzano il fabbisogno di EAA e l’equilibrio proteico muscolare. Possono esserci nuove richieste di precursori di EAA per funzioni quali la riparazione dei tessuti danneggiati, la guarigione delle ferite e la produzione di proteine della fase acuta. In queste condizioni è probabile che la normale risposta anabolica del muscolo scheletrico agli EAA assunti con la dieta diminuisca (resistenza anabolica). Di conseguenza, la rapida perdita di massa muscolare è una complicazione comune di gravi malattie e lesioni [59]. La stessa risposta può verificarsi, anche se in misura minore, in seguito a un allenamento intenso o a un evento agonistico, in particolare negli atleti che si trovano volontariamente o involontariamente in deficit calorico.
Punti chiave: Effetti degli EAA sul muscolo e sulle proteine dell’intero corpo
- Esiste una dose-risposta degli EAA orali sulla sintesi proteica del muscolo scheletrico che raggiunge un plateau a circa 15-18 g.
- Esiste una relazione tra la cinetica degli EAA plasmatici e la stimolazione della sintesi proteica.
- Gli EAA orali stimolano la sintesi proteica muscolare in misura maggiore rispetto a una pari quantità di proteine di alta qualità.
- La riduzione della risposta anabolica con l’invecchiamento richiede un diverso profilo di EAA, in particolare una maggiore proporzione di leucina.
- Il fabbisogno di EAA dell’intero organismo aumenta con il deficit calorico. Se questo fabbisogno non è soddisfatto, si verifica una disgregazione netta delle proteine muscolari per fornire gli EAA necessari.
- EAA e funzione fisica in assenza di esercizio fisico
Diversi studi documentano che la stimolazione acuta delle MPS da parte di composizioni libere di EAA si traduce in un aumento a lungo termine della massa e della funzione muscolare, anche in assenza di un controllo dell’assunzione di proteine con la dieta. Gli studi sui risultati sono stati generalmente condotti su individui anziani. Utilizzando un disegno randomizzato, in doppio cieco e controllato con placebo, donne anziane sono state assegnate a ricevere placebo o 15 g di EAA al giorno per tre mesi [60]. L’ingestione di 7,5 g di EAA ha stimolato acutamente la FSR delle proteine muscolari in entrambi i gruppi al basale [60]. La FSR basale a tre mesi era aumentata solo in coloro che ricevevano un’integrazione giornaliera di EAA, e l’entità della risposta acuta agli EAA era inalterata dopo tre mesi di consumo di EAA. Coerentemente con i dati sulla FSR delle proteine muscolari, la massa corporea magra è aumentata significativamente nei soggetti che ricevevano EAA ma non il placebo [36]. In uno studio simile, 12 soggetti intolleranti al glucosio hanno ingerito 11 g di EAA due volte al giorno tra i pasti per 16 settimane [61]. La dieta e l’attività fisica non sono state modificate in altro modo. Il consumo di EAA ha aumentato la massa magra e, soprattutto, ha migliorato una serie di parametri della funzione fisica [61]. In un gruppo di 38 donne anziane (≥75 anni), l’integrazione quotidiana con 3 g di EAA due volte al giorno per tre mesi ha migliorato significativamente la velocità di camminata [62]. Risultati simili sono stati osservati in uno studio che ha incluso 92 persone anziane a bassa funzionalità a cui sono stati somministrati per 12 settimane integratori di 15 g di proteine isolate del siero di latte, EAA (12 g di EAA più 3 g di aromi) o educazione alimentare [63]. I soggetti che hanno ricevuto gli EAA hanno migliorato significativamente la distanza percorsa in 6 minuti, la forza di presa e la forza delle gambe (coppia di picco misurata con il Cybex). Anche i soggetti che hanno ricevuto le proteine del siero del latte hanno migliorato significativamente la distanza percorsa in 6 minuti, ma il miglioramento è stato significativamente inferiore rispetto a quelli che hanno ricevuto gli EAA. La forza delle gambe non è migliorata nel gruppo del siero di latte. È interessante notare che la distanza percorsa dal gruppo di educazione alimentare è diminuita nel corso delle 12 settimane di intervento [63]. A riprova del potenziale impatto positivo dell’integrazione di EAA sui miglioramenti funzionali, l’entità del miglioramento osservato nella distanza di cammino di 6 minuti nei soggetti che ricevevano EAA era approssimativamente la stessa riportata in una revisione sistematica di studi che riportavano i risultati di 2-6 mesi di allenamento di resistenza in 241 individui [64]. Questi risultati sono coerenti con l’estrapolazione degli effetti acuti della somministrazione di EAA sul controllo della MPS [46] attraverso la farmacocinetica ematica [43]. In uno studio condotto su persone anziane e sane costrette al riposo a letto per 10 giorni, il consumo di tre dosi di 15 g di EAA al giorno ha attenuato il declino della funzione fisica evidente nei soggetti che avevano ricevuto un placebo equivalente dal punto di vista calorico [65]. In sintesi, gli studi esistenti sugli effetti degli EAA sui risultati funzionali in assenza di allenamento si sono concentrati in gran parte su popolazioni anziane o compromesse. Poiché gli EAA sono potenti stimolatori dell’anabolismo proteico muscolare e dell’intero corpo, queste popolazioni sono logiche destinatarie di indagini primarie in quanto manifestano una resistenza anabolica nel muscolo scheletrico che porta alla perdita muscolare, alla debolezza funzionale, alle comorbidità e ad altri esiti clinici negativi. Pertanto, è opportuno raccomandare ulteriori studi per determinare l’effetto anabolico degli EAA in giovani individui sani in assenza di allenamento.
- Interazione degli EAA con l’esercizio fisico
I primi esami incrociati degli effetti degli aminoacidi sul muscolo scheletrico hanno dimostrato che l’aumento della somministrazione di aminoacidi a riposo determina una stimolazione del trasporto di aminoacidi verso l’interno del muscolo scheletrico (dal 30 al 100%, a seconda dei singoli EAA), una stimolazione della sintesi proteica (dal 30 al 300%) e un miglioramento del bilancio netto di aminoacidi [9]. Quando l’esercizio di resistenza della parte inferiore del corpo è stato eseguito prima dell’infusione di aminoacidi, si sono verificati effetti maggiori nel trasporto verso l’interno di alcuni aminoacidi, ma soprattutto si sono registrati aumenti ancora maggiori nella sintesi proteica e nel bilancio proteico muscolare netto [9]. In ogni caso, non si sono verificati cambiamenti nella degradazione delle proteine muscolari. È importante notare che gli effetti combinati dell’esercizio di resistenza e dell’aumento dell’apporto di aminoacidi sono interattivi. Quando lo stesso esercizio di resistenza è stato eseguito senza la somministrazione di aminoacidi, si è registrato un aumento del trasporto interno di aminoacidi e della sintesi proteica muscolare; tuttavia, il bilancio muscolare netto è rimasto negativo [66]. L’assenza di miglioramento del bilancio netto è dovuta all’aumento della sintesi e della degradazione delle proteine dopo il solo esercizio di resistenza [66]. Pertanto, l’esercizio di resistenza da solo non porta all’anabolismo muscolare (il bilancio netto delle proteine muscolari è negativo). L’anabolismo si verifica solo se supportato dai precursori amminoacidici necessari. La Figura 3 rappresenta graficamente il bilancio trasversale degli arti della fenilalanina (un surrogato del bilancio degli aminoacidi, poiché non viene metabolizzata nel muscolo scheletrico) a digiuno, dopo il solo esercizio di resistenza, dopo l’infusione dei soli aminoacidi e con l’infusione combinata di aminoacidi ed esercizio di resistenza. Gli effetti interattivi degli EAA somministrati per via orale e dell’esercizio di resistenza hanno rivelato risultati simili. L’esercizio di resistenza della parte inferiore del corpo è stato seguito dalla somministrazione di EAA per via orale o di una miscela completa di aminoacidi. I risultati hanno indicato che gli EAA dopo l’esercizio fisico hanno migliorato il bilancio netto muscolare nella stessa misura della miscela completa, fornendo ulteriori prove [38] del fatto che, se somministrati insieme all’esercizio fisico, solo gli EAA sono necessari per stimolare l’anabolismo muscolare [67]. Anche l’ingestione orale in bolo di EAA dopo l’esercizio di resistenza della parte inferiore del corpo ha aumentato la sintesi proteica e il bilancio netto muscolare, indipendentemente dal fatto che la bevanda sia stata consumata una o tre ore dopo l’esercizio [68]. Vi sono indicazioni che i benefici degli EAA sul muscolo scheletrico potrebbero non dipendere interamente dalla stimolazione delle MPS. L’integrazione di EAA ha migliorato l’evidenza istologica del danno muscolare e ha ridotto la perdita di forza muscolare, anche in assenza di cambiamenti nella MPS [69].

Gli effetti interattivi degli EAA e dell’esercizio di resistenza si riflettono nella segnalazione dell’avvio della traduzione nel muscolo. Ai volontari è stata somministrata una soluzione di placebo, leucina, BCAA o EAA dopo l’esercizio contro resistenza. I risultati hanno indicato che 90 minuti dopo il recupero dell’esercizio, l’attivazione della proteina ribosomiale S6K1 e del fattore di iniziazione della traduzione eucariotica 4E-BP1, nonché una riduzione sostenuta dell’interazione 4E-BP1:eIF4E, erano maggiori con gli EAA [70]. Mentre nello studio sugli EAA è stato osservato un aumento di 9 volte dell’espressione di S6K1, la stimolazione complessiva dell’iniziazione della traduzione è stata più efficace con gli EAA, con conseguente aumento progressivo dell’iniziazione della traduzione (placebo < leucina < BCAA < EAA) [70]. Uno studio condotto su giovani uomini ha confermato l’aumento della via di segnalazione mammalian target of rapamycin complex 1 (mTORC1) dopo l’esercizio di resistenza, ma ha anche osservato che un integratore di EAA mantiene mTORC1 nelle regioni periferiche delle fibre muscolari, più vicino al suo attivatore diretto Rheb [71]. Gli autori hanno ipotizzato che “la localizzazione intracellulare di mTOR può servire a innescare la chinasi per futuri stimoli anabolici” [71]. Gli effetti degli EAA e dell’esercizio di resistenza sull’aumento della segnalazione anabolica sono coerenti con l’invecchiamento. Gli EAA e l’esercizio di resistenza aumentano le concentrazioni periferiche di EAA in egual misura sia nei soggetti giovani che in quelli più anziani [72]. Indipendentemente dall’età, con il trattamento combinato sono stati dimostrati aumenti di mTOR (Ser2481) e della proteina ribosomiale S6 (Ser235/236) [72], il che suggerisce una maggiore sensibilità muscolare agli stimoli combinati. inoltre, la somministrazione di EAA dopo l’esercizio fisico in uomini anziani porta a un aumento della proliferazione delle cellule satelliti [73]. Il prodotto metabolico di questa segnalazione è un miglioramento della sintesi proteica muscolare. Inoltre, donne anziane hanno eseguito un’estensione unilaterale del ginocchio e poi hanno consumato 1,5 o 6 g di una formula EAA con quantità variabili di leucina, oppure 20 o 40 g di proteine del siero di latte. I risultati hanno indicato che le dosi di 1,5 g e 6 g di EAA erano efficaci quanto 40 g di proteine del siero del latte nella stimolazione della sintesi proteica muscolare acuta (miofibrillare) [37].
- Strategie di integrazione: Tempistica degli EAA
È necessario considerare la tempistica della somministrazione di EAA in relazione all’esercizio di resistenza. I soggetti a cui sono stati somministrati EAA immediatamente prima o dopo l’esercizio di resistenza hanno entrambi registrato un aumento del 130% delle concentrazioni di fenilalanina arteriosa e muscolare [74]. Tuttavia, l’effetto sull’assorbimento netto di fenilalanina (una misura indiretta della sintesi proteica netta) è stato molto maggiore quando la bevanda è stata consumata subito prima dell’esercizio [74]. È importante notare che ogni trattamento ha portato a un bilancio netto di fenilalanina positivo; tuttavia, il migliore apporto di aminoacidi (flusso sanguigno X concentrazione arteriosa di EAA) quando è stato consumato immediatamente prima dell’esercizio ha portato a un apporto di aminoacidi circa 3 volte superiore [74]. L’effetto stimolante dell’esercizio di resistenza sul flusso sanguigno muscolare, se combinato con il maggiore apporto di aminoacidi derivante dal consumo prima dell’esercizio, determina una maggiore risposta anabolica nel muscolo scheletrico. Ciò è coerente con una recente revisione che denota la relazione tra l’aumento degli EAA periferici e la stimolazione della sintesi proteica muscolare e dell’intero corpo [43]. Altri lavori non confermano questi risultati, poiché una soluzione di carboidrati/EAA somministrata prima dell’esercizio di resistenza non ha migliorato la sintesi proteica muscolare post-esercizio [75]; tuttavia, le differenze metodologiche/interpretative e l’assunzione di carboidrati possono complicare la coerenza dell’interpretazione. Inoltre, è stato dimostrato che un secondo bolo di EAA un’ora dopo il primo duplica l’anabolismo muscolare della prima somministrazione, indicando che i meccanismi di sintesi non sono inattivi dopo una prima stimolazione [76].
- Interazione degli EAA con altre modalità di esercizio
A causa dei forti effetti interattivi dimostrati con gli EAA e l’esercizio di resistenza, la maggior parte del lavoro si è concentrata su questa combinazione. Anche i dati sulla combinazione di EAA ed esercizio aerobico sono coerenti con i suoi effetti sull’anabolismo proteico del muscolo scheletrico. Nei giovani adulti che eseguivano 90 minuti di esercizio in cicloergometria o con carico ponderato (30% della massa corporea) su tapis roulant, con o senza EAA (consumati ogni 30 minuti per tutta la durata dell’esercizio), la sintesi proteica muscolare era maggiore durante ciascuna modalità di esercizio con gli EAA [77]. Tuttavia, il trasporto del carico e gli EAA hanno determinato un aumento maggiore della MPS sia durante che dopo l’esercizio [77]. Questi risultati indicano che il carico del muscolo scheletrico fornisce uno stimolo più forte per gli effetti combinati di EAA ed esercizio fisico. L’interazione tra EAA ed esercizio aerobico è consistente anche nell’invecchiamento. Volontari anziani (72 ± 1 anno) sono stati randomizzati a ricevere 15 g/d di EAA o 15 g/d di EAA più 3 giorni/settimana di allenamento aerobico supervisionato. Coerentemente con i risultati precedenti, l’assunzione acuta di EAA prima dell’intervento ha aumentato la MPS [78]. Tuttavia, dopo 24 settimane di intervento, il gruppo che combinava EAA ed esercizio aerobico presentava una maggiore risposta sintetica del muscolo agli EAA rispetto al gruppo dei soli EAA [78], indicando che l’esercizio fisico costante sensibilizza ulteriormente il muscolo scheletrico agli effetti anabolici degli EAA. Soprattutto, la maggiore sensibilità del muscolo scheletrico agli EAA si è tradotta in una maggiore qualità muscolare e in una maggiore velocità di cammino sui 400 m nel gruppo EAA più esercizio aerobico [78].
L’esercizio/allenamento ad alta intensità e intermittente (HIIT) e la maggior parte degli sport di squadra (calcio, basket, hockey, tennis, ecc.) richiedono componenti di allenamento sia aerobico che anaerobico/di resistenza. Gli studi condotti sulle proteine suggeriscono che l’esercizio fisico ad alta intensità intrapreso con una maggiore disponibilità di proteine (cioè eseguito in uno stato di alimentazione con proteine) può migliorare sinergicamente l’ipertrofia muscolare [79]. Altri potenziali benefici includono l’aumento della biogenesi mitocondriale, il recupero dell’esercizio, la capacità aerobica e il miglioramento delle prestazioni di sprint [80]. Ad oggi, le poche ricerche che utilizzano EAA e HIIT non sono ancora definitive. In adulti sovrappeso/obesi non allenati, 8 settimane di allenamento a intervalli ad alta intensità (HIIT; 6-10 × 1 min@90% W max: 1 min di riposo) hanno prodotto un aumento significativo delle dimensioni, della sezione trasversale, del volume e della qualità del muscolo della coscia, ma non è stato potenziato sinergicamente da una bassa dose di EAA (3,6 g due volte al giorno) [81]. Inoltre, anche il VO2 è aumentato con l’HIIT, ma non è stato potenziato sinergicamente dagli EAA [82]. Nella stessa coorte, non sono stati riscontrati effetti acuti (3,6 g prima dell’esercizio) o cronici (dopo 4 e 8 settimane di 3,6 g due volte al giorno) dell’integrazione di EAA sul tempo di esaurimento o sulla progressione del carico di lavoro [83]. Sebbene non vi siano prove che suggeriscano che l’integrazione di EAA sia dannosa o attenui gli adattamenti fisiologici associati all’HIIT, non vi sono prove sufficienti per trarre conclusioni sui benefici in termini di adattamento e prestazioni. Tuttavia, c’è motivo di aspettarsi un’interazione degli EAA con l’esercizio aerobico. La sola camminata moderata su tapis roulant (45 minuti al 40% di VO2 di picco) in uomini giovani e anziani ha aumentato la sintesi proteica muscolare subito dopo l’esercizio, con la risposta dei più giovani mantenuta fino a un’ora dopo l’esercizio [84]. Anche la sintesi di fibrinogeno è stata elevata in entrambi i gruppi fino a tre ore dopo l’esercizio [84]. L’apporto di aminoacidi è stato maggiore subito dopo l’esercizio, il che denota ancora una volta l’effetto dell’esercizio sul flusso sanguigno degli arti. Pertanto, se l’aumento del flusso sanguigno si combina con un maggiore apporto di aminoacidi per via orale, ci si aspetta un anabolismo muscolare.
Per quanto riguarda le interazioni con l’esercizio fisico, gli EAA in forma libera possono essere presi in considerazione rispetto alle proteine intatte (siero di latte) sulla base della facilità di assunzione in prossimità e durante l’esercizio. Le formule orali di EAA in forma libera richiedono una digestione minima, comportano un carico gastrico minimo e sono rapidamente assorbite e trasportate in periferia. Per questo motivo, sono ideali per il consumo prima dell’esecuzione di un esercizio fisico rigoroso.
EAA e condizioni cliniche ed esiti
Gli effetti benefici dell’integrazione della dieta con EAA sono stati dimostrati in un’ampia varietà di condizioni cliniche. Le condizioni in gran parte associate all’invecchiamento sono state un obiettivo frequente della terapia con EAA, tra cui la sarcopenia [62,85], le infezioni contratte durante l’assistenza a lungo termine [86], la scarsa funzionalità fisica [63] e l’insufficienza cardiaca [40,87,88]. Gli effetti benefici degli EAA sono stati riportati anche nelle seguenti condizioni o situazioni: riabilitazione [89-92]; ictus [93,94]; riposo a letto/immobilizzazione [8,65,95-97]; malattia arteriosa periferica [98]; insufficienza renale [99-103]; infiammazione [104,105]; malattia critica [106]; cancro del polmone [107]; fibrosi cistica [108]; broncopneumopatia cronica ostruttiva [109-111]; guarigione delle ferite [112]; lesioni cerebrali [113,114]; sindrome metabolica e fattori di rischio cardiovascolare [115-117]; obesità [118,119]; grasso epatico [115,120-122]; e diabete [123-127]. È importante notare che in tutti questi studi gli effetti benefici sono stati osservati nonostante l’assenza di controllo del consumo di EAA contenuti nelle proteine alimentari, il che implica l’importanza di un assorbimento rapido e completo degli EAA liberi in circostanze cliniche in cui la digestione può essere compromessa e la resistenza anabolica è prevalente. I risultati ottenuti nelle popolazioni cliniche evidenziano la necessità e il potenziale impatto dell’integrazione di EAA nell’ambito degli sforzi di riabilitazione da lesioni ortopediche e interventi chirurgici associati. Questi scenari rappresentano gli ambienti clinici più probabili in cui si troveranno gli atleti agonisti e questa rimane un’area di ricerca poco esplorata.
Punti chiave: EAA, esercizio fisico e loro funzione
- Gli effetti anabolici degli EAA e dell’esercizio fisico sono interattivi, in quanto la risposta alla combinazione è maggiore della somma delle singole risposte. L’aumento del flusso sanguigno degli arti indotto dall’esercizio contribuisce a questa risposta aumentando il trasporto di EAA nel muscolo scheletrico.
- La combinazione di EAA ed esercizio aerobico, così come altre modalità di carico muscolare, è anche anabolizzante per il muscolo scheletrico.
- Gli EAA somministrati prima dell’esercizio fisico determinano un anabolismo maggiore rispetto a quelli assunti dopo il completamento dell’esercizio; tuttavia, un effetto anabolico minore può essere realizzato entro un’ora dalla cessazione dell’esercizio.
- In assenza di uno stimolo all’esercizio, la somministrazione di EAA in popolazioni anabolicamente resistenti, come quelle affette da invecchiamento e patologie cliniche, si è dimostrata benefica per i risultati clinici ed efficace nel ripristino della forza e delle prestazioni funzionali.
Domande rimanenti
Gli effetti metabolici degli EAA sono stati elegantemente articolati. Inoltre, è stata stabilita la loro interazione metabolica con l’esercizio di resistenza e aerobico. Esiste quindi una base metabolica per la traduzione dell’integrazione di EAA in risultati di performance. Come accennato in precedenza, il sostanziale effetto anabolico dell’integrazione di EAA in forma libera è coerente con la loro efficacia nelle popolazioni che trarrebbero maggior beneficio dal loro utilizzo. Per questo motivo, la stragrande maggioranza dei lavori longitudinali che hanno esaminato l’integrazione di EAA e i risultati funzionali si è svolta in popolazioni anziane o cliniche caratterizzate da insensibilità anabolica muscolare, perdita muscolare e/o debolezza muscolare. Meno lavori hanno documentato gli effetti/risultati a lungo termine associati all’uso di EAA in popolazioni di atleti. Inoltre, sarebbe utile un ulteriore lavoro che definisca il profilo ottimale degli EAA, nonché il dosaggio e la tempistica ottimali per circostanze specifiche.
Stechiometria degli EAA – l’importanza della corretta AA ratio
La stechiometria è il calcolo delle quantità relative di reagenti e prodotti nelle reazioni chimiche. La stechiometria si basa sulla legge di conservazione della massa, secondo la quale la massa totale dei reagenti è uguale alla massa totale dei prodotti, il che porta a capire che le relazioni tra le quantità di reagenti e prodotti formano tipicamente un rapporto di numeri interi positivi. Ciò significa che se le quantità dei singoli reagenti sono note, è possibile calcolare la quantità del prodotto. Al contrario, se un reagente ha una quantità nota e la quantità di prodotto può essere determinata empiricamente, è possibile calcolare anche la quantità degli altri reagenti.
In questo modo si sviluppano metodi per determinare le quantità di composti prodotti o consumati nelle reazioni chimiche e si descrivono alcuni tipi fondamentali di reazioni chimiche. Applicando i concetti e le competenze introdotte, si è in grado di spiegare cosa succede allo zucchero contenuto in una barretta di cioccolato che si mangia, o agli AA contenuti in una fonte proteica e/o integratore, tanto per fare un esempio.

Il concetto di reagente limitante è stato utilizzato dal chimico tedesco Justus von Liebig (1803-1873) nel XIX secolo per ricavare un’importante legge biologica ed ecologica. La legge del minimo di Liebig afferma che la sostanza essenziale disponibile nella quantità più piccola rispetto a un minimo critico controllerà la crescita e la riproduzione di qualsiasi specie vegetale o animale. Quando un gruppo di organismi esaurisce il reagente limitante essenziale, le reazioni chimiche necessarie per la crescita e la riproduzione devono arrestarsi. Vitamine, proteine e altri nutrienti sono essenziali per la crescita del corpo umano e delle popolazioni umane.
Alcuni di voi conosceranno già la “complementarietà degli AA”. In breve, e per fare un esempio, essa riguarda il modo più efficace per ottenere tutti i 9 EAA nella dieta di un vegetariano. La complementarietà degli AA consiste nel combinare due proteine vegetali (ad esempio, legumi e cereali) per ottenere tutti i 9 aminoacidi essenziali per l’organismo. La ripartizione della complementarietà degli AA è la seguente:
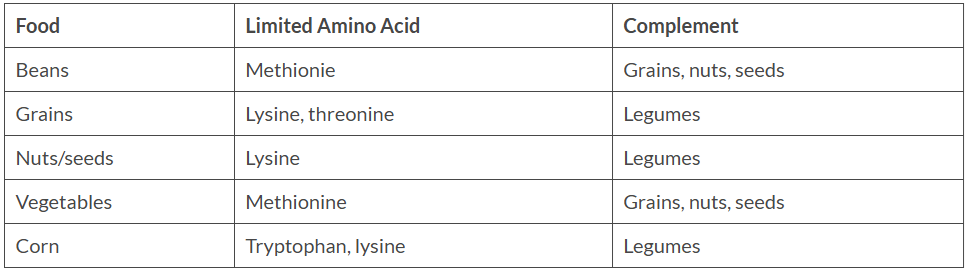
Quindi, l’idea della complementarità degli AA, non è altro che l’abbinamento di diversi alimenti della dieta al fine di fornire il giusto equilibrio di aminoacidi per costruire le proteine umane. Le proteine umane richiedono quantità stechiometriche di circa 9 aminoacidi “essenziali”; se ne manca solo uno, la proteina non può essere sintetizzata e ne deriva una malnutrizione proteica. Questo illustra il concetto di “reagente limitante”, ovvero un reagente presente in quantità inferiore a quella stechiometrica rispetto agli altri reagenti.
Un gruppo eterogeneo di culture sopravvissute in tutto il mondo ha adottato diete, per quanto diverse, che forniscono il corretto equilibrio di aminoacidi. Gli antropologi ritengono che l’adozione fortuita di queste diete abbia fornito alle culture un valore di sopravvivenza. Nelle aree in cui il cibo scarseggia, le culture che non adottano diete con un corretto equilibrio di aminoacidi potrebbero non sopravvivere.
In Sud America sono comuni le diete che combinano le tortillas di mais o altri prodotti a base di mais con i fagioli, come la tostada. I fagioli mangiati da soli forniscono quantità limitate di aminoacidi contenenti zolfo, come la metionina e la cisteina, quindi questi aminoacidi limitano la quantità di proteine umane che possono essere sintetizzate. I fagioli contengono grandi quantità di aminoacidi come la lisina e il triptofano, che sono quindi “reagenti in eccesso” quando vengono utilizzati per sintetizzare le proteine umane e vengono degradati in urea e sprecati. Se il grano, il riso o il mais vengono consumati da soli, in genere forniscono quantità di lisina e triptofano che limitano la quantità di proteine umane che possono essere sintetizzate. Ma se i fagioli vengono mangiati insieme ai cereali o al mais, i reagenti in eccesso dei fagioli completano i reagenti limitanti dei cereali (e viceversa). Le proteine umane possono quindi essere sintetizzate in modo efficiente e quantità molto ridotte di aminoacidi vengono semplicemente espulse come urea.
In India, il riso o il chapati vengono consumati con le lenticchie per fornire un equilibrio di aminoacidi.
Per capire meglio il concetto di stechiometria, i questa sede analizzeremo gli esperimenti che riguardano il mais e la malnutrizione proteica che ne può derivare se viene mangiato da solo. È noto che il mais è un alimento povero di proteine di per sé, essendo povero di lisina e triptofano [8], e ancora di più quando viene nixtamalizzato. Queste carenze hanno spinto i ricercatori a sviluppare il QPM (Quality Protein Maze) per aumentare le concentrazioni di questi aminoacidi essenziali nelle sue proteine.
Esperimenti sui ratti, il cui fabbisogno di aminoacidi è simile a quello degli esseri umani, forniscono una base per alcuni calcoli stechiometrici [9]. Come mostra la tabella sottostante, l’aumento di peso è stato minimo quando LYS o TRP sono stati aggiunti separatamente a una dieta “base”. Ciò significa che nessuno dei due, da solo, è un aminoacido limitante e impedisce la sintesi delle proteine dei topi. Ma quando sono stati aggiunti entrambi, è stato misurato un aumento significativo, insieme a una diminuzione dell’urea sierica. Ciò significa che entrambi erano limitanti e che, quando sono stati aggiunti entrambi, è stata sprecata una quantità molto minore di aminoacidi. Gli aminoacidi sono stati destinati alla sintesi proteica, anziché essere semplicemente metabolizzati ed escreti come urea. Mentre l’aggiunta di isoleucina nella dieta 5 ha fatto poca differenza (quindi deve essere fornita adeguatamente dal mais), l’aggiunta della sola treonina (THR) alla dieta 4 ha aumentato l’aumento di peso corporeo, quindi deve essere limitante in una dieta di mais + LYS + TRP. L’aggiunta di ILE, metionina (MET), istidina (HIS) e valina (VAL) costituisce infine una dieta quasi bilanciata, come dimostrano i grandi aumenti di peso e la bassa urea sierica della dieta 8.
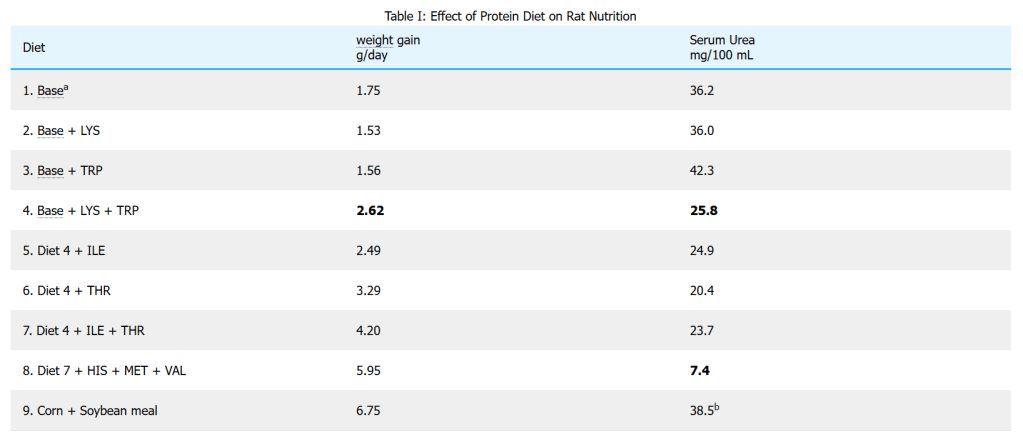
La dieta di base consisteva in 920,2 g di mais, 30,0 g di olio di mais, 35,0 g di miscela di minerali, 10 g di miscela di vitamine, 2,5 g di calcare e 2,3 g di colina. b Questo forte aumento è dovuto al raddoppio delle proteine totali della dieta, piuttosto che all’inefficienza proteica.
Lo stesso documento[10] fornisce la sequenza, dalla più limitante alla meno, degli aminoacidi del mais e il fabbisogno del ratto (simile a quello umano) pubblicato dal NRC[11]. Abbiamo aggiunto le quantità di aminoacidi nelle lenticchie per rappresentare i fagioli[12].

Corretta stechiometria o ratio degli aminoacidi:
In base ai dati della Tabella II, calcolare il rapporto molare ottimale tra lisina (LYS, C6H14N2O2, massa molare 146,19 g/mol) e arginina (ARG, C6H14N4O2, massa molare 174,2 g/mol) nella dieta.
Aminoacido limitante:
Dai dati della tabella precedente, calcolare quale, LYS o ARG, è il reagente limitante in una dieta a base di mais?
c. Quanto aminoacido in eccesso verrà sprecato in 1kg di dieta a base di mais?
Soluzione
a. L’equazione bilanciata avrà dei coefficienti che dobbiamo determinare:
x LYS + y ARG + altri amminoacidi → Proteina + acqua
Secondo la teoria atomica, per ogni y mole di ARG sono necessarie x mol di LYS per produrre proteine utili. Se la dieta è ottimale quando si consumano 7,0 g di LYS per ogni 6,0 g di ARG (questo rapporto potrebbe essere fornito dalle uova, per esempio), possiamo calcolare il rapporto stechiometrico ottimale:

Questo rapporto esatto di aminoacidi potrebbe non essere presente in una particolare proteina del ratto, ma è il rapporto medio per tutte le proteine del ratto. L’equazione chimica (parziale) è
Cioè, il rapporto stechiometrico S(LYS/ARG) = 7 mol LYS / 5 mol ARG.
b. Vediamo qual è il rapporto molare nella dieta a base di mais.
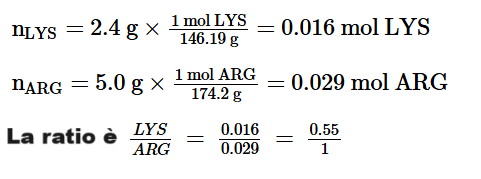
Chiaramente, la LYS è l’amminoacido limitante perché il rapporto iniziale tra LYS e ARG (0,55:1) è molto inferiore al rapporto stechiometrico richiesto (1,4:1).
Dall’esempio della dieta a base di mais si può iniziare a capire cosa bisogna fare per determinare quale dei due reagenti, X o Y, è limitante. Dobbiamo confrontare il rapporto stechiometrico S(X/Y) con il rapporto effettivo delle quantità di X e Y inizialmente mescolate.
La regola generale corrispondente, per qualsiasi reagente X e Y, è

Naturalmente, quando le quantità di X e Y sono esattamente nel rapporto stechiometrico, entrambi i reagenti vengono consumati completamente nello stesso momento e nessuno dei due è in eccesso.
Possiamo verificare che LYS è limitante calcolando la quantità di LYS che sarebbe necessaria se tutta la ARG reagisse, utilizzando un rapporto stechiometrico:
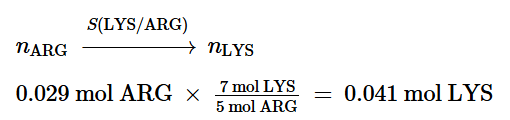
Allo stesso modo, se tutta la LYS reagisce, la quantità di ARG richiesta è
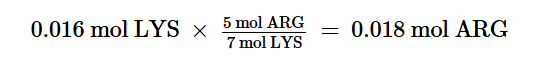
Questa quantità è molto inferiore a quella presente, quindi ARG è il reagente in eccesso.
c. Possiamo facilmente utilizzare le masse molari per convertire le quantità di ciascun amminoacido in masse.
Prepariamo una tabella:
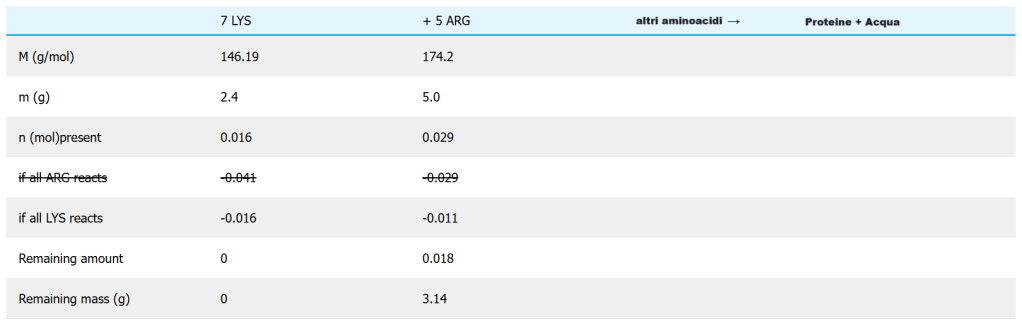
Al termine della reazione, rimangono 3,14 g dei 5,0 g originali (63%), che saranno metabolizzati in urea ed escreti. Dell’intera dieta di 2,4 g di LYS + 5,0 g di ARG, vediamo che 3,14 g o il 42% viene sprecato. Che spreco di cibo e di risorse per produrlo! Si noti che anche la porzione di mais dovrà essere maggiore rispetto alla porzione di dieta ottimale per ottenere la stessa quantità di proteine, perché il mais ha solo 5 g/kg di ARG, mentre la dieta ottimale ha 6,0 g/kg. La dieta ottimale potrebbe essere fornita dalla carne o dalle uova, ma sono impegnative per l’ambiente e presentano problemi di salute.
Una dieta di sussistenza a base di fagioli può anche portare a una malnutrizione proteica, come mostra la tabella II. Sebbene il contenuto di lisina sia molto superiore a quello dei fagioli, i livelli di metionina (MET) e cistina (CYS) sono bassi, così come quelli di fenilalanina (PHE) e tirosina (TYR).
Ma supponiamo che fagioli e mais vengano consumati nello stesso giorno, in una dieta che mescola in egual misura mais e lenticchie. Ricalcolate ora l’amminoacido limitante in una dieta con 2,4 + 6,3 = 8,7 g di LYS e 5,0 + 6,97 = 11,97 g di ARG.
b. In questo caso, quanta parte dell’amminoacido in eccesso viene sprecata?
Soluzione

Ora vediamo che il rapporto tra le quantità presenti è
0,060 mol LYS / 0,069 mol ARG = 0,869,
che è ancora inferiore al rapporto stechiometrico,
7 mol LYS / 5 mol ARG = 1,4
Quindi LYS è ancora una volta l’amminoacido limitante. Ricalcolando i valori in una tabella come sopra, otteniamo
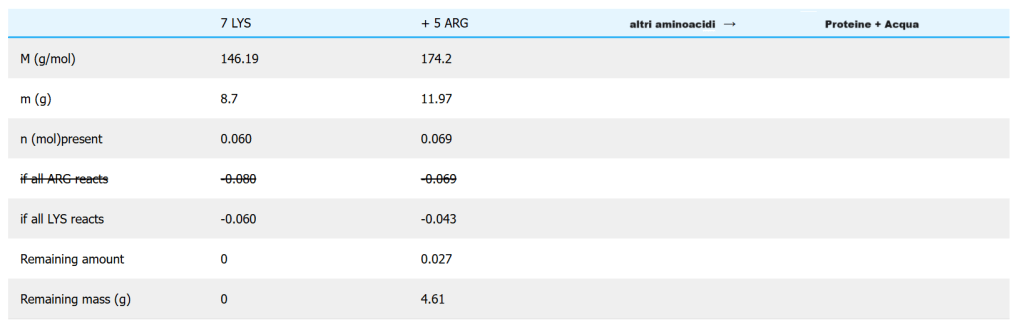
In questo caso, da una porzione di 11,97 g rimangono 4,61 g di ARG in eccesso, ovvero il 38% dell’ARG. La dieta totale è di 8,7 g di LYS + 11,97 g di ARG = 20,7 g, di cui solo il 22% viene sprecato, un grande miglioramento rispetto al caso del solo mais di cui sopra.
Per progettare una dieta adeguata, gli alimenti proteici (o singoli AA) complementari dovrebbero essere scelti dalle tabelle dei contenuti di aminoacidi degli alimenti.
Il processo di Nixtamalizzazione converte parte del già limitante triptofano in 2-amminoacetofenone, aggravando lo scarso valore nutrizionale e di sopravvivenza del mais. Ma la Nixtamalizzazione rende anche più biodisponibile la Niacina contenuta nei chicchi, riducendo l’incidenza della Pellagra e più che compensando la perdita di aminoacidi se nella dieta sono inclusi anche molti fagioli. La dieta a base di fagioli e mais, anche con la Nixtamalizzazione, ha un valore di sopravvivenza.
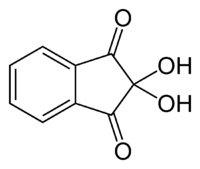
Per rilevare un amminoacido (anche in un’impronta digitale nella chimica forense), si utilizza spesso il test della ninidrina.
Nel test della ninidrina, due molecole di ninidrina (C9H6O4, mostrato a sinistra) vengono legate dalla N attaccata al primo carbonio della catena aminoacidica, producendo lo ione blu/viola mostrato di seguito.
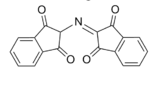
L’equazione chimica bilanciata è:
2 C9H6O4 + C11H12N2O2 → (C9H5O2)-N=(C9H4O2) + C10H9NO + CO2 + 3 H2O
Se si utilizzano 2,00 mg di ninidrina (Nin) per rilevare 2 mg di TRP, è stata aggiunta abbastanza ninidrina da reagire con tutta il TRP? Qual è il reagente limitante e quale massa di H2O si formerà?
La soluzione
Il rapporto stechiometrico che collega Nin e TRP è

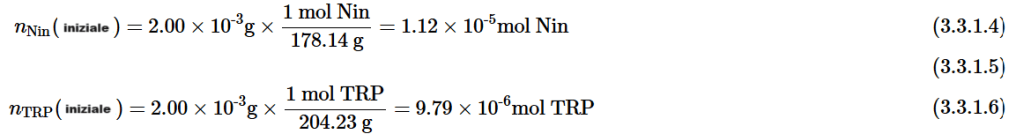

b) La quantità di prodotto acquoso che si forma in una reazione può essere calcolata attraverso un appropriato rapporto stechiometrico dalla quantità di un reagente consumato. Rimarrà una parte del reagente in eccesso TRP, ma tutta la quantità iniziale di Nin sarà consumata. Pertanto, utilizziamo nNin (iniziale) per calcolare la quantità di H2O ottenuta.
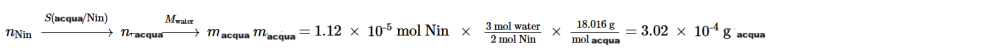
Si tratta di 0,302mg di acqua.
Questi calcoli possono essere organizzati come una tabella, con le voci sotto i rispettivi reagenti e prodotti dell’equazione chimica. I calcoli sono mostrati per ogni possibile caso, ipotizzando che un reagente sia completamente consumato e determinando se è presente una quantità sufficiente di altri reagenti per consumarlo. In caso contrario, lo scenario viene scartato.
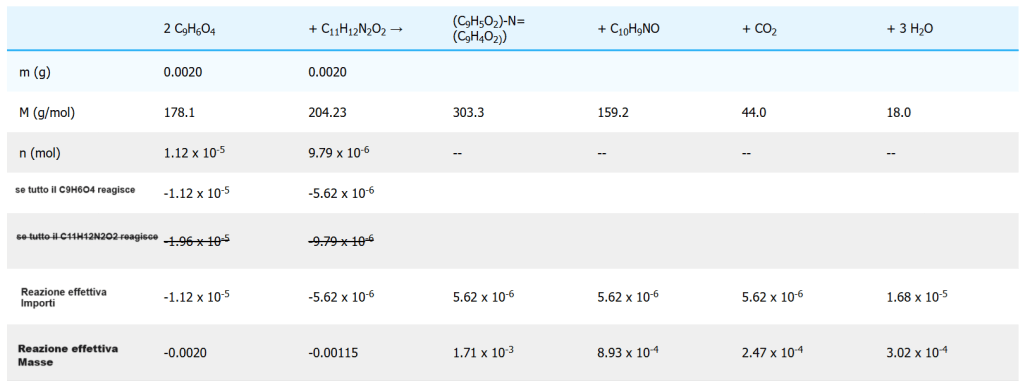
Come si può notare dall’esempio, nel caso in cui vi sia un reagente limitante, per calcolare la quantità di prodotto formato si deve utilizzare la quantità iniziale del reagente limitante. Utilizzare la quantità iniziale di un reagente presente in eccesso non sarebbe corretto, perché tale reagente non viene consumato interamente.
Sulla traccia della “complementarietà AA” potremmo prendere come esempio i piselli che sono poveri di Metionina ma ricchi di Lisina e, al contrario, il riso integrale che è ricco di Metionina ma povero di Lisina.
Se dovessimo prendere come esempio principale al quale applicare una stechiometria con l’aggiunta del reagente limitante da AA integrativi.
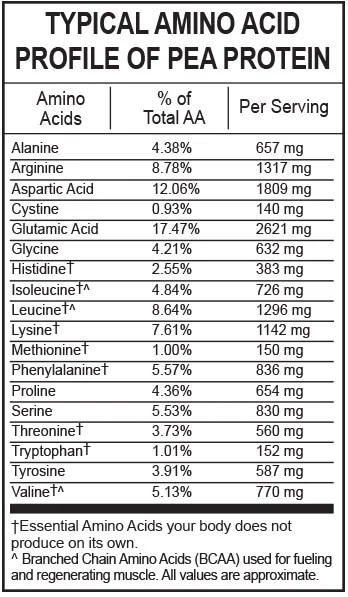
Vediamo dalla tabella sopra esposta che il reagente limitante nelle proteine del pisello è la Metionina mentre il reagente in eccesso è la Lisina.
In base ai dati precedentemente riportati, calcolare il rapporto molare ottimale tra Metionina (MHT, C5H11NO2S, massa molare 149,21 g/mol) e Lisina (LYS, C6H14N2O2, massa molare 146,19 g/mol) nella dieta.
Quindi, procedendo rapidamente…
x MHT + y LYS + altri amminoacidi → Proteina + acqua
Secondo la teoria atomica, per ogni y mole di LYS sono necessarie x mol di MHT per produrre proteine utili. Se la dieta è ottimale quando si consumano 7,0 g di LYS per ogni 2,1 g di MHT (questo rapporto potrebbe essere fornito dalle uova, per esempio), possiamo calcolare il rapporto stechiometrico ottimale:
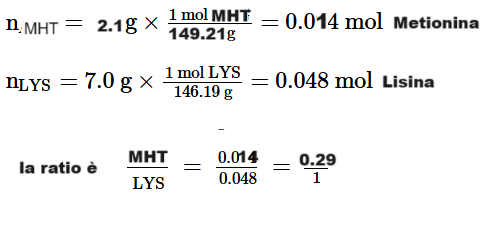
E poichè 0.29 è circa 1/3
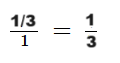
L’equazione chimica (parziale) è
Cioè, il rapporto stechiometrico S(MHT/LYS) = 1 mol MHT/ 3 mol LYS.
Accelerando la procedura di calcolo, sempre sulla linea prima esposta, abbiamo 1.5g di MHT e 11.42g di LYS con mole rispettivamente di 149.21 e 146.19 = 0.010 MHT e 0.078 LYS = 0.13/1
Anche qui, la MHT è l’amminoacido limitante perché il rapporto iniziale tra MHT e LYS (0,13:1) è inferiore al rapporto stechiometrico richiesto (0.29:1).
Di conseguenza, per ogni 100g di proteine del pisello andrebbero addizionati 140mg di MHT al fine di migliorare la ratio stechiometrica.
Nel riso “bianco”, comunemente consumato dai Bodybuilder, abbiamo la presenza dello stesso reagente limitante del pisello; ossia la MHT con il reagente in eccesso LYS.
- Punto della situazione
Dovremmo aver compreso, ora, che un prodotto contenete EAA andrebbe valutato in base alla sua formulazione stechiometrica la quale, per essere considerata ottimale, non deve presentare ne carenze ne eccessi per uno o più dei 9 EAA.

Sul mercato attuale sono presenti poche formulazioni stechiometriche di EEA valide. Tra queste vi è certamente la MAP® . Il MAP [Master Amino Acid Pattern®], è una combinazione stechiometrica di EAA usata anche in campo clinico. MAP fornisce, con il minor peso e volume, il maggior valore
nutritivo proteico/AA in assoluto.
Clinicamente, il MAP è particolarmente consigliabile per coloro che soffrono di nausea o di inappetenza sia per ragioni fisio-patologiche (AIDS, cancro, anemia, denutrizione, ecc.) sia per ragioni psicologiche (anoressia, bulimia, ecc.)
Il MAP fornisce, in soli 10g, un valore nutritivo proteico/AA pari a circa 350g di
carne rossa, pesce o pollame, con un valore energetico di sole 50Kcal.
Per via della sua stechiometria, 10g di MAP, a differenza dei 350g di carne, pesce o pollame a cui equivale, rilascia una quantità minima (meno dell’1%) di cataboliti azotati. Quindi, il MAP, o altra formulazione stechiometricamente corretta, è particolarmente consigliabile per l’alimentazione di coloro che hanno deficit di funzionalità epatica o renale o per coloro i quali desiderano gravarne il meno possibile per via del già presente impatto stressorio d’organo dato da terapia iatrogena.
Il MAP viene completamente assorbito in meno di 23 minuti dalla sua ingestione, poiché è assimilabile ad una proteina alimentare digerita (ossia scomposta nelle sue singole unità AA). Il MAP non necessita quindi dell’azione dell’ enzima peptidasi, ed il suo assorbimento, stimola la secrezione biliare, pancreatica ed intestinale in misura minima. Quindi, il MAP viene particolarmente consigliato per tutti coloro che soffrono di disturbi gastrointestinali anche per bisogno di consumare grosse quantità di cibo [vedi bodybuilder].
Punti chiave del MAP:
- Il MAP fornisce un 99% di Net Nitrogen Utilization (NNU): vale a dire che il 99% dei suoi aminoacidi costitutivi agiscono come precursori della sintesi proteica corporea.
- Il MAP fornisce una quantità minima (meno dell’ 1%) di cataboliti azotati.
- Il MAP é digerito e assorbito in meno di 23 minuti.
Sintesi e conclusioni finali:
I 15 punti seguenti costituiscono al momento “le linee guida” sugli EEA avallati dalla ISSN:
- L’integrazione di EAA in forma libera (non derivati da proteine esogene intatte) è un robusto stimolatore della sintesi e del turnover delle proteine muscolari.
- Gli EAA stimolano la sintesi proteica muscolare più di un isolato proteico isonitrogeno.
- L’ingestione di EAA produce un rapido aumento delle concentrazioni periferiche e il trasporto degli aminoacidi nel muscolo scheletrico.
- La stimolazione degli EAA della sintesi proteica muscolare può avvenire con dosaggi multipli e non interferisce con gli effetti dei pasti.
- Singoli o gruppi di EAA possono avviare il processo di stimolazione; tuttavia, una stimolazione significativa e prolungata si verifica quando vengono consumati tutti gli EAA.
- La stimolazione della sintesi proteica a riposo da parte degli EAA avviene con dosaggi che vanno da 1,5 g a 18 g.
- Una percentuale maggiore di leucina (%/g) contenuta nelle composizioni di EAA ingerite è necessaria per stimolare al massimo la sintesi proteica muscolare nelle popolazioni (invecchiamento, patologie cliniche) che dimostrano resistenza anabolica.
- Nelle popolazioni anabolicamente resistenti, l’integrazione longitudinale di EAA migliora i risultati funzionali.
- Gli effetti degli EAA e dell’esercizio fisico sono interattivi, tanto da amplificare gli effetti combinati. Questa interazione è dovuta a un maggiore apporto di EAA al muscolo in esercizio, grazie all’aumento del flusso sanguigno e alle più alte concentrazioni di EAA nel sangue.
- Le risposte anaboliche sono costantemente riportate con la combinazione dell’ingestione di EAA con l’esercizio di resistenza o aerobico. Questo effetto si mantiene con l’invecchiamento.
- L’integrazione di EAA in forma libera rientra nel limite massimo di sicurezza del consumo giornaliero abituale.
- L’integrazione di EAA è efficace nella maggior parte degli studi clinici e delle condizioni.
- Numerosi studi longitudinali che prevedono l’integrazione di EAA in popolazioni anziane riportano costantemente miglioramenti favorevoli sia a livello metabolico che funzionale.
- Sono necessarie ulteriori ricerche per esaminare il potenziale impatto della somministrazione di EAA in popolazioni atletiche sottoposte intenzionalmente o meno a privazione energetica sui cambiamenti del metabolismo proteico muscolare e sui cambiamenti associati in termini di prestazioni e composizione corporea.
- Sono necessarie ulteriori ricerche per esaminare il ruolo della somministrazione di EAA a popolazioni di atleti che attraversano periodi inaspettati e improvvisi di inattività, probabilmente secondari a lesioni acute e a periodi di riabilitazione che seguono abitualmente interventi chirurgici.
L’integrazione con EAA vede le sue migliori applicazioni in:
- Presenza di una carenza proteica, o comunque una condizione alimentare che non da modo di apportare la giusta quantità di EAA con gli alimenti;
- Bodybuilder in ipercalorica che vogliono ridurre il carico di cibo e massimizzare al meglio digestione e assorbimento AA.
- Soggetto che non tollera le proteine in polvere;
- Inserimento “compensativo” per ridurre il consumo di fonti proteiche intere.
- Soggetto con problematiche digestive di base.
Assicuratevi di acquistare prodotti di alta qualità altrimenti i vantaggi ottenibili e sopra esposti non si verificheranno.
Parliamo comunque di un integratore “compensativo” e “migliorativo” dello stato e compliance alimentare del utilizzatore.
Gli EEA non sostituiscono tutti i 21 AA; utilizzarli come substrato di sintesi per la matrice mancante è uno spreco di risorse e di soldi. Dovreste aver capito che è tutta una questione di equilibrio funzionale.
Gabriel Bellizzi [CEO BioGenTech]
Riferimenti:
1. Bradford, H, Schmidt, V.. The history of the discovery of the amino acids. Chem Rev. 1931;9:169–864. doi: 10.1021/cr60033a001 [CrossRef] [Google Scholar]
2. Dietary reference intakes for energy, carbohydrates, fiber, fat, protein and amino acids (macronutrients). Washington, DC: Institute of Medicine of the National Academies, 2005. 2002/2005. Report No. [Google Scholar]
3. Elango, R, Ball, RO, Pencharz, PB. Recent advances in determining protein and amino acid requirements in humans. British Journal Of Nutrition. 2012;108(2):S22–30. Epub 2012/10/31. PubMed PMID: 23107531. doi: 10.1017/S0007114512002504 [PubMed] [CrossRef] [Google Scholar]
4. Food and Agriculture Organization of the United Nations Dietary protein quality evaluation in human nutrition. Rome: FAO Food and Nutrition. 2013. 31 March – 2 April 2011. Report No. [Google Scholar]
5. CE, B, JS, A, DT, H. Protein quality in humans: assessment and in vitro estimation. Westport Connecticut: AVI Publishing, Inc; 1981. [Google Scholar]
6. Bifari, F, Ruocco, C, Decimo, I, et al. Amino acid supplements and metabolic health: a potential interplay between intestinal microbiota and systems control. Genes Nutr. 2017;12:27. Epub 2017/10/19. PubMed PMID: 29043007; PMCID: PMC5628494. doi: 10.1186/s12263-017-0582-2 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
7. Paddon-Jones, D, Sheffield-Moore, M, Urban, RJ, et al. Essential amino acid and carbohydrate supplementation ameliorates muscle protein loss in humans during 28 days bedrest. J Clin Endocrinol Metab. 2004;89(9):4351–4358. PubMed PMID: 15356032. doi: 10.1210/jc.2003-032159 [PubMed] [CrossRef] [Google Scholar]
8. Fitts, RH, Romatowski, JG, Peters, JR, et al. The deleterious effects of bed rest on human skeletal muscle fibers are exacerbated by hypercortisolemia and ameliorated by dietary supplementation. Am J Physiol Cell Physiol. 2007;293(1):C313–20. PubMed PMID: 17409123. doi: 10.1152/ajpcell.00573.2006 [PubMed] [CrossRef] [Google Scholar]
9. Biolo, G, Tipton, KD, Klein, S, et al. An abundant supply of amino acids enhances the metabolic effect of exercise on muscle protein. Am J Physiol. 1997;273(1 Pt 1):E122–9. PubMed PMID: 9252488. doi: 10.1152/ajpendo.1997.273.1.E122. [PubMed] [CrossRef] [Google Scholar]
10. Magaway, C, Kim, E, Jacinto, E. Targeting mTOR and metabolism in cancer: lessons and innovations. Cells. 2019;8(12). Epub 2019/12/11. PubMed PMID: 31817676; PMCID: PMC6952948. doi: 10.3390/cells8121584 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
11. Melick, CH, Jewell, JL. Regulation of mTORC1 by upstream stimuli. Genes (Basel). 2020;11(9). Epub 2020/08/29. PubMed PMID: 32854217; PMCID: PMC7565831. doi: 10.3390/genes11090989 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
12. Saxton, RA, Sabatini, DM. mTOR signaling in growth, metabolism, and disease. Cell. 2017;168(6):960–976. Epub 2017/03/12. PubMed PMID: 28283069; PMCID: PMC5394987. doi: 10.1016/j.cell.2017.02.004. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
13. Bruhat, A, Jousse, C, Carraro, V, et al. Amino acids control mammalian gene transcription: activating transcription factor 2 is essential for the amino acid responsiveness of the CHOP promoter. Mol Cell Biol. 2000;20(19):7192–7204. Epub 2000/09/13. PubMed PMID: 10982836; PMCID: PMC86273. doi: 10.1128/MCB.20.19.7192-7204.2000 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
14. Hargreaves, M. Exercise and gene expression. Prog Mol Biol Transl Sci. 2015;135:457–469. Epub 2000/09/13. PubMed PMID: 26477926. doi: 10.1016/bs.pmbts.2015.07.006 [PubMed] [CrossRef] [Google Scholar]
15. Drummond, MJ, Rasmussen, BB. Leucine-enriched nutrients and the regulation of mammalian target of rapamycin signalling and human skeletal muscle protein synthesis. Current opinion in clinical nutrition and metabolic care. 2008;11(3):222–226. Epub 2008/04/12. PubMed PMID: 18403916; PMCID: PMC5096790. doi: 10.1097/MCO.0b013e3282fa17fb [PMC free article] [PubMed] [CrossRef] [Google Scholar]
16. Dreyer, HC, Fujita, S, Glynn, EL, et al. Resistance exercise increases leg muscle protein synthesis and mTOR signalling independent of sex. Acta Physiol (Oxf). 2010;199(1):71–81. Epub 2010/01/15. PubMed PMID: 20070283; PMCID: PMC2881180. doi: 10.1111/j.1748-1716.2010.02074.x [PMC free article] [PubMed] [CrossRef] [Google Scholar]
17. Maier, T, Guell, M, Serrano, L. Correlation of mRNA and protein in complex biological samples. FEBS Lett. 2009;583(24):3966–3973. Epub 2009/10/24. PubMed PMID: 19850042. doi: 10.1016/j.febslet.2009.10.036. [PubMed] [CrossRef] [Google Scholar]
18. Greenhaff, PL, Karagounis, LG, Peirce, N, et al. Disassociation between the effects of amino acids and insulin on signaling, ubiquitin ligases, and protein turnover in human muscle. Am J Physiol. 2008;295(3):E595–604. PubMed PMID: 18577697. doi: 10.1152/ajpendo.90411.2008 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
19. Crick, FH. On protein synthesis. Symp Soc Exp Biol. 1958;12:138–163. Epub 1958/01/01. PubMed PMID: 13580867. [PubMed] [Google Scholar]
20. Graber, TG, Borack, MS, Reidy, PT, et al. Essential amino acid ingestion alters expression of genes associated with amino acid sensing, transport, and mTORC1 regulation in human skeletal muscle. Nutri Metabol. 2017;14:35. Epub 2017/05/16. PubMed PMID: 28503190; PMCID: PMC5426042. doi: 10.1186/s12986-017-0187-1 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
21. Wolfe, RR, Chinkes, D. Isotope tracers in metabolic research: principles and practice of kinetic analysis. New York, New Yor: Wiley-Liss; 2004. p. 274. [Google Scholar]
22. Biolo, G, Chinkes, D, Zhang, X, et al. Harry M. Vars research award: a new model to determine in vivo the relationship between amino acid transmembrane transport and protein kinetics in muscle. JPEN J Parenter Enteral Nutr. 1992;16(4):305–315. doi: 10.1177/0148607192016004305 [PubMed] [CrossRef] [Google Scholar]
23. Biolo, G, Fleming, RY, Maggi, SP, et al. Transmembrane transport and intracellular kinetics of amino acids in human skeletal muscle. Am J Physiol. 1995;268(1 Pt 1):E75–84. PubMed PMID: 7840186. doi: 10.1152/ajpendo.1995.268.1.E75. [PubMed] [CrossRef] [Google Scholar]
24. Tipton, KD, Borsheim, E, Wolf, SE, et al. Acute response of net muscle protein balance reflects 24-h balance after exercise and amino acid ingestion. Am J Physiol (Endocrinol Metab). 2003;284(1):E76–89. PubMed PMID: 12388164. doi: 10.1152/ajpendo.00234.2002. [PubMed] [CrossRef] [Google Scholar]
25. Plotkin, DL, Delcastillo, K, Van Every, DW, et al. Isolated leucine and branched-chain amino acid supplementation for enhancing muscular strength and hypertrophy: a narrative review. Int J Sport Nutr Exercise Metab. 2021;31(3):292–301. Epub 2021/03/21. PubMed PMID: 33741748. doi: 10.1123/ijsnem.2020-0356 [PubMed] [CrossRef] [Google Scholar]
26. Fuchs, CJ, Hermans, WJH, Holwerda, AM, et al. Branched-chain amino acid and branched-chain ketoacid ingestion increases muscle protein synthesis rates in vivo in older adults: a double-blind, randomized trial. Am J Clin Nutr. 2019;110(4):862–872. Epub 2019/06/30. PubMed PMID: 31250889; PMCID: PMC6766442. doi: 10.1093/ajcn/nqz120. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
27. Pinals, RS, Harris, ED, Burnett, JB, et al. Treatment of rheumatoid arthritis with L-histidine: a randomized, placebo-controlled, double-blind trial. J Rheumatol. 1977;4(4):414–419. Epub 1977/01/01. PubMed PMID: 342692. [PubMed] [Google Scholar]
28. Jackman, SR, Witard, OC, Jeukendrup, AE, et al. Branched-chain amino acid ingestion can ameliorate soreness from eccentric exercise. Med & Sci In Sports & Ex. 2010;42(5):962–970. PubMed PMID: 19997002. doi: 10.1249/MSS.0b013e3181c1b798 [PubMed] [CrossRef] [Google Scholar]
29. Cynober, L, Bier, DM, Kadowaki, M, et al. A proposal for an upper limit of leucine safe intake in healthy adults. J Nutr. 2012;142(12):2249S–2250S. Epub 2012/10/26. PubMed PMID: 23096009. doi: 10.3945/jn.112.160853 [PubMed] [CrossRef] [Google Scholar]
30. Kim, IY, Williams, RH, Schutzler, SE, et al. Acute lysine supplementation does not improve hepatic or peripheral insulin sensitivity in older, overweight individuals. Nutri Metabol. 2014;11(1):49. Epub 2014/10/18. PubMed PMID: 25324894; PMCID: PMC4198625. doi: 10.1186/1743-7075-11-49 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
31. Report of the expert advisory committee on amino acids. Ottawa, Canada: Minister of Supply and Services Canada, 1990. [Google Scholar]
32. Ryan-Harshman, M, Leiter, LA, Anderson, GH. Phenylalanine and aspartame fail to alter feeding behavior, mood and arousal in men. Physiol Behav. 1987;39(2):247–253. Epub 1987/01/01. PubMed PMID: 3575461. doi: 10.1016/0031-9384(87)90017-5. [PubMed] [CrossRef] [Google Scholar]
33. Growdon, JH, Nader, TM, Schoenfeld, J, et al. L-threonine in the treatment of spasticity. Clin Neuropharmacol. 1991;14(5):403–412. Epub 1991/10/01. PubMed PMID: 1742749. doi: 10.1097/00002826-199110000-00003 [PubMed] [CrossRef] [Google Scholar]
34. Cynober, L, Bier, DM, Kadowaki, M, et al. Proposals for upper limits of safe intake for arginine and tryptophan in young adults and an upper limit of safe intake for leucine in the elderly. J Nutr. 2016;146(12):2652S–2654S. Epub 2016/12/10. PubMed PMID: 27934658. doi: 10.3945/jn.115.228478 [PubMed] [CrossRef] [Google Scholar]
35. Volpi, E, Kobayashi, H, Sheffield-Moore, M, et al. Essential amino acids are primarily responsible for the amino acid stimulation of muscle protein anabolism in healthy elderly adults. Am J Clin Nutr. 2003;78(2):250–258. PubMed PMID: 12885705. doi: 10.1093/ajcn/78.2.250 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
36. Kobayashi, H, Borsheim, E, Anthony, TG, et al. Reduced amino acid availability inhibits muscle protein synthesis and decreases activity of initiation factor eIF2B. Am J Physiol. 2003;284(3):E488–98. PubMed PMID: 12556349. doi: 10.1152/ajpendo.00094.2002 [PubMed] [CrossRef] [Google Scholar]
37. Wilkinson, DJ, Bukhari, SSI, Phillips, BE, et al. Effects of leucine-enriched essential amino acid and whey protein bolus dosing upon skeletal muscle protein synthesis at rest and after exercise in older women. Clin Nutr. 2018;37(6 Pt A):2011–2021. Epub 2017/10/17. PubMed PMID: 29031484; PMCID: PMC6295981. doi: 10.1016/j.clnu.2017.09.008 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
38. Tipton, KD, Gurkin, BE, Matin, S, et al. Nonessential amino acids are not necessary to stimulate net muscle protein synthesis in healthy volunteers. J Nutr Biochem. 1999;10(2):89–95. PubMed PMID: 15539275. doi: 10.1016/S0955-2863(98)00087-4. [PubMed] [CrossRef] [Google Scholar]
39. Paddon-Jones, D, Sheffield-Moore, M, Katsanos, CS, et al. Differential stimulation of muscle protein synthesis in elderly humans following isocaloric ingestion of amino acids or whey protein. Exp Gerontol. 2006;41(2):215–219. PubMed PMID: 16310330. doi: 10.1016/j.exger.2005.10.006 [PubMed] [CrossRef] [Google Scholar]
40. Kim, IY, Park, S, Smeets, E, et al. Consumption of a specially-formulated mixture of essential amino acids promotes gain in whole-body protein to a greater extent than a complete meal replacement in older women with heart failure. Nutrients. 2019;11(6). Epub 2019/06/20. PubMed PMID: 31212940; PMCID: PMC6627910. doi: 10.3390/nu11061360 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
41. Bukhari, SS, Phillips, BE, Wilkinson, DJ, et al. Intake of low-dose leucine-rich essential amino acids stimulates muscle anabolism equivalently to bolus whey protein in older women at rest and after exercise. Am J Physiol. 2015;308(12):E1056–65. Epub 2015/04/02. PubMed PMID: 25827594. doi: 10.1152/ajpendo.00481.2014 [PubMed] [CrossRef] [Google Scholar]
42. Park, S, Church, DD, Azhar, G, et al. Anabolic response to essential amino acid plus whey protein composition is greater than whey protein alone in young healthy adults. J Int Soc Sports Nutr. 2020;17(1):9. Epub 2020/02/12. PubMed PMID: 32041644; PMCID: PMC7011510. doi: 10.1186/s12970-020-0340-5 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
43. Church, DD, Hirsch, KR, Park, S, et al. Essential amino acids and protein synthesis: insights into maximizing the muscle and whole-body response to feeding. Nutrients. 2020;12(12). Epub 2020/12/06. PubMed PMID: 33276485; PMCID: PMC7760188. doi: 10.3390/nu12123717 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
44. Adibi, SA, Fogel, MR, Agrawal, RM. Comparison of free amino acid and dipeptide absorption in the jejunum of sprue patients. Gastroenterology. 1974;67(4):586–591. Epub 1974/10/01. PubMed PMID: 4412534. doi: 10.1016/S0016-5085(19)32783-0. [PubMed] [CrossRef] [Google Scholar]
45. Drummond, MJ, Glynn, EL, Fry, CS, et al. An increase in essential amino acid availability upregulates amino acid transporter expression in human skeletal muscle. Am J Physiol. 2010;298(5):E1011–8. Epub 2010/03/23. PubMed PMID: 20304764; PMCID: PMC2867366. doi: 10.1152/ajpendo.00690.2009 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
46. Bohe, J, Low, A, Wolfe, RR, et al. Human muscle protein synthesis is modulated by extracellular, not intramuscular amino acid availability: a dose-response study. Journal Of Physiology. 2003;552(Pt 1):315–324. PubMed PMID: 12909668. doi: 10.1113/jphysiol.2003.050674. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
47. Mitchell, WK, Phillips, BE, Williams, JP, et al. A dose- rather than delivery profile-dependent mechanism regulates the “muscle-full” effect in response to oral essential amino acid intake in young men. J Nutr. 2015;145(2):207–214. Epub 2015/02/04. PubMed PMID: 25644339; PMCID: PMC4304023. doi: 10.3945/jn.114.199604 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
48. Anderson, GH, Moore, SE. Dietary proteins in the regulation of food intake and body weight in humans. J Nutr. 2004;134(4):974S–979S. PubMed PMID: 15051857. doi: 10.1093/jn/134.4.974S. [PubMed] [CrossRef] [Google Scholar]
49. Paddon-Jones, D, Sheffield-Moore, M, Aarsland, A, et al. Exogenous amino acids stimulate human muscle anabolism without interfering with the response to mixed meal ingestion. Am J Physiol. 2005;288(4):E761–7. PubMed PMID: 15572657. doi: 10.1152/ajpendo.00291.2004 [PubMed] [CrossRef] [Google Scholar]
50. Abdulla, H, Bass, JJ, Stokes, T, et al. The effect of oral essential amino acids on incretin hormone production in youth and ageing. Endocrinol Diabetes Metab. 2019;2(4):e00085. Epub 2019/10/09. PubMed PMID: 31592446; PMCID: PMC6775449. doi: 10.1002/edm2.85 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
51. Park, S, Jang, J, Choi, MD, et al. The anabolic response to dietary protein is not limited by the maximal stimulation of protein synthesis in healthy older adults: a randomized crossover trial. Nutrients. 2020;12(11). Epub 2020/10/30. PubMed PMID: 33114585; PMCID: PMC7693481. doi: 10.3390/nu12113276 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
52. Fry, CS, Drummond, MJ, Glynn, EL, et al. Aging impairs contraction-induced human skeletal muscle mTORC1 signaling and protein synthesis. Skelet Muscle. 2011;1(1):11. Epub 2011/07/30. PubMed PMID: 21798089; PMCID: PMC3156634. doi: 10.1186/2044-5040-1-11 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
53. Katsanos, CS, Kobayashi, H, Sheffield-Moore, M, et al. Aging is associated with diminished accretion of muscle proteins after the ingestion of a small bolus of essential amino acids. Am J Clin Nutr. 2005;82(5):1065–1073. PubMed PMID: 16280440. doi: 10.1093/ajcn/82.5.1065 [PubMed] [CrossRef] [Google Scholar]
54. Paddon-Jones, D, Sheffield-Moore, M, Zhang, XJ, et al. Amino acid ingestion improves muscle protein synthesis in the young and elderly. Am J Physiol. 2004;286(3):E321–8. PubMed PMID: 14583440. doi: 10.1152/ajpendo.00368.2003 [PubMed] [CrossRef] [Google Scholar]
55. Katsanos, CS, Kobayashi, H, Sheffield-Moore, M, et al. A high proportion of leucine is required for optimal stimulation of the rate of muscle protein synthesis by essential amino acids in the elderly. Am J Physiol. 2006;291(2):E381–7. PubMed PMID: 16507602. doi: 10.1152/ajpendo.00488.2005 [PubMed] [CrossRef] [Google Scholar]
56. Carbone, JW, McClung, JP, Pasiakos, SM. Skeletal muscle responses to negative energy balance: effects of dietary protein. Adv nutri (Bethesda, Md). 2012;3(2):119–126. Epub 2012/04/21. PubMed PMID: 22516719; PMCID: PMC3648712 conflicts of interest. doi: 10.3945/an.111.001792 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
57. Trappe, TA, Gastaldelli, A, Jozsi, AC, et al. Energy expenditure of swimmers during high volume training. Medi and sci sports and exerci. 1997;29(7):950–954. Epub 1997/07/01. PubMed PMID: 9243495. doi: 10.1097/00005768-199707000-00015 [PubMed] [CrossRef] [Google Scholar]
58. Gwin, JA, Church, DD, Hatch-McChesney, A, et al. Effects of high versus standard essential amino acid intakes on whole-body protein turnover and mixed muscle protein synthesis during energy deficit: a randomized, crossover study. Clin Nutr. 2021;40(3):767–777. Epub 2020/08/10. PubMed PMID: 32768315. doi: 10.1016/j.clnu.2020.07.019 [PubMed] [CrossRef] [Google Scholar]
59. Biolo, G, Fleming, RY, Maggi, SP, et al. Inverse regulation of protein turnover and amino acid transport in skeletal muscle of hypercatabolic patients. J Clin Endocrinol Metab. 2002;87(7):3378–3384. PubMed PMID: 12107253. doi: 10.1210/jcem.87.7.8699 [PubMed] [CrossRef] [Google Scholar]
60. Dillon, EL, Sheffield-Moore, M, Paddon-Jones, D, et al. Amino acid supplementation increases lean body mass, basal muscle protein synthesis, and insulin-like growth factor-I expression in older women. J Clin Endocrinol Metab. 2009;94(5):1630–1637. PubMed PMID: 19208731. doi: 10.1210/jc.2008-1564 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
61. Borsheim, E, Bui, QU, Tissier, S, et al. Effect of amino acid supplementation on muscle mass, strength and physical function in elderly. Clin Nutr. 2008;27(2):189–195. PubMed PMID: 18294740. doi: 10.1016/j.clnu.2008.01.001. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
62. Kim, HK, Suzuki, T, Saito, K, et al. Effects of exercise and amino acid supplementation on body composition and physical function in community-dwelling elderly Japanese sarcopenic women: a randomized controlled trial. J Am Geriatr Soc. 2012;60(1):16–23. PubMed PMID: 22142410. doi: 10.1111/j.1532-5415.2011.03776.x [PubMed] [CrossRef] [Google Scholar]
63. Azhar, G, Wei, JY, Schutzler, SE, et al. Daily consumption of a specially formulated essential amino acid-based dietary supplement improves physical performance in older adults with low physical functioning. J Gerontol A Biol Sci Med Sci. 2021;76(7):1184–1191. Epub 2021/01/22. PubMed PMID: 33475727; PMCID: PMC8202157. doi: 10.1093/gerona/glab019 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
64. Hwang, CL, Chien, CL, Wu, YT. Resistance training increases 6-minute walk distance in people with chronic heart failure: a systematic review. J Physiother. 2010;56(2):87–96. Epub 2010/05/21. PubMed PMID: 20482475. doi: 10.1016/s1836-9553(10)70038-2. [PubMed] [CrossRef] [Google Scholar]
65. Ferrando, AA, Paddon-Jones, D, Hays, NP, et al. EAA supplementation to increase nitrogen intake improves muscle function during bed rest in the elderly. Clin Nutr. 2010;29:18–23. PubMed PMID: 19419806. doi: 10.1016/j.clnu.2009.03.009. [PubMed] [CrossRef] [Google Scholar]
66. Biolo, G, Maggi, SP, Williams, BD, et al. Increased rates of muscle protein turnover and amino acid transport after resistance exercise in humans. Am J Physiol. 1995;268(3 Pt 1):E514–20. PubMed PMID: 7900797. doi: 10.1152/ajpendo.1995.268.3.E514. [PubMed] [CrossRef] [Google Scholar]
67. Tipton, KD, Ferrando, AA, Phillips, SM, et al. Postexercise net protein synthesis in human muscle from orally administered amino acids. Am J Physiol. 1999;276(4Pt1):E628–34. PubMed PMID: 10198297. doi: 10.1152/ajpendo.1999.276.4.E628. [PubMed] [CrossRef] [Google Scholar]
68. Rasmussen, BB, Tipton, KD, Miller, SL, et al. An oral essential amino acid-carbohydrate supplement enhances muscle protein anabolism after resistance exercise. J Appl Physiol. 2000;88(2):386–392. PubMed PMID: 10658002. doi: 10.1152/jappl.2000.88.2.386 [PubMed] [CrossRef] [Google Scholar]
69. Waskiw-Ford, M, Hannaian, S, Duncan, J, et al. Leucine-enriched essential amino acids improve recovery from post-exercise muscle damage independent of increases in integrated myofibrillar protein synthesis in young men. Nutrients. 2020;12(4). Epub 2020/04/16. PubMed PMID: 32290521; PMCID: PMC7231404. doi: 10.3390/nu12041061 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
70. Moberg, M, Apro, W, Ekblom, B, et al. Activation of mTORC1 by leucine is potentiated by branched-chain amino acids and even more so by essential amino acids following resistance exercise. Am J Physiol Cell Physiol. 2016;310(11):C874–84. Epub 2016/04/08. PubMed PMID: 27053525. doi: 10.1152/ajpcell.00374.2015 [PubMed] [CrossRef] [Google Scholar]
71. Hannaian, SJ, Hodson, N, Abou Sawan, S, et al. Leucine-enriched amino acids maintain peripheral mTOR-Rheb localization independent of myofibrillar protein synthesis and mTORC1 signaling postexercise. J Appl Physiol. 2020;129(1):133–143. Epub 2020/06/12. PubMed PMID: 32525432; PMCID: PMC7469228. doi: 10.1152/japplphysiol.00241.2020 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
72. Lees, MJ, Wilson, OJ, Webb, EK, et al. Novel essential amino acid supplements following resistance exercise induce aminoacidemia and enhance anabolic signaling irrespective of age: a proof-of-concept trial. Nutrients. 2020;12(7). Epub 2020/07/16. PubMed PMID: 32664648; PMCID: PMC7400893. doi: 10.3390/nu12072067 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
73. Reidy, PT, Fry, CS, Dickinson, JM, et al. Postexercise essential amino acid supplementation amplifies skeletal muscle satellite cell proliferation in older men 24 hours postexercise. Physiol Rep. 2017;5(11). Epub 2017/06/10. PubMed PMID: 28596299; PMCID: PMC5471431. doi: 10.14814/phy2.13269 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
74. Tipton, KD, Rasmussen, BB, Miller, SL, et al. Timing of amino acid-carbohydrate ingestion alters anabolic response of muscle to resistance exercise. Am J Physiol. 2001;281(2):E197–206. PubMed PMID: 11440894. doi: 10.1152/ajpendo.2001.281.2.E197 [PubMed] [CrossRef] [Google Scholar]
75. Fujita, S, Dreyer, HC, Drummond, MJ, et al. Essential amino acid and carbohydrate ingestion before resistance exercise does not enhance postexercise muscle protein synthesis. J Appl Physiol. 2009;106(5):1730–1739. Epub 2017/06/10. PubMed PMID: 18535123; PMCID: PMC2681328. doi: 10.1152/japplphysiol.90395.2008 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
76. Borsheim, E, Tipton, KD, Wolf, SE, et al. Essential amino acids and muscle protein recovery from resistance exercise. Am J Physiol. 2002;283(4):E648–57. PubMed PMID: 12217881. doi: 10.1152/ajpendo.00466.2001 [PubMed] [CrossRef] [Google Scholar]
77. Pasiakos, SM, McClung, HL, Margolis, LM, et al. Human muscle protein synthetic responses during weight-bearing and non-weight-bearing exercise: a comparative study of exercise modes and recovery nutrition. Plos One. 2015;10(10):e0140863. PubMed PMID: 26474292; PMCID: PMC4608805. doi: 10.1371/journal.pone.0140863. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
78. Markofski, MM, Jennings, K, Timmerman, KL, et al. Effect of aerobic exercise training and essential amino acid supplementation for 24 weeks on physical function, body composition, and muscle metabolism in healthy, independent older adults: a randomized clinical trial. J Gerontol A Biol Sci Med Sci. 2019;74(10):1598–1604. Epub 2018/05/12. PubMed PMID: 29750251; PMCID: PMC6748753. doi: 10.1093/gerona/gly109 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
79. Callahan, MJ, Parr, EB, Hawley, JA, et al. Can high-intensity interval training promote skeletal muscle anabolism? Sports Med (Auckland, NZ). 2021;51(3):405–421. Epub 2017/10/17. PubMed PMID: 33512698. doi: 10.1007/s40279-020-01397-3. [PubMed] [CrossRef] [Google Scholar]
80. Forbes, SC, Candow, DG, Smith-Ryan, AE, et al. Supplements and nutritional interventions to augment high-intensity interval training physiological and performance adaptations—A narrative review. Nutrients. 2020;12(2):390. Epub 2020/02/07. PubMed PMID: 32024038; PMCID: PMC7071320. doi: 10.3390/nu12020390. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
81. Hirsch, KR, Greenwalt, CE, Saylor, HE, et al. High-intensity interval training and essential amino acid supplementation: effects on muscle characteristics and whole-body protein turnover. Physiol Rep. 2021;9(1):e14655. Epub 2020/12/29. PubMed PMID: 33369879; PMCID: PMC7769174. doi: 10.14814/phy2.14655 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
82. Hirsch, KR, Greenwalt, CE, Cabre, HE, et al. Metabolic effects of high-intensity interval training and essential amino acids. Eur J Appl Physiol. 2021;121(12):3297–3311. Epub 2020/12/29. PubMed PMID: 34427732. doi: 10.1007/s00421-021-04792-4 [PubMed] [CrossRef] [Google Scholar]
83. Hirsch, KR, Cabre, HE, Gould, LM, et al. Effects of essential amino acids on high-intensity interval training performance, fatigue outcomes, and workload progression. J Am Nutr Assoc. 2023;42(4):411–417. Epub 2020/12/29. PubMed PMID: 35512775. doi: 10.1080/07315724.2022.2060373 [PubMed] [CrossRef] [Google Scholar]
84. Sheffield-Moore, M, Yeckel, CW, Volpi, E, et al. Postexercise protein metabolism in older and younger men following moderate-intensity aerobic exercise. Am J Physiol. 2004;287(3):E513–22. Epub 2004/05/20. PubMed PMID: 15149953. doi: 10.1152/ajpendo.00334.2003 [PubMed] [CrossRef] [Google Scholar]
85. Aquilani, R, D’Antona, G, Baiardi, P, et al. Essential amino acids and exercise tolerance in elderly muscle-depleted subjects with chronic diseases: a rehabilitation without rehabilitation? Biomed Res Int. 2014;2014:341603. Epub 2014/07/11. PubMed PMID: 25009815; PMCID: PMC4070286. doi: 10.1155/2014/341603 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
86. Aquilani, R, Zuccarelli, GC, Dioguardi, FS, et al. Effects of oral amino acid supplementation on long-term-care-acquired infections in elderly patients. Arch Gerontol Geriatr. 2011;52(3):e123–8. Epub 2010/10/12. PubMed PMID: 20934757. doi: 10.1016/j.archger.2010.09.005 [PubMed] [CrossRef] [Google Scholar]
87. Aquilani, R, Viglio, S, Iadarola, P, et al. Oral amino acid supplements improve exercise capacities in elderly patients with chronic heart failure. Am J Cardiol. 2008;101(11A):104E–110E. Epub 2008/07/02. PubMed PMID: 18514618. doi: 10.1016/j.amjcard.2008.03.008 [PubMed] [CrossRef] [Google Scholar]
88. Scognamiglio, R, Piccolotto, R, Negut, C, et al. Oral amino acids in elderly subjects: effect on myocardial function and walking capacity. Gerontology. 2005;51(5):302–308. Epub 2005/08/20. PubMed PMID: 16110231. doi: 10.1159/000086366 [PubMed] [CrossRef] [Google Scholar]
89. Aquilani, R, Zuccarelli, GC, Condino, AM, et al. Despite inflammation, supplemented essential amino acids may improve circulating levels of albumin and haemoglobin in patients after hip fractures. Nutrients. 2017;9(6). Epub 2017/06/22. PubMed PMID: 28635634; PMCID: PMC5490616. doi: 10.3390/nu9060637 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
90. Aquilani, R, Zuccarelli Ginetto, C, Rutili, C, et al. Supplemented amino acids may enhance the walking recovery of elderly subjects after hip fracture surgery. Aging Clin Exp Res. 2019;31(1):157–160. Epub 2018/04/19. PubMed PMID: 29667153. doi: 10.1007/s40520-018-0941-x [PubMed] [CrossRef] [Google Scholar]
91. Baldissarro, E, Aquilani, R, Boschi, F, et al. The hip functional retrieval after elective surgery May be enhanced by supplemented essential amino acids. Biomed Res Int. 2016;2016:9318329. Epub 2016/04/26. PubMed PMID: 27110573; PMCID: PMC4823478. doi: 10.1155/2016/9318329 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
92. Ferrando, A, Bamman, MM, Schutzler, S, et al. Increased nitrogen intake following hip arthroplasty expedites muscle strength recovery. J Aging: Res And Clin Pract. 2013;2(4):369. [Google Scholar]
93. Aquilani, R, Boselli, M, D’Antona, G, et al. Unaffected arm muscle hypercatabolism in dysphagic subacute stroke patients: the effects of essential amino acid supplementation. Biomed Res Int. 2014;2014:964365. Epub 2016/04/26. PubMed PMID: 25431770; PMCID: PMC4241696. doi: 10.1155/2014/964365 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
94. Aquilani, R, Emilio, B, Dossena, M, et al. Correlation of deglutition in subacute ischemic stroke patients with peripheral blood adaptive immunity: essential amino acid improvement. Int J Immunopathol Pharmacol. 2015;28(4):576–583. Epub 2015/10/07. PubMed PMID: 26437899. doi: 10.1177/0394632015608249 [PubMed] [CrossRef] [Google Scholar]
95. Brooks, N, Cloutier, GJ, Cadena, SM, et al. Resistance training and timed essential amino acids protect against the loss of muscle mass and strength during 28 days of bed rest and energy deficit. J Appl Physiol. 2008;105(1):241–248. Epub 2008/05/17. PubMed PMID: 18483167; PMCID: PMC2494840. doi: 10.1152/japplphysiol.01346.2007 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
96. Cholewa, JM, Dardevet, D, Lima-Soares, F, et al. Dietary proteins and amino acids in the control of the muscle mass during immobilization and aging: role of the MPS response. Amino Acids. 2017;49(5):811–820. Epub 2017/02/09. PubMed PMID: 28175999. doi: 10.1007/s00726-017-2390-9 [PubMed] [CrossRef] [Google Scholar]
97. Holloway, TM, McGlory, C, McKellar, S, et al. A novel amino acid composition ameliorates short-term muscle disuse atrophy in healthy young men. Front Nutr. 2019;6:105. Epub 2019/07/30. PubMed PMID: 31355205; PMCID: PMC6636393. doi: 10.3389/fnut.2019.00105 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
98. Killewich, LA, Tuvdendorj, D, Bahadorani, J, et al. Amino acids stimulate leg muscle protein synthesis in peripheral arterial disease. J Vasc Surg. 2007;45(3):554–559. discussion 9-60. Epub 2007/02/27. PubMed PMID: 17321342. doi: 10.1016/j.jvs.2006.11.033 [PubMed] [CrossRef] [Google Scholar]
99. Bauerdick, H, Spellerberg, P, Lamberts, B. Therapy with essential amino acids and their nitrogen-free analogues in severe renal failure. Am J Clin Nutr. 1978;31(10):1793–1796. Epub 1978/10/01. PubMed PMID: 707334. doi: 10.1093/ajcn/31.10.1793 [PubMed] [CrossRef] [Google Scholar]
100. Eustace, JA, Coresh, J, Kutchey, C, et al. Randomized double-blind trial of oral essential amino acids for dialysis-associated hypoalbuminemia. Kidney Int. 2000;57(6):2527–2538. Epub 2000/06/09. PubMed PMID: 10844622. doi: 10.1046/j.1523-1755.2000.00112.x [PubMed] [CrossRef] [Google Scholar]
101. Ferrando, AA, Raj, D, Wolfe, RR. Amino acid control of muscle protein turnover in renal disease. J Ren Nutr. 2005;15(1):34–38. PubMed PMID: 15648004. doi: 10.1053/j.jrn.2004.09.014. [PubMed] [CrossRef] [Google Scholar]
102. Hecking, E, Kohler, H, Zobel, R, et al. Treatment with essential amino acids in patients on chronic hemodialysis: a double blind cross-over study. Am J Clin Nutr. 1978;31(10):1821–1826. Epub 1978/10/01. PubMed PMID: 360819. doi: 10.1093/ajcn/31.10.1821 [PubMed] [CrossRef] [Google Scholar]
103. Unverdi, S, Ceri, M, Uz, E, et al. The effectiveness of oral essential aminoacids and aminoacids containing dialysate in peritoneal dialysis. Ren Fail. 2014;36(9):1416–1419. Epub 2014/09/24. PubMed PMID: 25246343. doi: 10.3109/0886022X.2014.950933 [PubMed] [CrossRef] [Google Scholar]
104. Kato, H, Miura, K, Nakano, S, et al. Leucine-enriched essential amino acids attenuate inflammation in rat muscle and enhance muscle repair after eccentric contraction. Amino Acids. 2016;48(9):2145–2155. Epub 2016/05/12. PubMed PMID: 27168073; PMCID: PMC4989025. doi: 10.1007/s00726-016-2240-1 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
105. Rittig, N, Bach, E, Thomsen, HH, et al. Amino acid supplementation is anabolic during the acute phase of endotoxin-induced inflammation: a human randomized crossover trial. Clin Nutr. 2016;35(2):322–330. Epub 2015/04/22. PubMed PMID: 25896101. doi: 10.1016/j.clnu.2015.03.021. [PubMed] [CrossRef] [Google Scholar]
106. Jones, C, Eddleston, J, McCairn, A, et al. Improving rehabilitation after critical illness through outpatient physiotherapy classes and essential amino acid supplement: a randomized controlled trial. J Crit Care. 2015;30(5):901–907. Epub 2016/05/12. PubMed PMID: 26004031. doi: 10.1016/j.jcrc.2015.05.002 [PubMed] [CrossRef] [Google Scholar]
107. Engelen, M, Safar, AM, Bartter, T, et al. High anabolic potential of essential amino acid mixtures in advanced nonsmall cell lung cancer. Ann Oncol. 2015;26(9):1960–1966. Epub 2015/06/27. PubMed PMID: 26113648; PMCID: PMC4551158. doi: 10.1093/annonc/mdv271 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
108. Engelen, MP, Com, G, Wolfe, RR, et al. Dietary essential amino acids are highly anabolic in pediatric patients with cystic fibrosis. J Cyst Fibros. 2013;12(5):445–453. Epub 2013/01/30. PubMed PMID: 23357545; PMCID: PMC3640686. doi: 10.1016/j.jcf.2012.12.011 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
109. Dal Negro, RW, Aquilani, R, Bertacco, S, et al. Comprehensive effects of supplemented essential amino acids in patients with severe COPD and sarcopenia. Monaldi Arch Chest Dis. 2010;73(1):25–33. Epub 2010/05/27. PubMed PMID: 20499791. doi: 10.4081/monaldi.2010.310 [PubMed] [CrossRef] [Google Scholar]
110. Dal Negro, RW, Testa, A, Aquilani, R, et al. Essential amino acid supplementation in patients with severe COPD: a step towards home rehabilitation. Monaldi Arch Chest Dis. 2012;77(2):67–75. Epub 2012/12/01. PubMed PMID: 23193843. doi: 10.4081/monaldi.2012.154 [PubMed] [CrossRef] [Google Scholar]
111. Jonker, R, Deutz, NE, Erbland, ML, et al. Effectiveness of essential amino acid supplementation in stimulating whole body net protein anabolism is comparable between COPD patients and healthy older adults. Metabolism. 2017;69:120–129. Epub 2017/03/14. PubMed PMID: 28285641; PMCID: PMC5351771. doi: 10.1016/j.metabol.2016.12.010 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
112. Corsetti, G, Romano, C, Pasini, E, et al. Diet enrichment with a specific essential free amino acid mixture improves healing of undressed wounds in aged rats. Exp Gerontol. 2017;96:138–145. Epub 2017/07/04. PubMed PMID: 28669821. doi: 10.1016/j.exger.2017.06.020 [PubMed] [CrossRef] [Google Scholar]
113. Borsheim, E, Bui, QU, Wolfe, RR. Plasma amino acid concentrations during late rehabilitation in patients with traumatic brain injury. Archives of physical medicine and rehabilitation. Arch Phys Med Rehabil. 2007;88(2):234–238. Epub 2007/02/03. PubMed PMID: 17270522. doi: 10.1016/j.apmr.2006.11.003. [PubMed] [CrossRef] [Google Scholar]
114. Boselli, M, Aquilani, R, Baiardi, P, et al. Supplementation of essential amino acids may reduce the occurrence of infections in rehabilitation patients with brain injury. Nutr Clin Pract. 2012;27(1):99–113. Epub 2012/02/07. PubMed PMID: 22307494. doi: 10.1177/0884533611431068 [PubMed] [CrossRef] [Google Scholar]
115. Borsheim, E, Bui, QU, Tissier, S, et al. Amino acid supplementation decreases plasma and liver triacylglycerols in elderly. Nutrition. 2009;25:281–288. PubMed PMID: 19041223. doi: 10.1016/j.nut.2008.09.001. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
116. Coker, RH, Deutz, NE, Schutzler, S, et al. Nutritional supplementation with essential amino acids and phytosterols may reduce risk for metabolic syndrome and cardiovascular disease in overweight individuals with Mild Hyperlipidemia. J Endocrinol Diabetes Obes. 2015;3(2):Epub 2016/01/05. PubMed PMID: 26726312; PMCID: PMC4696774. [PMC free article] [PubMed] [Google Scholar]
117. Marquis, BJ, Hurren, NM, Carvalho, E, et al. Skeletal muscle acute and chronic metabolic response to essential amino acid supplementation in hypertriglyceridemic older adults. Curr Dev Nutr. 2017;1(11):e002071. Epub 2018/06/30. PubMed PMID: 29955688; PMCID: PMC5998789. doi: 10.3945/cdn.117.002071 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
118. Coker, RH, Miller, S, Schutzler, S, et al. Whey protein and essential amino acids promote the reduction of adipose tissue and increased muscle protein synthesis during caloric restriction-induced weight loss in elderly, obese individuals. Nutr J. 2012;11:105. Epub 2018/06/30. PubMed PMID: 23231757; PMCID: PMC3546025. doi: 10.1186/1475-2891-11-105 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
119. Coker, RH, Shin, K, Scholten, K, et al. Essential amino acid-enriched meal replacement promotes superior net protein balance in older, overweight adults. Clin Nutr. 2019;38(6):2821–2826. Epub 2015/04/22. PubMed PMID: 30638738; PMCID: PMC6588419. doi: 10.1016/j.clnu.2018.12.013. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
120. Coker, MS, Ladd, KR, Kim, J, et al. Essential amino acid supplement lowers intrahepatic lipid despite excess alcohol consumption. Nutrients. 2020;12(1). Epub 2020/01/23. PubMed PMID: 31963802; PMCID: PMC7019240. doi: 10.3390/nu12010254 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
121. Jegatheesan, P, Beutheu, S, Ventura, G, et al. Effect of specific amino acids on hepatic lipid metabolism in fructose-induced non-alcoholic fatty liver disease. Clin Nutr. 2016;35(1):175–182. Epub 2015/03/05. PubMed PMID: 25736031. doi: 10.1016/j.clnu.2015.01.021 [PubMed] [CrossRef] [Google Scholar]
122. Theytaz, F, Noguchi, Y, Egli, L, et al. Effects of supplementation with essential amino acids on intrahepatic lipid concentrations during fructose overfeeding in humans. Am J Clin Nutr. 2012;96(5):1008–1016. Epub 2012/10/05. PubMed PMID: 23034968. doi: 10.3945/ajcn.112.035139 [PubMed] [CrossRef] [Google Scholar]
123. Brocca, L, D’Antona, G, Bachi, A, et al. Amino acid supplements improve native antioxidant enzyme expression in the skeletal muscle of diabetic mice. Am J Cardiol. 2008;101(11A):57E–62E. Epub 2008/07/02. PubMed PMID: 18514628. doi: 10.1016/j.amjcard.2008.03.002 [PubMed] [CrossRef] [Google Scholar]
124. Natarajan Sulochana, K, Lakshmi, S, Punitham, R, et al. Effect of oral supplementation of free amino acids in type 2 diabetic patients– a pilot clinical trial. Med Sci Monit. 2002;8(3): CR131–7. Epub 2002/03/12. PubMed PMID: 11887024. [PubMed] [Google Scholar]
125. Pellegrino, MA, Patrini, C, Pasini, E, et al. Amino acid supplementation counteracts metabolic and functional damage in the diabetic rat heart. Am J Cardiol. 2008;101(11A):49E–56E. Epub 2008/07/02. PubMed PMID: 18514627. doi: 10.1016/j.amjcard.2008.03.001 [PubMed] [CrossRef] [Google Scholar]
126. Solerte, SB, Fioravanti, M, Locatelli, E, et al. Improvement of blood glucose control and insulin sensitivity during a long-term (60 weeks) randomized study with amino acid dietary supplements in elderly subjects with type 2 diabetes mellitus. Am J Cardiol. 2008;101(11A):82E–88E. Epub 2008/07/02. PubMed PMID: 18514633. doi: 10.1016/j.amjcard.2008.03.006 [PubMed] [CrossRef] [Google Scholar]
127. Solerte, SB, Gazzaruso, C, Schifino, N, et al. Metabolic effects of orally administered amino acid mixture in elderly subjects with poorly controlled type 2 diabetes mellitus. Am J Cardiol. 2004;93(8A):23A–29A. Epub 2008/07/02. PubMed PMID: 15094102. doi: 10.1016/j.amjcard.2003.11.006 [PubMed] [CrossRef] [Google Scholar]
