Introduzione alla Parte 4:
Nella 3° parte abbiamo analizzato le caratteristiche e funzioni biochimiche della L-Citrullina e della L-Arginina. In questa quarta parte, invece, andremo ad analizzare uno degli integratori a base di AA più discussi in assoluto: gli Aminoacidi a Catena Ramificata/BCAA.
BCAA – caratteristiche biochimiche:
Un aminoacido a catena ramificata (BCAA) è un aminoacido con una catena laterale alifatica con un ramo (un atomo di carbonio centrale legato a tre o più atomi di carbonio). Tra gli aminoacidi proteinogenici, vi sono tre BCAA: leucina, isoleucina e valina.[1] Tra i BCAA non proteinogenici vi sono l’acido 2-aminoisobutirrico e l’alloisoleucina.
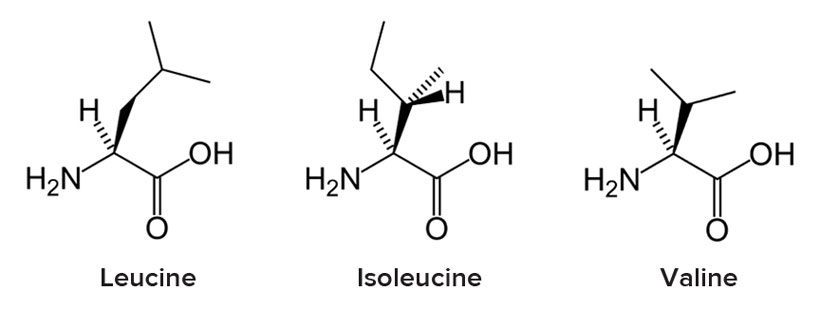
I tre BCAA proteinogenici sono tra i nove aminoacidi essenziali per l’uomo, rappresentando il 35% degli aminoacidi essenziali nelle proteine muscolari e il 40% degli aminoacidi preformati richiesti dai mammiferi.[2] La sintesi dei BCAA avviene in tutti i luoghi delle piante, all’interno dei plastidi della cellula, come determinato dalla presenza di mRNA che codificano per gli enzimi della via metabolica.[3][4][5] L’ossidazione dei BCAA può aumentare l’ossidazione degli acidi grassi e svolgere un ruolo nell’obesità. Fisiologicamente, i BCAA svolgono un ruolo nel sistema immunitario e nella funzione cerebrale. I BCAA vengono scomposti efficacemente dagli enzimi deidrogenasi e decarbossilasi espressi dalle cellule immunitarie e sono necessari per la crescita e la proliferazione dei linfociti e per l’attività dei linfociti T citotossici.[4] Infine, i BCAA condividono con gli aminoacidi aromatici (Trp, Tyr e Phe) la stessa proteina di trasporto nel cervello. Una volta nel cervello, i BCAA possono avere un ruolo nella sintesi proteica, nella sintesi dei neurotrasmettitori e nella produzione di energia.[4]
Cinque enzimi partecipano alle vie di sintesi parallele di isoleucina, valina e leucina: la treonina deidrogenasi, l’acetoidrossiacido sintasi, la chetoacido reduttasi, la diidrossiacido deidrogenasi e l’aminotransferasi.[3] La treonina deidrogenasi catalizza la deaminazione e la disidratazione della treonina a 2-chetobutirrato e ammoniaca. L’isoleucina forma un circuito di feedback negativo con la treonina deidrogenasi. L’acetoidrossiacido sintasi è il primo enzima della via parallela che esegue la reazione di condensazione in entrambe le fasi: condensazione del piruvato ad acetolattato nella via della valina e condensazione del piruvato e del 2-chetobutirrato per formare acetoidrossibutirrato nella via dell’isoleucina. Successivamente, la chetoacido-riduttasi riduce gli acetoidrossiacidi della fase precedente per produrre diidrossiacidi in entrambe le vie della valina e dell’isoleucina. La diidrossiacido deidrogenasi converte i diidrossiacidi nella fase successiva. La fase finale della via parallela è condotta dall’amino-transferasi, che produce i prodotti finali di valina e isoleucina.[3] Una serie di altri quattro enzimi – isopropilmalato sintasi, isopropilmalato isomerasi, isopropilmalato deidrogenasi e aminotransferasi – è necessaria per la formazione della leucina dal 2-ossolsovalerato.[3]
La degradazione degli aminoacidi a catena ramificata coinvolge il complesso della deidrogenasi degli alfa-chetoacidi a catena ramificata (BCKDH). Una carenza di questo complesso porta a un accumulo di aminoacidi a catena ramificata (leucina, isoleucina e valina) e dei loro sottoprodotti tossici nel sangue e nelle urine, dando alla condizione il nome di malattia delle urine a sciroppo d’acero. D’altra parte, l’attività incontrollata di questo complesso causa un deficit di chetoacido deidrogenasi a catena ramificata.

Il complesso BCKDH converte gli aminoacidi a catena ramificata in derivati dell’acil-CoA, che dopo successive reazioni vengono convertiti in acetil-CoA o succinil-CoA che entrano nel ciclo dell’acido citrico.[6]
Gli enzimi coinvolti sono l’aminotransferasi a catena ramificata e la 3-metil-2-ossobutanoato deidrogenasi.
Mentre la maggior parte degli aminoacidi viene ossidata nel fegato, i BCAA vengono ossidati principalmente nel muscolo scheletrico e in altri tessuti periferici.[4] Sono stati testati gli effetti della somministrazione di BCAA sulla crescita muscolare del diaframma di ratto e si è concluso che non solo una miscela di BCAA da sola ha lo stesso effetto sulla crescita di una miscela completa di aminoacidi, ma che una miscela di aminoacidi con tutti i BCAA tranne i BCAA non influisce sulla crescita muscolare del diaframma di ratto. [7] La somministrazione di isoleucina o valina da sole non ha influenzato la crescita muscolare, anche se la somministrazione di leucina da sola sembra essere quasi altrettanto efficace della miscela completa di BCAA. La leucina attiva indirettamente la p70 S6 chinasi e stimola l’assemblaggio del complesso eIF4F, essenziali per il legame dell’mRNA nell’avvio della traslazione.[7] La p70 S6 chinasi fa parte della via di segnalazione del complesso mammalian target of rapamycin (mTOR) ed è stato dimostrato che consente l’ipertrofia adattiva e il recupero del muscolo di ratto. [8] A riposo, l’infusione di proteine stimola la sintesi proteica 30 minuti dopo l’inizio dell’infusione e la sintesi proteica rimane elevata per altri 90 minuti.[9] L’infusione di leucina a riposo produce un effetto stimolante di sei ore e un aumento della sintesi proteica attraverso la fosforilazione della p70 S6 chinasi nei muscoli scheletrici.[10] Dopo l’esercizio di resistenza, senza la somministrazione di BCAA, una sessione di esercizio di resistenza non influisce sulla fosforilazione di mTOR e produce addirittura una diminuzione della fosforilazione di Akt. È stata rilevata una certa fosforilazione della p70 S6 chinasi. Quando sono stati somministrati BCAA dopo una sessione di allenamento, una fosforilazione sufficiente di p70 S6 chinasi e S6 ha indicato l’attivazione della cascata di segnalazione.[10]

Oltre alla segnalazione cellulare, la via mTOR svolge anche un ruolo nella crescita delle cellule beta che porta alla secrezione di insulina.[11] L’elevata presenza di glucosio nel sangue avvia il processo della via di segnalazione mTOR, in cui la leucina svolge un ruolo indiretto.[9][12] La combinazione di glucosio, leucina e altri attivatori fa sì che mTOR inizi a segnalare la proliferazione delle cellule beta e la secrezione di insulina. Concentrazioni più elevate di leucina causano un’iperattività della via mTOR e l’attivazione della chinasi S6 porta all’inibizione del substrato del recettore dell’insulina attraverso la fosforilazione della serina.[11][12] Nella cellula l’aumento dell’attività del complesso mTOR causa l’eventuale incapacità delle cellule beta di rilasciare insulina e l’effetto inibitorio della chinasi S6 porta all’insulino-resistenza nelle cellule, contribuendo allo sviluppo del diabete di tipo 2.[12]
La metformina è in grado di attivare l’AMP chinasi che fosforila le proteine coinvolte nella via mTOR e porta alla progressione del complesso mTOR dallo stato inattivo a quello attivo.[12] Si suggerisce che la Metformina agisca come inibitore competitivo dell’amminoacido leucina nella via mTOR.
BCAA e Sport:
Sappiamo che la Leucina, in particolare, attiva mTOR, un segnale anabolico che media la sintesi proteica muscolare [13], a sua volta correlata agli adattamenti della forza e dell’ipertrofia [14]. A tal fine, si è ipotizzato che i BCAA siano utili per le prestazioni, il recupero e la composizione corporea [15].
Una recente pubblicazione sostiene che l’assunzione di livelli accettabili di BCAA dovrebbe essere prioritaria rispetto alla partecipazione all’esercizio fisico [16]. Tuttavia, l’ingestione orale di BCAA è molto discutibile per quanto riguarda l’ottimizzazione delle prestazioni e della sintesi proteica [14,17,18]. Recenti review sistematiche mostrano che l’integrazione di BCAA tende ad attenuare l’indolenzimento muscolare, che è un indicatore di danno muscolare [17,18]. Gli effetti ergogenici dei BCAA sono stati esaminati principalmente negli adulti e pochi studi hanno incluso partecipanti allenati, che possono differire sostanzialmente in termini di prestazioni, danno muscolare e composizione corporea. Inoltre, l’Australian Institute of Sport ha classificato i BCAA nel gruppo C, che comprende gli integratori privi di supporto scientifico tra gli atleti o studi non conclusivi. Tuttavia, i BCAA non sono raccomandati nei programmi di integrazione [15]. La panoramica del Comitato Olimpico Internazionale non ha menzionato i BCAA tra i diversi argomenti trattati, ovvero gli integratori utilizzati per prevenire o trattare le carenze di nutrienti, gli integratori utilizzati per fornire energia e gli integratori che migliorano le prestazioni sportive [19]. Per quanto riguarda i tre BCAA, sono stati descritti solo gli effetti della leucina sul turnover proteico, anche se gli studi citati non includevano partecipanti allenati [20,21].
Negli studi che hanno valutato l’impatto dell’integrazione di BCAA sulle prestazioni, i partecipanti erano in genere atleti di ciclismo e corsa [21,22,24,26], atleti impegnati in allenamenti contro-resistenza [23,25,27], pallavolisti [28] e calciatori [29,30]. Tenendo conto delle variazioni nei protocolli di integrazione, i risultati suggeriscono che i BCAA hanno effetti insignificanti sulle prestazioni. In un altro studio, i partecipanti hanno seguito una dieta ipocalorica con carboidrati o BCAA e un pesante programma di allenamento contro-resistenza per 8 settimane [26]. Gli autori hanno riscontrato che l’integrazione con BCAA ha aumentato significativamente la forza della parte superiore (15,1 ± 2,2 kg) e inferiore del corpo (7,1 ± 1,6 kg), mentre il gruppo CHO ha mostrato cambiamenti trascurabili nella forza della parte superiore del corpo (4,8 ± 1,8 kg). Uno studio separato, che ha esaminato gli effetti dell’integrazione di BCAA a lungo termine per 10 settimane in 18 ciclisti, ha riscontrato un’interazione tra gruppo e tempo per il picco di potenza nel gruppo BCAA [27]. Tuttavia, gli autori non hanno controllato l’apporto nutrizionale e gli atleti sono stati istruiti a mantenere le loro abitudini alimentari durante l’indagine [27]. Altri studi hanno esaminato gli effetti dell’integrazione di BCAA per 7-8 giorni [25,31,32] immediatamente prima, durante o dopo l’esercizio fisico [21,28,29,30]. Per questi studi, pochi manoscritti hanno testato l’integrazione di BCAA in riferimento agli indicatori di prestazione.
L’efficacia dell’integrazione di BCAA sulla composizione corporea è stata esaminata in 50 corridori amatoriali [25], 17 atleti contro-resistenza [26] e 18 ciclisti [27]. Dopo 7 giorni di integrazione orale, sono stati osservati cambiamenti comparabili nel peso corporeo nel gruppo BCAA e nel gruppo di controllo [25]. Sono stati osservati effetti trascurabili per il gruppo BCAA nel tessuto magro e nella massa grassa [26,27].
L’indolenzimento o il recupero muscolare sono stati valutati mediante l’uso di scale o esaminando i cali di prestazione post-esercizio attraverso l’uso di test specifici sul campo o in laboratorio. Negli sport di resistenza (corsa o ciclismo), i risultati degli studi estratti non sono conclusivi. Le valutazioni dello sforzo percepito e della fatica mentale sono risultate significativamente ridotte nel gruppo BCAA tra sette ciclisti di resistenza [21], mentre in 50 maratoneti non sono state riportate differenze nelle valutazioni dello sforzo percepito [25]. Al contrario, l’indolenzimento muscolare è risultato inferiore nel gruppo BCAA rispetto al placebo in 16 corridori di distanza [33]. Gli studi che hanno incluso partecipanti allenati contro-resistenza e che hanno esaminato gli effetti dei BCAA sull’indolenzimento muscolare o sul recupero hanno indicato potenziali benefici di leucina, isoleucina o valina nell’attenuazione dell’indolenzimento muscolare dopo l’esercizio [34,35]. Due studi hanno riportato che il consumo di un’integrazione di BCAA ha attenuato i cali di prestazione [36,37]. Una serie di parametri biochimici, ormonali e molecolari sono stati analizzati dopo un intervento di esercizio fisico combinato con l’integrazione di BCAA. I risultati principali di questi studi estratti rivelano che l’assunzione di BCAA ha causato un sostanziale miglioramento del rapporto BCAA:triptofano [21,27] e della risposta immunitaria [27,38,39]. Tenendo conto delle variazioni metodologiche tra gli studi, i cambiamenti ormonali indicano che l’integrazione di BCAA ha favorito una risposta ormonale anabolizzante. Il livello di cortisolo è diminuito dopo l’esercizio fisico e, parallelamente, il testosterone tendeva ad aumentare nei partecipanti impegnati nell’allenamento contro-resistenza [40]. Gli studi che hanno esaminato i meccanismi biochimici si sono concentrati principalmente su segnali metabolici specifici e sulla loro dipendenza dal meccanismo del complesso target della rapamicina 1 (mTORC1).
BCAA e sintesi proteica muscolare:
Le proteine muscolari sono in costante stato di turnover, il che significa che vengono continuamente prodotte nuove proteine mentre quelle più vecchie vengono degradate. Lo stato anabolico non ha una definizione specifica, ma in generale si riferisce alla circostanza in cui il tasso di sintesi delle proteine muscolari supera il tasso di degradazione delle proteine muscolari. Il risultato è un aumento della massa muscolare. Convenzionalmente si ritiene che lo stato anabolico sia guidato da una stimolazione della sintesi proteica muscolare, ma teoricamente potrebbe anche derivare da un’inibizione della degradazione delle proteine muscolari.
L’obiettivo metabolico principale del consumo di integratori di BCAA è quello di massimizzare lo stato anabolico. È opinione diffusa che i BCAA inducano uno stato anabolico stimolando la sintesi proteica muscolare. Un’abbondante disponibilità di tutti gli EAA è un requisito per una stimolazione significativa della sintesi proteica muscolare [41]. La sintesi proteica muscolare sarà limitata dalla mancanza di disponibilità di uno qualsiasi degli EAA, mentre una carenza di NEAA può essere compensata da una maggiore produzione de novo dei NEAA carenti [41]. Nello stato postprandiale successivo a un pasto contenente proteine, tutti i precursori degli EAA necessari per la sintesi di nuove proteine muscolari possono essere ricavati dalle elevate concentrazioni plasmatiche derivanti dalla digestione delle proteine consumate o dal riciclo dalla scomposizione delle proteine. In questa circostanza di abbondante disponibilità di EAA, il tasso di sintesi proteica muscolare supera il tasso di degradazione, producendo così uno stato anabolico. Nello stato post-assorbitivo i livelli plasmatici di EAA scendono al di sotto dei valori post-prandiali perché gli aminoacidi non vengono più assorbiti. Di conseguenza, gli EAA non vengono più assunti dal muscolo, ma rilasciati dal muscolo nel plasma [42]. Questo stato catabolico della proteina muscolare nello stato post-assorbitivo consente di mantenere la disponibilità di EAA per altri tessuti per mantenere il tasso di sintesi proteica a spese della proteina muscolare, che può essere considerata come una riserva di EAA a cui attingere per il resto del corpo.
Poiché gli EAA non possono essere prodotti nell’organismo e vi è un rilascio netto di EAA dal muscolo, nello stato post-assorbitivo l’unica fonte di precursori di EAA per la sintesi proteica muscolare è costituita dagli EAA intracellulari derivati dalla degradazione delle proteine muscolari [42]. Oltre a essere reincorporati nelle proteine muscolari attraverso la sintesi, alcuni EAA rilasciati dalla disgregazione delle proteine muscolari possono essere parzialmente ossidati all’interno del muscolo, rendendoli così indisponibili per la reincorporazione nelle proteine muscolari. Gli EAA rilasciati dalla degradazione delle proteine muscolari che non vengono reincorporati nelle proteine muscolari o ossidati all’interno del tessuto muscolare vengono rilasciati nel plasma, dove possono essere assorbiti da altri tessuti come precursori per la sintesi proteica o ossidati irreversibilmente [43]. Pertanto, il tasso di sintesi proteica muscolare sarà sempre inferiore al tasso di degradazione delle proteine muscolari nello stato post-assorbitivo, a causa del flusso netto di EAA dalla degradazione delle proteine al plasma e alle vie ossidative. In altre parole, è impossibile che la sintesi proteica muscolare superi il tasso di degradazione delle proteine muscolari quando i precursori derivano interamente dalla degradazione delle proteine, e quindi non si può verificare uno stato anabolico in assenza di assunzione di aminoacidi esogeni.
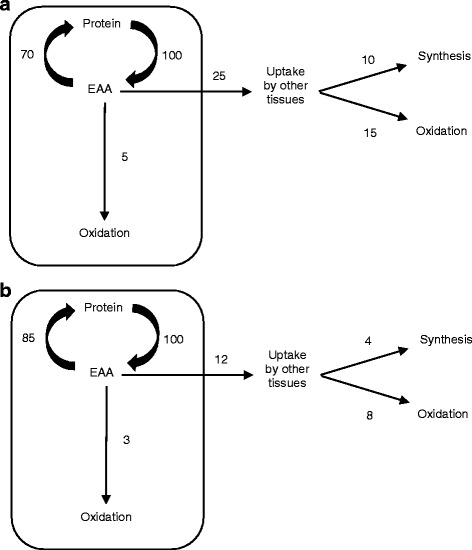
Tutti i precursori EAA per la sintesi proteica muscolare nello stato post-assorbitivo derivano dalla disgregazione delle proteine muscolari. È stato costantemente riportato che negli esseri umani normali in fase post-assorbitiva il tasso di degradazione delle proteine muscolari supera il tasso di sintesi delle proteine muscolari di circa il 30% [44]. Il consumo dei soli BCAA (cioè senza gli altri EAA) può aumentare la sintesi proteica muscolare nello stato post-assorbitivo solo aumentando l’efficienza del riciclo degli EAA dalla disgregazione proteica alla sintesi proteica, invece di essere rilasciati nel plasma o ossidati. Questo perché tutti i 9 EAA (e gli 11 NEAA) sono necessari per produrre proteine muscolari e gli EAA non possono essere prodotti dall’organismo. Se si consumano solo 3 EAA, come nel caso del consumo di BCAA, la ripartizione proteica è l’unica fonte dei restanti EAA necessari come precursori per la sintesi proteica muscolare. È quindi teoricamente impossibile che il consumo di soli BCAA crei uno stato anabolico in cui la sintesi proteica muscolare superi la degradazione delle proteine muscolari. Se si ipotizza generosamente che il consumo di BCAA migliori del 50% l’efficienza del riciclo degli EAA dalla disgregazione delle proteine muscolari alla sintesi delle proteine muscolari, ciò si tradurrebbe in un aumento del 15% del tasso di sintesi delle proteine muscolari (30% riciclato allo stato basale X 50% miglioramento del riciclo = 15% aumento della sintesi). Inoltre, una riduzione del 50% del rilascio di EAA nel plasma dal muscolo ridurrebbe anche i pool plasmatici e intracellulari di EAA liberi. La figura seguente illustra schematicamente questi principi. Poiché un miglioramento del 50% nell’efficienza del riciclo sarebbe circa il limite massimo ragionevole, ciò significa che la stimolazione massima della sintesi proteica muscolare non potrebbe superare il 15%. Ciò corrisponderebbe a un aumento del tasso di sintesi frazionale del muscolo da un valore di circa 0,050%/h allo stato basale a 0,057%/h, e questa differenza nel tasso di sintesi frazionale (FSR) delle proteine sarebbe difficile da misurare con precisione [45].
I BCAA sono stati somministrati per via endovenosa negli unici studi che hanno determinato la risposta del metabolismo proteico muscolare in soggetti umani ai soli BCAA. Sebbene l’infusione di BCAA non sia la modalità convenzionale di assunzione di un integratore alimentare, è stato dimostrato che gli aminoacidi infusi per via endovenosa e quelli ingeriti per via orale producono effetti comparabili sulla sintesi proteica muscolare in altre circostanze [46]. Di conseguenza, è ragionevole valutare i documenti in cui viene descritta la risposta della sintesi proteica muscolare all’infusione endovenosa di BCAA in soggetti umani.
Louard et al. [47] hanno utilizzato il metodo dell’equilibrio dell’avambraccio per quantificare la risposta all’infusione endovenosa di una miscela di BCAA per 3 ore in 10 soggetti in fase post-assorbitiva. Il metodo dell’equilibrio dell’avambraccio prevede la misurazione dell’assorbimento e del rilascio di singoli EAA (leucina e fenilalanina in questo caso) e delle loro controparti marcate isotopicamente. Vengono calcolati i tassi di scomparsa (Rd) e di comparsa (Ra) di fenilalanina e leucina. Partendo dal presupposto che il bilancio di leucina e fenilalanina nel muscolo è rappresentativo di tutti gli EAA, il Rd. della fenilalanina è considerato un riflesso della sintesi proteica muscolare, poiché la sintesi proteica è l’unico destino della fenilalanina assunta dal plasma nel muscolo. La Rd. della leucina non può essere interpretata in relazione alla sintesi proteica, poiché la leucina assunta dal muscolo può essere ossidata oltre che incorporata nelle proteine. L’infusione di 3 ore di BCAA ha aumentato le concentrazioni plasmatiche di tutti e 3 i BCAA di quattro volte, mentre le concentrazioni di altri EAA sono diminuite [47]. Invece di essere stimolata dall’infusione di BCAA, la sintesi proteica muscolare è diminuita da 37+/- 3 a 21 +/- 2 nmol/min/100 ml di gamba (statisticamente significativo, p < 0,05) [47]. Non si sono verificate variazioni significative nel bilancio netto della fenilalanina, il che indica che anche la degradazione delle proteine muscolari è stata ridotta in misura simile alla riduzione della sintesi proteica muscolare. Il bilancio tra la sintesi e la degradazione delle proteine muscolari è rimasto negativo, il che significa che lo stato catabolico è persistito e non si è prodotto uno stato anabolico. La diminuzione simultanea della sintesi e della degradazione delle proteine muscolari durante l’infusione di BCAA può essere descritta come una diminuzione del turnover proteico muscolare.
Risultati simili sono stati ottenuti dagli stessi ricercatori quando hanno esteso l’infusione di BCAA a 16 ore in 8 volontari normali e hanno determinato se l’aumento cronico di BCAA stimolasse la sintesi proteica muscolare [48]. Per calcolare la sintesi e la ripartizione delle proteine muscolari è stata utilizzata la stessa metodologia di bilanciamento dell’avambraccio dello studio precedente. L’infusione di 16 ore ha aumentato le concentrazioni di BCAA da 5 a 8 volte [48], ovvero il doppio dei livelli raggiunti con una dose normale di BCAA ingeriti per via orale [49]. Come nello studio precedente, la sintesi proteica muscolare (riflessa dalla fenilalanina Rd) si è ridotta nei soggetti che hanno ricevuto i BCAA rispetto all’infusione di soluzione salina, passando da 36 +/- 5 a 27 +/-2 nmol/min/100 ml. Anche la disgregazione proteica muscolare si è ridotta, il che significa che anche il turnover proteico muscolare è stato ridotto e che è persistito uno stato catabolico.
Da questi due studi possiamo concludere che l’infusione di BCAA non solo non aumenta il tasso di sintesi proteica muscolare nei soggetti umani, ma anzi riduce il tasso di sintesi proteica muscolare e il tasso di turnover proteico muscolare. Lo stato catabolico non è stato invertito in uno stato anabolico in nessuno dei due studi. Inoltre, una riduzione prolungata del tasso di turnover delle proteine muscolari dovrebbe avere un effetto negativo sulla forza muscolare, anche se la massa muscolare viene mantenuta. Il ricambio delle proteine muscolari rinnova le fibre muscolari e determina una maggiore efficienza della contrazione a livello di singola fibra [50], che si riflette in un aumento della forza in vivo, indipendentemente dalla massa muscolare [51, 52].
Il mancato aumento significativo della sintesi proteica muscolare in risposta all’infusione dei soli BCAA è atteso in base alle considerazioni teoriche discusse in precedenza e illustrate nella figura sopra esposta per quanto riguarda il requisito di tutti gli EAA per sostenere un aumento. Invece, poiché la disgregazione delle proteine muscolari è diminuita, è diminuita anche la disponibilità di EAA, che a sua volta ha ridotto il tasso di sintesi proteica muscolare.
L’affermazione che la sintesi proteica muscolare sia stimolata dai BCAA deriva, almeno in parte, dall’osservazione dell’aumento della segnalazione anabolica intracellulare, compreso lo stato di attivazione di fattori chiave coinvolti nell’avvio della sintesi proteica [53]. La teoria secondo cui l’attivazione dei fattori di segnalazione anabolica intracellulare provoca un aumento del tasso di sintesi proteica muscolare si è radicata nei moderni concetti di regolazione della sintesi proteica muscolare. L’aumento della segnalazione anabolica in risposta ai BCAA è stato citato come prova di una stimolazione della sintesi proteica muscolare, anche in assenza della misurazione della sintesi proteica muscolare (ad esempio, [53]). Tuttavia, l’attivazione delle vie di segnalazione anabolica può coincidere con un aumento della sintesi proteica muscolare solo in presenza di un’ampia quantità di EAA che forniscano i precursori necessari per produrre proteine complete.

La dissociazione tra lo stato di fosforilazione dei fattori di segnalazione e la sintesi proteica muscolare nell’uomo è stata dimostrata in diverse circostanze quando la disponibilità di tutti gli EAA è limitata. Ad esempio, un aumento della concentrazione di insulina (ad esempio in seguito all’assunzione di glucosio) è un potente attivatore delle vie di segnalazione anabolica, ma non riesce ad aumentare la FSR muscolare a causa della carenza di EAA [54]. Al contrario, il consumo di una piccola quantità (3 g) di EAA stimola la sintesi proteica muscolare senza influenzare l’attività dei fattori di iniziazione, come Akt, S6 chinasi e 4E-BP1 [55]. Un piccolo aumento delle concentrazioni plasmatiche di EAA non avrebbe alcun effetto se la sintesi proteica fosse limitata dallo stato di attivazione dei fattori di iniziazione. Negli studi citati in precedenza, in cui i BCAA sono stati infusi per via endovenosa, è ragionevole presumere che un aumento così consistente delle concentrazioni di BCAA avrebbe attivato i fattori di segnalazione, eppure la sintesi proteica muscolare è effettivamente diminuita a causa della mancanza di disponibilità di EAA derivante da una diminuzione della disgregazione proteica. Pertanto, nei soggetti umani la somministrazione di EAA può aumentare la sintesi proteica muscolare in assenza di qualsiasi cambiamento nell’attivazione dei fattori di iniziazione, mentre l’attivazione dei fattori di iniziazione in assenza del consumo di tutti gli EAA non ha alcun effetto sulla sintesi proteica muscolare. Questi risultati possono essere interpretati solo come la dimostrazione che il controllo limitante della sintesi proteica muscolare basale nell’uomo è la disponibilità di tutti gli EAA e non l’attività dei fattori di segnalazione anabolica. Questa conclusione mette ulteriormente in dubbio il ruolo dell’integrazione alimentare dei soli BCAA come stimolatori della sintesi proteica muscolare.
Se si considerano tutte le prove e le teorie, è ragionevole concludere che non esistono prove credibili che l’ingestione di un integratore alimentare di BCAA determini da solo una stimolazione fisiologicamente significativa delle proteine muscolari. Anzi, le prove disponibili indicano che i BCAA in realtà diminuiscono la sintesi proteica muscolare. Tutti gli EAA devono essere disponibili in abbondanza perché l’aumento della segnalazione anabolica si traduca in un’accelerazione della sintesi proteica muscolare.
A differenza della mancanza di un effetto interattivo tra BCAA e carboidrati, i BCAA possono potenziare l’effetto anabolico di un pasto proteico. Ad esempio, l’aggiunta di 5 g di BCAA a una bevanda contenente 6,25 g di proteine del siero di latte ha aumentato la sintesi proteica muscolare a un livello paragonabile a quello indotto da 25 g di proteine del siero di latte [56]. Questo risultato suggerisce che uno o più BCAA potrebbero essere limitanti per la stimolazione della sintesi proteica muscolare da parte delle proteine del siero di latte, oppure che i BCAA in più inducono un maggiore potenziale di risposta anabolica del muscolo alle proteine del siero di latte attivando i fattori di iniziazione. In entrambi i casi, la risposta dei BCAA in combinazione con le proteine intatte è una questione diversa rispetto all’effetto dei soli BCAA, poiché le proteine intatte forniscono tutti gli EAA necessari per produrre una proteina intatta.
Le risposte ai singoli BCAA (cioè leucina, valina o isoleucina) potrebbero differire dalla combinazione dei tre per diversi motivi. È dimostrato che la leucina da sola può esercitare una risposta anabolica (ad esempio, [57]), mentre non esistono dati simili per l’isoleucina o la valina. Pertanto, ci si potrebbe aspettare che la leucina da sola sia più efficace della combinazione di tutti i BCAA. Tuttavia, un’integrazione alimentare di sola leucina presenta due limitazioni significative. In primo luogo, gli stessi problemi che limitano l’entità della stimolazione della sintesi proteica muscolare da parte dei soli BCAA, relativi alla disponibilità degli altri EAA necessari per la produzione di proteine muscolari intatte, limitano anche la risposta alla sola leucina. In secondo luogo, l’aumento della concentrazione plasmatica di leucina attiva la via metabolica che ossida tutti i BCAA. Di conseguenza, l’ingestione della sola leucina determina una diminuzione delle concentrazioni plasmatiche di valina e isoleucina. La disponibilità di valina e isoleucina può quindi diventare limitante per la sintesi proteica muscolare quando si consuma solo leucina. Questo potrebbe essere il motivo per cui gli studi sui risultati a lungo termine con l’integrazione dietetica di leucina non hanno dato risultati positivi [58]. Il motivo principale per cui un integratore alimentare contiene tutti i BCAA rispetto alla sola leucina è quello di superare le diminuzioni delle concentrazioni plasmatiche di valina e isoleucina che si verificherebbero quando la leucina viene somministrata da sola.
Sebbene un integratore alimentare con tutti i BCAA superi le diminuzioni di concentrazione derivanti dal consumo della sola leucina, l’aggiunta di valina e isoleucina può comunque limitare l’efficacia della sola leucina a causa della competizione per il trasporto nelle cellule muscolari. I BCAA sono tutti trasportati attivamente nelle cellule, comprese quelle muscolari, dallo stesso sistema di trasporto. Pertanto, se forniti insieme, i BCAA competono tra loro per il trasporto nelle cellule. Se uno dei BCAA (ad esempio, la leucina) è limitante per la sintesi proteica, l’aggiunta degli altri due BCAA potrebbe limitare la stimolazione della sintesi proteica a causa del ridotto ingresso della leucina nella cellula. I BCAA competono anche con altri aminoacidi per il trasporto, compresa la fenilalanina, e questa competizione potrebbe influenzare la disponibilità intramuscolare di altri EAA. A causa della competizione per i trasportatori, è possibile che la leucina da sola, ad esempio, abbia un effetto stimolante transitorio sulla sintesi proteica muscolare (ad esempio, [59]) laddove i BCAA non riescono a suscitare tale risposta [60, 61].
Conclusioni:

Come abbiamo visto, la ricerca ha evidenziato che l’integrazione di BCAA non sembra avere un impatto significativo sulle prestazioni. D’altra parte, l’ingestione orale di BCAA isolati riduce l’indolenzimento muscolare. I BCAA sono disponibili anche in diversi prodotti di integrazione (ad esempio, proteine del siero del latte) e sono spesso combinati con altri nutrienti (ad esempio, carboidrati). Pertanto, i potenziali benefici dell’integrazione di BCAA isolati negli atleti per attenuare l’indolenzimento muscolare e ritardare l’affaticamento devono essere interpretati con cautela.
Rimane il fatto che un aumento fisiologicamente significativo del tasso di sintesi proteica muscolare richiede un’adeguata disponibilità di tutti i precursori aminoacidici. La fonte di EAA per la sintesi proteica muscolare nello stato post-assorbitivo è il pool libero intracellulare. Gli EAA liberi intracellulari disponibili per l’incorporazione nelle proteine derivano dalla degradazione delle proteine muscolari. In condizioni normali, circa il 70% degli EAA rilasciati dalla degradazione delle proteine muscolari viene reincorporato nelle proteine muscolari. L’efficienza della reincorporazione degli EAA provenienti dalla degradazione delle proteine nelle proteine muscolari può essere aumentata solo in misura limitata. Per questo motivo fondamentale, un’integrazione alimentare di soli BCAA non può sostenere un aumento del tasso di sintesi proteica muscolare. La disponibilità degli altri EAA diventerà rapidamente limitante per la sintesi proteica accelerata. Coerentemente con questa prospettiva, i pochi studi condotti su soggetti umani hanno riportato una diminuzione, piuttosto che un aumento, della sintesi proteica muscolare dopo l’assunzione di BCAA. Si può concludere, quindi, che gli integratori alimentari di BCAA da soli non promuovono l’anabolismo muscolare.
Direi che le informazioni riportate siano sufficienti a far desistere nell’acquisto di questo integratore chiunque sia dotato di un minimo di capacità cognitiva…
Gabriel Bellizzi [CEO BioGenTech]
Riferimenti:
- Sowers S. “A Primer on Branched Chain Amino Acids” (PDF). Huntington College of Health Sciences. Archived from the original (PDF) on 28 August 2017. Retrieved 22 March 2011.
- Shimomura Y, Murakami T, Nakai N, Nagasaki M, Harris RA (June 2004). “Exercise encourages BCAA catabolism: effects of BCAA supplementation on skeletal muscle during exercise”. The Journal of Nutrition. 134 (6 Suppl): 1583S–1587S. doi:10.1093/jn/134.6.1583S. PMID 15173434.
- Jump up to:a b c d Singh BK, Shaner DL (July 1995). “Biosynthesis of Branched Chain Amino Acids: From Test Tube to Field”. The Plant Cell. 7 (7): 935–944. doi:10.1105/tpc.7.7.935. PMC 160890. PMID 12242394.
- Jump up to:a b c d Monirujjaman M (2014). “Metabolic and Physiological Roles of Branched-Chain Amino Acids”. Advances in Molecular Biology. 2014: 1–6. doi:10.1155/2014/364976. hdl:1993/30476.
- Babchia N, Calipel A, Mouriaux F, Faussat AM, Mascarelli F (January 2010). “The PI3K/Akt and mTOR/P70S6K signaling pathways in human uveal melanoma cells: interaction with B-Raf/ERK”. Investigative Ophthalmology & Visual Science. 51 (1): 421–9. doi:10.1167/iovs.09-3974. PMID 19661225.
- Sears DD, Hsiao G, Hsiao A, Yu JG, Courtney CH, Ofrecio JM, et al. (November 2009). “Mechanisms of human insulin resistance and thiazolidinedione-mediated insulin sensitization”. Proceedings of the National Academy of Sciences of the United States of America. 106 (44): 18745–50. Bibcode:2009PNAS..10618745S. doi:10.1073/pnas.0903032106. PMC 2763882. PMID 19841271.
- Jump up to:a b Scaini, G.; Jeremias, I. C.; Morais, M. O.; Borges, G. D.; Munhoz, B. P.; Leffa, D. D.; Andrade, V. M.; Schuck, P. F.; Ferreira, G. C.; Streck, E. L. (2012). “DNA damage in an animal model of maple syrup urine disease”. Molecular Genetics and Metabolism. 106 (2): 169–174. doi:10.1016/j.ymgme.2012.04.009. PMID 22560665.
- Jump up to:a b Kimball SR, Jefferson LS (January 2006). “Signaling pathways and molecular mechanisms through which branched-chain amino acids mediate translational control of protein synthesis”. The Journal of Nutrition. 136 (1 Suppl): 227S–31S. doi:10.1093/jn/136.1.227S. PMID 16365087.
- Jump up to:a b Bodine SC, Stitt TN, Gonzalez M, Kline WO, Stover GL, Bauerlein R, et al. (November 2001). “Akt/mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo”. Nature Cell Biology. 3 (11): 1014–9. doi:10.1038/ncb1101-1014. PMID 11715023. S2CID 16284975.
- Jump up to:a b c Blomstrand E, Eliasson J, Karlsson HK, Köhnke R (January 2006). “Branched-chain amino acids activate key enzymes in protein synthesis after physical exercise”. The Journal of Nutrition. 136 (1 Suppl): 269S–73S. doi:10.1093/jn/136.1.269S. PMID 16365096.
- Jump up to:a b c d Melnik BC (March 2012). “Leucine signaling in the pathogenesis of type 2 diabetes and obesity”. World Journal of Diabetes. 3 (3): 38–53. doi:10.4239/WJD.v3.i3.38. PMC 3310004. PMID 22442749.
- Jump up to:a b Balcazar Morales N, Aguilar de Plata C (July 2012). “Role of AKT/mTORC1 pathway in pancreatic β-cell proliferation”. Colombia Medica. 43 (3): 235–43. doi:10.25100/cm.v43i3.783. PMC 4001958. PMID 24893199.
- Phillips S.M. The impact of protein quality on the promotion of resistance exercise-induced changes in muscle mass. Nutr. Metab. 2016;13:64. doi: 10.1186/s12986-016-0124-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Plotkin D.L., Delcastillo K., Van Every D.W., Tipton K.D., Aragon A.A., Schoenfeld B.J. Isolated Leucine and Branched-Chain Amino Acid Supplementation for Enhancing Muscular Strength and Hypertrophy: A Narrative Review. Int. J. Sport Nutr. Exerc. Metab. 2021;31:292–301. doi: 10.1123/ijsnem.2020-0356. [PubMed] [CrossRef] [Google Scholar]
- Australian Institute of Sports . Branched-Chain Amino Acids (Bcaa) Summary Report: Consideration for Classification of a Supplement Ingredient. Australian Institute of Sport; Bruce, Australia: 2021. [Google Scholar]
- Jäger R., Kerksick C.M., Campbell B.I., Cribb P.J., Wells S.D., Skwiat T.M., Purpura M., Ziegenfuss T.N., Ferrando A.A., Arent S.M., et al. International Society of Sports Nutrition Position Stand: Protein and exercise. J. Int. Soc. Sports Nutr. 2017;14:20. doi: 10.1186/s12970-017-0177-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Wolfe R.R. Branched-chain amino acids and muscle protein synthesis in humans: Myth or reality? J. Int. Soc. Sports Nutr. 2017;14:30. doi: 10.1186/s12970-017-0184-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Doma K., Singh U., Boullosa D., Connor J.D. The effect of branched-chain amino acid on muscle damage markers and performance following strenuous exercise: A systematic review and meta-analysis. Appl. Physiol. Nutr. Metab. 2021;46:1303–1313. doi: 10.1139/apnm-2021-0110. [PubMed] [CrossRef] [Google Scholar]
- Hormoznejad R., Zare A.J., Mansoori A. Effect of BCAA supplementation on central fatigue, energy metabolism substrate and muscle damage to the exercise: A systematic review with meta-analysis. Sport Sci. Health. 2019;15:265–279. doi: 10.1007/s11332-019-00542-4. [CrossRef] [Google Scholar]
- Maughan R.J., Burke L.M., Dvorak J., Larson-Meyer D.E., Peeling P., Phillips S.M., Rawson E.S., Walsh N.P., Garthe I., Geyer H., et al. IOC consensus statement: Dietary supplements and the high-performance athlete. Br. J. Sports Med. 2018;52:439–455. doi: 10.1136/bjsports-2018-099027. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Wilkinson D.J., Hossain T., Hill D.S., Phillips B.E., Crossland H., Williams J., Loughna P., Churchward-Venne T.A., Breen L., Phillips S.M., et al. Effects of leucine and its metabolite β-hydroxy-β-methylbutyrate on human skeletal muscle protein metabolism. J. Physiol. 2013;591:2911–2923. doi: 10.1113/jphysiol.2013.253203. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Areces F., Salinero J.J., Abian-Vicen J., González-Millán C., Gallo-Salazar C., Ruiz-Vicente D., Lara B., Del Coso J. A 7-day oral supplementation with branched-chain amino acids was ineffective to prevent muscle damage during a marathon. Amino Acids. 2014;46:1169–1176. doi: 10.1007/s00726-014-1677-3. [PubMed] [CrossRef] [Google Scholar]
- Dudgeon W.D., Kelley E.P., Scheett T.P. In a single-blind, matched group design: Branched-chain amino acid supplementation and resistance training maintains lean body mass during a caloric restricted diet. J. Int. Soc. Sports Nutr. 2016;13:1. doi: 10.1186/s12970-015-0112-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Kephart W.C., Wachs T.D., Thompson R.M., Brooks Mobley C., Fox C.D., McDonald J.R., Ferguson B.S., Young K.C., Nie B., Martin J.S., et al. Ten weeks of branched-chain amino acid supplementation improves select performance and immunological variables in trained cyclists. Amino Acids. 2016;48:779–789. doi: 10.1007/s00726-015-2125-8. [PubMed] [CrossRef] [Google Scholar]
- Moberg M., Apró W., Ekblom B., van Hall G., Holmberg H.C., Blomstrand E. Activation of mTORC1 by leucine is potentiated by branched-chain amino acids and even more so by essential amino acids following resistance exercise. Am. J. Physiol. Cell Physiol. 2016;310:C874–C884. doi: 10.1152/ajpcell.00374.2015. [PubMed] [CrossRef] [Google Scholar]
- Samuelsson H., Moberg M., Apró W., Ekblom B., Blomstrand E. Intake of branched-chain or essential amino acids attenuates the elevation in muscle levels of PGC-1α4 mRNA caused by resistance exercise. Am. J. Physiol. Endocrinol. Metab. 2016;311:E246–E251. doi: 10.1152/ajpendo.00154.2016. [PubMed] [CrossRef] [Google Scholar]
- Smith J.W., Krings B.M., Shepherd B.D., Waldman H.S., Basham S.A., McAllister M.J. Effects of carbohydrate and branched-chain amino acid beverage ingestion during acute upper body resistance exercise on performance and postexercise hormone response. Appl. Physiol. Nutr. Metab. 2018;43:504–509. doi: 10.1139/apnm-2017-0563. [PubMed] [CrossRef] [Google Scholar]
- Martín-Martínez J.P., Calleja Gonzalez J., Adsuar Sala J.C., Gómez-Pomares S., Carlos-Vivas J., Pérez-Gómez J. Short-term branched-chain amino acid supplementation does not enhance vertical jump in professional volleyball players. A double-blind, controlled, randomized study. Nutr. Hosp. 2020;37:1007–1011. [PubMed] [Google Scholar]
- Pancar S. The effect of Branched Chain Amino Acids Intake Before and after Exercise on Physical Performance and Recovery. Ambient. Sci. 2020;7:243–246. doi: 10.21276/ambi.2020.07.sp1.oa
- [CrossRef] [Google Scholar]33. Mor A., Acar K., Yilmaz A.K., Arslanoglu E. The effects of BCAA and creatine supplementation on anaerobic capacity and ball kicking speed in male football players. J. Mens Health. 2022;18:5. [Google Scholar]34. Koba T., Hamada K., Samurai M., Matsumoto K., Higuchi T., Zhao M., Miyata H. Effect of A Branched-chain Amino Acids Supplementation on Muscle Soreness during Intensive Training Program: 229: Board# 136: 11:00 AM–12:30 PM. Med. Sci. Sports Exerc. 2005;37:S43. [Google Scholar]
- Gee T.I., Deniel S. Branched-chain aminoacid supplementation attenuates a decrease in power-producing ability following acute strength training. J. Sports Med. Phys. Fit. 2016;56:1511–1517. [PubMed] [Google Scholar]
- Waldron M., Whelan K., Jeffries O., Burt D., Howe L., Patterson S.D. The effects of acute branched-chain amino acid supplementation on recovery from a single bout of hypertrophy exercise in resistance-trained athletes. Appl. Physiol. Nutr. Metab. 2017;42:630–636. doi: 10.1139/apnm-2016-0569. [PubMed] [CrossRef] [Google Scholar]
- VanDusseldorp T.A., Escobar K.A., Johnson K.E., Stratton M.T., Moriarty T., Cole N., McCormick J.J., Kerksick C.M., Vaughan R.A., Dokladny K., et al. Effect of Branched-Chain Amino Acid Supplementation on Recovery Following Acute Eccentric Exercise. Nutrients. 2018;10:1389. doi: 10.3390/nu10101389. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Bassit R.A., Sawada L.A., Bacurau R.F., Navarro F., Martins E., Jr., Santos R.V., Caperuto E.C., Rogeri P., Costa Rosa L.F. Branched-chain amino acid supplementation and the immune response of long-distance athletes. Nutrition. 2002;18:376–379. doi: 10.1016/S0899-9007(02)00753-0. [PubMed] [CrossRef] [Google Scholar]
- Bassit R.A., Sawada L.A., Bacurau R.F., Navarro F., Costa Rosa L.F. The effect of BCAA supplementation upon the immune response of triathletes. Med. Sci. Sports Exerc. 2000;32:1214–1219. doi: 10.1097/00005768-200007000-00005. [PubMed] [CrossRef] [Google Scholar]
- Nemet D., Wolach B., Eliakim A. Proteins and amino acid supplementation in sports: Are they truly necessary? Isr. Med. Assoc. J. 2005;7:328–332. [PubMed] [Google Scholar]
- Vahid I., Abdolali B., Fatemeh M., Alireza N., Mehdi S. The effects of branch-chain amino acids on fatigue in the athletes. Interv. Med. Appl. Sci. 2018;10:233–235. doi: 10.1556/1646.10.2018.10. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Lysenko E.A., Vepkhvadze T.F., Lednev E.M., Vinogradova O.L., Popov D.V. Branched-chain amino acids administration suppresses endurance exercise-related activation of ubiquitin proteasome signaling in trained human skeletal muscle. J. Physiol. Sci. 2018;68:43–53. doi: 10.1007/s12576-016-0506-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Goldberg A.L., Chang T.W. Regulation and significance of amino acid metabolism in skeletal muscle. Fed. Proc. 1978;37:2301–2307. [PubMed] [Google Scholar]
- Stipanuk M.H., Claudill M.A. Biochemical, Physiological, and Molecular Aspects of Human Nutrition. Saunders; St. Louis, MO, USA: 2013. [Google Scholar]
- Volpi E, Kobayashi H, Sheffield-Moore M, Mittendorfer B, Wolfe RR. Essential amino acids are primarily responsible for the amino acid stimulation of muscle protein anabolism in healthy elderly adults. Am J Clin Nutr. 2003;78:250–258. [PMC free article] [PubMed] [Google Scholar]
- Cahill GF, Jr, Aoki TT. Starvation and body nitrogen. Trans Am Clin Climatol Assoc. 1971;82:43–51. [PMC free article] [PubMed] [Google Scholar]
- Wolfe RR. The underappreciated role of muscle in health and disease. Am J Clin Nutr. 2006;84(3):475–482. [PubMed] [Google Scholar]
- Biolo G, Gastaldelli A, Zhang X-J, Wolfe RR. Protein synthesis and breakdown in skin and muscle: a leg model of amino acid kinetics. Am J Physiol Endocrinol Metab. 1994;30:E467–E474. [PubMed] [Google Scholar]
- Smith GI, Patterson BW, Mittendorfer B. Human muscle protein turnover-why is it so variable? J Appl Physiol. 1985;110:480–491. doi: 10.1152/japplphysiol.00125.2010. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Rasmussen BB, Wolfe RR, Volpi E. Oral and intravenously administered amino acids produce similar effects on muscle protein synthesis in the elderly. J Nutr Health Aging. 2002;6:358–362. [PMC free article] [PubMed] [Google Scholar]
- Louard RJ, Barrett EJ, Gelfand RA. Effect of infused branched-chain amino acids on muscle and whole body amino acid metabolism in man. Clin Sci. 1990;79:457–466. doi: 10.1042/cs0790457. [PubMed] [CrossRef] [Google Scholar]
- Louad RJ, Barrett EJ, Gelfand RA. Overnight branched-chain amino acid infusion causes sustained suppression of muscle proteolysis. Metabolism. 1995;44:424–429. doi: 10.1016/0026-0495(95)90047-0. [PubMed] [CrossRef] [Google Scholar]
- Matthews DE. Observations of branched-chain amino acid administration in humans. J Nutr. 2005;135:1580S–1584S. [PMC free article] [PubMed] [Google Scholar]
- Fitts RH, Ramatowski JG, Peters JR, Paddon-Jones D, Wolfe RR, Ferrando AA. The deleterious effects of bed rest on human skeletal muscle fibers are exacerbated by hypercortisolemia and ameliorated by dietary supplementation. Am J Physiol Cell Physiol. 2007;293:C313–C320. doi: 10.1152/ajpcell.00573.2006. [PubMed] [CrossRef] [Google Scholar]
- Balagopal P, Rooyackers OE, Adey DB, Ades PA, Nair KS. Effects of aging on in vivo synthesis of skeletal muscle myosin heavy-chain and sarcoplasmic protein in humans. Am J Phys. 1997;273:E790–E800. [PubMed] [Google Scholar]
- Paddon-Jones D, Sheffield-Moore M, Urban RJ, Aarsland A, Wolfe RR, Ferrando AA. The catabolic effects of prolonged inactivity and acute hypercortisolemia are offset by dietary supplementation. J Clin Endocrinol Metab. 2005;90(3):1453–1459. doi: 10.1210/jc.2004-1702. [PubMed] [CrossRef] [Google Scholar]
- Blomstrand E, Eliasson J, Karlsson HKR, Kohnke R. Branched-chain amino acids activate key enzymes in protein synthesis after physical exercise. J Nutr. 2006;136:269S–273S. [PubMed] [Google Scholar]
- Greenhaff PL, Karagounis LG, Peirce N, Simpson EJ, Hazell M, Layfield R, Wackerhage H, Smith K, Atherton P, Selby A, Rennie MJ. Disassociation between the effects of amino acids and insulin on signaling, ubiquitin ligases, and protein turnover in muscle. Am J Physiol Endocrinol Metab. 2008;295:E 590–E 597. doi: 10.1152/ajpendo.90411.2008. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Bukari SS, Phillips BE, Wilinson DJ, Limb MC, Rankin D, Mitchell WK, Kobayashi H, Greenhaff PL, Smith K, Atherton PJ. Intake of low-dose leucine-rich essential amino acids stimulates muscle anabolism equivalently to bolus whey protein in older women at rest and after exercise. Am J Phys. 2015;308:E1056–E1065. [PubMed] [Google Scholar]
- Churchward-Venne TA, Breen L, Di Donato DM, Hector AJ, Mitchell CJ, Moore DR, Stellingwerff T, Breuille D, Offord EA, Baker SK, Phillips SM. Leucine supplementation of a low-protein mixed macronutrient beverage enhances myofibrillar protein synthesis in young men: a double blind, randomized trial. Am J Clin Nutr. 2014;99:276–286. doi: 10.3945/ajcn.113.068775. [PubMed] [CrossRef] [Google Scholar]
- Wilinson DJ, Hossain T, Hill DS, Phillips BE, Crossland H, Williams J, Loughna P, Chruchward-Venne TA, Breen L, Phillips SM, Etheridge T, Rathmacher JA, Smith K, Szewczk NJ, Atherton PJ. Effects of leucine and its metabolite β-hydroxy-β-methlybutryate on human skeletal muscle protein metabolism. J Physiol. 2013;591:2911–2923. doi: 10.1113/jphysiol.2013.253203. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Van Loon LJ. Leucine as a pharmaconutrient in health and disease. Curr Opin Clin Nutr Metab Care. 2012;15:71–77. doi: 10.1097/MCO.0b013e32834d617a. [PubMed] [CrossRef] [Google Scholar]
- Ferrando AA, Williams BD, Stuart CA, Lane HW, Wolfe RR. Oral branched chain amino acids decrease whole-body proteolysis. JPEN. 1995;19:47–54. doi: 10.1177/014860719501900147. [PubMed] [CrossRef] [Google Scholar]
- Louard RJ, Barrett EJ, Gelfand RA. Effect of infused branched-chain amino acids on muscle and whole body amino acid metabolism in man. Clin Sci. 1990;79:457–466. doi: 10.1042/cs0790457. [PubMed] [CrossRef] [Google Scholar]
- Louad RJ, Barrett EJ, Gelfand RA. Overnight branched-chain amino acid infusion causes sustained suppression of muscle proteolysis. Metabolism. 1995;44:424–429. doi: 10.1016/0026-0495(95)90047-0. [PubMed] [CrossRef] [Google Scholar]
