Introduzione:
Le ricerche che vanno dalla seconda parte del XX secolo a oggi hanno dimostrato che l’allenamento contro-resistenza aumenta la crescita delle fibre muscolari scheletriche radiali (o trasversali) (rivisto in Folland e Williams, 2007; Walker et al., 2011; Haun et al., 2019c). Tuttavia, si conoscono meno gli adattamenti morfologici che si verificano nelle fibre muscolari in seguito a interventi di allenamento contro-resistenza. E’ stato recentemente ipotizzato che un allenamento contro-resistenza a volume più elevato possa facilitare la crescita delle fibre attraverso un aumento sproporzionato del volume del sarcoplasma rispetto all’accrescimento delle proteine della miofibrilla (Haun et al., 2019b; Vann et al., 2020b). L’ipertrofia sarcoplasmatica è stata una descrizione corrente di questo fenomeno e questo termine verrà utilizzato in questa sede. Non sono il primo a suggerire che l’ipertrofia sarcoplasmatica si verifichi in risposta all’allenamento contro-resistenza, e gli studi citati più avanti in questo articolo hanno sostenuto questo meccanismo. Tuttavia, è generalmente accettato dalla comunità scientifica che l’ipertrofia convenzionale si verifica in risposta all’allenamento contro-resistenza; in particolare, le fibre muscolari subiscono una crescita radiale indotta dall’allenamento attraverso un accrescimento proporzionale di proteine miofibrillari e di spazio nel sarcoplasma. In base a questo presupposto, se un individuo presenta un aumento del 20% dell’area trasversale media delle fibre (fCSA) e supponendo che le miofibrille costituiscano il ∼85% dello spazio intracellulare, un’aggiunta del 17% di proteine miofibrillari e un aumento del 3% del volume del sarcoplasma accompagnerebbero la crescita delle fibre. Questa modalità di ipertrofia delle fibre muscolari è certamente ragionevole. Ciononostante, ad oggi esiste un solo studio sull’uomo che supporta vagamente questo meccanismo (Luthi et al., 1986), e questo studio viene discusso in modo più dettagliato più avanti nell’articolo.
Numerosi studi hanno riportato che i tassi di sintesi delle proteine miofibrillari aumentano ore dopo un allenamento in persone non allenate (reviewed in Walker et al., 2011; Haun et al., 2019c) e allenate (reviewed in Damas et al., 2015). Queste osservazioni sono state coerenti e danno certamente credito al modello convenzionale di ipertrofia discusso in precedenza. Pur essendo informativi, gli studi sui traccianti non hanno chiarito in che misura l’accumulo di proteine miofibrillari a lungo termine contribuisca all’ipertrofia delle fibre muscolari. In effetti, gli aumenti post-esercizio dei tassi di sintesi proteica miofibrillare ore dopo un allenamento non sono correlati con i risultati ipertrofici a lungo termine (reviewed in Mitchell et al., 2015). Gli studi che esaminano i tassi integrati di sintesi proteica miofibrillare a distanza di giorni o settimane dall’allenamento hanno prodotto associazioni migliori con i risultati ipertrofici (Brook et al., 2015; Damas et al., 2016a; Bell et al., 2019). Tuttavia, rimane possibile che la varianza esistente tra questi dati del tracciante e i risultati ipertrofici sia legata alla crescita di componenti non miofibrillari. Inoltre, nessuna indagine sull’uomo ha determinato se l’accrescimento proteico delle miofibrille indotto dall’allenamento avvenga attraverso l’allargamento di miofibrille preesistenti, la creazione di nuove miofibrille (cioè la miofibrillogenesi de novo) o l’allargamento delle miofibrille seguito da una scissione delle stesse per mantenere una dimensione miofibrillare conservata.Si tratta certamente di lacune nella letteratura sull’allenamento contro-resistenza. Tuttavia, piuttosto che concentrarsi su questi inconvenienti, è più utile fornire una review dettagliata e approfondita degli scenari in cui l’ipertrofia sarcoplasmatica è stata e non è stata osservata nella letteratura sull’allenamento contro-resistenza nell’uomo. Voglio anche spiegare perché questo fenomeno può verificarsi da una prospettiva teorica e meccanicistica. Infine, partendo dal presupposto che l’ipertrofia sarcoplasmatica è un adattamento all’allenamento contro-resistenza, discuterò le implicazioni più ampie di questo meccanismo.
Morfologia intracellulare delle fibre muscolari:
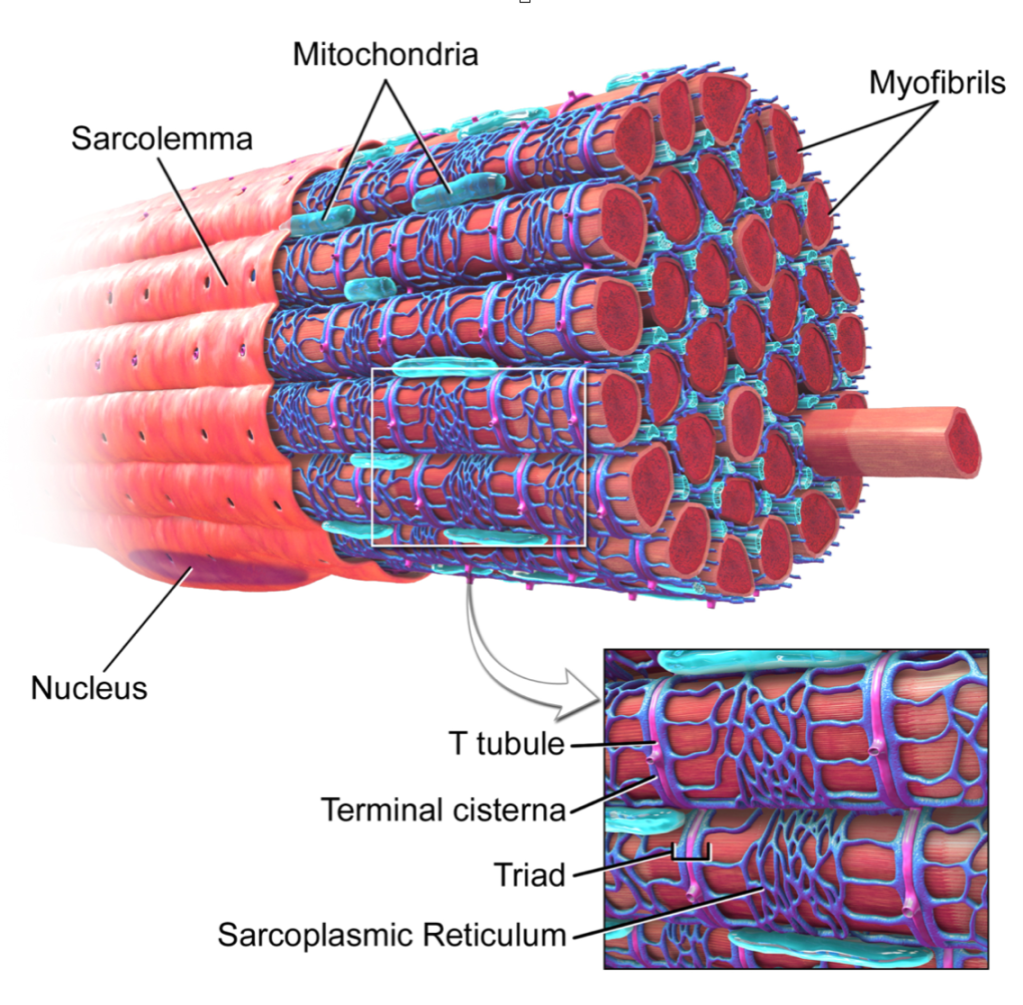
Prima di discutere le diverse modalità di ipertrofia, è fondamentale che i lettori comprendano la morfologia intracellulare delle fibre muscolari. La figura seguente illustra la sezione trasversale di una fibra muscolare come appare al microscopio elettronico a trasmissione (TEM). Da un punto di vista molecolare, le osservazioni in laboratorio hanno riportato che il tessuto muscolare è composto per il ∼75% da acqua, per il ∼10-15% da proteine miofibrillari e per il ∼5% da proteine non miofibrillari (o sarcoplasmatiche) (Vann et al., 2020b). Da un punto di vista spaziale, tuttavia, la maggior parte della fibra muscolare è occupata dalle miofibrille; secondo alcune stime, le miofibrille occupano ∼85% dello spazio intracellulare (Macdougall et al., 1982; Alway et al., 1988; Claassen et al., 1989). Le miofibrille sono costituite da varie proteine, tra cui le isoforme della catena pesante e della catena leggera della miosina, varie isoforme dell’actina, varie isoforme della troponina e della tropomiosina, proteine della linea z (ad esempio, alfa-actinina, proteina LIM specifica del muscolo, miopalladina e teletonina), proteine della linea m (ad esempio, miomesina e proteina M tra le altre) e altre proteine che servono a mantenere l’integrità strutturale delle miofibrille (ad esempio, titina e nebulina tra le altre) (Haun et al., 2019c; Vann et al., 2020b). Nel complesso, questo pool di proteine è solitamente indicato come la frazione miofibrillare del tessuto muscolare. Lo spazio tra le miofibrille è scarso (cioè, secondo le stime sopra riportate, il ∼15% dello spazio intracellulare non è occupato dalle miofibrille). Questi spazi contengono organelli e componenti cellulari, tra cui i mitocondri (probabilmente sotto forma di reticolo), il reticolo sarcoplasmatico, macromolecole (ad esempio, ribosomi, glicogeno e goccioline lipidiche) e varie proteine ed enzimi. Il TEM ha dimostrato che i mitocondri occupano il 5-6% dello spazio all’interno delle fibre muscolari, mentre il sarcoplasma ne occupa il 9% (Claassen et al., 1989). Il mezzo acquoso in cui risiedono le miofibrille e i componenti non miofibrillari è chiamato sarcoplasma. Come il citoplasma di altre cellule, il sarcoplasma è fondamentale per mantenere l’equilibrio degli ioni e del pH all’interno delle fibre muscolari. I componenti non miofibrillari delle fibre muscolari e il sarcoplasma costituiscono la cosiddetta frazione sarcoplasmatica del tessuto muscolare.

La figura qui sopra non illustra come le differenze nel tipo di fibra influenzino la morfologia cellulare. Gli studi sugli animali hanno dimostrato che le differenze principali tra le fibre a contrazione lenta (tipo I) e quelle a contrazione rapida (tipo II) sono le seguenti:
1- le fibre a contrazione lenta contengono più mitocondri (o un reticolo mitocondriale espanso) rispetto alle fibre a contrazione rapida (Schiaffino et al., 1970);
2- le fibre a contrazione rapida possiedono vescicole del reticolo sarcoplasmatico più grandi che circondano le miofibrille (Lee et al., 1991) e
3- le vescicole del reticolo sarcoplasmatico circondano le miofibrille, e i diametri delle miofibrille sembrano essere leggermente più grandi nelle fibre a contrazione rapida, sebbene i sarcomeri siano leggermente più lunghi e le linee z siano leggermente più spesse nelle fibre a contrazione lenta (Schiaffino et al., 1970).
Alcune di queste caratteristiche specifiche del tipo di fibra sono state evidenziate anche nel muscolo scheletrico umano con metodi TEM (Alway et al., 1988). La figura seguente è un’immagine TEM che mostra visivamente alcune di queste differenze specifiche del tipo di fibra.
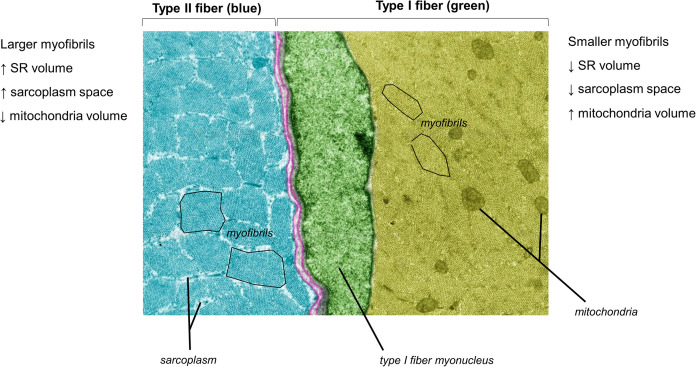
Immagine TEM pseudocolorata in sezione trasversale di un ratto Wistar (8.000×) che mostra le differenze morfologiche tra i diversi tipi di fibre muscolari. L’immagine è stata concessa in licenza da sciencesource.com (per gentile concessione di Jose Luis Calvo) dagli autori per scopi di pubblicazione scientifica.
Anche il sarcolemma, o membrana cellulare di una fibra muscolare, è un importante argomento di discussione. Il sarcolemma contiene varie proteine, tra cui recettori e trasportatori legati alla membrana. Il sarcolemma contiene anche proteine transmembrana e queste proteine formano complessi che collegano proteine citoscheletriche intracellulari a proteine che risiedono nella matrice extracellulare (Henderson et al., 2017). Dati recenti proteomici indicano che alcune proteine associate al sarcolemma sono arricchite nella frazione miofibrillare (ad esempio, la distrofina), mentre altre sono arricchite nella frazione sarcoplasmatica (ad esempio, la vinculina) (Vann et al., 2020b). Il processo di omogeneizzazione del tessuto porta probabilmente a questa compartimentazione differenziale delle proteine associate al sarcolemma. In particolare, sebbene queste proteine siano arricchite in una o in entrambe le frazioni, non rientrano tecnicamente in nessuna delle due classificazioni. Questo argomento verrà rivisto più avanti.
Metodi utilizzati per valutare l’ipertrofia sarcoplasmatica:
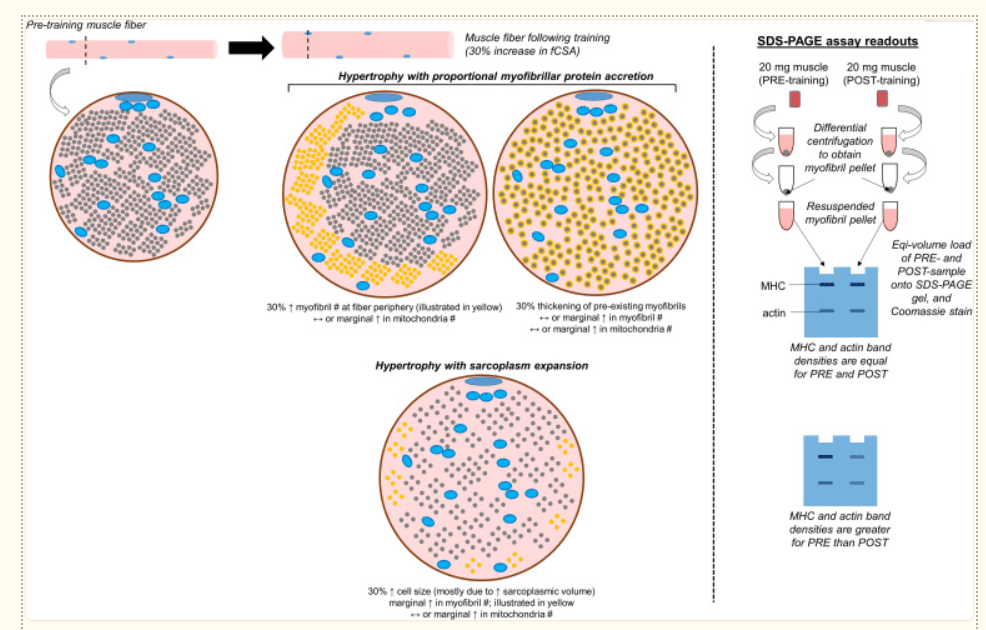
Esistono quattro metodi pubblicati che sono stati utilizzati per segnalare che l’ipertrofia sarcoplasmatica può verificarsi in risposta all’allenamento di resistenza. Tre di questi metodi includono la TEM, la colorazione con falloidina e la colorazione SDS-PAGE e Coomassie. Anche la valutazione della tensione specifica nelle fibre muscolari isolate (o spellate) può fornire una prova indiretta dell’ipertrofia sarcoplasmatica. Di seguito vengono illustrati i meccanismi, i vantaggi e gli svantaggi di ciascun metodo.
- TEM
Questo metodo prevede di sottoporre un piccolo pezzo di tessuto muscolare (∼1-2 mg) a lunghe fasi di fissazione e disidratazione, seguite da un’inclusione in resina. Vengono quindi generate sezioni di spessore nanometrico con l’ausilio di un ultramicrotomo; queste sezioni vengono posizionate su piccole griglie e trattate chimicamente con acetato di uranile e citrato di piombo per generare contrasto tra le strutture cellulari. Le griglie contenenti una o più sezioni possono quindi essere visualizzate in un TEM. Supponendo che questi metodi siano eseguiti correttamente, le immagini ottenute da questa tecnica forniscono miofibrille con una buona risoluzione a ingrandimenti di 1.000-20.000×. I ricercatori possono quindi utilizzare un software di analisi delle immagini manuale o automatico per dimensionare le miofibrille, i mitocondri e il vuoto spaziale che esiste tra queste strutture (cioè il sarcoplasma). I filamenti di miosina e di actina possono anche essere fotografati a ingrandimenti di ∼40.000× per esaminare la spaziatura e le proprietà reticolari. Uno dei principali svantaggi della TEM è che la tecnica fornisce solo un’immagine bidimensionale per una porzione di una o due fibre muscolari. Sebbene sia possibile acquisire più immagini casuali su più fibre muscolari per ottenere una rappresentazione più olistica del tessuto, l’ottenimento di 20 immagini per soggetto fornirebbe (nella migliore delle ipotesi) solo dati relativi a porzioni di 20-40 cellule. Un secondo limite della TEM è che i metodi di fissazione, disidratazione, inclusione, colorazione e ultramicrotomo richiedono giorni di lavoro in laboratorio. Questo non solo è problematico dal punto di vista della produttività, ma l’elevato numero di passaggi potrebbe alterare artificialmente la spaziatura miofibrillare, confondendo le misure del volume sarcoplasmatico. A questo proposito, sono stati segnalati artefatti TEM (ad esempio, spaziatura delle strutture cellulari o contrazione degli organelli) dovuti a errori di elaborazione (Mollenhauer, 1993), e questi fenomeni possono portare a conclusioni errate sulle proprietà cellulari. Infine, i dispositivi GST sono raramente presenti nei laboratori di fisiologia dell’esercizio, dati i costi e le competenze necessarie per il funzionamento e la manutenzione delle apparecchiature.
- Colorazione con falloidina
Si tratta di un metodo istologico in cui una soluzione di colorazione contenente un fluoroforo coniugato alla falloidina (ad esempio, Alexa Fluor 488 Phalloidin; Thermo Fisher, Waltham, MA, Stati Uniti) viene applicata a sezioni muscolari aderenti a vetrini da microscopio. Le proprietà chimiche della falloidina le consentono di legarsi con elevata specificità ai polimeri di actina; pertanto, un punto di forza della tecnica è la specificità della colorazione. L’abbondanza relativa di actina nelle sezioni trasversali di muscolo incubate con Alexa Fluor 488 Falloidina può essere ottenuta in ∼20-30 fibre intere con una semplice microscopia a fluorescenza con un ingrandimento di 200×. Se si ottengono più immagini di una sezione in diverse regioni del tessuto, si possono interrogare ∼50-100 fibre. Con un software di conteggio automatico dei pixel, è possibile fornire un conteggio imparziale dei pixel verdi all’interno dei bordi colorati di distrofina per ricavare l’abbondanza relativa di actina per miofibra. Oltre all’elevata specificità di legame della falloidina all’actina, un altro punto di forza della tecnica è il campionamento di un maggior numero di fibre intere rispetto all’imaging TEM. Anche le fasi di lavorazione del tessuto sono meno laboriose rispetto alla preparazione TEM. Come la TEM, tuttavia, anche questa tecnica è limitata a un’immagine bidimensionale. Un’altra limitazione è che nelle fibre muscolari sono presenti proteine di actina non contrattili che fungono da impalcatura (Stromer, 1998). Anche se queste proteine probabilmente non costituiscono gran parte della frazione proteica sarcoplasmatica, è probabile che la falloidina si leghi a queste proteine e generi segnale dal materiale non contrattile. Per eseguire con successo questa tecnica è necessaria anche un’adeguata conservazione dei tessuti mediante congelamento lento in mezzi a temperatura di taglio ottimale. Un congelamento improprio potrebbe portare a un artefatto comunemente osservato di grandi strutture simili a vacuoli, che potrebbero essere erroneamente interpretate come spazio non occupato dalle miofibrille (Meng et al., 2014). Per ulteriori dettagli su questo metodo, il lettore può fare riferimento al nostro lavoro passato (Haun et al., 2019b). Inoltre, Gokhin et al. (2008) hanno utilizzato questo metodo per quantificare le quantità relative di materiale contrattile per fibra muscolare nei roditori in crescita.
- Elettroforesi su gel di sodio dodecil solfato-poliacrilammide (SDS-PAGE) con colorazione Coomassie
Si tratta di una tecnica non istologica che consente di determinare le abbondanze relative delle isoforme proteiche della catena pesante della miosina, dell’actina, della tropomiosina, della troponina e della catena leggera della miosina per milligrammo di tessuto muscolare umido o secco. Poiché abbiamo eseguito diverse iterazioni di questo saggio (Roberts et al., 2018; Haun et al., 2019b; Vann et al., 2020b), forniremo una descrizione più approfondita di questa tecnica rispetto ad altre. Nella Figura 3 è riportato anche uno schema che mostra come vengono interpretati i risultati del saggio. Va notato che anche altri ricercatori hanno eseguito questa tecnica per quantificare la quantità relativa di proteine contrattili per unità di tessuto in varie specie (Yamada et al., 1997; Thys et al., 2001; Wilkens et al., 2008). Una volta ottenuta la biopsia muscolare, il tessuto viene avvolto in una pellicola pre-etichettata, congelato in azoto liquido e trasportato a -80°C per la conservazione a lungo termine. Dato che il tessuto è congelato allo stato nativo e che le fibre muscolari contengono ∼75% di acqua, come già detto, si parla comunemente di tessuto umido. Durante il giorno della sperimentazione, il tessuto viene rimosso da -80°C e posto su un mortaio raffreddato ad azoto liquido (LN2). Il tessuto viene quindi polverizzato con un pestello raffreddato a LN2 e una frazione del tessuto (∼20 mg) viene posta in una provetta da 1,7 mL prepesata contenente un tampone a base di Tris con Triton-X 100 allo 0,5% e inibitori delle proteasi (denominato tampone 1). Questi dettagli sono fondamentali, poiché questo primo tampone contiene il detergente Triton-X, che è in grado di lisare le membrane cellulari senza solubilizzare le miofibrille. Questo tampone può anche essere uno dei motivi per cui alcune proteine del sarcolemma sono arricchite nella frazione proteica sarcoplasmatica, come indicato in precedenza nella recensione. Le provette vengono quindi ripesate per ottenere un peso muscolare umido basato sulla differenza di peso tra la provetta prima e dopo l’aggiunta di tessuto. La provetta contenente il tampone 1 e il tessuto viene quindi rimossa dalla bilancia analitica, polverizzata con pestelli a tenuta fino alla formazione di un impasto, quindi le provette vengono tappate e centrifugate. Dopo la centrifugazione, rimangono un surnatante liquido e un pellet. Il surnatante contiene principalmente il tampone 1 e i costituenti del sarcoplasma (ad esempio, proteine sarcoplasmatiche e mitocondriali). Il pellet contiene soprattutto proteine miofibrillari, dato che non sono state solubilizzate. Tuttavia, abbiamo rilevato anche alcune proteine istoniche nella frazione pellettata con la proteomica (Vann et al., 2020b). Sebbene la presenza di queste proteine nucleari sia minima rispetto ad altre proteine contrattili (ad esempio, la catena pesante della miosina, la titina, la nebulina e altre), questi dati suggeriscono che i nuclei vengono probabilmente eliminati durante la prima fase di centrifugazione. Circa il 90% del surnatante viene rimosso con una pipetta, il surnatante viene posto in una nuova provetta da 1,7 mL e questa provetta contenente la frazione sarcoplasmatica viene conservata a -80°C per le analisi successive. Alla provetta originale da 1,7 mL contenente il pellet di proteine miofibrillari viene aggiunto altro tampone 1 e il pellet viene risospeso per lavarlo. Lo slurry ottenuto viene centrifugato e il surnatante risultante viene scartato dopo la centrifugazione. Il pellet di miofibrille può essere asciugato all’aria con ghiaccio e poi risospeso in quello che abbiamo chiamato tampone 2, un tampone a base di Tris contenente inibitori delle proteasi, cloruro di potassio, glicerolo e spermidina. In particolare, tutti questi additivi favoriscono la solubilizzazione del pellet di miofibrille. Una volta risospese le miofibrille, un volume prestabilito della risospensione (ad esempio, 10 μL) può essere preparato con tampone riducente e sottoposto a SDS-PAGE. Il gel può quindi essere colorato con Coomassie, la densità delle bande prominenti esistenti a ∼220 kD (catena pesante di miosina) e 43 kD (actina) può essere quantificata e le densità delle bande possono essere divise per il peso del muscolo per ottenere le quantità relative di catena pesante di miosina e actina. In relazione alle limitazioni discusse con il TEM e l’istologia, l’uso di questo metodo presenta dei vantaggi. In primo luogo, viene campionata una quantità maggiore di muscolo rispetto alla TEM o alla colorazione con falloidina, e questo vantaggio offre una maggiore sicurezza nelle conclusioni sullo stato fisiologico del tessuto. In secondo luogo, la determinazione dell’abbondanza relativa (o delle concentrazioni) delle due principali proteine contrattili consente di estrapolare le proprietà tridimensionali del tessuto. In alternativa, se le abbondanze relative della catena pesante della miosina e dell’actina diminuiscono con un concomitante aumento dell’area del tessuto o della fCSA durante l’allenamento di resistenza, questo risultato potrebbe riflettere un aumento del volume del sarcoplasma in centinaia di fibre muscolari. In terzo luogo, abbiamo dimostrato che questa tecnica presenta una buona riproducibilità e sensibilità (Roberts et al., 2018). Tuttavia, come nel caso del Western blotting, una limitazione importante del metodo è che fornisce dati su lisati grezzi. A questo proposito, l’osservazione di diminuzioni indotte dall’allenamento nelle abbondanze relative della catena pesante della miosina e dell’actina può indicare la presenza di edema localizzato (piuttosto che di ipertrofia sarcoplasmatica). Allo stesso modo, questo metodo genera una classificazione binaria delle proteine come miofibrillari o sarcoplasmatiche. In effetti, i nostri dati di proteomica hanno dimostrato che la maggior parte delle proteine miofibrillari ottenute con questo metodo sono proteine contrattili o altre proteine associate alle miofibrille, mentre la maggior parte delle proteine sarcoplasmatiche ottenute sono enzimi che risiedono nel sarcoplasma (Vann et al., 2020b). Tuttavia, in ogni frazione si trovano tracce di proteine che potrebbero essere considerate contaminanti. Come già detto, sono state identificate proteine nucleari nella frazione miofibrillare e proteine del sarcolemma sono state trovate in entrambe le frazioni. Abbiamo anche rilevato tracce di isoforme di laminina e collagene nella frazione miofibrillare. Anche se non è una limitazione, il ricercatore deve assicurarsi che il tessuto muscolare sia visibilmente privo di sangue, grasso e tessuto connettivo subito dopo la biopsia e prima del congelamento istantaneo. A questo proposito, il tessuto congelato con sangue residuo aumenterà artificialmente il peso del muscolo umido e questo errore tecnico porterà alla falsa conclusione che le abbondanze relative delle proteine contrattili sono inferiori rispetto ai campioni di tessuto visibilmente privi di sangue. Infine, la sospensione delle miofibrille nel tampone 2 (descritto sopra) rappresenta una sfida tecnica. Sebbene i ricercatori abbiano sviluppato una tecnica che solubilizza le miofibrille (Roberts et al., 2020), gli altri ricercatori interessati all’utilizzo di questa tecnica dovrebbero eseguire un’ampia sperimentazione per garantire che la solubilizzazione sia ottimizzata prima di aumentare la scala della sperimentazione.
- Valutazione della tensione specifica nelle singole fibre muscolari
Questa tecnica viene eseguita utilizzando un trasduttore di forza specializzato e può fornire una valutazione indiretta del materiale contrattile per sezione trasversale di fibra muscolare (D’antona et al., 2007; Degens et al., 2010; Meijer et al., 2015). I lettori interessati a osservare questa tecnica possono fare riferimento a un eccellente articolo sui metodi visivi di Roche et al. (2015), nonché a una revisione completa sull’argomento di Canepari et al. (2010). Questo metodo prevede innanzitutto l’ottenimento di una biopsia, la crioconservazione del tessuto e il suo congelamento fino al giorno della sperimentazione. Il giorno della sperimentazione, il tessuto viene scongelato e permeabilizzato in una soluzione contenente Triton X-100. Il tessuto viene quindi posto in una soluzione rilassante, le singole fibre vengono sezionate (o spellate) e una fibra viene sospesa da un capo all’altro a perni opposti con suture di nylon che si interfacciano con un trasduttore di forza. La tensione della fibra viene regolata nella soluzione rilassante al microscopio per ottenere una lunghezza ottimale del sarcomero (∼2,6 μm). A questo punto, è possibile ottenere i diametri delle fibre per estrapolare i valori di fCSA, presumendo che le fibre scorticate adottino una sezione trasversale circolare. Le fibre vengono quindi trasferite in una soluzione fisiologica di “attivazione” (pH 7,0) contenente calcio, ATP e altri componenti. La forza isometrica sviluppata dalla fibra viene quindi monitorata fino al raggiungimento di un plateau; questo valore può essere diviso per fCSA per ottenere la tensione normalizzata per l’area della fibra (cioè la tensione specifica). Come ulteriore passo, i ricercatori possono determinare il tipo di fibra rimuovendo la fibra dall’apparato del trasduttore di forza, omogeneizzandola in tamponi specifici, eseguendo SDS-PAGE con colorazione Coomassie o argento e osservando il modello di banding dell’isotipo della catena pesante della miosina. Se si esegue questa tecnica con due fibre che presentano diametri simili, si può ragionevolmente concludere che la fibra che presenta un valore di tensione specifica inferiore possiede meno miofibrille in sezione trasversale. Il punto di forza della tecnica sono i dati funzionali acquisiti su fibre ex vivo. Per fare un esempio contestuale, può essere impegnativo disgiungere il ruolo che gli adattamenti neurali svolgono nel processo di adattamento quando un individuo presenta un aumento della forza e dell’ipertrofia muscolare durante un periodo di allenamento alla resistenza. A tal fine, le interrogazioni di singole fibre possono fornire prove più chiare per stabilire se l’ipertrofia delle fibre muscolari e, più specificamente, l’accumulo di proteine miofibrillari possano aver contribuito all’aumento della forza. Un limite di questa tecnica è che vengono analizzati solo segmenti di singole fibre piuttosto che fibre di lunghezza intera. Un’altra limitazione è che la permeabilizzazione altera le caratteristiche intrinseche delle fibre, come la sensibilità al calcio e l’equilibrio osmotico, e le fibre si espandono artificialmente a causa di questi cambiamenti, come evidenziato dai valori di fCSA sensibilmente più grandi rispetto ai valori di fCSA ottenuti tramite istologia. Una terza e significativa limitazione di questa tecnica è rappresentata dalle delicate e lunghe fasi di microdissezione e dalla delicatezza dell’interfacciamento delle fibre con il trasduttore di forza. A causa del lavoro richiesto per eseguire questa tecnica, è comune che vengano analizzate meno di 10 fibre per soggetto (Meijer et al., 2015). Infine, come nel caso della TEM, questa tecnica non viene eseguita su larga scala a causa delle attrezzature specializzate e delle competenze necessarie.
In particolare, tutti i metodi discussi in precedenza richiedono l’ottenimento di biopsie di muscolo scheletrico da partecipanti umani che, di per sé, possono rappresentare una limitazione per molti laboratori. Il campionamento bioptico del muscolo vasto laterale è inoltre limitato da una bassa resa di tessuto (∼100 mg) rispetto alle dimensioni del muscolo. A questo proposito, le analisi su cadavere mostrano che la massa dell’intero muscolo vasto laterale è in media di ∼375 g negli esseri umani di età superiore a 80 anni (Ward et al., 2009), e queste masse probabilmente superano in media i 500 g nei partecipanti più giovani e sani. Di conseguenza, una biopsia preleverebbe solo 1/2500 di un muscolo quadricipite. Questa cifra diventa più misera se si considera che la TEM interroga 1-2 mg di tessuto, gli studi sulle fibre scorticate interrogano ∼10 delle centinaia di migliaia di fibre del muscolo vasto laterale, gli studi istologici esaminano decine di fibre e gli studi biochimici interrogano 20-30 mg di tessuto. Un’altra limitazione della tecnica bioptica è che presumibilmente lo stesso fascio di fibre non viene campionato quando si esegue il metodo nei momenti precedenti e successivi all’intervento. Il lettore non esperto deve essere consapevole di queste limitazioni per apprezzare meglio le argomentazioni presentate in questa revisione.
Prove nell’uomo a sostegno dell’ipertrofia sarcoplasmatica indotta dall’allenamento contro-resistenza:
Macdougall et al. (1982) hanno pubblicato il primo studio sull’uomo che fornisce buone prove per suggerire che l’ipertrofia sarcoplasmatica può contribuire in modo significativo all’ipertrofia delle fibre muscolari. Circa un secolo prima, Morpurgo riportò i risultati del primo studio sull’ipertrofia indotta dall’allenamento in un modello animale; l’autore riteneva che l’aumento delle dimensioni delle fibre fosse principalmente legato all’espansione dei componenti non miofibrillari (Morpurgo, 1897). Un precedente rapporto di potenziale ipertrofia sarcoplasmatica con l’allenamento contro-resistenza è stato riportato anche da Penman, che ha utilizzato metodi TEM (Penman, 1969). Tuttavia, lo studio di Morpurgo riguardava animali allenati al tapis roulant, mentre lo studio di Penman era limitato a 2-3 partecipanti, il che precludeva valutazioni statistiche formali. Macdougall et al. (1982) hanno esaminato cinque partecipanti che si sono impegnati in 6 mesi di allenamento contro-resistenza della parte superiore del braccio. Sono state ottenute biopsie del muscolo tricipite prima e dopo l’intervento di allenamento. I campioni di muscolo sono stati analizzati per la morfologia con metodi TEM. I valori di fCSA di tipo II sono aumentati in seguito all’allenamento e gli autori hanno inoltre osservato una diminuzione del ∼3% dello spazio bidimensionale occupato dalle miofibrille (p < 0,05) e un aumento del ∼15% dello spazio occupato dal sarcoplasma (p < 0,05). Più convincenti sono i dati riportati nello stesso articolo relativi a sette partecipanti che avevano anni di esperienza nell’allenamento contro-resistenza. Questi individui possedevano fibre muscolari di tipo II più grandi rispetto ai partecipanti non allenati prima dell’intervento di allenamento di 6 mesi, ma mostravano valori inferiori del 30% nello spazio occupato dalle miofibrille e valori due volte superiori nello spazio occupato dal sarcoplasma. Toth et al. (2012) hanno utilizzato la TEM per riferire che 18 settimane di allenamento contro-resistenza hanno ridotto lo spazio occupato dalle miofibrille del ∼15% nelle fibre muscolari del vasto laterale di individui sani. Meijer et al. (2015) hanno successivamente utilizzato tecniche di isolamento delle fibre e hanno riportato che i body-builder, che possedevano fibre muscolari del vasto laterale di grandi dimensioni, presentavano valori di tensione specifica inferiori del ∼40% rispetto ai partecipanti non allenati. Un gruppo di ricerca ha utilizzato la SDS-PAGE e la colorazione Coomassie per determinare che 6 settimane di allenamento contro-resistenza ad alto volume hanno ridotto le abbondanze relative (per milligrammo di tessuto secco) della catena pesante della miosina e dell’actina del ∼30% nel muscolo vasto laterale di 15 partecipanti ben allenati (Haun et al., 2019b). La colorazione con falloidina è stata utilizzata anche per mostrare che la densità della proteina actina per fibra è diminuita in questi partecipanti da prima a dopo l’intervento. Questo studio è stato limitato dal fatto che la biopsia post-allenamento è stata raccolta dopo solo 24 ore di recupero dall’ultimo allenamento. Tuttavia, otto di questi partecipanti hanno effettuato una terza biopsia 8 giorni dopo l’ultimo allenamento e le caratteristiche dell’ipertrofia sarcoplasmatica erano ancora evidenti. Più recentemente, è stato pubblicato uno studio su 15 uomini di età universitaria, precedentemente allenati, in cui le biopsie del vasto laterale sono state ottenute prima di un intervento di allenamento di 10 settimane e 72 ore dopo l’ultimo allenamento (Vann et al., 2020a). Rispetto a tutti gli studi citati, i partecipanti hanno eseguito un allenamento contro-resistenza a carico più elevato in cui gli esercizi sono stati eseguiti con 3-5 serie di 3-8 ripetizioni al ∼80-90% di forza massima (1RM). In media, i valori di fCSA di tipo I non sono cambiati e quelli di fCSA di tipo II sono aumentati del 19% (p < 0,05). Mentre la SDS-PAGE e la colorazione Coomassie hanno indicato che l’allenamento ha ridotto le abbondanze relative delle proteine della catena pesante della miosina e dell’actina (per milligrammo di tessuto secco) solo del ∼3%, questi cambiamenti da prima a dopo l’allenamento sono stati statisticamente significativi (p < 0,05). In particolare, queste diminuzioni della proteina contrattile per milligrammo di tessuto non erano così robuste come quelle osservate nel nostro studio precedente di Haun et al. (2019b) (cioè, diminuzioni del ∼30%). Al posto dell’ipertrofia delle fibre di tipo II osservata nel secondo studio, questi dati suggeriscono che un’apprezzabile accrescimento di proteine miofibrillari si è probabilmente verificato con un allenamento a breve termine a carico più elevato. Ciononostante, gli studi del nostro laboratorio suggeriscono che l’ipertrofia sarcoplasmatica può essere evidente con nuovi paradigmi di allenamento in soggetti già allenati. Inoltre, i nostri dati indicano che questa modalità di ipertrofia si verifica maggiormente con un allenamento a volume più elevato.
Nel complesso, i sette studi sull’uomo sopra menzionati forniscono prove ragionevoli che suggeriscono che l’ipertrofia sarcoplasmatica può verificarsi durante l’allenamento contro-resistenza. Sebbene tutti gli studi differiscano per quanto riguarda la durata dell’allenamento e gli schemi di carico, solo lo studio più recente ha attuato quello che sarebbe comunemente considerato un allenamento con carichi più elevati (cioè l’esecuzione di meno di cinque ripetizioni per serie a >85% del 1RM). Questo punto è importante da notare in quanto si riferisce ai contenuti discussi più avanti.
Prove nell’uomo che confutano l’ipertrofia sarcoplasmatica indotta dall’allenamento contro-resistenza:
Prima di discutere i dati sull’uomo che confutano il coinvolgimento dell’ipertrofia sarcoplasmatica nella crescita delle fibre, è importante discutere uno studio cardine sui roditori che ha preceduto il lavoro sull’uomo. Goldspink (1964) pubblicò un rapporto che coinvolgeva quattro gruppi di topi femmina. Due gruppi sono stati addestrati a procurarsi il cibo azionando un apparecchio a carrucola caricato a resistenza che aveva come obiettivo il muscolo bicipite brachiale; l’unica variabile che differenziava questi gruppi era la quantità di cibo somministrata al giorno (cioè 3,5 g/d e 5,0 g/d). Gli altri due gruppi non sono stati alloggiati con dispositivi a carrucola e sono serviti come gruppi di controllo con alimentazione corrispondente. Dopo 25 giorni di sperimentazione, tutti i topi sono stati soppressi e i muscoli bicipiti sono stati esaminati istologicamente al microscopio ottico con ingrandimento 1000×. Indipendentemente dalla quantità di cibo somministrata, i topi alloggiati con sistemi a carrucola possedevano fibre più grandi del 30% rispetto agli animali di controllo. È stata inoltre rilevata una forte relazione lineare tra la fCSA media e il numero di miofibrille nei topi alloggiati con sistemi a carrucola. Le fibre grandi, e presumibilmente ipertrofizzate, nei topi sottoposti a esercizio fisico possedevano anche meno spazio occupato dal sarcoplasma rispetto alle fibre più piccole. Per spiegare i suoi risultati, l’autore ha dichiarato (pag. 215):
È stato dimostrato che il numero di miofibrille per fibra aumenta in modo lineare con l’aumento del diametro della fibra. Ciò significa che l’aumento del numero di [mio]fibrille non procede allo stesso ritmo dell’aumento dell’area della sezione trasversale della fibra. Non è stato possibile misurare con precisione il diametro delle [mio]fibrille utilizzando la microscopia ottica, ma sembra molto probabile che la loro circonferenza aumenti con l’aumentare delle dimensioni della fibra.
Pur essendo limitati ai roditori, questi dati suggeriscono che una quantità apprezzabile di accrescimento di proteine miofibrillari accompagna l’ipertrofia delle fibre muscolari indotta dal carico contro-resistenza. Inoltre, i dati di Goldspink suggeriscono che le miofibrille aumentano in circonferenza piuttosto che in numero e che un leggero grado di impacchettamento delle miofibrille – o un aumento sproporzionato dell’accumulo di proteine miofibrillari rispetto alla crescita delle fibre – può essere coinvolto nell’ipertrofia delle fibre indotta dal carico. In seguito Goldspink ha scritto un eccellente capitolo del libro in cui discute i meccanismi di addizione delle miofibrille con la crescita delle fibre durante i periodi di allenamento (Goldspink, 2011). Ha citato numerosi studi sugli animali, molti dei quali sono stati eseguiti da Goldspink (2011), che suggeriscono: (i) la creazione di nuove miofibrille (cioè la miofibrillogenesi de novo) si verifica solo durante lo sviluppo embrionale, (ii) l’accrescimento proteico delle miofibrille negli animali sessualmente maturi comporta probabilmente l’aggiunta di proteine di nuova sintesi alla periferia delle miofibrille esistenti e (iii) le miofibrille possono proliferare durante i periodi di allenamento, anche se ciò è probabilmente dovuto alla scissione delle miofibrille.
Mentre il lavoro di Goldspink ha aggiunto enormi conoscenze sul comportamento delle miofibrille, finora nessuno studio sull’uomo ha fornito questo livello di dettaglio. In accordo con i risultati di Goldspink, tuttavia, esistono pochi dati sull’uomo che confutano l’idea che l’ipertrofia sarcoplasmatica indotta dall’allenamento contro-resistenza preceda o contribuisca alla crescita delle fibre o dei tessuti. Luthi et al. (1986) hanno utilizzato la TEM per esaminare gli adattamenti morfologici nelle fibre muscolari del vasto laterale di otto uomini di età universitaria non allenati che si sono allenati contro-resistenza per 6 settimane. Mentre l’area del vasto laterale è aumentata dell’8,4%, i valori di fCSA e la densità delle miofibrille sono rimasti invariati. Questi risultati suggeriscono che l’accumulo proporzionale di proteine miofibrillari accompagna la crescita muscolare durante l’allenamento. I dati TEM sono stati combinati con quelli della tomografia computerizzata a metà coscia per stimare che il volume assoluto occupato dalle miofibrille è aumentato del 10% in tutti i muscoli estensori della gamba. In particolare, non è stato delineato se questo aumento del contenuto di miofibrille si sia verificato attraverso la creazione di nuove miofibrille, l’allargamento di miofibrille preesistenti e/o la scissione di miofibrille. Inoltre, l’ipotesi che la morfologia acquisita tramite TEM si applichi a tutti i muscoli estensori della gamba ha dei limiti, dato che la TEM esamina una quantità estremamente ridotta di tessuto, come già detto. Infine, la mancanza di aumenti di fCSA con l’allenamento al posto di aumenti dell’area muscolare è difficile da riconciliare e si riferisce a una questione più ampia di mancanza di accordo tra i metodi utilizzati per valutare l’ipertrofia, come abbiamo discusso in precedenza (Haun et al., 2019c). Uno studio successivo dello stesso gruppo di ricerca ha esaminato le immagini TEM ad alto ingrandimento degli stessi partecipanti per determinare i cambiamenti nella spaziatura dei filamenti spessi e sottili con l’allenamento (Claassen et al., 1989). La distanza tra i filamenti di miosina era simile nei momenti precedenti e successivi all’intervento. Questi risultati forniscono un’ulteriore prova che l’accumulo di proteine miofibrillari è proporzionale alla crescita del tessuto. In quest’ultima relazione sono stati utilizzati anche dati di tomografia computerizzata ottenuti in precedenza per dimostrare che la densità radiologica dei muscoli della mezza coscia aumentava con l’allenamento. È interessante notare che i ricercatori hanno attribuito quest’ultimo risultato a un potenziale aumento dell’impacchettamento delle miofibrille. Sebbene sia una conclusione ragionevole, questo risultato potrebbe anche essere legato a una diminuzione dei lipidi intramuscolari o a un aumento del contenuto di proteine non contrattili (ad esempio, proteine della matrice extracellulare). Inoltre, la presunzione degli autori che si sia verificato un impacchettamento delle miofibrille è in conflitto con i loro precedenti dati TEM che suggeriscono che, mentre il contenuto di miofibrille è aumentato in termini assoluti, la densità e la spaziatura delle miofibrille sono state conservate. Uno studio di Trappe et al. (2000) ha esaminato i cambiamenti di tensione specifici nelle fibre muscolari isolate del vasto laterale di sette uomini anziani precedentemente non allenati dopo 12 settimane di allenamento contro-resistenza. Sebbene le fibre di tipo I e IIa abbiano mostrato un aumento del 20% e del 13% dei valori di fCSA, i valori di tensione specifica in entrambi i tipi di fibre erano simili ai punti temporali precedenti e successivi. Analogamente a quanto riportato da Luthi et al. (1986), questi risultati suggeriscono che l’accrescimento proporzionale delle proteine miofibrillari accompagna la crescita delle fibre. Il gruppo di Trappe ha pubblicato uno studio di follow-up su sette donne anziane non allenate che si sono impegnate in 12 settimane di allenamento contro-resistenza (Trappe et al., 2001). A differenza dei maschi nel loro precedente studio, le fibre di tipo IIa non si sono ipertrofizzate. Inoltre, i confronti statistici hanno indicato che i valori di tensione specifica di entrambi i tipi di fibre non sono stati influenzati dall’allenamento. Questi risultati suggeriscono che l’allenamento non ha influenzato la morfologia delle fibre di tipo IIa e che la crescita radiale delle fibre di tipo I è stata accompagnata da un aumento proporzionale delle proteine miofibrillari. Risultati simili sono stati riportati da altri ricercatori in sei uomini precedentemente non allenati, sottoposti a 12 settimane di allenamento contro-resistenza (Widrick et al., 2002); in particolare, l’ipertrofia delle fibre del muscolo vasto laterale si è verificata senza alterazioni dei valori di tensione specifica delle fibre isolate.
Più di recente, un gruppo di ricerca ha esaminato gli adattamenti tissutali del vasto laterale che si sono verificati in maschi in età universitaria precedentemente non allenati, sottoposti a 12 settimane di allenamento contro- resistenza (Roberts et al., 2018). I partecipanti sono stati suddivisi in rispondenti alti e bassi in base a un punteggio composito delle variazioni da prima a dopo l’intervento della fCSA media, della massa di tessuto magro totale del corpo determinata con l’assorbimetria a raggi X a doppia energia e dello spessore del vasto laterale. I 13 soggetti ad alta risposta hanno registrato un aumento del 34% della fCSA media e del 24% dello spessore del vasto laterale. Tuttavia, questi individui non hanno registrato cambiamenti nelle abbondanze di proteine della catena pesante della miosina e dell’actina per milligrammo di tessuto umido, e lo stesso è stato riscontrato per i 12 soggetti a bassa risposta anabolica, che non hanno mostrato praticamente alcun cambiamento nella fCSA media. Analogamente a molti degli studi precedenti, questi risultati suggeriscono che l’accrescimento proteico delle miofibrille era proporzionale alla crescita delle fibre e dei tessuti nei soggetti ad alta risposta. Nel complesso, questi studi suggeriscono in larga misura che la crescita della fibra muscolare o del tessuto in risposta a 6-12 settimane di allenamento contro-resistenza avviene attraverso un’ipertrofia convenzionale piuttosto che sarcoplasmatica. In relazione alle ipotesi formulate più avanti, è importante notare che tutti questi studi hanno esaminato partecipanti non allenati in precedenza.
Anche diversi studi sui traccianti mettono in dubbio la veridicità dell’ipertrofia sarcoplasmatica. Ad esempio, Moore et al. (2009) hanno riferito che un allenamento contro-resistenza provoca forti aumenti dei tassi di sintesi proteica miofibrillare a digiuno e minime alterazioni dei tassi di sintesi proteica sarcoplasmatica in una finestra di 5 ore dopo l’esercizio. Inoltre, questi autori hanno riferito che i tassi di sintesi proteica sarcoplasmatica erano più reattivi all’apporto di nutrienti dopo l’esercizio piuttosto che all’esercizio stesso. Gasier et al. (2012) hanno pubblicato risultati simili utilizzando il metodo del tracciante D2O per dimostrare che un allenamento contro-resistenza della parte inferiore del corpo ha stimolato un aumento dei tassi di sintesi proteica miofibrillare, pur non influenzando i tassi di sintesi proteica complessiva in una finestra di 16 ore dopo l’esercizio. Anche Wilkinson et al. (2014) hanno utilizzato il metodo del tracciante D2O per dimostrare che 4 giorni di allenamento di resistenza unilaterale delle gambe per un periodo di 8 giorni hanno aumentato significativamente i tassi di sintesi proteica miofibrillare, senza influenzare i tassi di sintesi proteica sarcoplasmatica. Allo stesso modo, altri hanno utilizzato il metodo del tracciante D2O per dimostrare che i tassi di sintesi proteica miofibrillare sono elevati settimane dopo l’inizio dell’allenamento contro-resistenza (Brook et al., 2015). Questi dati suggeriscono complessivamente che il pool di proteine miofibrillari, piuttosto che quello sarcoplasmatico, potrebbe subire l’espansione più forte all’inizio dell’allenamento. Tuttavia, anche in questo caso, tutti questi studi sono stati condotti su partecipanti non allenati.
Oltre a questi interventi a breve termine, esistono anche interventi cronici e confronti trasversali che mettono legittimamente in dubbio il coinvolgimento dell’ipertrofia sarcoplasmatica nell’ipertrofia muscolare a lungo termine. Alway et al. (1988) hanno utilizzato la TEM per segnalare che lo spazio intracellulare occupato dalle miofibrille nelle fibre muscolari del gastrocnemio era simile tra soggetti allenati contro-resistenza e sedentari, nonostante i valori di fCSA fossero maggiori nei soggetti allenati contro-resistenza. Shoepe et al. (2003) hanno confrontato le caratteristiche delle fibre del vasto laterale di sei uomini di età universitaria non allenati rispetto a sei ben allenati (l’età di allenamento dichiarata era in media di ∼7 anni). Mentre i valori di fCSA di tipo I e II erano significativamente maggiori nella coorte ben allenata, i valori di tensione specifica erano simili tra i gruppi, suggerendo un’ipertrofia a lungo termine delle fibre con un accrescimento proporzionale di proteine miofibrillari. I due studi citati suggeriscono che la crescita delle fibre a lungo termine con l’allenamento contro-resistenza avviene attraverso l’ipertrofia convenzionale. Tuttavia, questi dati sono in contrasto con altri studi. Pansarasa et al. (2009) hanno esaminato le caratteristiche delle fibre del vasto laterale in cinque donne di età universitaria che si sono allenate contro-resistenza per un anno. La tensione specifica è aumentata significativamente nelle fibre di tipo I e II, mentre i valori medi di fCSA non sono cambiati da prima a dopo l’intervento. Sebbene siano difficili da conciliare, questi risultati supportano un modello di ipertrofia a lungo termine in cui si verifica un impacchettamento delle miofibrille senza un aumento dell’ipertrofia delle fibre muscolari. E’ stato recentemente esaminato lo spessore del vasto laterale e le caratteristiche del tessuto in sei uomini di età universitaria ben allenati (l’età di allenamento dichiarata era in media di ∼10 anni) rispetto a sei uomini non allenati (Vann et al., 2020b). Mentre lo spessore del muscolo era maggiore del 22% (p < 0,05) nella coorte allenata, anche le abbondanze di catena pesante di miosina e actina per milligrammo di muscolo umido erano maggiori del ∼9% (p < 0,05). I valori di fCSA di tipo I e II erano numericamente maggiori, ma statisticamente simili tra le coorti. D’Antona et al. (2006) hanno anche riportato che i valori di tensione specifica delle fibre di tipo II erano significativamente maggiori nei bodybuilder ben allenati rispetto ai controlli allenati a livello ricreativo. Anche in questo caso, i risultati di entrambi gli studi suggeriscono che l’ipertrofia a lungo termine è accompagnata dall’impaccamento delle miofibrille. Contrariamente alle implicazioni di tutti gli studi citati, due studi su body-builder ben allenati suggeriscono che sono evidenti le caratteristiche dell’ipertrofia sarcoplasmatica (Macdougall et al., 1982; Meijer et al., 2015). Nel complesso, questi risultati discordanti rendono difficile stabilire come l’allenamento contro-resistenza a lungo termine influisca sulla densità delle miofibrille e/o se l’ipertrofia sarcoplasmatica sia un processo coinvolto quando gli individui diventano più allenati. È plausibile che dosi diverse di allenamento contro-resistenza nel corso di anni di allenamento possano provocare cambiamenti diversi nella morfologia muscolare. Si tratta di un’area non risolta e sono necessarie ulteriori ricerche per comprendere meglio i risultati adattativi a livello cellulare in risposta a diversi stili di allenamento.
Creare un paradigma Considerando l’evidenza collettiva:
Considerando la letteratura citata, è difficile costruire un paradigma collettivo di crescita delle fibre muscolari che coinvolga l’ipertrofia sarcoplasmatica. Tuttavia, possiamo ipotizzare che ci siano tre scenari candidati in cui l’ipertrofia sarcoplasmatica potrebbe manifestarsi con l’allenamento contro-resistenza. In particolare, si ritiene che l’ipertrofia sarcoplasmatica sia:
- un sintomo transitorio dell’edema indotto dall’allenamento,
- un meccanismo transitorio di crescita delle fibre muscolari e/o
- il risultato del raggiungimento di una soglia di accrescimento delle proteine miofibrillari in individui ben allenati.
L’edema tissutale è associato a un danno localizzato e si manifesta come una ritenzione di liquido interstiziale tra le cellule. Specificamente al danno muscolare indotto dall’esercizio fisico, l’edema può essere accompagnato da un danno al sarcolemma in cui si verifica un’infiltrazione di grandi proteine del siero (ad esempio, albumina) e di liquido all’interno e intorno alle fibre muscolari (Valle et al., 2013). In queste circostanze, sembra plausibile che l’edema possa elevare artificialmente i valori di fCSA attraverso la ritenzione di liquidi intracellulari, che si manifesterebbe come un’espansione del sarcoplasma. A sostegno di questa ipotesi, Yu et al. (2013) hanno esaminato l’effetto di una corsa prolungata al piano inferiore sulla fCSA media del muscolo soleo in uomini di età universitaria. Questo studio è stato limitato dal fatto che non sono state ottenute biopsie ripetute dai partecipanti; in particolare, 16 uomini hanno eseguito l’allenamento e le biopsie sono state ottenute da un sottogruppo di partecipanti a 1 ora dopo l’esercizio, 2-3 giorni dopo l’esercizio e 7-8 giorni dopo l’esercizio. Questo studio è stato inoltre limitato dal fatto che la corsa ad alto volume al piano di sotto ha poca somiglianza con l’esercizio contro-resistenza. Ciononostante, i valori medi di fCSA erano superiori del 30% nelle biopsie ottenute 7-8 giorni dopo l’esercizio rispetto a quelle ottenute nei momenti precedenti e gli autori hanno ipotizzato che ciò fosse principalmente associato a un edema localizzato. Sebbene sia informativo, è difficile determinare se l’ipertrofia sarcoplasmatica fosse evidente, dato che non sono state eseguite interrogazioni ultrastrutturali. Tuttavia, questo studio dimostra che i cambiamenti dell’fCSA nei giorni successivi al danno muscolare sono dovuti all’edema, che probabilmente si manifesta con un’espansione del sarcoplasma. Le valutazioni non invasive dell’edema possono essere eseguite anche acquisendo immagini muscolari con ultrasuoni o risonanza magnetica (RM) e quantificando l’intensità dell’eco B-mode o l’intensità del segnale nelle immagini pesate in T2, rispettivamente. Damas et al. (2016c) hanno monitorato i cambiamenti nell’intensità dell’eco B-mode del vasto laterale in uomini non allenati di età universitaria prima, dopo 3 settimane e dopo un intervento di allenamento contro-resistenza di 10 settimane. Mentre l’aumento dell’area muscolare è stato registrato a 3 settimane e dopo l’allenamento, l’aumento dell’edema (cioè l’intensità del segnale B-mode/area del vasto laterale) è stato riscontrato solo a 3 settimane. Gli autori hanno concluso che l’ipertrofia muscolare era confusa dall’edema a 3 settimane, ma non a 10 settimane dall’allenamento. Questo articolo ha anche portato a discutere se l’ipertrofia muscolare possa essere valutata accuratamente senza gli effetti confondenti dell’edema nel primo mese di allenamento in partecipanti precedentemente non allenati (Damas et al., 2016b; Defreitas et al., 2016). Quando si mettono in relazione questi risultati con la nozione di ipertrofia sarcoplasmatica indotta dall’allenamento, è plausibile che questo fenomeno possa essere osservato sia in:
- individui non allenati durante il primo mese di allenamento, sia
- individui allenati esposti a paradigmi di allenamento non abituali.
Il lavoro del laboratorio di Haun et al. (2019b), che ha dimostrato che l’allenamento facilita gli aspetti dell’ipertrofia sarcoplasmatica, si allinea con quest’ultima ipotesi poiché i partecipanti, pur essendo ben allenati, hanno eseguito volumi di allenamento straordinariamente elevati e non abituali. A ulteriore sostegno di questa tesi vi sono dati precedenti relativi a questi partecipanti che dimostrano che l’aumento del contenuto di fluido extracellulare nel corpo intero (valutato mediante spettroscopia di impedenza bioelettrica, o BIS) ha contribuito in modo significativo all’aumento delle variazioni della massa muscolare nel corpo intero con l’allenamento (Haun et al., 2018). Sebbene in precedenza avessimo sostenuto che l’edema non confondesse le variabili di risultato in questo studio (Haun et al., 2019b), i dati BIS sopra citati forniscono la prova del contrario. Pertanto, in futuro, i ricercatori dovrebbero considerare gli effetti confondenti dell’edema quando misurano i surrogati grossolani dell’ipertrofia muscolare e i cambiamenti morfologici o biochimici nel tessuto muscolare. Inoltre, l’influenza dello stato di idratazione sulle macro- e micro-variabili legate all’ipertrofia dovrebbe continuare a essere esplorata, dato che sono stati segnalati spostamenti di liquidi durante i periodi cronici di allenamento di resistenza (ad esempio, acqua intramuscolare e volume plasmatico) (Reidy et al., 2017).
Oltre a essere un potenziale sintomo di edema, si propone che l’ipertrofia sarcoplasmatica possa essere un meccanismo che contribuisce alle prime fasi di crescita delle fibre radiali. È comune che l’fCSA medio aumenti del ∼15-30% in risposta a mesi di allenamento contro-resistenza (rivisto in Grgic e Schoenfeld, 2018). Questi risultati suggeriscono che le fibre muscolari devono generare una quantità apprezzabile di spazio intracellulare per accumulare più proteine miofibrillari. Un potenziale meccanismo per realizzare tale crescita potrebbe coinvolgere l’ipertrofia sarcoplasmatica seguita dal “riempimento” dello spazio sarcoplasmatico appena generato con proteine miofibrillari. Questo meccanismo contrasta con la nozione avanzata da Phillips (Phillips, 2000), secondo cui l’impacchettamento delle miofibrille precede l’ipertrofia e il nuovo materiale miofibrillare aggiunto “spinge” il sarcolemma verso l’esterno. Sebbene nessuno dei due meccanismi abbia prove definitive a sostegno nell’uomo, i dati raccolti in altre linee cellulari suggeriscono che l’ipertrofia sarcoplasmatica possa essere favorita durante la crescita delle fibre muscolari. A questo proposito, Neurohr et al. (2019) hanno recentemente dimostrato che l’espansione citoplasmatica si verifica prontamente in lievito e cellule primarie di mammifero attraverso l’interruzione di un gene (Cdc28). Gli autori hanno anche notato che la biosintesi di RNA e proteine non è aumentata con l’aumento della crescita cellulare e hanno ipotizzato che questo fenomeno sia dovuto al carico trascrizionale imposto ai nuclei. Questo lavoro è limitato dal fatto che la crescita cellulare negli organismi intatti è vincolata dal tessuto connettivo, mentre questo vincolo non è applicabile nelle colture monostrato. Tuttavia, questi risultati dimostrano in linea di principio che l’espansione citoplasmatica è un meccanismo conservato di ipertrofia cellulare nel lievito e in numerose cellule di mammifero. I dati di Neurohr et al. (2019) ribadiscono inoltre la nozione che le cellule possiedono un rapporto ottimale tra DNA e volume cellulare, poiché i processi di biosintesi dei ribosomi, dell’mRNA e delle proteine sono ad alta intensità di risorse (rivisti in Gillooly et al., 2015). Sebbene le fibre muscolari siano multinucleate, la teoria del dominio mionucleare si basa su un presupposto simile (Allen et al., 1999): in particolare, un aumento delle dimensioni delle fibre muscolari richiede l’aggiunta di mionuclei dalle cellule satelliti per sostenere l’accrescimento e il mantenimento del materiale intracellulare appena aggiunto. Pertanto, le fibre muscolari potrebbero crescere preferenzialmente attraverso l’ipertrofia sarcoplasmatica all’inizio di un intervento di allenamento, dato che:
- questo meccanismo sembra essere conservato in diversi tipi di cellule, come discusso in precedenza,
- l’accrescimento dei mionuclei ritarda all’inizio dell’allenamento e alcuni studi hanno riportato che la crescita delle fibre avviene senza accrescimento dei mionuclei (rivisto in Murach et al,
- se la crescita delle fibre avvenisse attraverso l’ipertrofia convenzionale o l’impacchettamento delle miofibrille senza l’accrescimento dei mionuclei, allora i mionuclei residenti sarebbero probabilmente sollecitati a coordinare la produzione su larga scala dei ribosomi, degli mRNA che codificano le grandi proteine delle miofibrille e di altri mRNA necessari per l’omeostasi cellulare. Questo concetto è ulteriormente illustrato nella seguente.
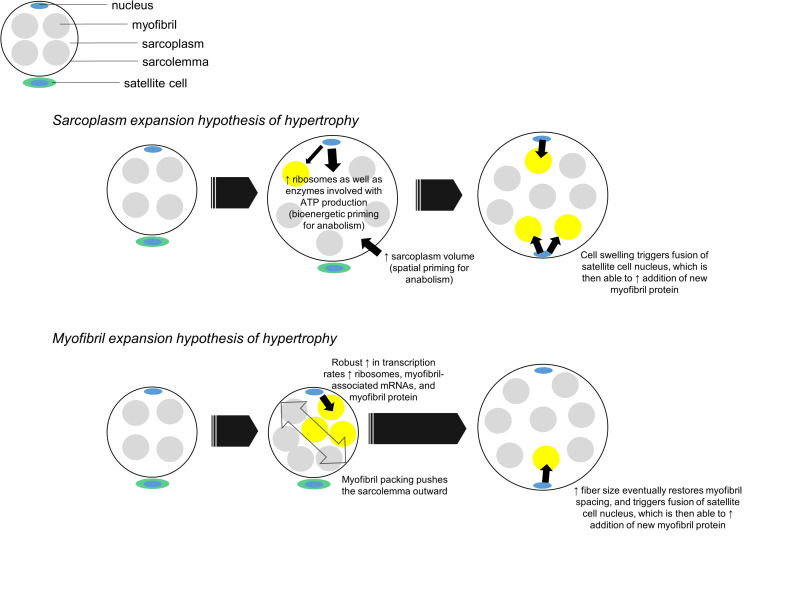
In relazione alla figura sopra esposta, l’ipotesi di espansione del sarcoplasma dell’ipertrofia muscolare durante l’allenamento contro-resistenza prevede quanto segue:
- Prima dell’aggiunta mionucleare mediata dalle cellule satelliti, le fibre muscolari subiscono un priming spaziale attraverso l’ipertrofia sarcoplasmatica, un priming bioenergetico attraverso l’aumento della regolazione degli enzimi necessari per la generazione di ATP e un priming della biosintesi proteica attraverso la biogenesi dei ribosomi. Questi fenomeni preparano spazialmente, “bioenergeticamente” e “biosinteticamente” le fibre per l’accrescimento proteico delle miofibrille, gestendo efficacemente il carico trascrizionale sui mionuclei residenti.
- Una volta che si verifica l’addizione mionucleare mediata dalle cellule satelliti, i nuovi domini mionucleari possono facilitare una significativa crescita della sintesi di mRNA associati alle miofibrille e di proteine delle miofibrille. Questo è il riempimento dello spazio del sarcoplasma con componenti contrattili.
In relazione ai fenomeni discussi sopra, è da notare che i partecipanti che hanno mostrato segni di ipertrofia sarcoplasmatica nel nostro studio sull’allenamento a volume più elevato non hanno mostrato aumenti nel numero di mionuclei per fibra (Haun et al., 2019a, b). Pertanto, anche se in via speculativa, un motivo per cui si è verificata l’ipertrofia sarcoplasmatica potrebbe essere legato al carico trascrizionale imposto ai mionuclei residenti senza l’accrescimento dei mionuclei, come discusso in precedenza. Questi partecipanti hanno anche dimostrato un aumento della biogenesi dei ribosomi e dell’espressione proteica degli enzimi sarcoplasmatici responsabili della generazione di ATP attraverso le vie ATP-PCr e glicolitica. Quest’ultima osservazione potrebbe essere correlata agli aspetti della biosintesi proteica e del priming bioenergetico dell’ipertrofia sarcoplasmatica discussi in precedenza. Sebbene questi dati siano convincenti, sono necessarie ulteriori ricerche per convalidare questo modello.
Infine, si ipotizza che un terzo scenario che coinvolge l’ipertrofia sarcoplasmatica possa comportare il raggiungimento di una soglia di accrescimento di proteine miofibrillari nelle fibre muscolari di grandi dimensioni con anni di allenamento contro-resistenza. Si ritiene che questa modalità di ipertrofia si verifichi per ragioni simili a quelle discusse in precedenza; in particolare, lo stress trascrizionale imposto ai mionuclei residenti nelle fibre muscolari di grandi dimensioni favorirebbe la crescita cellulare attraverso l’ipertrofia sarcoplasmatica. Questa ipotesi è ulteriormente illustrata nella figura seguente.

Anche in questo caso, si tratta di un’ipotesi speculativa, dato che, come per le altre due ipotesi citate, non esistono praticamente dati a supporto. Inoltre, attualmente non si sa se esista una soglia di accrescimento delle miofibrille nelle fibre muscolari. A sostegno di questa ipotesi, tuttavia, altri ricercatori hanno ipotizzato che nelle cellule mitoticamente attive si verifichi una soglia di accrescimento proteico, che agisce per innescare la divisione cellulare (Soltani et al., 2016). Poiché le miofibre sono cellule post-mitotiche che non possono dividersi, l’ipertrofia sarcoplasmatica potrebbe essere l’unico modo attraverso il quale le fibre di grandi dimensioni sono in grado di crescere. In effetti, questa è una potenziale spiegazione del perché alcuni degli studi citati hanno riportato caratteristiche di ipertrofia sarcoplasmatica in body-builder con anni di esperienza di allenamento (Macdougall et al., 1982; Meijer et al., 2015). Questo potrebbe anche essere il motivo per cui si sono osservate caratteristiche di ipertrofia sarcoplasmatica in individui precedentemente allenati e sottoposti a nuovi paradigmi di allenamento (Haun et al., 2019b; Vann et al., 2020a). A parte ciò, è stata avanzata un’altra teoria per spiegare il comportamento delle grandi fibre muscolari in risposta a stimoli ipertrofici. Murach et al. (2019) hanno ipotizzato che le fibre muscolari dei mammiferi (e le miofibrille all’interno delle fibre) siano in grado di dividersi in risposta a un sovraccarico, e gli autori hanno fornito dati umani e animali che supportano queste ipotesi [esempi includono riferimenti (Goldspink, 1970; Timson et al., 1985; Antonio e Gonyea, 1994)]. Non è ancora noto se una soglia di accumulo di proteine miofibrillari all’interno di una fibra muscolare inneschi la scissione delle fibre. Inoltre, al di là dell’analisi bidimensionale su sezioni seriali tramite istologia (Eriksson et al., 2005, 2006), la scissione delle fibre nell’uomo non è stata dimostrata in modo convincente. Altri ricercatori hanno anche fornito prove convincenti che suggeriscono che la scissione delle fibre percepita nei muscoli dei roditori sottoposti a sovraccarico è dovuta principalmente ad alterazioni dell’angolo di pennato e della lunghezza delle fibre piuttosto che alla scissione (Jorgenson e Hornberger, 2019). È chiaro che c’è ancora molto da risolvere per quanto riguarda la risposta fisiologica delle grandi miofibre agli stimoli ipertrofici.
Sebbene il modello di ablazione sinergica nei roditori abbia i suoi limiti (ad esempio, una crescita muscolare rapida e non fisiologica in risposta a uno stimolo di crescita costante), tali esperimenti sui roditori possono fornire informazioni utili per sostenere o confutare i meccanismi teorici proposti sopra. In particolare, i ricercatori hanno già riflettuto sullo stress trascrizionale suscitato sui mionuclei residenti durante l’ipertrofia indotta dal sovraccarico. Il gruppo di McCarthy (Kirby et al., 2016) ha somministrato 5-etinil uridina a topi wild-type con l’intento di etichettare la trascrizione di RNA nascente in risposta all’ipertrofia indotta da sovraccarico. Questi autori hanno esaminato diversi gruppi di topi, tra cui controlli sham-operated (CTL) o topi esposti a tre, sette o 14 giorni di sovraccarico delle plantari tramite ablazione sinergica (SA). Si è osservato un aumento lineare del peso delle plantari nei gruppi in cui CTL < SA di 3 giorni < SA di 7 giorni < SA di 14 giorni. Tuttavia, la trascrizione nascente era regolata solo nei topi con SA di 3 giorni rispetto a quelli con CTL. Questi dati suggeriscono che, sebbene i mionuclei residenti presentino una riserva trascrizionale durante l’ipertrofia, questa risposta è rapida, pulsatile e di durata limitata. È stato inoltre riportato che la trascrizione nascente è più bassa nelle fibre più grandi durante la SA. Questa scoperta è in linea con quella di Neurohr et al. (2019), che hanno dimostrato che la biosintesi dell’RNA non è in scala nelle cellule di mammifero che crescono attraverso l’ipertrofia citoplasmatica in vitro. Resta da stabilire se i risultati di Kirby et al. (2016) indichino o meno che le fibre grandi e ipertrofiche crescono prevalentemente attraverso l’ipertrofia sarcoplasmatica. Tuttavia, riteniamo che questi parallelismi tra gli studi siano interessanti e meritevoli di ulteriori approfondimenti. Riteniamo inoltre che il modello murino Pax7-DTA possa essere informativo per determinare se l’ipertrofia sarcoplasmatica accompagni la crescita delle fibre durante le prime fasi dell’ipertrofia indotta da sovraccarico. I topi Pax7-DTA sono geneticamente modificati in modo tale che, quando viene loro somministrato tamoxifene, mostrano un’ablazione quasi completa delle cellule satelliti a causa di eventi mediati da Cre-ER che guidano l’espressione del frammento A della tossina difterica (DTA) nelle cellule Pax7+ (Lepper et al., 2011). Mccarthy et al. (2011) hanno dimostrato che, mentre l’accrescimento mionucleare è abrogato in questi topi durante l’ipertrofia plantare indotta dall’ablazione sinergica, la crescita delle fibre non è stata compromessa. Se le ipotesi di cui sopra fossero vere per quanto riguarda lo stress dei mionuclei residenti durante la crescita delle fibre indotta dal sovraccarico, allora è possibile che l’ipertrofia sarcoplasmatica si sia verificata maggiormente nei topi a cui è stato somministrato il Tamoxifene (cioè quelli che non mostravano accrescimento di mionuclei) rispetto ai topi a cui non è stato somministrato il Tamoxifene (cioè quelli che mostravano accrescimento di mionuclei). Tuttavia, in questi animali non è stata valutata la morfologia muscolare. Allo stesso modo, altri hanno dimostrato che la crescita delle fibre plantari in risposta all’ablazione sinergica è ridotta nei topi Pax7-DTA a cui è stato somministrato Tamoxifene (Egner et al., 2016). Alla luce delle nostre ipotesi e di questi dati contrastanti sul modello Pax7-DTA, sono giustificati futuri esperimenti che esaminino gli adattamenti morfologici che si verificano in questo modello murino.
Implicazioni più ampie:
Il tema dell’ipertrofia sarcoplasmatica esiste da decenni in ambito atletico. Stone ne parlò come di un potenziale adattamento all’allenamento all’inizio degli anni ’80 (Stone et al., 1983) e Kraemer e Zatsiorsky (2006) ipotizzarono che l’ipertrofia convenzionale e quella sarcoplasmatica derivino rispettivamente da allenamenti ad alto e basso carico (Kraemer e Zatsiorsky, 2006). Sebbene queste ipotesi siano in una certa misura speculative, esistono dati a sostegno dei paradigmi di carico volumetrico che influenzano la densità miofibrillare. A questo proposito, due degli studi citati in precedenza che hanno osservato caratteristiche di ipertrofia sarcoplasmatica sono stati condotti su culturisti ben allenati (Macdougall et al., 1982; Meijer et al., 2015), e questa popolazione si allena generalmente con volumi più elevati. Al contrario, esistono caratteristiche di impacchettamento delle miofibrille negli atleti di potenza (Meijer et al., 2015; Fluck et al., 2019), e questa popolazione si allena generalmente con carichi più elevati e volumi inferiori. Anche i due studi citati del nostro laboratorio supportano questo modello (Haun et al., 2019b; Vann et al., 2020a), ed è da notare che una riduzione della densità dell’impaccamento dei miofilamenti attraverso l’ipertrofia sarcoplasmatica può anche promuovere alcuni adattamenti dell’allenamento, come l’aumento della velocità di accorciamento delle fibre muscolari (Metzger e Moss, 1987).
Anche la rilevanza mainstream dell’ipertrofia sarcoplasmatica con l’allenamento di resistenza sta prendendo piede. Dal 2014 sono stati pubblicati diversi articoli online per i non addetti ai lavori che parlano dell’ipertrofia sarcoplasmatica con l’allenamento alla resistenza. Allo stesso modo, la più grande enciclopedia online del mondo1 discute le sfumature relative all’ipertrofia miofibrillare rispetto a quella sarcoplasmatica in un articolo principale intitolato Ipertrofia muscolare, nonostante nessuno dei due meccanismi sia stato ampiamente validato. È quindi evidente che il pubblico generale è interessato a saperne di più su questo aspetto della fisiologia muscolare. Per il futuro, più laboratori dovranno perseguire questa domanda di ricerca per convalidare i risultati precedenti e fornire scoperte significative.
Determinare se l’ipertrofia sarcoplasmatica sia un “unicorno” scientifico o un adattamento all’allenamento di resistenza è fondamentale per il campo per diversi motivi. A tal fine, alcuni hanno ipotizzato che la vera ipertrofia si verifichi solo quando l’accrescimento delle proteine miofibrillari è proporzionale all’aumento della fCSA (Damas et al., 2015; Taber et al., 2019). Si tratta di un’ipotesi interessante per diversi motivi. In primo luogo, altri hanno notato che l’ipertrofia muscolare scheletrica indotta dall’allenamento contro-resistenza non è fortemente associata all’aumento della forza (Ahtiainen et al., 2016). In altre parole, muscoli più grandi dopo l’allenamento non producono un aumento proporzionale della forza. Questo è probabilmente vero per una serie di ragioni, molte delle quali sono state spiegate da Taber et al. (2019). Per ribadire un punto chiave di Taber et al. (2019), il ruolo che l’ipertrofia sarcoplasmatica può avere nella spiegazione di questa relazione imperfetta, per quanto piccolo, dovrebbe essere ulteriormente esaminato. Come già detto, alcuni risultati della nostra ricerca suggeriscono che l’allenamento ad alto volume promuove l’ipertrofia sarcoplasmatica in misura maggiore rispetto all’allenamento ad alto carico. La definizione di ciascuna modalità di allenamento è intrinsecamente difficile. Ad esempio, alcuni considerano l’esecuzione di serie contenenti più di 10 ripetizioni al ∼60-70% di 1RM come un allenamento a più alto volume, mentre altri possono considerare l’allenamento ad alto volume come l’esecuzione di serie di alte ripetizioni fino al cedimento utilizzando il 30% di 1RM. Pertinenti ai temi qui discussi sono i risultati di Mitchell et al. (2012), che hanno riferito che l’allenamento di resistenza degli estensori delle gambe all’80% dell’1RM e al 30% dell’1RM ha prodotto aumenti simili dell’area della sezione trasversale del muscolo della mezza coscia e dell’fCSA del muscolo. Sebbene le caratteristiche ipertrofiche fossero simili con ogni forma di allenamento, indagare sul modo in cui ogni forma di allenamento influisce sulla morfologia muscolare sarà utile alla luce di alcuni risultati delle nostre ricerche citati in precedenza. Altri dati interessanti che possono essere correlati all’ipertrofia sarcoplasmatica provengono da Kadi et al. (2004) che hanno ottenuto biopsie seriali del vasto laterale da partecipanti non allenati durante un intervento di allenamento contro-resistenza di 90 giorni seguito da un periodo di disallenamento di 90 giorni. Dopo 90 giorni di allenamento, la fCSA media è aumentata del 16% rispetto ai valori precedenti all’allenamento. Tre giorni di detraining hanno aumentato numericamente la fCSA del ∼3% rispetto al punto di 90 giorni e del 19% rispetto al pre-training. È sorprendente che i valori medi di fCSA siano tornati ai livelli pre-allenamento dopo soli altri sette giorni di disallenamento. In sostanza, questi dati suggeriscono che durante il detraining si verifica un rapido decadimento dei valori medi di fCSA. Abbiamo sostenuto che, se le fibre muscolari avessero subito una significativa accrescimento miofibrillare, ci sarebbe voluto più tempo per osservare l’atrofia indotta dal detraining (Roberts et al., 2018). Tuttavia, se l’ipertrofia sarcoplasmatica ha contribuito in modo significativo alla crescita delle fibre, rimane plausibile che il ripristino dello spazio sarcoplasmatico ai valori precedenti all’allenamento possa aver contribuito in larga misura al fenomeno del detraining. Quindi, ancora una volta, l’utilizzo di metodi per valutare la morfologia cellulare in questi scenari fornirà informazioni utili in relazione agli adattamenti da detraining. Infine, ci sono i dati sull’allenamento di resistenza a lungo termine pubblicati da Fatouros et al. (2005), in cui si è tentati di ipotizzare che alcuni risultati dello studio possano essere dovuti, in parte, all’ipertrofia sarcoplasmatica. Questi autori hanno diviso uomini anziani precedentemente non allenati in un gruppo di allenamento a bassa intensità (n = 18) e in un gruppo di allenamento ad alta intensità (n = 20). Entrambi i gruppi hanno eseguito un allenamento di resistenza per tutto il corpo per 6 mesi, ma il primo gruppo ha utilizzato pesi corrispondenti a ∼55% 1RM mentre il secondo gruppo ha utilizzato pesi corrispondenti a ∼82% 1RM. La forza della parte superiore e inferiore del corpo è stata misurata utilizzando gli esercizi di chest press e leg press, rispettivamente, prima e dopo l’allenamento. Tutti i partecipanti si sono poi staccati per 48 settimane e la forza è stata nuovamente valutata. I partecipanti al gruppo ad alta intensità hanno acquisito più forza con l’allenamento, come era prevedibile. Tuttavia, i partecipanti al gruppo ad alta intensità hanno mantenuto una forza maggiore rispetto a quelli del gruppo a bassa intensità dopo il lungo periodo di disallenamento. Anche le circonferenze a metà coscia e le pieghe della pelle sono state ottenute in tutti i punti temporali sopra menzionati, ma non sono state notate differenze degne di nota nella crescita o nell’atrofia muscolare tra i gruppi; ciò è probabilmente dovuto alla risoluzione relativamente scarsa che le valutazioni delle pieghe della pelle e delle circonferenze forniscono. Sebbene questi risultati possano essere in parte legati agli adattamenti neurali a lungo termine con l’allenamento a carichi più elevati, è possibile ipotizzare che l’allenamento di resistenza a carichi più elevati possa anche aver favorito una maggiore accumulazione di proteine miofibrillari rispetto all’allenamento a carichi più bassi, viste le argomentazioni esposte in precedenza. A questo proposito, è opportuno replicare studi come questi, in cui le biopsie vengono analizzate per individuare le caratteristiche dell’ipertrofia convenzionale rispetto a quella sarcoplasmatica.
Conclusioni:
Le ricerche suggeriscono che possono verificarsi diversi adattamenti morfologici con l’ipertrofia delle fibre muscolari durante i periodi di allenamento contro-resistenza. Tuttavia, la letteratura sull’uomo presenta ancora notevoli lacune per quanto riguarda il modo in cui le diverse forme di allenamento o la durata dell’allenamento influenzano gli adattamenti morfologici. Nonostante la scarsità di dati, l’intento finale nel redigere questo articolo è quello di suscitare ulteriore interesse per questo argomento di ricerca. Tali ricerche aiuteranno a confermare o a confutare il ruolo dell’ipertrofia sarcoplasmatica nel facilitare gli adattamenti dell’allenamento contro-resistenza.
Infatti, ritengo che la domanda più rilevante è se questo fenomeno abbia implicazioni pratiche significative.
Sebbene la ricerca sia ancora preliminare, la risposta breve è: dipende dagli obbiettivi individuali. L’aumento della massa sarcoplasmatica sarebbe certamente vantaggioso per chi cerca di migliorare l’estetica, poiché qualsiasi aumento delle dimensioni muscolari è un vantaggio, indipendentemente dalle implicazioni funzionali. L’aumento delle proteine sarcoplasmatiche può persino contribuire a migliorare le prestazioni negli allenamenti di tipo bodybuilding, aumentando il potenziale di costruzione muscolare con attività di sostegno alla componente miofibrillare.
D’altra parte, l’ipertrofia sarcoplasmatica sarebbe probabilmente di scarso beneficio per un atleta che cerca di migliorare la forza, come un PowerLifter. Questi ultimi, giustamente, si concentrano principalmente sul sollevamento di carichi più pesanti e di volumi più bassi per massimizzare la forza nei sollevamenti. Detto questo, alcuni PowerLifter come Layne Norton, Ph.D., combinano il lavoro di forza con modalità incentrate sul pompaggio, come l’allenamento per la restrizione del flusso sanguigno, per ottenere il meglio da entrambi i metodi.
Gabriel Bellizzi [CEO BioGenTech]
Riferimenti:
- Corpo di base fonti articolo: Sarcoplasmic Hypertrophy in Skeletal Muscle: A Scientific “Unicorn” or Resistance Training Adaptation?
- Ahtiainen J. P., Walker S., Peltonen H., Holviala J., Sillanpaa E., Karavirta L., et al. (2016). Heterogeneity in resistance training-induced muscle strength and mass responses in men and women of different ages. Age 38:10. [PMC free article] [PubMed] [Google Scholar]
- Allen D. L., Roy R. R., Edgerton V. R. (1999). Myonuclear domains in muscle adaptation and disease. Muscle Nerve 22 1350–1360. 10.1002/(sici)1097-4598(199910)22:10<1350::aid-mus3>3.0.co;2-8 [PubMed] [CrossRef] [Google Scholar]
- Alway S. E., Macdougall J. D., Sale D. G., Sutton J. R., Mccomas A. J. (1988). Functional and structural adaptations in skeletal muscle of trained athletes. J. Appl. Physiol. 64 1114–1120. 10.1152/jappl.1988.64.3.1114 [PubMed] [CrossRef] [Google Scholar]
- Antonio J., Gonyea W. J. (1994). Muscle fiber splitting in stretch-enlarged avian muscle. Med. Sci. Sports Exerc. 26 973–977. [PubMed] [Google Scholar]
- Bell K. E., Brook M. S., Snijders T., Kumbhare D., Parise G., Smith K., et al. (2019). Integrated myofibrillar protein synthesis in recovery from unaccustomed and accustomed resistance exercise with and without multi-ingredient supplementation in overweight older men. Front. Nutr. 6:40. 10.3389/fnut.2019.00040 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Brook M. S., Wilkinson D. J., Mitchell W. K., Lund J. N., Szewczyk N. J., Greenhaff P. L., et al. (2015). Skeletal muscle hypertrophy adaptations predominate in the early stages of resistance exercise training, matching deuterium oxide-derived measures of muscle protein synthesis and mechanistic target of rapamycin complex 1 signaling. FASEB J. 29 4485–4496. 10.1096/fj.15-273755 [PubMed] [CrossRef] [Google Scholar]
- Canepari M., Pellegrino M. A., D’antona G., Bottinelli R. (2010). Single muscle fiber properties in aging and disuse. Scand. J. Med. Sci. Sports 20 10–19. 10.1111/j.1600-0838.2009.00965.x [PubMed] [CrossRef] [Google Scholar]
- Claassen H., Gerber C., Hoppeler H., Luthi J. M., Vock P. (1989). Muscle filament spacing and short-term heavy-resistance exercise in humans. J. Physiol. 409 491–495. 10.1113/jphysiol.1989.sp017509 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Damas F., Phillips S., Vechin F. C., Ugrinowitsch C. (2015). A review of resistance training-induced changes in skeletal muscle protein synthesis and their contribution to hypertrophy. Sports Med. 45 801–807. 10.1007/s40279-015-0320-0 [PubMed] [CrossRef] [Google Scholar]
- Damas F., Phillips S. M., Libardi C. A., Vechin F. C., Lixandrao M. E., Jannig P. R., et al. (2016a). Resistance training-induced changes in integrated myofibrillar protein synthesis are related to hypertrophy only after attenuation of muscle damage. J. Physiol. 594 5209–5222. 10.1113/jp272472 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Damas F., Phillips S. M., Lixandrao M. E., Vechin F. C., Libardi C. A., Roschel H., et al. (2016b). An inability to distinguish edematous swelling from true hypertrophy still prevents a completely accurate interpretation of the time course of muscle hypertrophy. Eur. J. Appl. Physiol. 116 445–446. 10.1007/s00421-015-3287-5 [PubMed] [CrossRef] [Google Scholar]
- Damas F., Phillips S. M., Lixandrao M. E., Vechin F. C., Libardi C. A., Roschel H., et al. (2016c). Early resistance training-induced increases in muscle cross-sectional area are concomitant with edema-induced muscle swelling. Eur. J. Appl. Physiol. 116 49–56. 10.1007/s00421-015-3243-4 [PubMed] [CrossRef] [Google Scholar]
- D’Antona G., Lanfranconi F., Pellegrino M. A., Brocca L., Adami R., Rossi R., et al. (2006). Skeletal muscle hypertrophy and structure and function of skeletal muscle fibres in male body builders. J. Physiol. 570 611–627. 10.1113/jphysiol.2005.101642 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- D’antona G., Pellegrino M. A., Carlizzi C. N., Bottinelli R. (2007). Deterioration of contractile properties of muscle fibres in elderly subjects is modulated by the level of physical activity. Eur. J. Appl. Physiol. 100 603–611. 10.1007/s00421-007-0402-2 [PubMed] [CrossRef] [Google Scholar]
- Defreitas J. M., Beck T. W., Stock M. S. (2016). The findings of Damas et al. have not influenced the previously proposed time course of skeletal muscle hypertrophy. Eur. J. Appl. Physiol. 116 443–444. 10.1007/s00421-015-3286-6 [PubMed] [CrossRef] [Google Scholar]
- Degens H., Bosutti A., Gilliver S. F., Slevin M., Van Heijst A., Wust R. C. (2010). Changes in contractile properties of skinned single rat soleus and diaphragm fibres after chronic hypoxia. Pflugers Arch. 460 863–873. 10.1007/s00424-010-0866-5 [PubMed] [CrossRef] [Google Scholar]
- Egner I. M., Bruusgaard J. C., Gundersen K. (2016). Satellite cell depletion prevents fiber hypertrophy in skeletal muscle. Development 143 2898–2906. 10.1242/dev.134411 [PubMed] [CrossRef] [Google Scholar]
- Eriksson A., Kadi F., Malm C., Thornell L. E. (2005). Skeletal muscle morphology in power-lifters with and without anabolic steroids. Histochem. Cell Biol. 124 167–175. 10.1007/s00418-005-0029-5 [PubMed] [CrossRef] [Google Scholar]
- Eriksson A., Lindstrom M., Carlsson L., Thornell L. E. (2006). Hypertrophic muscle fibers with fissures in power-lifters; fiber splitting or defect regeneration? Histochem. Cell Biol. 126 409–417. 10.1007/s00418-006-0176-3 [PubMed] [CrossRef] [Google Scholar]
- Fatouros I. G., Kambas A., Katrabasas I., Nikolaidis K., Chatzinikolaou A., Leontsini D., et al. (2005). Strength training and detraining effects on muscular strength, anaerobic power, and mobility of inactive older men are intensity dependent. Br. J. Sports Med. 39 776–780. 10.1136/bjsm.2005.019117 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Fluck M., Kramer M., Fitze D. P., Kasper S., Franchi M. V., Valdivieso P. (2019). Cellular aspects of muscle specialization demonstrate genotype – phenotype interaction effects in athletes. Front. Physiol. 10:526. 10.3389/fphys.2019.00526 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Folland J. P., Williams A. G. (2007). The adaptations to strength training : morphological and neurological contributions to increased strength. Sports Med. 37 145–168. 10.2165/00007256-200737020-00004 [PubMed] [CrossRef] [Google Scholar]
- Gasier H. G., Fluckey J. D., Previs S. F., Wiggs M. P., Riechman S. E. (2012). Acute resistance exercise augments integrative myofibrillar protein synthesis. Metabolism 61 153–156. 10.1016/j.metabol.2011.07.001 [PubMed] [CrossRef] [Google Scholar]
- Gillooly J. F., Hein A., Damiani R. (2015). Nuclear DNA content varies with cell size across human cell types. Cold Spring Harb. Perspect. Biol. 7:a019091. 10.1101/cshperspect.a019091 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Gokhin D. S., Ward S. R., Bremner S. N., Lieber R. L. (2008). Quantitative analysis of neonatal skeletal muscle functional improvement in the mouse. J. Exp. Biol. 211 837–843. 10.1242/jeb.014340 [PubMed] [CrossRef] [Google Scholar]
- Goldspink G. (1964). The combined effects of exercise and reduced food intake on skeletal muscle fibers. J. Cell. Comp. Physiol. 63 209–216. 10.1002/jcp.1030630211 [PubMed] [CrossRef] [Google Scholar]
- Goldspink G. (1970). The proliferation of myofibrils during muscle fibre growth. J. Cell Sci. 6 593–603. [PubMed] [Google Scholar]
- Goldspink G. (2011). Alterations in myofibril size and structure during growth, exercise, and changes in environmental temperature. Compr. Physiol. 2 539–554. [Google Scholar]
- Grgic J., Schoenfeld B. J. (2018). Are the hypertrophic adaptations to high and low-load resistance training muscle fiber type specific? Front. Physiol. 9:402. 10.3389/fphys.2018.00402 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Haun C. T., Vann C. G., Mobley C. B., Osburn S. C., Mumford P. W., Roberson P. A., et al. (2019a). Pre-training skeletal muscle fiber size and predominant fiber type best predict hypertrophic responses to 6 weeks of resistance training in previously trained young men. Front. Physiol. 10:297. 10.3389/fphys.2019.00297 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Haun C. T., Vann C. G., Mobley C. B., Roberson P. A., Osburn S. C., Holmes H. M., et al. (2018). Effects of graded whey supplementation during extreme-volume resistance training. Front. Nutr. 5:84. 10.3389/fnut.2018.00084 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Haun C. T., Vann C. G., Osburn S. C., Mumford P. W., Roberson P. A., Romero M. A., et al. (2019b). Muscle fiber hypertrophy in response to 6 weeks of high-volume resistance training in trained young men is largely attributed to sarcoplasmic hypertrophy. PLoS One 14:e0215267. 10.1371/journal.pone.0215267 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Haun C. T., Vann C. G., Roberts B. M., Vigotsky A. D., Schoenfeld B. J., Roberts M. D. (2019c). A critical evaluation of the biological construct skeletal muscle hypertrophy: size matters but so does the measurement. Front. Physiol. 10:247. 10.3389/fphys.2019.00247 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Henderson C. A., Gomez C. G., Novak S. M., Mi-Mi L., Gregorio C. C. (2017). Overview of the muscle cytoskeleton. Compr. Physiol. 7 891–944. 10.1002/cphy.c160033 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Jorgenson K. W., Hornberger T. A. (2019). The overlooked role of fiber length in mechanical load-induced growth of skeletal muscle. Exerc. Sport Sci. Rev. 47 258–259. 10.1249/jes.0000000000000198 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Kadi F., Schjerling P., Andersen L. L., Charifi N., Madsen J. L., Christensen L. R., et al. (2004). The effects of heavy resistance training and detraining on satellite cells in human skeletal muscles. J. Physiol. 558 1005–1012. 10.1113/jphysiol.2004.065904 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Kirby T. J., Patel R. M., Mcclintock T. S., Dupont-Versteegden E. E., Peterson C. A., Mccarthy J. J. (2016). Myonuclear transcription is responsive to mechanical load and DNA content but uncoupled from cell size during hypertrophy. Mol. Biol. Cell 27 788–798. 10.1091/mbc.e15-08-0585 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Kraemer W. J., Zatsiorsky V. M. (2006). Science and Practice of Strength Training. Champaign, IL: Human Kinetics. [Google Scholar]
- Lee Y. S., Ondrias K., Duhl A. J., Ehrlich B. E., Kim D. H. (1991). Comparison of calcium release from sarcoplasmic reticulum of slow and fast twitch muscles. J. Membr. Biol. 122 155–163. 10.1007/bf01872638 [PubMed] [CrossRef] [Google Scholar]
- Lepper C., Partridge T. A., Fan C. M. (2011). An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development 138 3639–3646. 10.1242/dev.067595 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Luthi J. M., Howald H., Claassen H., Rosler K., Vock P., Hoppeler H. (1986). Structural changes in skeletal muscle tissue with heavy-resistance exercise. Int. J. Sports Med. 7 123–127. 10.1055/s-2008-1025748 [PubMed] [CrossRef] [Google Scholar]
- Macdougall J. D., Sale D. G., Elder G. C., Sutton J. R. (1982). Muscle ultrastructural characteristics of elite powerlifters and bodybuilders. Eur. J. Appl. Physiol. Occup. Physiol. 48 117–126. 10.1007/bf00421171 [PubMed] [CrossRef] [Google Scholar]
- Mccarthy J. J., Mula J., Miyazaki M., Erfani R., Garrison K., Farooqui A. B., et al. (2011). Effective fiber hypertrophy in satellite cell-depleted skeletal muscle. Development 138 3657–3666. 10.1242/dev.068858 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Meijer J. P., Jaspers R. T., Rittweger J., Seynnes O. R., Kamandulis S., Brazaitis M., et al. (2015). Single muscle fibre contractile properties differ between body-builders, power athletes and control subjects. Exp. Physiol. 100 1331–1341. 10.1113/ep085267 [PubMed] [CrossRef] [Google Scholar]
- Meng H., Janssen P. M., Grange R. W., Yang L., Beggs A. H., Swanson L. C., et al. (2014). Tissue triage and freezing for models of skeletal muscle disease. J. Vis. Exp. 89:51586. [PMC free article] [PubMed] [Google Scholar]
- Metzger J. M., Moss R. L. (1987). Shortening velocity in skinned single muscle fibers. Influence of filament lattice spacing. Biophys. J. 52 127–131. 10.1016/s0006-3495(87)83197-1 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mitchell C. J., Churchward-Venne T. A., Cameron-Smith D., Phillips S. M. (2015). What is the relationship between the acute muscle protein synthesis response and changes in muscle mass? J. Appl. Physiol. 118 495–497. 10.1152/japplphysiol.00609.2014 [PubMed] [CrossRef] [Google Scholar]
- Mitchell C. J., Churchward-Venne T. A., West D. W., Burd N. A., Breen L., Baker S. K., et al. (2012). Resistance exercise load does not determine training-mediated hypertrophic gains in young men. J. Appl. Physiol. 113 71–77. 10.1152/japplphysiol.00307.2012 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mollenhauer H. H. (1993). Artifacts caused by dehydration and epoxy embedding in transmission electron microscopy. Microsc. Res. Tech. 26 496–512. 10.1002/jemt.1070260604 [PubMed] [CrossRef] [Google Scholar]
- Moore D. R., Tang J. E., Burd N. A., Rerecich T., Tarnopolsky M. A., Phillips S. M. (2009). Differential stimulation of myofibrillar and sarcoplasmic protein synthesis with protein ingestion at rest and after resistance exercise. J. Physiol. 587 897–904. 10.1113/jphysiol.2008.164087 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Morpurgo B. (1897). Ueber Activitäts-Hypertrophie der willkürlichen Muskeln. Arch. Pathol. Anat. Physiol. Klin. Med. 1S0 522–554. [Google Scholar]
- Murach K. A., Dungan C. M., Peterson C. A., Mccarthy J. J. (2019). Muscle fiber splitting is a physiological response to extreme loading in animals. Exerc. Sport Sci. Rev. 47 108–115. 10.1249/jes.0000000000000181 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Murach K. A., Englund D. A., Dupont-Versteegden E. E., Mccarthy J. J., Peterson C. A. (2018). Myonuclear domain flexibility challenges rigid assumptions on satellite cell contribution to skeletal muscle fiber hypertrophy. Front. Physiol. 9:635. 10.3389/fphys.2018.00635 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Neurohr G. E., Terry R. L., Lengefeld J., Bonney M., Brittingham G. P., Moretto F., et al. (2019). Excessive cell growth causes cytoplasm dilution and contributes to senescence. Cell 176:1083. 10.1016/j.cell.2019.01.018 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Pansarasa O., Rinaldi C., Parente V., Miotti D., Capodaglio P., Bottinelli R. (2009). Resistance training of long duration modulates force and unloaded shortening velocity of single muscle fibres of young women. J. Electromyogr. Kinesiol. 19 e290–e300. 10.1016/j.jelekin.2008.07.007 [PubMed] [CrossRef] [Google Scholar]
- Penman K. A. (1969). Ultrastructural changes in human striated muscle using three methods of training. Res. Q. 40 764–772. 10.1080/10671188.1969.10614916 [PubMed] [CrossRef] [Google Scholar]
- Phillips S. M. (2000). Short-term training: when do repeated bouts of resistance exercise become training? Can J. Appl. Physiol. 25 185–193. 10.1139/h00-014 [PubMed] [CrossRef] [Google Scholar]
- Reidy P. T., Borack M. S., Markofski M. M., Dickinson J. M., Fry C. S., Deer R. R., et al. (2017). Post-absorptive muscle protein turnover affects resistance training hypertrophy. Eur. J. Appl. Physiol. 117 853–866. 10.1007/s00421-017-3566-4 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Roberts M. D., Romero M. A., Mobley C. B., Mumford P. W., Roberson P. A., Haun C. T., et al. (2018). Skeletal muscle mitochondrial volume and myozenin-1 protein differences exist between high versus low anabolic responders to resistance training. PeerJ 6:e5338. 10.7717/peerj.5338 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Roberts M. D., Young K. C., Fox C. D., Vann C. G., Roberson P. A., Osburn S. C., et al. (2020). An optimized procedure for isolation of rodent and human skeletal muscle sarcoplasmic and myofibrillar proteins. J. Biol. Methods 7:e127. [PMC free article] [PubMed] [Google Scholar]
- Roche S. M., Gumucio J. P., Brooks S. V., Mendias C. L., Claflin D. R. (2015). Measurement of maximum isometric force generated by permeabilized skeletal muscle fibers. J. Vis. Exp. 100:e52695. [PMC free article] [PubMed] [Google Scholar]
- Schiaffino S., Hanzlikova V., Pierobon S. (1970). Relations between structure and function in rat skeletal muscle fibers. J. Cell Biol. 47 107–119. 10.1083/jcb.47.1.107 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Shoepe T. C., Stelzer J. E., Garner D. P., Widrick J. J. (2003). Functional adaptability of muscle fibers to long-term resistance exercise. Med. Sci. Sports Exerc. 35 944–951. 10.1249/01.mss.0000069756.17841.9e [PubMed] [CrossRef] [Google Scholar]
- Soltani M., Vargas-Garcia C. A., Antunes D., Singh A. (2016). Intercellular variability in protein levels from stochastic expression and noisy cell cycle processes. PLoS Comput. Biol. 12:e1004972. 10.1371/journal.pcbi.1004972 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Stone M. H., Wilson D. R. R., Newton H. (1983). Physiological basis. Strength Cond. J. 5 40–64. [Google Scholar]
- Stromer M. H. (1998). The cytoskeleton in skeletal, cardiac and smooth muscle cells. Histol. Histopathol. 13 283–291. [PubMed] [Google Scholar]
- Taber C. B., Vigotsky A., Nuckols G., Haun C. T. (2019). Exercise-induced myofibrillar hypertrophy is a contributory cause of gains in muscle strength. Sports Med. 49 993–997. 10.1007/s40279-019-01107-8 [PubMed] [CrossRef] [Google Scholar]
- Thys T. M., Blank J. M., Coughlin D. J., Schachat F. (2001). Longitudinal variation in muscle protein expression and contraction kinetics of largemouth bass axial muscle. J. Exp. Biol. 204 4249–4257. [PubMed] [Google Scholar]
- Timson B. F., Bowlin B. K., Dudenhoeffer G. A., George J. B. (1985). Fiber number, area, and composition of mouse soleus muscle following enlargement. J. Appl. Physiol. 58 619–624. 10.1152/jappl.1985.58.2.619 [PubMed] [CrossRef] [Google Scholar]
- Toth M. J., Miller M. S., Vanburen P., Bedrin N. G., Lewinter M. M., Ades P. A., et al. (2012). Resistance training alters skeletal muscle structure and function in human heart failure: effects at the tissue, cellular and molecular levels. J. Physiol. 590 1243–1259. 10.1113/jphysiol.2011.219659 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Trappe S., Godard M., Gallagher P., Carroll C., Rowden G., Porter D. (2001). Resistance training improves single muscle fiber contractile function in older women. Am. J. Physiol. Cell Physiol. 281 C398–C406. [PubMed] [Google Scholar]
- Trappe S., Williamson D., Godard M., Porter D., Rowden G., Costill D. (2000). Effect of resistance training on single muscle fiber contractile function in older men. J. Appl. Physiol. 89 143–152. 10.1152/jappl.2000.89.1.143 [PubMed] [CrossRef] [Google Scholar]
- Valle X., Til L., Drobnic F., Turmo A., Montoro J. B., Valero O., et al. (2013). Compression garments to prevent delayed onset muscle soreness in soccer players. Muscles Ligaments Tendons J. 3 295–302. [PMC free article] [PubMed] [Google Scholar]
- Vann C. G., Osburn S. C., Mumford P. W., Roberson P. A., Fox C. D., Sexton C. L., et al. (2020a). Skeletal muscle protein composition adaptations to 10 weeks of high-load resistance training in previously-trained males. Front. Physiol. 11:259. 10.3389/fphys.2020.00259 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Vann C. G., Roberson P. A., Osburn S. C., Mumford P. W., Romero M. A., Fox C. D., et al. (2020b). Skeletal muscle myofibrillar protein abundance is higher in resistance-trained men, and aging in the absence of training may have an opposite effect. Sports 8:7. 10.3390/sports8010007 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Walker D. K., Dickinson J. M., Timmerman K. L., Drummond M. J., Reidy P. T., Fry C. S., et al. (2011). Exercise, amino acids, and aging in the control of human muscle protein synthesis. Med. Sci. Sports Exerc. 43 2249–2258. 10.1249/mss.0b013e318223b037 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ward S. R., Eng C. M., Smallwood L. H., Lieber R. L. (2009). Are current measurements of lower extremity muscle architecture accurate? Clin. Orthop. Relat. Res. 467 1074–1082. 10.1007/s11999-008-0594-8 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Widrick J. J., Stelzer J. E., Shoepe T. C., Garner D. P. (2002). Functional properties of human muscle fibers after short-term resistance exercise training. Am. J. Physiol. Regul. Integr. Comp. Physiol. 283 R408–R416. [PubMed] [Google Scholar]
- Wilkens J. L., Cavey M. J., Shovkivska I., Zhang M. L., Ter Keurs H. E. (2008). Elasticity, unexpected contractility and the identification of actin and myosin in lobster arteries. J. Exp. Biol. 211 766–772. 10.1242/jeb.007658 [PubMed] [CrossRef] [Google Scholar]
- Wilkinson D. J., Franchi M. V., Brook M. S., Narici M. V., Williams J. P., Mitchell W. K., et al. (2014). A validation of the application of D(2)O stable isotope tracer techniques for monitoring day-to-day changes in muscle protein subfraction synthesis in humans. Am. J. Physiol. Endocrinol. Metab. 306 E571–E579. [PMC free article] [PubMed] [Google Scholar]
- Yamada A., Yoshio M., Nakayama H. (1997). Bi-directional movement of actin filaments along long bipolar tracks of oriented rabbit skeletal muscle myosin molecules. FEBS Lett. 409 380–384. 10.1016/s0014-5793(97)00558-9 [PubMed] [CrossRef] [Google Scholar]
- Yu J. G., Liu J. X., Carlsson L., Thornell L. E., Stal P. S. (2013). Re-evaluation of sarcolemma injury and muscle swelling in human skeletal muscles after eccentric exercise. PLoS One 8:e62056. 10.1371/journal.pone.0062056 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
